Non-celiac gluten sensitivity (NCGS) is a syndrome characterized by intestinal and extraintestinal symptoms related to the ingestion of gluten-containing foods in patients not affected by celiac disease or gluten allergy. Symptoms occur within hours or days after the ingestion of gluten. Three gluten-induced heterogeneous situations were identified: a) celiac disease (autoimmune); b) allergy to wheat (allergic); c) non-celiac gluten sensitivity (non-autoimmune and non-allergic). Sensitivity to gluten has been described under various names: gluten hypersensitivity, gluten sensitivity, gluten intolerance, so that in 2012 the consensus established the name non-celiac gluten sensitivity (NCGS) to distinguish it from celiac disease. The incidence of NCGS in patients with neuropsychiatric symptoms - autistic spectrum disorders or schizophrenia - has been discussed in recent years, suggesting that they may be part of the NCGS spectrum in some cases. In general, NCGS, like celiac disease and wheat allergy, is treated with gluten-free diet. Since it is not known whether NCGS is permanent or transient, the periodic reintroduction of gluten into the diet may be recommended. Thus, celiac disease and gluten allergy are two well-defined gluten-induced diseases with clear diagnostic and treatment guidelines, while the NCGS is a controversial entity with more questions than answers upon pathogenesis, diagnosis and treatment.
Sensibilitatea la gluten nonceliacă
Non-celiac gluten sensitivity
First published: 09 ianuarie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Pedi.48.4.2017.1368
Abstract
Rezumat
Sensibilitatea la gluten nonceliacă (NCGS) este un sindrom caracterizat prin simptome intestinale și extraintestinale legate de ingestia de alimente care conțin gluten la indivizi care nu sunt afectați nici de boala celiacă, nici de alergie la gluten. Simptomele apar în decurs de ore sau zile după ingestia de gluten. S-au identificat trei situații eterogene induse de gluten: a) boala celiacă (autoimună); b) alergia la grâu (alergică); c) sensibilitatea la gluten nonceliacă (nonautoimună și nonalergică). Sensibilitatea la gluten a fost descrisă sub diverse denumiri: hipersensibilitate la gluten, sensibilitate la gluten, intoleranță la gluten nonceliacă, pentru ca în 2012 să se stabilească prin consens denumirea sensibilitate la gluten nonceliacă (non-celiac gluten sensitivity - NCGS), pentru a o deosebi de boala celiacă. Se discută în ultimii ani despre incidența NCGS la subiecți cu simptome neuropsihice - tulburări de spectru autist sau schizofrenie -, sugerându-se că acestea pot fi o parte din spectrul NCGS la unele cazuri. În general, NCGS, ca și boala celiacă și alergia la grâu, este tratată cu dietă fără gluten. Deoarece nu se cunoaște dacă NCGS este permanentă sau tranzitorie, reintroducerea periodică a glutenului în dietă poate fi recomandată. Astfel, boala celiacă și alergia la gluten sunt două boli induse de gluten bine definite, cu ghiduri clare de diagnostic și tratament, pe când NCGS este o entitate controversată încă, cu mai multe întrebări decât răspunsuri privind natura, diagnosticul și tratamentul său.
Grâul este un element de bază în dieta umană de peste 10 000 de ani. Răspunsul la proteinele dietetice din grâu poate determina o varietate de simptome și de răspunsuri imunologice.
Glutenul reprezintă o familie de proteine care se regăsește în cereale, frecvent implicate într-o serie de patologii digestive, manifestate în special la vârstă mică. Sensibilitatea la gluten reprezintă o entitate nouă, introdusă în momentul descrierii patologiei induse de gluten la indivizi cu simptome similare cu cele ale bolii celiace, dar fără prezența anticorpilor specifici și a leziunilor intestinale regăsite în celiachie.
Spectrul patologiilor induse de gluten este din ce în ce mai mare, pe măsură ce mecanisme noi patogenice sunt înțelese și descrise. Se discută în prezent de patologii legate de gluten („gluten-related disorders”). În 2011, la Londra, 15 experți au propus o nouă clasificare a tulburărilor legate de gluten. Catassi propune termenul „gluten-related disorders” pentru a include toate situațiile legate de ingestia de alimente cu gluten. Totodată, se discută despre rolul glutenului în dezvoltarea sistemului imun digestiv, existând astăzi două opinii extreme: glutenul este văzut atât ca prieten, cât și ca dușman.
În 2013, la Londra un grup de 15 experți, identifică trei situații eterogene induse de gluten: boala celiacă (mecanism autoimun), alergia la grâu (mecanism alergic) și sensibilitatea la gluten nonceliacă (nonautoimună, nonalergică).
Dacă primele două (boala celiacă și alergia la grâu) au devenit deja clasice, fiind descrise, studiate și înțelese, cea de a treia entitate - sensibilitatea la gluten nonceliacă – este un subiect în atenție, ca o nouă boală sau sindrom cu intoleranță la gluten.
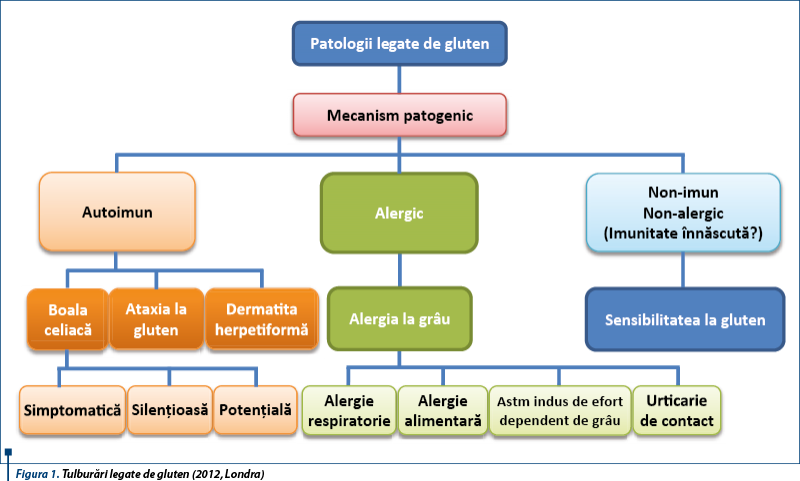
Până de curând, cele mai frecvente tulburări legate de gluten la copii includeau numai boala celiacă, având mecanism autoimun, și alergia la gluten (reacție alergică mediată IgE). În boala celiacă, pacienții predispuși genetic reacționează la gliadina din grâu, determinând simptome intestinale și extraintestinale. Alergia la grâu apare ca un răspuns mediat IgE care duce la apariția simptomelor gastrointestinale cutanate și/sau respiratorii.
La acestea s-a adăugat o nouă entitate, cunoscută sub numele de sensibilitate la gluten nonceliacă (mecanism nonautoimun, nonalergic), recunoscută în special la adult, dar identificată și la copii.
Sensibilitatea la gluten nonceliacă (non-celiac gluten sensitivity; NCGS)
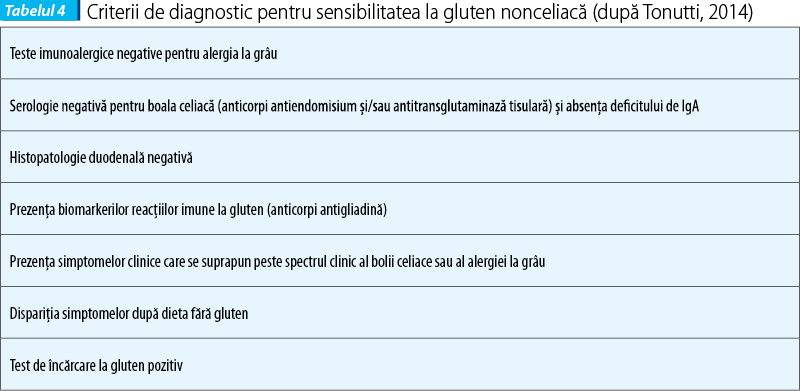
Sensibilitatea la gluten nonceliacă (NCGS) este o entitate relativ nouă și este definită prin prezența unor simptome variate legate de ingestia de gluten, la pacienți la care s-au exclus boala celiacă și alergia la grâu și la care simptomele se ameliorează sub regim fără gluten. Conceptul sensibilității la gluten a fost descris sub diverse denumiri: hipersensibilitate la gluten, sensibilitate la gluten (First Experts’ Meeting, Londra, 2011), intoleranță la gluten nonceliacă.
În 2012, Second Experts’ Meeting on Gluten Sensitivity (München) hotărăște prin consens schimbarea numelui de „gluten sensitivity” în „non-celiac gluten sensitivity”, pentru a evita confuzia cu boala celiacă. Sensibilitatea la gluten nonceliacă este un sindrom caracterizat prin simptome intestinale și extraintestinale legate de ingestia de alimente care conțin gluten la pacienți care nu sunt afectați nici de boală celiacă, nici de alergie la grâu.
Epidemiologie
Prevalența bolii în populația generală nu se cunoaște exact; aceasta ar fi între 0,5% în medicina primară și de 6% în centre de referință în țări diferite. Nu sunt date de prevalență la copii.
Se consideră că NCGS ar fi mai frecventă decât boala celiacă (aceasta din urmă afectează 1% din populația generală). NCGS se descrie mai frecvent la adult și la sexul feminin, precum și la copii, adulți tineri sau adulți de vârstă medie.
Patogenie
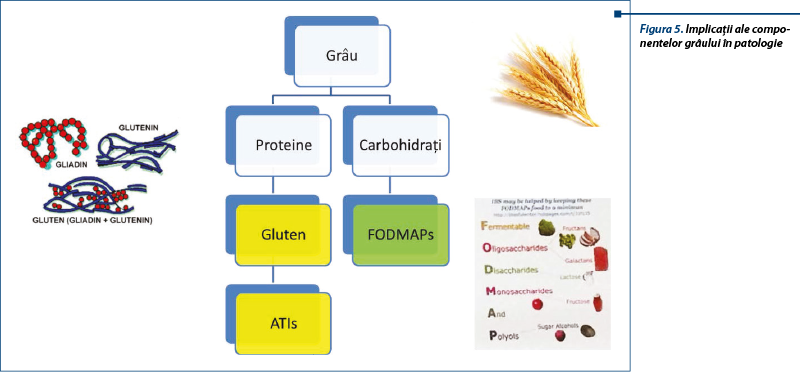
Glutenul, principala proteină complexă conținută în grâu, orz și secară a fost identificat ca posibil trigger al acestui sindrom. S-a sugerat că și alte proteine din grâu în afară de gluten, ca inhibitorii de amilază-tripsină (ATI), pot contribui la acest sindrom. Studii recente subliniază rolul posibil al FODMAPs (Fermentable Oligo-, Di-, Monosaccharides and Polyols) în dezvoltarea bolii. Cele mai frecvente surse alimentare de FODMAPs sunt laptele, legumele, mierea de albine, unele fructe și vegetale, alături de care sunt incluse grâul și secara (care conțin atât FODMAPs, cât și gluten).

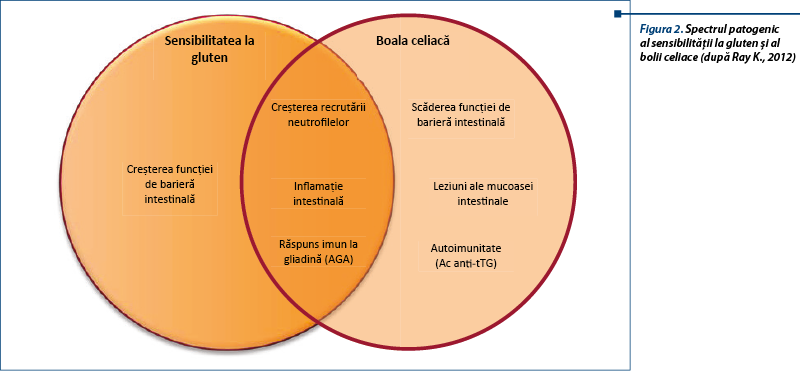
Boala este provocată de cereale care conțin gluten, dar nu s-a identificat fracțiunea proteică incriminată, care ar putea fi diferită de glutenul însuși. Mecanismul bolii nu este elucidat. Se sugerează un rol posibil al imunității înnăscute induse de grâu, ca și alterarea permeabilității intestinale, cu absorbția excesivă de peptide derivate din gluten. Nu s-a identificat un factor genetic predispozant. Date recente sugerează rolul major al sistemului imun înnăscut, printr-un răspuns înnăscut anormal indus de grâu. Există o expresie crescută a markerilor de imunitate înnăscută (TLR-2), creșterea densității celulelor T intraepiteliale CD3+ și alterarea permeabilității intestinale („leaky gut”), care duc la absorbția excesivă a peptidelor derivate din gluten.
NCGS poate fi asociată cu activarea răspunsului imun înnăscut indus de gluten mai mult decât răspunsul adaptativ. Triggerul real în NCGS nu este definit. Glutenul nu este singurul responsabil, fiind incriminate și alte proteine din grâu, ca inhibitorul de amilază-tripsină (ATI), dar și carbohidrații din grâu (FODMAPs) sau fungi.
Tablou clinic
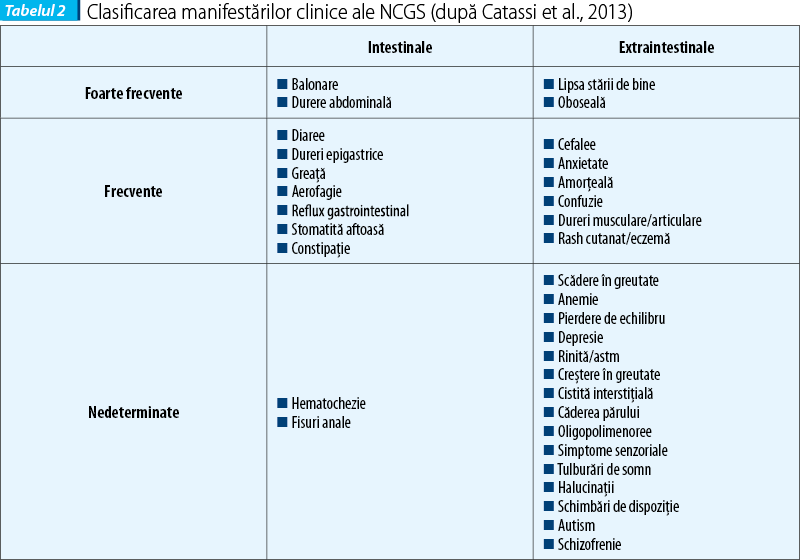
Afecțiunea poate fi descrisă la pacienții care nu au nici boală celiacă și nici alergie la grâu, dar la care apare ameliorarea simptomelor sub regim fără gluten. Tabloul clinic poate fi multisistemic. Simptomele apar în decurs de ore sau zile după ingestia de gluten, dispar la eliminarea glutenului și reapar la încărcarea cu gluten (ore, zile). Simptomele în NCGS pot fi intestinale și extraintestinale.
La adult, simptomele intestinale sunt asemănătoare cu cele din sindromul de intestin iritabil (simptome IBS-like): dureri abdominale, balonare, constipație, diaree, disconfort abdominal. Simptomele extraintestinale (sistemice) sunt: cefalee, confuzie, oboseală, depresie, dureri musculare și articulare, dermatită (eczemă, rash cutanat), anemie și simptome neurologice. Pacienții reclamă relația cauzală între ingestia de alimente care conțin gluten și agravarea simptomelor. La copil se descriu simptome intestinale de tip IBS-like (dureri abdominale, diaree cronică), iar semnele extraintestinale sunt mai puțin frecvente (oboseala).
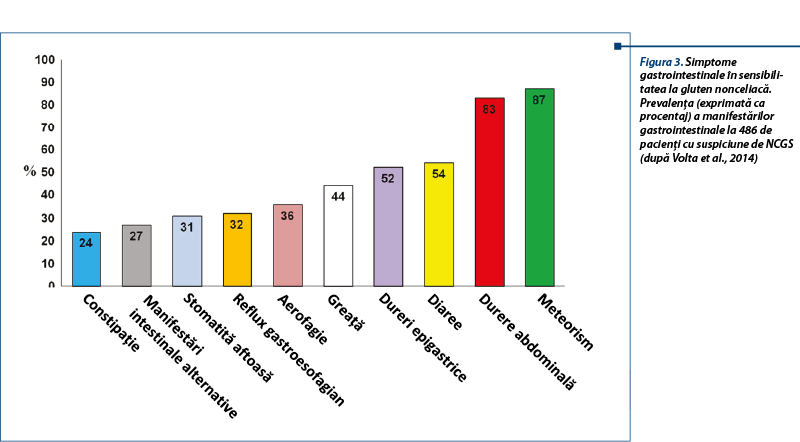
Aspectele clinice întâlnite în NCGS au multiple fațete, care includ: dermatita herpetiformă, sindromul de intestin iritabil, autismul, schizofrenia și ataxia gluten-sensibilă. Se discută în ultimii ani despre incidența NCGS la pacienți cu simptome neuropsihice (tulburări de spectru autist sau schizofrenie), sugerându-se că acestea pot fi o parte din spectrul NCGS la unele cazuri.
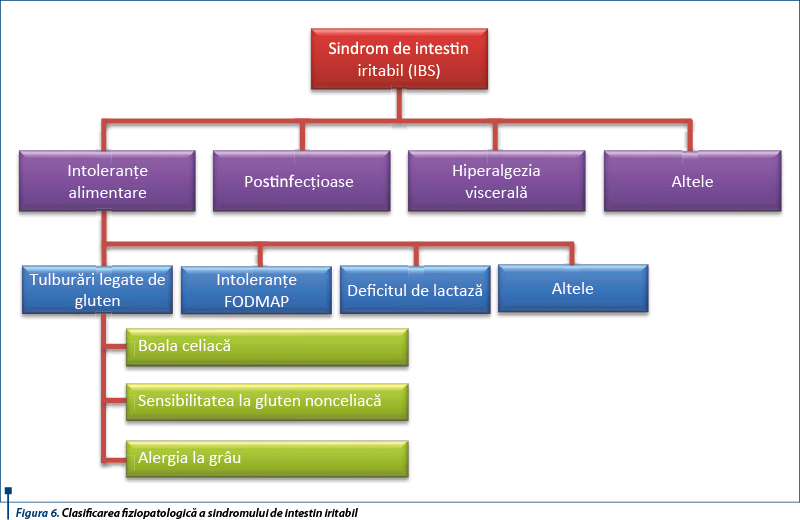
1. NCGS și sindromul de intestin iritabil (IBS)
NCGS și IBS (irritable bowel syndrome - sindromul de intestin iritabil) sunt entități mult studiate în prezent. La bolnavii cu IBS se recomandă screeningul serologic pentru boala celiacă, deoarece aceasta este de 4 ori mai frecventă la acești bolnavi față de pacienții sănătoși. Se apreciază în prezent că unii bolnavi cu IBS pot dezvolta NCGS (Arranz et al., 1993), iar recent se susține ideea că NCGS este frecvent întâlnită la pacienții cu sindrom de intestin iritabil, tulburare denumită „gluten-sensitive IBS”. Un procent de 30% dintre cei cu sindrom IBS-like au sensibilitate la grâu. Alte componente ale grâului pot fi responsabile de hipersensibilitatea la gluten.
Deși NCGS este declanșată de ingestia de cereale care conțin gluten, nu s-a identificat componenta dietetică agresivă; aceasta poate fi una dintre proteinele grâului - glutenul sau inhibitorii de amilază-tripsină (ATI), fie carbohidrații complecși din grâu (FODMAPs).
În hipersensibilitatea la grâu un rol important îl au inhibitorii de amilază-tripsină (ATI). Aceștia sunt proteine derivate din plante care inhibă paraziții obișnuiți ai grâului, inhibitorii alfa-amilazelor și proteazelor, cu rol important în procesul metabolic de dezvoltare a bobului. ATI reprezintă 2-4% din proteinele grâului modern, fiind consumați în cantități de 0,5-1 g pe zi. Aceștia sunt activatori ai celulelor sistemului imun înnăscut (celule dendritice, macrofage).
Inducerea manifestărilor NCGS-like (balonare, diaree) poate fi produsă de carbohidrații complecși existenți în bobul de grâu, așa-numiții FODMAPs (Fermentable Oligo-, Di-, Monosaccharides and Polyols). Alimentele bogate în gluten/grâu conțin cantități crescute de FODMAPs. Între NCGS și intoleranța FODMAPs există o suprapunere de simptome, dar în acest caz FODMAPs nu pot fi în întregime și exclusiv responsabile de simptomele relatate de pacienții cu NCGS, fiind implicat glutenul și alte proteine descrise mai sus.
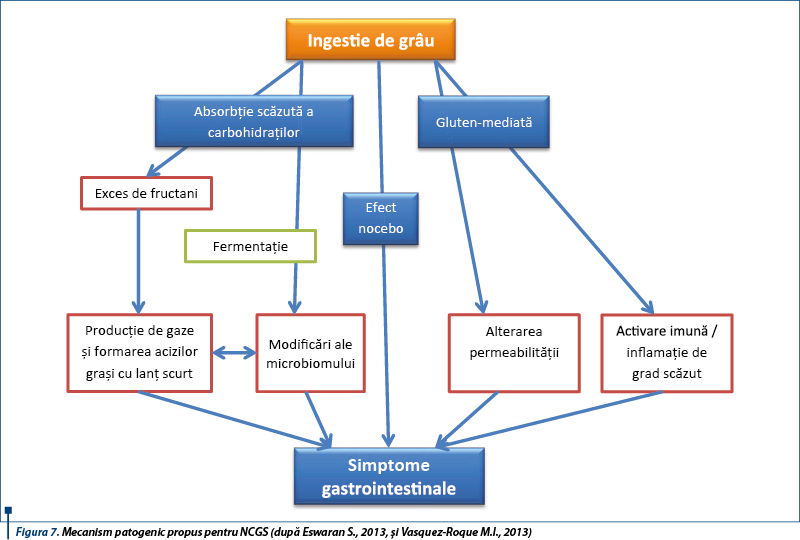
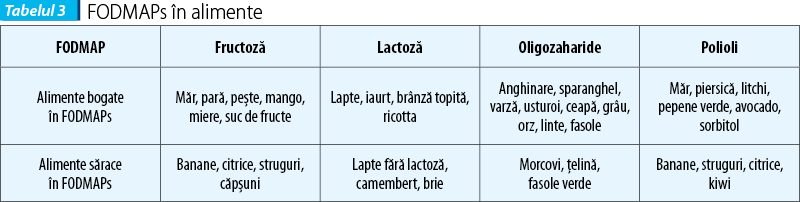
FODMAPs sunt reprezentate de fructani, galactani, fructoză și polioli, prezente în grâu, vegetale și derivate de lapte.
2. NCGS și unele simptome și tulburări neurologice/psihiatrice
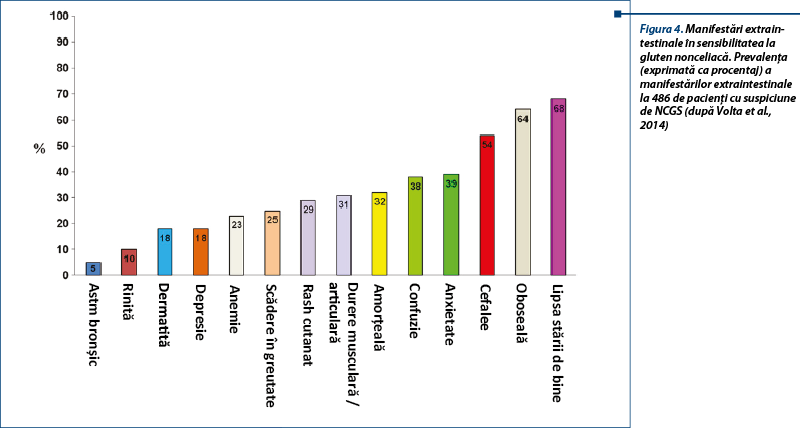
Există studii numeroase în ultimii ani care leagă NCGS de unele afecțiuni neurologice/psihiatrice ca: ataxia, neuropatia periferică, schizofrenia, autismul, depresia, anxietatea, halucinațiile. Studii numeroase efectuate în ultimele două decade arată efectul dietei și al nutriției în tulburările de spectru autist. Dietele de tip gluten-free și casein-free reprezintă intervențiile nutriționale cele mai populare în autism.
Gliadorfina și caseomorfina sunt peptide opioide formate prin digestia incompletă a alimentelor care conțin gluten și cazeină. Gliadorfina (peptid-gliadina) se leagă de receptorii opioizi din creier, din zonele implicate în vorbire și auz, și au efecte morfin-like. Gliadorfina se regăsește în autism, schizofrenie și boala celiacă.
Digestia incompletă a peptidelor derivate din gluten și cazeină duce la absorbția anormală a acestora printr-o barieră intestinală incompletă; aceste peptide trec bariera hematoencefalică și se leagă de receptorii opioizi din creier. Efectele lor negative se manifestă prin scăderea atenției, alterarea dezvoltării neurocomportamentale, a integrării sociale și a proceselor de învățare.
Copiii cu autism au anticorpi antigliadină (AGA) de tip IgG (nu IgA) crescuți, anticorpi anticazeină și anti-lapte integral prezenți. Excluderea glutenului poate influența pozitiv evoluția unor copii cu autism. Eficacitatea dietei fără gluten și fără cazeină este încă de probat. Autismul poate fi o parte a NCGS cel puțin la unele cazuri.
În ceea ce privește schizofrenia, încă din 1960 s-a observat o asociere între aceasta și boala celiacă. Studii recente (2012, 2013) arată că 5,5% dintre bolnavii cu schizofrenie au anticorpi antitransglutaminază tisulară (ATG) în titru crescut, comparativ cu cei 1% din lotul de control. Anticorpi antigliadină (AGA) de tip IgG prezintă 23,1% dintre cei cu schizofrenie, comparativ cu lotul de control, la care acești anticorpi se regăseau în procent de 3,1%. Mulți bolnavi cu anticorpi antitransglutaminază tisulară pozitivi au anticorpi antiendomisium (EMA) negativi. Numai 2% dintre bolnavii cu schizofrenie au criterii complete de includere în boala celiacă (anticorpi anti-tTG pozitivi, anticorpi EMA pozitivi). Mulți bolnavi cu anticorpi anti-tTG pozitivi au anticorpi anti-tTG6 pozitivi, aceștia reprezentând biomarkeri de neuroinflamație mai mult, decât de boală celiacă. Studiile indică existența răspunsului imun specific la gluten la unii bolnavi, probabil legat de NCGS.
Diagnosticul pozitiv al NCGS
Suspiciunea de diagnostic de NCGS se ridică la bolnavii cu simptome intestinale și extraintestinale persistente, care au markeri serologici normali pentru boala celiacă (CD) și alergia la grâu (WA) sub dieta cu gluten și la bolnavii care acuză agravarea simptomelor după ingestia de alimente bogate în gluten. Nu există un biomarker sensibil și specific.
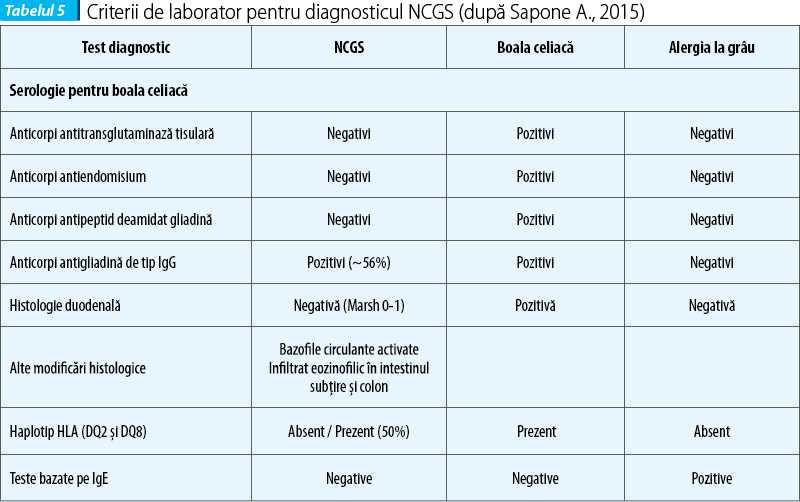
Diagnosticul de NCGS se stabilește pe relația clară cauză - efect, între ingestia de gluten și apariția simptomelor. Problema majoră în diagnosticul NCGS este diferențierea de alte tulburări legate de gluten, ca boala celiacă și alergia la grâu. De remarcat că manifestările gastrointestinale în aceste entități sunt asemănătoare și nu sunt distincte. Prezența anticorpilor IgA antitransglutaminază și a anticorpilor IgG antipeptide deamidate ale gliadinei și atrofia duodenală viloasă susțin diagnosticul de boală celiacă. Prezența anticorpilor IgE la grâu confirmă diagnosticul de alergie la grâu.
Absența markerilor tipici de boală celiacă (anticorpi anti-tTG și EMA) în absența deficitului de IgA, teste imune alergice negative la grâu, examen histologic duodenal negativ (Marsh 0 sau 1), posibil prezența anticorpilor antigliadină, prezența simptomelor clinice care se suprapun (overlap) cu boala celiacă și alergia la grâu, dispariția simptomelor la regimul gluten-free și proba de încărcare cu gluten pozitivă susțin diagnosticul de NCGS.
Criteriile de laborator pentru NCGS
Serologia pentru boala celiacă este negativă (anticorpii antitransglutaminază, antiendomisium, antipeptide deamidate ale gliadinei). De remarcat că anticorpii anti-gliadină pot fi pozitivi în 56% din cazurile cu NCGS. Anticorpii antigliadină, produși ca răspuns la gliadina din grâu, au sensibilitate (60%) și specificitate (79%) joase. La populația sănătoasă sunt prezenți numai anticorpi anti-gliadină tip IgG între 2-8%. Anticorpii antigliadină de tip IgG pot fi prezenți la unii pacienți cu NCGS - 56,4% (Volta, 2015), iar în boala celiacă - 81,2%. Anticorpii antigliadină de tip IgA se găsesc în proporție de 7% în NCGS și de 75% în boala celiacă. De subliniat că anticorpii antigliadină de tip IgG nu sunt markeri caracteristici pentru NCGS, dar pot fi pozitivi la 56,4% dintre bolnavi.
La majoritatea bolnavilor cu NGCS se produce dispariția anticorpilor antigliadină de tip IgG la scoaterea glutenului. Negativarea anticorpilor antigliadină de tip IgG în evoluția NCGS este în relație cu răspunsul clinic bun la dieta gluten-free. Aceștia dispar la adult după 6 luni de dietă gluten-free.
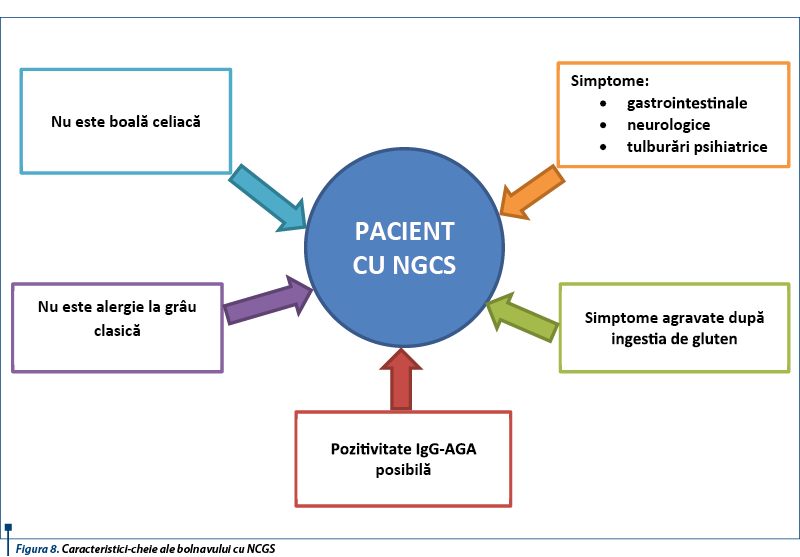
Caracteristicile-cheie de identificare a bolnavului cu NCGS sunt prezentate în figura 8.
Scopul confirmării diagnosticului de NCGS privește:
- evaluarea răspunsului clinic la dieta gluten-free (GFD);
- evaluarea efectelor clinice după reintroducerea glutenului (după GFD).
Diagnostic diferențial
Diagnosticul diferențial este posibil prin coroborarea datelor clinice, biologice, genetice și histologice, pentru a departaja cele trei manifestări legate de gluten (alergia alimentară, boala celiacă și NCGS).
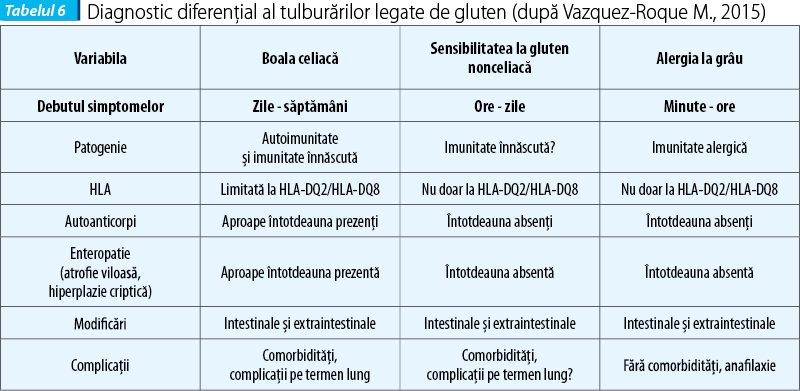
Manifestările legate de gluten pot fi diferențiate pe baza unor aspecte ca debutul simptomelor, patogenie, HLA, autoanticorpi, enteropatie (definită histologic prin atrofie viloasă și hiperplazie criptică), semne clinice și complicații, așa cum sunt prezentate în tabelul 6.
Tratament
În general, pentru NCGS, ca și pentru boala celiacă și alergia la grâu, tratamentul constă în dietă gluten-free (GFD).
Evoluție
Nu se știe exact dacă evoluția este tranzitorie sau permanentă, de aceea este nevoie de reevaluare periodică la 6-12 luni, în vederea reintroducerii glutenului.
Sensibilitatea la gluten nonceliacă la copil
Sensibilitatea la gluten nonceliacă la copil era până de curând diagnosticată ca „reacție adversă non-IgE la grâu”. Francavilla și colab. publică în 2014 primul studiu care descrie o serie de cazuri pediatrice de NCGS, care demonstrează existența bolii și la copii, la toate vârstele, prezentând aspecte parțial similare cu cele de la adult. NCGS la copil prezintă simptome digestive asemănătoare cu boala celiacă și cu tulburările funcționale - semne nespecifice care nu sunt sugestive pentru NCGS. Semnele extradigestive sunt mai puțin frecvente ca la adult (oboseala). Lipsesc markerii biochimici, serologici și genetici, la fel ca la adult. În NCGS, examenul genetic HLA-DQ2 este pozitiv în 46% dintre cazuri și anticorpii antigliadină de tip IgG sunt prezenți în 66% dintre cazuri. Anticorpii antigliadină și HLA-DQ2 sunt pozitive la 50% dintre cazuri, ca la adult, dar mai frecvente decât la grupul de control.
Examenul histologic la copilul cu NCGS arată mucoasă normală sau ușor infiltrată (Marsh 0 = 82%, Marsh 1 = 18%) și limfocitele intraepiteliale scăzute. Nu se știe dacă NCGS este permanentă sau tranzitorie, de aceea se recomandă reevaluarea periodică la 6-12 luni, în vederea reintroducerii glutenului, pentru a evita dietele gluten-free inutile, nemotivate, întrucât pe termen lung acestea sunt periculoase, au cost ridicat și risc de încadrare incorectă a bolii.
Ca urmare a lipsei markerilor serologici sau a histologiei specifice, diagnosticul sensibilității la gluten nonceliace rămâne clinic și se bazează pe excluderea bolii celiace și a alergiei la grâu și pe testul de încărcare la gluten. NCGS la copil este o entitate nouă, care așteaptă validare și clarificări. NCGS trebuie suspectată numai la copii selectați, după ce s-au exclus boala celiacă și alergia la grâu.
Concluzii
Boala celiacă și alergia la grâu sunt boli induse de gluten care sunt bine definite, cu ghiduri clare de diagnostic și tratament, pe când NCGS este o entitate încă discutată, cu mai multe întrebări decât răspunsuri privind natura ei, diagnosticul și tratamentul.
Bibliografie
2. Cooper BT, Holmes GK, Ferguson R, Thompson RA, Allan RN, Cooke WT. Gluten sensitive diarrhea without evidence of celiac disease. Gastroenterology, 1980;79:801-6.
3. Cristofori F, Arezzo F, Gentile A, Francavilla R. Gluten Sensitivity in Pediatrics: A Clinical Conundrum. Curr Pediatr Rep (2014) 2:204–210.
4. Eswaran S., Goel A., Chey W.D. What role does wheat play in the symptoms of irritable bowel syndrome? Gastroenterol. Hepatol.2013;9:85–91.
5. Ferguson A, Arranz E, O'Mahony S. Clinical and pathological spectrum of coeliac disease-active, silent, latent, potential. Gut. 1993 Feb; 34(2): 150–151.
6. Francavilla R, Cristofori F, Castellaneta S, Polloni C, Albano V, Dellatte S et al. Clinical, Serologic, and Histologic Features of Gluten Sensitivity in Children. J Pediatr 2014;164:463-7.
7. Meijer CR, Shamir R, Mearin ML. Coeliac Disease and Noncoeliac Gluten Sensitivity. JPGN 2015;60: 429–432.
8. Nijeboer P, Bontkes HJ, Mulder CJJ, Bouma G. Non-celiac Gluten Sensitivity. Is it in the Gluten or the Grain? J Gastrointestin Liver Dis, December 2013 Vol. 22 No 4: 435-440.
9. Ray K. Microbiota: Tolerating gluten - a role for gut microbiota in celiac disease? Nature Reviews Gastroenterology & Hepatology 9, 242 (2012).
10. Sapone A, Lammers KM, Mazzarella G, Mikhailenko I, Cartenì M, Casolaro V, Fasano A. Differential mucosal IL-17 expression in two gliadin-induced disorders: gluten sensitivity and the autoimmune enteropathy celiac disease. Int Arch Allergy Immunol. 2010;152(1):75-80.
11. Sapone A, Leffler DA, Mukherjee R. Non-celiac Gluten Sensitivity: Where We Are in 2015? Practical Gastroenterology, June 2015.
12. Tonutti E, Bizzaro N. Diagnosis and classification of celiac disease and gluten sensitivity. Autoimmun Rev. 2014 Apr-May;13(4-5):472-6.
13. Vazquez-Roque M, Oxentenko AS. Nonceliac Gluten Sensitivity. Mayo Clin Proc., September 2015;90(9):1272-1277.
14. Vazquez-Roque MI, Camilleri M, Smyrk T, et al. A Controlled Trial of Gluten-Free Diet in Patients With Irritable Bowel Syndrome-Diarrhea: Effects on Bowel Frequency and Intestinal Function. Gastroenterology. 2013;144:903–911.
15. Volta U, Bardella MT, Calabrò A, Troncone R, Corazza GR and The Study Group for Non-Celiac Gluten Sensitivity. An Italian prospective multicenter survey on patients suspected of having non-celiac gluten sensitivity. BMC Medicine 2014, 12:85.
16. Volta U, De Giorgio R. New understanding of gluten sensitivity. Nat. Rev. Gastroenterol. Hepatol. 9, 295–299 (2012).
17. Volta U, Caio G, De Giorgio R, Henriksen C, Skodje G, Lundin KE. Non-celiac gluten sensitivity: a work-in-progress entity in the spectrum of wheat-related disorders. Best Pract Res Clin Gastroenterol. 2015 Jun; 29(3):477-91.
Articole din ediţiile anterioare
Sindrom Lyell - consideraţii pe baza unui caz clinic
Lyell syndrome – or toxic epidermal necrolysis – is a severe mucocutaneous reaction caused by the administration of a drug, and is characterized by...
Sindromul hiper-IgE − între provocări clinice şi complexitate patogenică
Sindromul hiper-IgE este o imunodeficienţă primară complexă, ce implică sistemul imun, oasele, ţesutul conjunctiv şi dinţii. Alături de valorile m...
Hipertensiunea arterială la copilul de azi – începutul unei boli cronice la adultul de mâine
Hipertensiunea arterială la copil reprezintă un sindrom clinic care apare atunci când valoarea tensiunii arteriale depăşeşte percentila 95 pent...
Tratamentul insuficienţei hepatice acute la copil
Insuficienţa hepatică acută (IHA) este un sindrom caracterizat prin alterarea rapidă a funcţiei hepatice, icter şi coagulopatie severă (o valoare a...