Haemolytic uremic syndrome ( HUS) is the most frequent and severe cause of acute kidney injury (AKI) in infants and children. The authors present an update in HUS with prodromal diarrhea, also called typical HUS, caused by Shiga-like toxins produced by enterohemorhagic, invasive, type of E. coli, EHEC- Stx or verotoxins. Typical HUS has a sudden onset, affecting children who were previously healthy. The severity of this syndrome is remarkable, being a life-threatening multisystemic disease. By definition, HUS consists of a triad of symptoms: haemolytic anaemia with fragmented erythrocytes, schizocytes, thrombocytopenia and AKI. All over the world there are outbreaks of STEC-HUS and unfortunately there is no specific therapy for D+ HUS. The mortality rates (between 5-10%) is constantly associated with extrarenal involvement of the disease, with multiple organ failure, and mainly central nervous system involvement (cerebral edema, vascular injuries, intracranial hypertension), followed by seizures and other neurological signs noted early in the course of the disease. Some other HUS major complications are also described: colonic strictures, intestinal perforations, intussuception, billiary lithiasis, pancreatitis, diabetes, cardiac, pulmonary and muscle impairment, hypertension and progressive chronic renal disease (CKD), or end stage renal disease (ESRD) in 4% of the cases who need dialytic therapy. Early diagnosis and supportive care are of major importance. In 10% of cases, CKD is diagnosed even after 15 years or more of follow-up, in 20-60% of the patients who manifested persistent proteinuria and/or hypertension. These problems may appear after several years of apparent recovery. This is why this pathology still remains a major cause of morbidity and mortality in children younger than five years old. The authors also present a series of 32 cases admitted in the Emergency Children’s Hospital ”Maria Sklodowska Curie”, Nephrology - Dialysis department, in the year 2016.
Sindromul hemolitic uremic tipic. Abordare diagnostică și terapeutică. Serie de cazuri
Typical haemolytic uremic syndrome. Therapeutic and diagnostic approach. Case series
First published: 09 noiembrie 2016
Editorial Group: MEDICHUB MEDIA
Abstract
Rezumat
Sindromul hemolitic uremic (SHU) este cea mai frecventă și severă cauză de injurie renală acută (IRA) la sugar și copil. Autorii prezintă actualități diagnostice și terapeutice în SHU, cu diaree prodromală, denumit și SHU tipic, cauzat de serotoxine „Shiga like”, produse de diferite tipuri de E. coli invazive, enterohemoragice, numite EHEC - Stx sau verotoxine. SHU debutează brusc și afectează un copil aflat în plină stare de sănătate la momentul îmbolnăvirii. Severitatea acestui sindrom este remarcabilă, întrucât afectarea este multisistemică, cu implicații asupra prognosticului vital. Prin definiție, SHU se caracterizează prin existența triadei compusă din anemie hemolitică microangiopatică, cu eritrocite fragmentate, schizocite, depistate pe frotiul de sânge periferic, trombocitopenie și injurie renală acută. În toată lumea au loc epidemii ale sindromului hemolitic uremic datorat E. coli, producătoare de toxină Shiga (Stx). Nu există la momentul actual un tratament specific pentru SHU tipic. Rata mortalității în faza acută a bolii este de 5-10% și este în mod constant asociată cu manifestările extrarenale ale bolii, cu insuficiența multiorganică și, în principal, cu afectarea sistemului nervos central (edem cerebral, injurii vasculare, hipertensiune intracraniană), ce se traduce clinic prin convulsii și alte semne neurologice apărute precoce în evoluția bolii. În SHU se descriu și alte complicații majore, precum: stricturi ale colonului, perforații intestinale sau invaginație intestinală, litiază biliară, pancreatită, diabet, afectare severă cardiacă, pulmonară sau musculară, hipertensiune, boală renală progresivă (BCR) sau boală renală cronică terminală (ESRD) în 4% din cazurile severe ce necesită terapie dialitică de lungă durată. Diagnosticul precoce și tratamentul suportiv au importanță majoră în abordarea clinică a SHU tipic. În 10% din cazuri, pacienții ajung în stadiul de BCR după 15 ani de la episodul acut (20-60% dintre pacienții care prezintă proteinurie persistentă și hipertensiune arterială, consecințe ale BCR). Acestea sunt motivele pentru care această afecțiune rămâne o cauză majoră de morbiditate și mortalitate în patologia pediatrică. În cadrul articolului, autorii prezintă și seria de 32 de cazuri de SHU tipic spitalizate în secția de nefrologie-dializă a Spitalului „Maria Sklodowska Curie” în anul 2016.
Review al literaturii de specialitate
Sindromul hemolitic uremic (SHU) a fost descris de Gasser în 1955, iar în anii ’80, Karmali și colaboratorii au publicat mai multe cazuri de sindrom hemolitic uremic care asociau prodrom diareic (SHU tipic) datorat toxinei Shiga-like (Stx sau verotoxină).
SHU este definit prin existența unei triade compuse din: anemie hemolitică microangiopatică (având valori ale hemoglobinei sub 10 g/dl și prezența eritrocitelor fragmentate, a schizocitelor pe frotiul din sângele periferic); trombocitopenie (valoarea trombocitelor sub 150.000/uL) și injurie renală acută (IRA) evidențiată prin valori ale creatininei serice mai mari de 1,5 ori față de normalul pentru vârstă și gen. Majoritatea cazurilor de SHU tipic apar în peste 90% din cazuri la copilul de vârstă mică și se asociază infecției cu Escherichia coli, în timp ce forma atipică poate să apară la orice vârstă, fiind determinată de anomalii genetice ale factorilor implicați în reglarea căii alterne a complementului(1).
SHU tipic este, din punct de vedere patogenic, o vasculită, stratul vascular afectat fiind endoteliul; astfel SHU este, în egală măsură, o endotelită. Injuria endoteliului vascular poate fi cauzată de o serie de factori precum: toxine bacteriene, medicamente, boli sistemice, malignități, anomalii în reglarea căii alterne a complementului, diminuarea valorilor proteinei ce clivează factorul von Willebrand (FvW) - ADAMTS13, preeclampsie sau sindrom HELLP(1). Din cauza modificărilor vasculare structurale cauzate de diferiți triggeri, este afectată și încetinită microcirculația prin formare de trombi la acest nivel. Într-un astfel de context patogenic se descrie microangiopatia trombotică (TMA), ce cuprinde un grup de entități caracterizate printr-o leziune histologică identică: trombi arteriolari, edem al intimei vasculare și necroză fibrinoidă a peretelui vascular(2,16) (figura 1).

Leziunile vasculare din TMA sunt ilustrate de două tablouri clinice: SHU și purpura trombotică trombocitopenică (PTT), ambele caracterizate prin microangiopatie și tromboze, și reprezintă entități clinice diferite. SHU este definit prin triada: anemie hemolitică microangiopatică, trombocitopenie și injurie renală acută, în timp ce PTT se caracterizează prin pentada: anemie hemolitică microangiopatică, trombocitopenie, febră, injurie renală acută și anomalii neurologice. Pe diferite serii clinice de cazuri, manifestările renale sunt mai pregnante în SHU, iar cele neurologice în PTT.
Din punct de vedere histopatologic, se observă: îngroșarea peretelui vascular, edemul și dezlipirea celulelor endoteliale, agregare plachetară, tromboze, acumulare de material ocluziv în spațiul subendotelial și obstrucție vasculară parțială sau completă. Compoziția trombilor diferă în SHU față de PTT(3,4). În SHU asociat cu toxina Shiga (Stx), trombii sunt bogați în fibrină, iar în PTT trombii conțin factor von Willebrand și trombocite degranulate (anomalii trombocitare)(1,2,4). Astfel, atât SHU, cât și PTT se manifestă ca microangiopatii trombozante. Anemia microangiopatică nu se asociază cu test Coombs pozitiv; în ambele tipuri de TMA, anemia este rezultatul modificărilor reologice produse de trombii formați.
Deși face parte din categoria microangiopatiilor trombotice, SHU se subclasifică la rândul său în mai multe categorii. Clasic, sindromul hemolitic uremic era subclasificat în funcție de existența sau nu a prodromului diareic în: SHU D+ (cu prodrom diareic), respectiv SHU D- (fără prodrom diareic). Altfel spus, SHU postinfecțios care asociază diaree prodromală (fiind datorat proteinelor toxigenice, invazive, Stx1 și Stx2, numite și verotoxine VT-1, VT-2) se numește SHU tipic, în timp ce SHU non-postinfecțios (din cauza unor anomalii ale căilor de reglare ale complementului, cauze imunologice, oncologice, obstetricale etc.) se numește SHU atipic. Ultima clasificare apărută în protocolul de diagnostic și tratament al SHU atipic din ianuarie 2016 împarte SHU în mai multe subgrupe(1) (figura 2).

Conform acestei clasificări, SHU tipic, cauzat de Stx1 sau Stx2, face parte din SHU postinfecțioase, alături de SHU pneumococic sau cel apărut în contextul epidemiilor gripale cu virus AH1N1.
În zilele noastre, incidența SHU asociat cu Escherichia coli producătoare de toxină Shiga (SHU-STEC) este de aproximativ 6/100.000 la sugar și copilul cu vârstă sub 5 ani și 2/100.000 în întreaga populație (incluzând și adulții)(5). În Europa, 60-70% din cazuri sunt datorate E. coli producătoare de toxină Shiga (Stx), serotip O157: H7, numit și E. coli enterohemoragic (EHEC).
Alte serotipuri enterohemoragice întâlnite în patologia copilului sunt: O26 (25%), O111 (11%), O145 (11%) și O103 (6%), în timp ce O55, O27, O118 și O120 reprezintă sub 1% din totalul cazurilor.
Frecvent, această infecție evoluează în valuri epidemice. În perioada mai-iulie 2011, mai multe țări europene (în special în regiunile din nordul Germaniei) au raportat cea mai importantă cazuistică STEC-HUS descrisă până în acest moment (3.816 pacienți cu infecție STEC, 845 de cazuri de SHU și 54 de decese)(5). Incidența bolii rămâne constantă, chiar ușor crescută. În Argentina și Uruguay, endemicitatea cu Stx - E. coli este cea mai mare din lume; aproximativ 39% din carnea de vită este infestată cu Stx - E. coli(2).
Escherichia coli enterotoxigen se întâlnește într-o varietate de surse: apă, lapte, produse lactate, legume, carne infestată ce provine de la animalele cornute (vaci, oi, capre), dar și cai, câini, păsări sălbatice sau domestice, muște ce se hrănesc cu fecalele acestor animale. Stx-E. coli este cvasiprezent la cornute. Este important de subliniat faptul că o cantitate foarte mică de produs infestat poate cauza boala. Devine astfel esențială reducerea contaminării cu fecale în timpul sacrificării animalelor și al procesării cărnii. Educația sanitară impune o igienă riguroasă legată de prepararea cărnii și a produselor din carne (mai ales carnea tocată), a laptelui și preparatelor din lapte (nepasteurizat), separarea produselor crude de cele procesate, utilizarea atentă a ustensilelor din bucătărie la gătit (tocătoare, caserole). Nu trebuie neglijată nici igiena personală (spălatul mâinilor). De asemenea, se pot contamina jucăriile, iar copilul poate fi expus prin manipularea acestora(5).
SHU tipic este o boală sistemică; deși apare în întreaga lume, este mai puțin raportat în țările cu servicii medicale puțin dezvoltate. Odată ingerată, E. coli produce toxina Shiga, ce se multiplică în colonul pacientului. Sunt două tipuri de toxine, Stx1 și Stx2, molecule similare toxinei produse de Shigella disenteriae (toxina Shiga).
Din punct de vedere clinic, în 38-75% din cazuri apar dureri abdominale sub formă de crampe sau tenesme și diaree non-sangvinolentă, simptomatologie notată după o latență de aproximativ 3 zile de la ingestia produsului infestat. La 70% din pacienți, diareea devine sangvinolentă după 1-2 zile și poate fi asociată cu vărsături. Leziunile inflamatorii și hemoragiile mucoasei se descriu a fi localizate la nivelul colonului ascendent și transvers. Transportul toxinei prin epiteliul gastrointestinal se realizează printr-un mecanism transcelular, favorizat de migrația leucocitelor la nivelul endoteliului vascular(5,6). Proteinele care favorizează agresivitatea celor două toxine sunt: intimina, care mediază aderarea Stx1 la celulele mucoasei colonului, și globotriosilceramidul (Gb3), ce mediază aderarea Stx2 la polimorfonuclearele neutrofile (PMN), monocite, eritrocite și la celulele endoteliale.
Toxinele (Stx1 și Stx2, sau verotoxinele 1 și 2) sunt formate din subunitatea A și 5 subunități B (subunitatea A mediază efectul toxic, în timp ce subunitățile B promovează legarea de unele celule de tip eucariot). Cele 5 subunități B se leagă la nivel tisular de Gb3, cu care formează un por. Prin acest por pătrunde intracitoplasmatic strict subunitatea A, cu activitate toxică, enzimatică. Aceasta este transportată în aparatul Golgi, iar prin mecanism retrograd ajunge la nivelul ribozomilor de pe suprafața reticulului endoplasmatic rugos. Odată ajunsă la nivel ribozomal, subunitatea A blochează ireversibil componenta 60S ribozomală, fapt corelat cu inhibiția sintezei proteice și moarte celulară. Cu cât sunt afectate mai multe celule prin acest mecanism, cu atât severitatea tabloului clinic este mai marcată, mai gravă(6).
Stx2 este de aproximativ 400 de ori mai toxică decât Stx1 și este responsabilă de boala renală. Gb3 se găsește în cantitate crescută la nivelul celulelor din parenchimul renal, fapt ce se corelează cu toxicitatea renală. Totodată, Stx2 duce la supraexpresia Gb3 la nivelul sistemului nervos central; astfel, complicațiile neurologice se întâlnesc în formele severe de boală, fiind cele care întunecă prognosticul și pot conduce evoluția pacientului către exitus. Localizarea anatomică a Gb3 este dependentă de vârstă, explicând astfel vulnerabilitatea copilului față de SHU tipic.
Injuriile tubulare se asociază cu eliberarea unui număr mare de citokine și chemokine (TNF, PDGF și IL8). Într-o primă fază apare diareea, urmată de injuria renală acută (în 7-10 zile de la ingestia toxinei). Microscopic, se constituie depozite de fibrină în capilare, cu tromboză și hialinoză consecutive(6). Ulterior, în evoluția bolii apare afectare tubulară focală sau segmentară, cu necroze, atrofie tubulară și modificări interstițiale. Toate acestea conduc la apariția bolii renale progresive. Leziunile tubulare explică și fiziopatologia tulburărilor de reglare hidrică de la acest nivel (Stx 2, prin subunitatea B, inhibă absorbția apei la nivelul celulelor epiteliale tubulare).
Deși se descriu aceste leziuni microscopice renale, la pacientul cu SHU nu se recomandă efectuarea puncției-biopsie renale. Investigațiile minime ce trebuie avute în vedere sunt: hemogramă cu frotiu de sânge periferic, markeri ai sindromului inflamator, evaluarea echilibrului acido-bazic, teste ale funcției renale, teste hepatice, glicemie, amilază, lipază, LDH, sumar de urină. Astfel, hemograma și frotiul de sânge periferic vor evidenția anemia, hemoliza (cu particularitățile morfologice care ilustrează microangiopatia, prezența schizocitelor) și trombocitopenia. Primele investigații ce sugerează un SHU în desfășurare sunt leucocitoza severă (și progresiv crescândă), trombocitopenia marcată și prezența eritrocitelor fragmentate (schizocite) pe frotiu. Inițial, azotemia crescută poate fi atribuită deshidratării, dar, asociată hemolizei și trombocitopeniei, aceasta marchează de fapt debutul SHU. Un alt indicator precoce al SHU este valoarea crescută a LDH-ului. Sumarul de urină poate furniza mai multe modificări: hematurie, proteinurie (semne de afectare glomerulară), în condițiile unei emisii de urină chiar minime la debutul bolii.
Sunt necesare teste rapide pentru cele două tipuri de toxine - VT1 și VT2, coproculturi pentru tipizarea E. coli, determinări genetice (serice, salivare) pentru depistarea factorilor de agresivitate prin PCR. În cazul multor pacienți, „pasajul” bacterian este de foarte scurtă durată, dar implicațiile epidemiologice sunt mari. În SHU tipic, de regulă, coagularea nu este modificată; fibrinogenul, tromboplastina, timpul parțial de tromboplastină au valori normale sau ușor crescute. Icterul este un semn clinic inconstant; bilirubina are valori normale (întrucât hemoliza apare prin mecanisme reologice, fiind strict localizată la nivelul endoteliului; nu este o hemoliză desfășurată la nivel sistemic). Fracțiunile complementului și alte determinări specifice (mutații ale genelor specifice ale complementului) și activitatea proteazei de clivare a factorului von Willebrand - ADAMTS13 sunt necesare în diagnosticul SHU atipic. Fracțiunile C3 și C4 pot fi scăzute la jumătate din pacienții cu SHU-Stx.
La debutul bolii pot să apară simptome neurologice sau cardiace asociate pe termen lung cu un prognostic nefavorabil. Mortalitatea (3-5%) este constant cauzată de patologia extrarenală, insuficiența multiorganică, afectarea sistemului nervos central (edem cerebral, injurii vasculare, hipertensiune intracraniană), convulsii sau alte semne neurologice(7,8). Citokinele proinflamatorii au rol de „pivot” în declanșarea encefalopatiei (fiind implicate în apariția necrozei arteriolare intracerebrale și a afectării endoteliale). Hiponatremia (mai rar, hipernatremia) este un alt factor responsabil de modificările neurologice. În Japonia, 64% din pacienții cu hiponatremie (Na <130 mEq), la debutul SHU, au avut indicație de terapie de substituție renală(13,25). Totodată, cei care primesc fluide hipotone pot să asocieze hiponatremie iatrogenă, ce facilitează apariția edemului cerebral, acesta fiind un alt criteriu obligatoriu de instituire a dializei. Prin urmare, cauzele encefalopatiei în SHU sunt: microangiopatia, hipertensiunea intracraniană și hiponatremia. Manifestările neurologice sunt extrem de variate și pot îmbrăca mai multe forme: alterări ale stării de conștiență, confuzie, convulsii în 25% din cazuri (stare de rău convulsiv), agitație, halucinații, sindrom piramidal sau extrapiramidal, hemipareze, hemiplegii, tulburări de vedere/orbire, dizabilități severe - persistente sau permanente; edemul cerebral și hernierile cerebrale sunt implicate în cazurile de deces(6,9). În contextul tabloului clinic sugestiv de encefalopatie, ilustrată de o largă varietate de manifestări neurologice, recomandările sunt pentru utilizarea pulsterapiei cu metilprednisolon timp de 3 zile consecutiv, cu prognostic evolutiv favorabil(8).
Sunt descriși mai mulți factori nefavorabili atât pentru prognosticul vital, cât și pentru patologia neurologică sechelară și/sau boală progresivă renală. Aceștia sunt reprezentați de severitatea encefalopatiei acute, leucocitoza progresiv crescândă, în discordanță cu anemia și trombocitopenia, severitatea afectării gastrointestinale și complicațiile acesteia, severitatea afectării renale, necesitatea a peste 20 de zile de dializă.
Fiind o boală sistemică, în cazul multor pacienți diagnosticați cu SHU apare o simptomatologie complexă atât renală, cât și extrarenală, ce se poate concretiza în: diabet insulinodependent, pancreatită, insuficiență pancreatică, complicații gastrointestinale (stricturi la nivelul colonului, perforații intestinale, prolaps rectal, invaginație intestinală), calculi biliari, afectare pulmonară, cardiacă, hepatică, afectarea mușchilor scheletici, diverse leziuni neurologice (chiar și accidente vasculare cerebrale) progresive, sechelare, hematurie, proteinurie, hipertensiune, boală renală cronică progresivă.
În faza acută a bolii, tratamentul este suportiv(17,18). Dacă pacientul este deshidratat, se recomandă folosirea soluțiilor saline izotonice (pentru a preveni instalarea oliguriei, anuriei, cât și instituirea terapiei de substituție renală). Bolusurile saline (SF 0,9%, 10-15 mL/kg) la debut limitează depleția intravasculară, scad intensitatea trombozelor, hipoperfuzia, hipoxia și leziunile ischemice consecutive. Hiperhidratarea reprezintă un risc, dar și deshidratarea și hemoconcentrația sunt riscuri, la debut, pentru complicațiile neurologice și boala cronică renală evolutivă(10).
Studiile de cohortă efectuate au arătat că pacienții care au primit antibiotic în faza prodromală au avut prognostic infaust, față de cei care nu au primit antibiotic, întrucât se consideră că antibioticul omoară bacteria și duce la eliberarea unei cantități mai mari de verotoxină; totodată, această verotoxină va sta în contact cu mucoasa colonului mai mult timp în cazul folosirii antibioticelor(15,22). Prin urmare, vor fi tratate complicațiile: manifestările neurologice, mai ales convulsiile (20-40% din copii prezintă convulsii), iar în cazul crizelor de convulsii recurente și prelungite se va administra tratament profilactic cu fenitoin. Va fi tratată specific și hipertensiunea arterială, manifestare clinică frecvent asociată. Pentru aceasta din urmă, prima linie de tratament este reprezentată de blocantele de calciu, iar ulterior se poate asocia și furosemidul. Dacă efectul cumulativ nu este suficient, se instituie dializa.
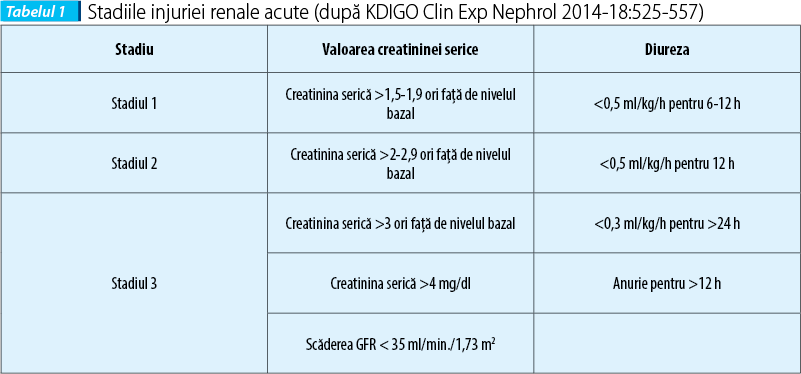
Din cauza injuriei renale acute, până la 60% din pacienți necesită terapie de substituție renală(11). Condițiile de inițiere a terapiei de substituție renală sunt clar stipulate în Kidney Disease Improving Global Outcomes (KDIGO); astfel, se recurge la dializă când există: semne de hipervolemie - edem pulmonar acut, insuficiență cardiacă, HTA neresponsivă la tratament, diselectrolitemii (hiperpotasemie >6,5 mEq/L, hiponatremie <120 mEq/L, acidoză cu pH <7, 20), manifestări uremice sau în funcție de valorile retenției azotate și de monitorizarea diurezei. KDIGO subclasifică injuria renală acută în 3 stadii, iar dintre acestea, stadiile 2 și 3 necesită dializă. Astfel, dacă un copil are valoarea creatininei serice >2 x normalul pentru vârstă și gen sau are diureza <0,5 ml/kg/h pentru cel puțin 12 ore consecutive, întrunește criteriile de inițiere a dializei (tabelul 1).
Trebuie să ținem cont că dializa nu influențează evoluția bolii, ci este doar o metodă suportivă de tratament. În literatura de specialitate nu există studii clare care să ateste posibilele beneficii ale diverselor tipuri de dializă folosite. În multe cazuri este justificată inițierea preventivă a dializei în condițiile în care în SHU este clinic demonstrată o perioadă lungă de oligoanurie. Această condiție trebuie anticipată și nici nu trebuie să se ajungă la o supraîncărcare volemică neresponsivă la tratament. În general, metodele de inițiere a dializei sunt bine conturate, în schimb, în literatura de specialitate există puține referiri legate de momentul stopării dializei. De regulă, dializa se suprimă atunci când funcția renală își reia activitatea, astfel încât să corespundă nevoilor pacientului sau când nu mai sunt clinic prezente criteriile pentru care a fost inițiată dializa, cu o excepție: se consideră că valorile retenției azotate sunt influențate de mai mulți factori, printre care statusul volemic și rata catabolismului; de aceea, acești parametri nu se recomandă drept criterii în a stopa dializa. În schimb, ceilalți parametri trebuie evaluați zilnic pentru a decide momentul oportun pentru oprirea dializei. Dintre aceștia, cel mai important criteriu este reluarea diurezei, dar în nici un caz nu se recomandă folosirea diureticelor pentru a scădea durata sau frecvența dializei. Nu este descrisă o durată maximală a terapiei de substituție renală pentru injuria renală acută întrucât s-a înregistrat o rată de supraviețuire de 35% la copiii care au necesitat dializă mai mult de 28 de zile. Trebuie însă avut în vedere și faptul că utilizarea procedurilor dialitice pe o perioadă >25 de zile se corelează cu boala renală progresivă, BCR și ESRD.
Plasmafereza nu este recomandată în schema inițială de tratament din SHU tipic. Se pare că aceasta va contribui la deteriorarea funcției renale și la prognosticul nefavorabil pe termen lung(6). În schimb, utilizată precoce, reprezintă tratamentul de elecție în SHU atipic și PTT, în special la adult.
Terapia cu anticorpi monoclonali (Eculizumab) îndreptați împotriva C5 blochează activarea componentelor terminale ale complementului și este singura medicație autorizată în SUA, la adult și adolescentul cu vârstă mai mare de 12 ani, pentru tratamentul SHU non-Stx (aprobare FDA 2011); există studii care au arătat că îmbunătățește semnificativ rata filtrării glomerulare, ameliorează trombocitopenia, cât și alți parametri serici(23,24).
În managementul pacientului cu SHU tipic se adaugă și terapie hidroelectrolitică specifică(12), monitorizarea și tratamentul complicațiilor hematologice, monitorizarea tensiunii arteriale și controlul blocadei renină-angiotensină la pacienții cu boală renală cronică progresivă, monitorizarea frecventă a valorilor hemoglobinei pe parcursul terapiei de substituție renală și introducerea cât mai rapidă, dacă este posibil, a nutriției pe cale orală.
Transfuziile cu masă eritrocitară sunt necesare dacă valorile hemoglobinei scad rapid sau dacă aceasta atinge o valoare sub 6-7 g/dL; durata de 2-4 ore a transfuziei de sânge va asocia și tratament diuretic pentru evitarea supraîncărcării lichidiene. Terapiile noi recomandă încărcare lichidiană intravenoasă precoce (imediat după diagnostic), în scopul diminuării trombozelor și a leziunilor ischemice multiorganice, cu efecte favorabile atât pe termen scurt, cât și în evoluția pe termen lung a bolii(10,20).
Transplantul renal este recomandat în cazul pacienților copii cu SHU tipic care progresează spre boală renală cronică - stadiu terminal (ESRD). Recurența bolii în rinichiul transplantat este 0-10%. Transplantul renal nu este o opțiune pentru pacienții cu non-Stx - SHU, în cazul cărora se descrie recurența bolii în 50% din cazuri și eșecul grefei renale în peste 90% din recurențe; în cazul copiilor cu defect genetic de HF1 se recomandă transplant hepatic (HF1 este o proteină plasmatică cu origine hepatică). Transplantul simultan rinichi-ficat, în cazurile efectuate, a fost însă complicat de rejetul rapid al grefei hepatice(12).
Durata oligoanuriei este cel mai elocvent element de prognostic pe termen lung pentru viitoarele posibile complicații. Întrucât există posibilitatea creșterii presiunii intraglomerulare, cu hiperfiltrare consecutivă în faza regenerativă a SHU și implicit asocierea proteinuriei, se recomandă utilizarea unei diete hipoproteice (2,5-1,5 g prot/kg), a inhibitorilor de enzimă de conversie ai angiotensinei (captopril, enalapril) sau, pentru copilul de vârstă mai mare, a blocanților receptorilor angiotensinei (sartani) în vederea inhibiției sistemului renină - angiotensină - aldosteron(12,14,19,21).
Deși s-au făcut progrese mari în înțelegerea fiziopatologiei SHU determinat de E. coli producătoare de Stx, schemele de tratament nu s-au schimbat în ultimii ani. Prin urmare, diagnosticul este clinic, iar necesitatea diagnosticului precoce este imperioasă.
După un episod de SHU, aprecierea prognosticului indică o rată de supraviețuire la 5 ani de 80%, iar 2/3 din decese apar în primii 2 ani de la injuria renală acută, în funcție de severitatea acesteia. În contextul nivelului cunoașterii actuale etiologice, patogenice și mai ales terapeutice, SHU reprezintă o provocare continuă inter- și multidisciplinară pentru pediatri, infecționiști, epidemiologi, terapiști intensiviști, imagiști, chirurgi pediatri, pentru studiile de medicină fundamentală și biologie celulară, pentru serviciile de sănătate publică și, mereu în prima linie, pentru nefrologul pediatru.
Materiale și metode
S-a efectuat un studiu medical cantitativ, transversal, descriptiv/non-experimental, retrospectiv, ce a inclus un lot de 32 de pacienți diagnosticați cu sindrom hemolitic-uremic tipic, internați în perioada februarie - noiembrie 2016 în Spitalul Clinic de Urgenţă pentru Copii „Maria Sklodowska Curie” din Bucureşti. Totodată, au fost studiate datele demografice ale pacienților (vârstă, gen, mediul de proveniență) și datele clinico-patologice, care au fost prelucrate folosind programul Microsoft Office Excel 2010.
Rezultate și discuții
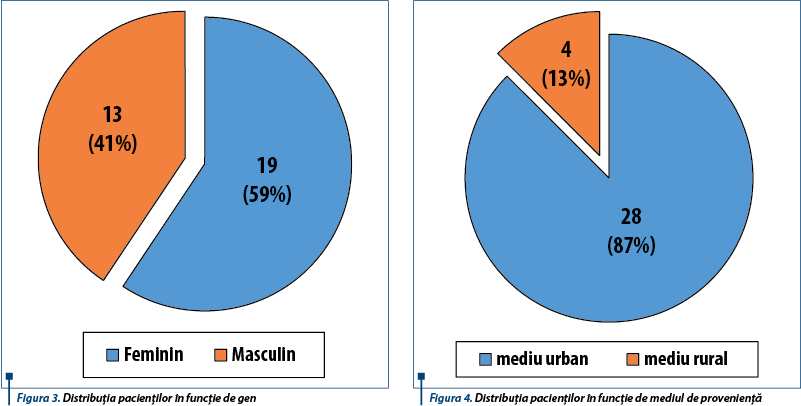
Din cei 32 de pacienți studiați, majoritatea a fost reprezentată de fete (19 pacienți) - figura 3, iar cea mai mare parte a pacienților au provenit din mediul urban (figura 4).
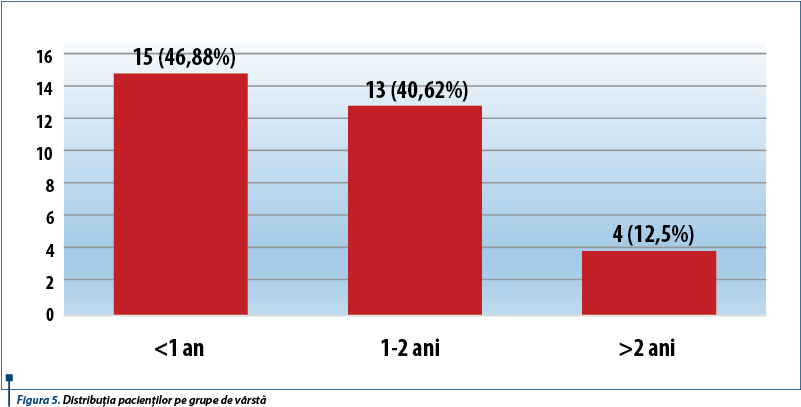
Pacienții cuprinși în studiu au avut vârste cuprinse între 6 luni și 3 ani și 5 luni, fiind preponderent sugari (15 pacienți) și antepreșcolari cu vârste cuprinse între 1 și 2 ani (13 pacienți), în timp ce doar 4 pacienți au avut vârsta peste 2 ani (figura 5).
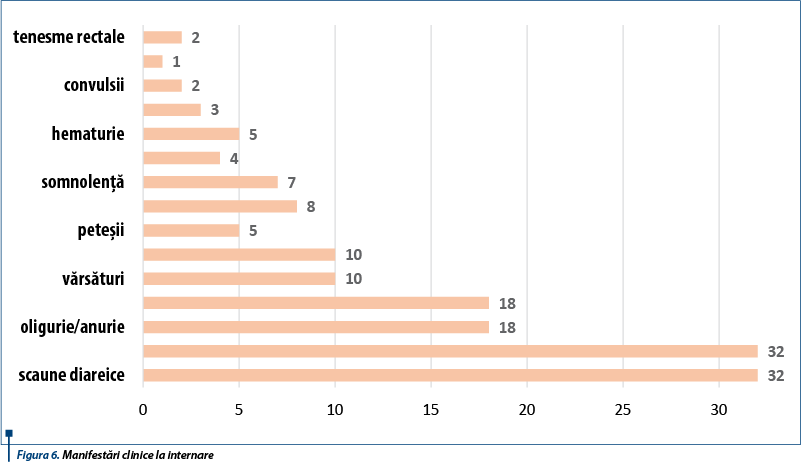
Principalele manifestări clinice la internare (figura 6) au fost scaunele diareice (toți pacienții au asociat în evoluție scaune diareice, iar 13 dintre aceștia au prezentat scaune cu striuri de sânge) - figura 7, oligurie/anurie (18 cazuri, din care 4 au prezentat anurie) - figura 8, tegumente palide (toți cei 32 de pacienți), edeme (în 18 cazuri - 56,25%), vărsături (10 cazuri), peteșii (5 cazuri), semne de deshidratare (10 cazuri); două cazuri au prezentat convulsii hiponatremice.
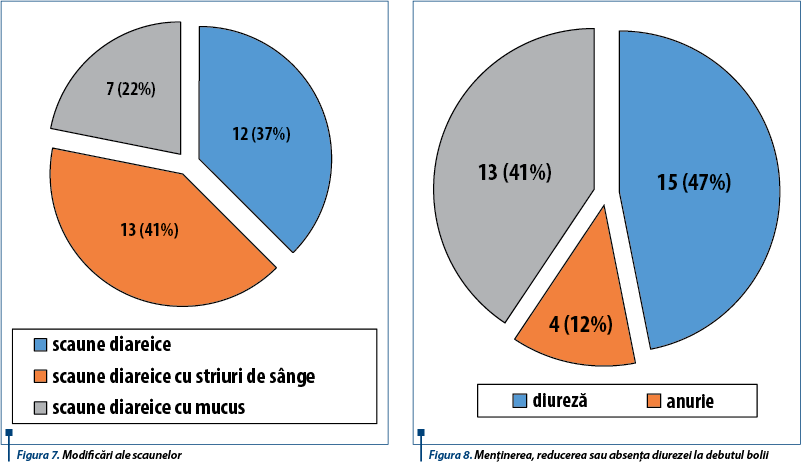
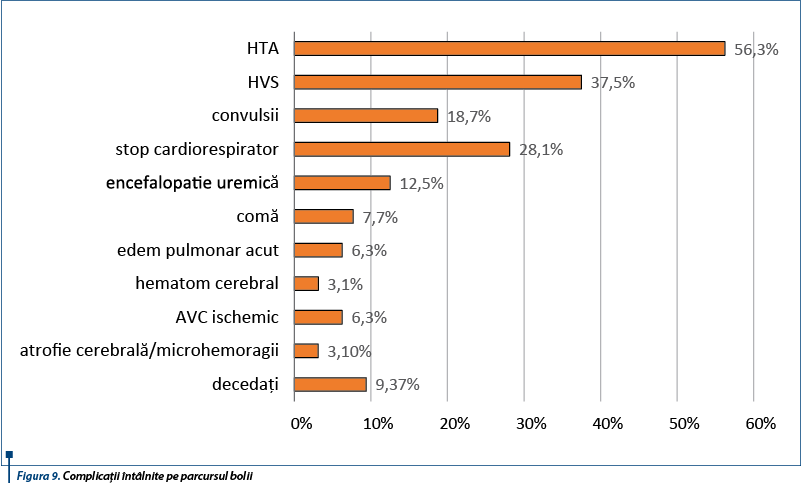
Evoluția pacienților a fost grevată de numeroase complicații întâlnite pe parcursul bolii. Cele mai frecvente complicații întâlnite în această serie de cazuri au fost îndeosebi cardiovasculare și neurologice - 18 pacienți (56,3%) au dezvoltat hipertensiune arterială, 5 pacienți au asociat hipertrofie ventriculară stângă (37%), 2 cazuri de edem pulmonar acut, 6 cazuri de convulsii prin dezechilibre hidroelectrolitice, 4 pacienți au dezvoltat encefalopatie uremică, 2 pacienți comă, 1 caz de hematom cerebral, 2 cazuri de AVC ischemic, 1 caz de atrofie cerebrală/microhemoragii. De asemenea, 3 cazuri au prezentat stop cardiorespirator neresponsiv la manevrele de resuscitare (figura 9).
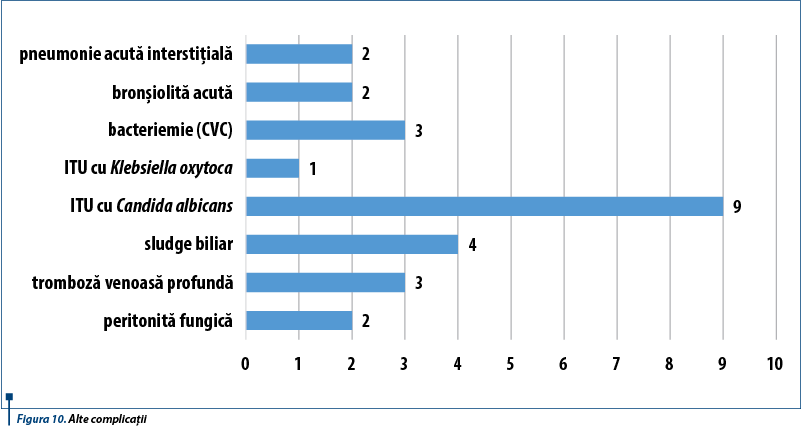
Alte complicații pe care le-au prezentat pacienții din lotul studiat au fost reprezentate de: infecții de tract urinar cu Candida albicans (9 pacienți), sludge biliar (4 pacienți), peritonită fungică, tromboză venoasă profundă, bronșiolită acută, pneumonie interstițială, infecție de tract urinar cu Klebsiella oxytoca, bacteriemie (cateter venos central) (figura 10).
Ecografia transtoracică a evidențiat următoarele modificări la 21 de pacienți: hipertrofie ventriculară stângă, disfuncție diastolică, disfuncție sistolică, insuficiență mitrală, insuficiență aortică și pericardită.
Concluzii
În ultimii ani s-au făcut progrese importante în înțelegerea TMA, a SHU și a PTT. Identificarea toxinelor Shiga (Stx), a anomaliilor proteice implicate în clivarea factorului von Willebrand, a factorilor implicați în cascada complementului a dus la identificarea unor etiologii distincte în cadrul TMA(4). Deși activitatea ADAMTS13 distinge SHU de PTT, fiziopatologia altor forme secundare de TMA rămâne necunoscută. Trebuie subliniat faptul că principalele organe-țintă în cazul pacienților cu SHU - Stx (STEC-HUS) sunt rinichiul și creierul, iar activarea căii alterne a complementului poate fi implicată în fiziopatologia STEC-SHU, dar sunt încă necesare studii clinice care să precizeze dacă blocarea acestui „traseu” poate atenua desfășurarea și evoluția bolii pe termen lung(6).
SHU tipic este o entitate (etiologică, clinică, patogenică) bine definită, ce necesită eforturi conjugate din partea unei echipe de specialiști în inițierea unui plan terapeutic suportiv precoce, agresiv și eficient, adresat tuturor complicațiilor cunoscute și posibile, menit să atenueze și, poate, să stopeze evoluția nefavorabilă și severitatea bolii. Se impune astfel promovarea colaborării intense interdisciplinare în managementul sindromului hemolitic uremic.
Bibliografie
2. Taylor C. Mark. Enterohaemorragic Escherichia coli and Shigella dysenteriae type 1-induced haemolytic uraemic syndrome. Pediatr Nephrol (2008) 23: 1425-1431.
3. Takashi Igarashi, Shuichi Ito, Mayumi Sako et al. - Guidelines for the management and investigation of hemolytic uremic syndrome. Clin Exp Nephrol (2014) 18:525–557.
4. Askenazi DJ, Feig DI, Graham NM, et al. 3–5 year longitudinal follow-up of pediatric patients after acute renal failure. Kidney Int 2006; 69: 184–189.
5. Palevsky PM, Zhang JH, O’Connor TZ, et al. Intensity of renal support in critically ill patients with acute kidney injury. N Engl J Med 2008; 359: 7–20.
6. KDIGO Clinical Practice Guideline for Acute Kidney Injury, Volume 2, issue 1, march 2012 http://www.kidney-international.org/
7. Symons JM, Chua AN, Somers MJ, et al. Demographic characteristics of pediatric continuous renal replacement therapy: a report of the prospective pediatric continuous renal replacement therapy registry. Clin J Am Soc Nephrol 2007; 2: 732–738.
8. Trachtman Howard. Introduction: education teaching article series on hemolytc uremic syndrome. Pediatr Nephrol (2008) 23: 1423-1424.
9. Rust Robert Stanley Jr, Amy Kao, Hemolytic Uremic Syndrome, http://emedicine.medscape.com/article/1183555-overview.
10. Copelovitch Lawrence, Kaplan S. Bernard. The trombotic microangiopathies. Pediatr Nephrol (2008) 23: 1761-1767.
11. Borton Chloe. Haemolytic Uraemic Syndrome. http://patient.info/print/2220.
12. Tratchman Howard, Austin Catherine, Lewinski Maria and Stahl A. K. Rolf. Renal and neurogical involvement in typicak Shiga toxin-associated HUS. Nature Reviews/Nephrology. 8. November 2012. 658-669.
13. Takanashi Jun-ichi, Taneichi Hiromichi, Yahata Yuikiro, et al. Clinical and radiological features of encephalopathy during 2011 E coli O111 outbreak in Japan. 2014 American Academy of Neurology. Neurology 82. February 18.2014. 564-572.
14. Nathason Sylvie, Kwon Theresa, Elmaleh Monique, Charbit Marina et al. Acute Neurological Involvement in Diarrhea-Associated Hemolytic Uremic Syndrome. Clin J Am Soc Nephrol. 2010 Jul; 5(7): 1218-1228.
15. Ardissino Gianluigi, Tell Francesca, Possenti Ilaria, et al. Early Volume Expansion and Outcomes of Hemolytic Uremic Syndrome. Pediatrics Vol 137, Number 1, January 2016, 1-9.
16. Keir Richard Lindsay, Coward J.M., Advances in our understanding of the pathogenesis of glomerular thrombotic microangiopathy. Pediatr Nephrol (2011) 26:523-533.
17. Malvinder S Parmar Chief Editor, Srikanth Nagalia, et al. Hemolytic–Uremic Syndrome Treatment & Management, http//emedicine.medscape.com/article/201181-treatment. Feb. 2015.
18. Scheiring Johanna, Andreoli P. Sharon, Zimmerhack l Lothar Bernd. Treatment and outcome of Shiga-toxin-associated hemolytic uremic syndrome (HUS). Pediatr Nephrol (2008) 23: 1749-1760.
19. Caletti Maria Gracia, Missoni Mabel, Vezzani Clarisa et al. Effect of diet, enalapril, or lorasartan in post-diarrheal hemolytic urmic syndrome nephropathy. Pediatr Nephrol (2011) 26: 1247-1254.
20. Tan J. Audrey, Dronen C. Steven et al. http//emedicine. Medscape. Com /article /779218-treatment. Ian 2015.
21. Peron E, Zaharia A, Zota LC, Severi E, Mardh O, Usein C, Bălgrădean M, Espinosa L, Jansa J, Scavia G, Rafila A, Serban A, Pistol A. Early findings in out break of haemolytic uraemic syndrome among young children caused by Shiga toxin–producing Escherichia coli, Romania, January to February 2016 www.eurosurveillance.org. 1-6.
22. Bălgrădean Mihaela, Lupu Anca Dana. Renal involvement in severe sepsis and septic shock of small children. R.J.of Ped- vol LXI, 1. 2012, 10-14.
23. Kahn Huna, Ramus Ronald. HELLP Syndrome, emedecine.medscape.com/article/1394126-overview. Dec 302015.1-5.
24. Manenti Lucio, Gnappi Elisa, Vaglio Augusto et al. Atypic haemolytic uraemic syndrome with underlying glomerulopathies. A case series and a review of the literature. Nephrol Dial Transplant (2013) 28: 2246-2259.
25. Bălgrădean Mihaela. Sindromul hemolitic uremic, în: Patologie actuală în nefrologia pediatrică. București, Editura Economică 2005. ISBN 973-709-130-2. 157-163/ și Sindromul hemolitic uremic, în: Patologie actuală în nefrologia pediatrică. București, MedBook 2016. ISBN 978-606-93708-2-7. 168-181.
Articole din ediţiile anterioare
Factori legaţi de stilul de viaţă pentru obezitatea infantilă în preadolescenţă
Supraponderalitatea şi obezitatea sunt definite ca acumularea anormală sau excesivă de grăsime, care prezintă un risc pentru sănătate. Obezitatea a...
Recomandări actuale în managementul şi urmărirea astmului bronşic la copil
Astmul bronşic reprezintă cea mai frecventă boală cronică a copilăriei şi principala cauză de morbiditate, având drept consecinţe absenteism şcolar...
Intoleranţa la lactoză la copil
Intoleranţa la lactoză este o reacţie adversă alimentară cu mecanism neimun, datorată unei deficienţe în lactază, enzimă secretată de epiteliul i...
Febra - un prieten care ne poate trăda
Febra reprezintă simptomul cel mai frecvent, la toate vârstele copilului, dar în special la cel mic, care determină adresabilitatea către medicul p...