Hyperadrenocorticism is a common endocrine disorders in ferrets, which differs from the disease seen in humans, dogs, and cats. In humans, dogs and cats an elevated blood cortisol level is responsible for clinical signs, while in ferrets the signs are caused by high concentrations of sex-related steroids (androstenedione, 17a-hydroxy-progesterone, dehydroepiandrosterone sulfate, estradiol). While over 60% of the cases of hyperadrenocorticism in dogs, and cats are caused by a pituitary tumor, in ferrets, the primary cause of the disease is almost always a uni- or bilateral abnormality of the adrenal gland. The measurement of hormone concentrations, however, does not allow differentiation between hyperadrenocorticism and functional ovarian remnant tissue, thus diagnosis is based on clinical.signs in combination with identifying the affected gland during an ultrasonographic examination.
Aspectele ultrasonografice ale suprarenalelor la dihor
Ultrasonographic aspects of adrenal glands in ferrets
First published: 09 septembrie 2016
Editorial Group: MEDICHUB MEDIA
Abstract
Rezumat
Hiperadrenocorticismul reprezintă o boală endocrină frecvent întâlnită la dihori, ce diferă de boala întâlnită la oameni, câini și pisici. La om, câine și pisică, nivelul crescut al cortizolului este responsabil de apariția semnelor clinice, pe când la dihori semnele sunt determinate de concentrațiile crescute de steroizi sexuali (androstenedion, 17-hidroxi-progesteron, sulfat de dehidroepiandrosteron, estradiol). În timp ce peste 60% din cazurile de hiperadrenocorticism întâlnite la câine și pisică sunt determinate de tumori pituitare, la dihori, principala cauză a acestei boli este, de regulă, o anormalitate localizată uni- sau bilateral la nivelul glandei suprarenale. Determinările concentrațiilor hormonale nu permit diferențierea între hiperadrenocorticism și țesut ovarian remanent, astfel încât diagnosticul se bazează pe semnele clinice în corelație cu examinarea ultrasonografică a glandei suprarenale.
Glandele suprarenale la dihor - repere anatomice
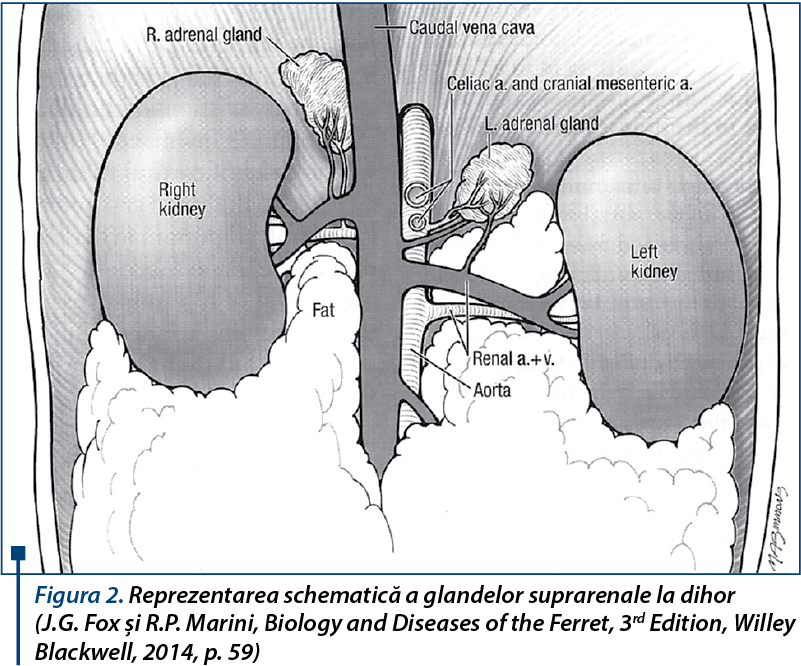
Glandele suprarenale sunt structuri pereche, poziționate craniomedial față de rinichi, fiind învelite în grăsimea retroperitoneală.
Glanda suprarenală stângă se află cranial de originea arterei mezenterice craniale, lângă aortă, vena adreno-lombară trecând peste suprafața ventrală a acesteia.
Glanda suprarenală dreaptă se află în contact cu suprafața latero-dorsală a venei cave caudale, fiind poziționată mai cranial decât glanda suprarenală stângă.
Din punct de vedere embriologic, glanda suprarenală este formată din două glande endocrine cu funcții și origini distincte. Medulara secretă epinefrină și norepinefrină (origine ectodermală), în timp ce corticala este împărțită în trei zone: glomerulară, fasciculată și reticulată (origine mezodermală).
Zona glomerulară este situată periferic (rol în sinteza și secreția hormonilor mineralcorticoizi - în special aldosteron). Zona glomerulară este urmată concentric de zona fasciculată (rol în sinteza și secreția de glucocorticoizi - cortizol și corticosteron, dar și a hormonilor androgeni).
Zona fasciculată se află în contact cu medulara, cu rol în biosinteza și secreția hormonilor androgeni.
Sinteza hormonilor adenocorticali
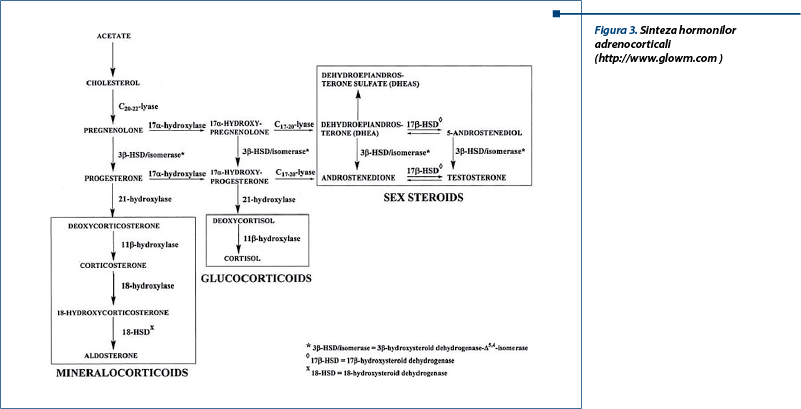
Cortico-suprarenala produce hormoni steroidieni derivați dintr-o structură ciclopentanoperhidrofenantren, care este compusă din trei inele ciclohexani și un inel ciclopentanic. Colesterolul, în principal LDL colesterolul, care se află în circulația periferică, este precursorul tuturor hormonilor steroidieni, indiferent de locul în care aceștia sunt sintetizați, lucru care implică acțiunea enzimelor din grupul citocrom P450. Cu ajutorul enzimei SCC (Side Chain Cleavage enzyme), colesterolul este sintetizat în pregnenolon, care este biosintetizat mai apoi în progesteron sau 17a-hidroxipregnenolon. Apoi, 17-hidroxilaza progesteronului în zona glomerulară sau a 17a-hidroxipregnenolonului în zona fasciculată formează dezoxicorticosteron, respectiv 11-dezoxicortizol. Conversia 11-dezoxicortizolului în cortizol reprezintă ultimul pas în biosinteza cortizolului. De asemenea, dezoxicorticosteronul poate fi convertit în corticosteron de către 11b-hidroxilaza în zona glomerulară, care mai apoi este sintetizat în aldosteron de către aldosteron sintetaza.
Axa hipotalamus - hipofiză - corticosuprarenală
ACTH-ul reprezintă principalul hormon hipofizar care stimulează secreția de glucocorticoizi adrenocorticali. Secreția de ACTH este stimulată în principal de către CRH (Corticotrophin-releasing hormone), hormon sintetizat în hipotalamus și care poate fi potențat de către AVP (arginin-vasopresina). Glucocorticoizii exercită rol direct de feedback negativ asupra secreției proprii, prin inhibarea transcripției POMC (Pro-opiomelanocortin) în glanda hipofizară și sintetizarea CRH și respectiv AVP la nivelul hipotalamusului.
Hiperadrenocorticismul la dihori
Hiperadrenocorticismul este considerat una dintre cele mai comune patologii a dihorilor. A fost descris pentru prima dată de Fox et al., în anul 1987, iar de atunci noi studii au adus informații suplimentare despre această endocrinopatie complexă. Principala caracteristică a hiperadrenocorticismului la canide și felide o reprezintă creșterea concentrației de cortizol seric, în timp ce la dihori este reprezentată de creșterile concentrațiilor plasmatice de androsteneidon, 17a-hidroxiprogesteron și estradiol.
Peste 60% din cazurile de hiperadrenocorticism la om, câine și pisică sunt cauzate de tumori pituitare, în timp ce în aproximativ 85% din cazurile de hiperadrenocorticism la dihori se observă hiperplazia unei singure suprarenale, fără atrofia celeilalte, în timp ce în restul de 15% din cazuri se poate observa hiperplazie bilaterală (Weiss și Scott, 1997). Modificările histologice variază de la hiperplazie nodulară până la adenom sau adenocarcinom, fără a oferi însă nici o informație asupra prognosticului. În cazul dihorilor cu hiperadrenocorticism nu au fost raportate tumori hipofizare.
Cercetările au arătat că efectele sterilizării timpurii, combinate cu cele ale fotofazei prelungite artificial (dihorii crescuți în casă), îi predispun la hiperadrenocorticism (Shoemaker et al., 2002). Hipotalamusul dihorului sterilizat continuă să secrete GnRH, care stimulează hipofiza să secrete LH și FSH. Cantitatea crescută de LH și FSH stimulează la rândul ei zona reticulară a suprarenalelor, rezultând astfel o creștere a secreției de hormoni sexuali. În absența secreției gonadale de estrogeni și androgeni, lipsește feedbackul negativ asupra hipotalamusului, cauzând astfel o secreție continuă de GnRH și de stimulare a suprarenalelor, rezultând astfel sindromul de hiperadrenocorticism.
Sterilizarea timpurie mai poate iniția, de asemenea, o creștere bruscă a LH-ului, care determină o hiperactivitate inițială a cortexului suprarenal, rezultând astfel o receptivitate crescută a acestuia. De asemenea, studiile au arătat că dihorii crescuți în casă sunt mai predispuși la hiperadrenocorticism comparativ cu cei crescuți afară, din cauza influenței luminii (fotofaza prelungită artificial); astfel, scade secreția de melatonină (feedbackul negativ asupra hipotalamusului și secreției de GnRH) (Wagner et al., 2001, 2005).
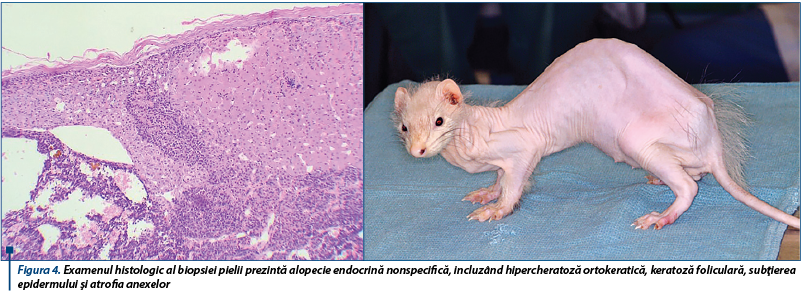
Semnele clinice reprezintă o expresie a producţiei exagerate de hormoni sexuali. Cele mai importante semne clinice ale hiperadrenocorticismului la dihor sunt reprezentate de alopecie simetrică, inflamație vulvară la femelele sterilizate, prurit neparazitar și nonfungic, strangurie la masculii castrați și reapariția comportamentului sexual la subiecții sterilizați.
Confirmarea diagnosticului se face pe baza examenului clinic, titrarea hormonilor serici (17a-hidroxiprogesteron, estradiol, androsteneidon) și examinarea imagistică a suprarenalelor. Examinarea ultrasonografică a glandelor suprarenale în stabilirea diagnosticului de hiperadrenocorticism este deosebit de utilă, deoarece determinarea concentrațiilor de hormoni serici nu permite diferențierea dintre patologia glandelor suprarenale și patologia țesutului ovarian remanent funcțional și nici nu poate determina care dintre cele două glande suprarenale este afectată.
Ultrasonografia este utilizată pentru identificarea și aprecierea glandei suprarenale afectate și pentru a determina dimensiunea, forma, structura și posibilele invaziuni vasculare ale glandei. Mai mult, anormalitățile organelor abdominale, precum țesutul ovarian remanent, pot fi determinate prin ultrasonografie.
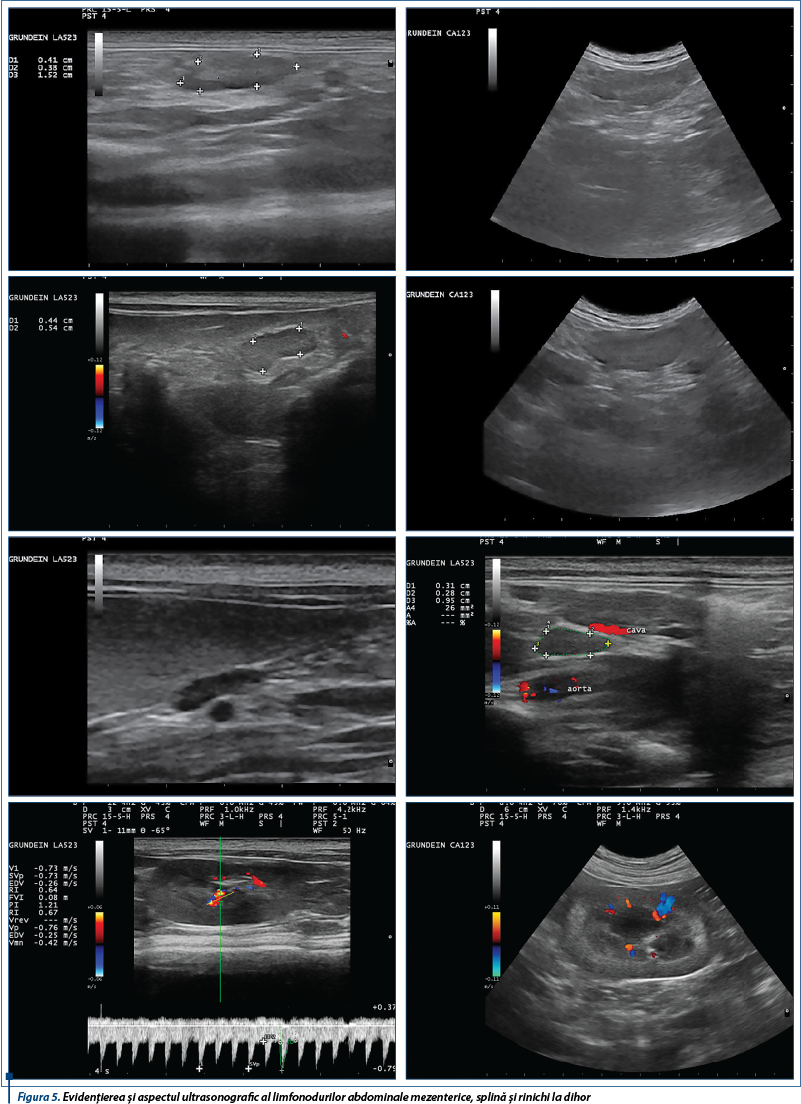
Acuratețea cu care sunt identificate glandele suprarenale variază considerabil (50% până la 100%). Rata de detectare scăzută i-a condus pe unii autori să sugereze că ultrasonografia poate avea o valoare scăzută în diagnosticarea hiperadrenocorticismului la dihori. Rata de detecție mică se poate justifica prin prezența limfonodurilor abdominale mărite. Aceste limfonoduri au formă rotundă sau ovală, sunt de obicei hipoecogene în comparație cu grăsimea adiacentă și seamănă cu glandele suprarenale. Prin utilizarea reperelor anatomice (ca, de exemplu, glanda suprarenală dreaptă este atașată la suprafața dorso-laterală a venei cave caudale; glanda suprarenală stângă este localizată ventro-lateral de aortă, caudal de originea arterei mezenterice craniale), permit diferențierea dintre limfonoduri și glandele suprarenale, dar și evaluarea tuturor organelor abdominale.
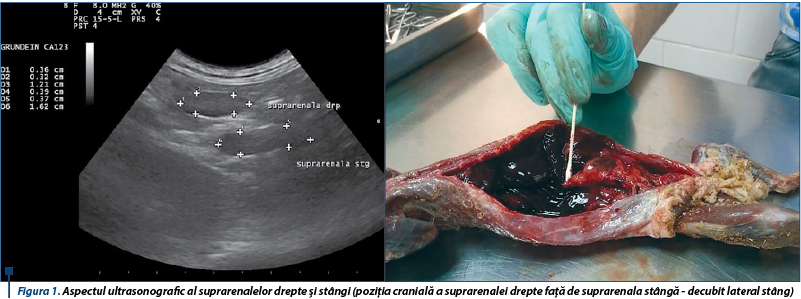
Glandele suprarenale normale la dihor sunt alungite sau ovale, au structură uniformă și sunt hipoecogene față de grăsimea adiacentă. Ecogenitatea crescută a glandelor suprarenale poate fi întâlnită în timpul examinării ultrasonografice a dihorilor sănătoși (în special la masculii nesterilizați), acest lucru putând fi explicat prin prezența unui strat de grăsime mai mare sau prin posibilitatea să fi stocat grăsime în glandele suprarenale.
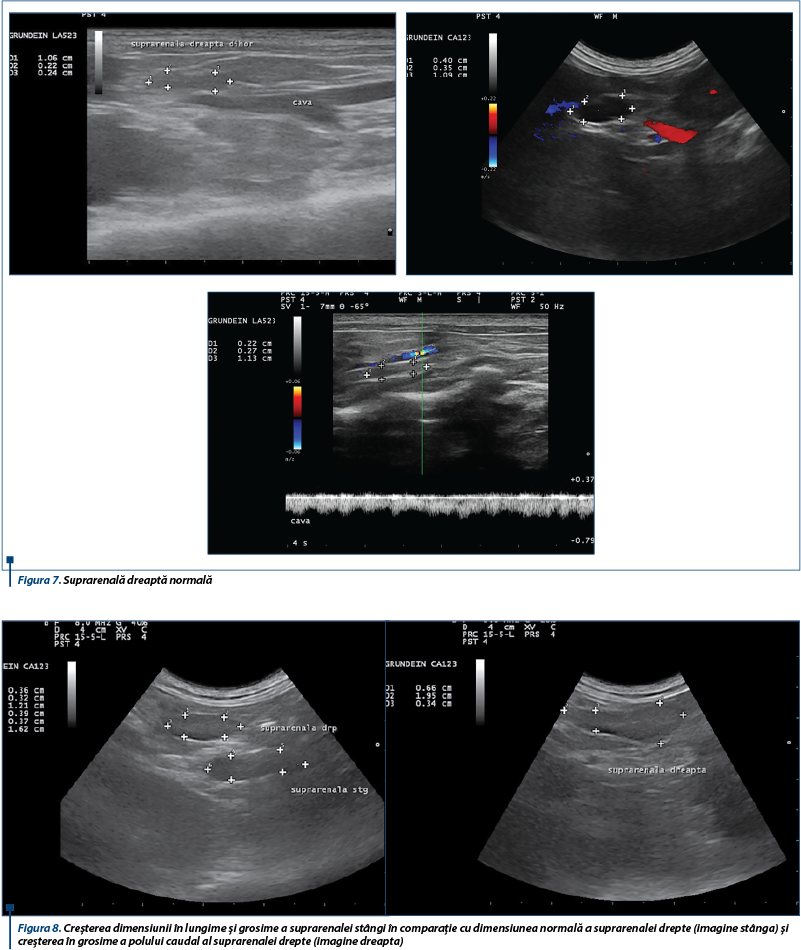
Examinarea de-a lungul planului longitudinal drept a condus la identificarea glandei suprarenale drepte dorsal față de vena cavă caudală (figura 7, stânga), la intrarea în ficat. Când această metodă nu a dat rezultate imediate, ficatul a fost examinat în direcție transversă, iar aorta, vena cavă caudală și vena portă au fost identificate (figura 7, dreapta). Prin înclinarea ușoară a sondei în direcție craniocaudală și mutarea acesteia gradual în direcție caudală de-a lungul venei cave caudale, folosind ficatul ca fereastră acustică pe cât posibil, a fost localizată glanda suprarenală dreaptă. Polul caudal al glandei suprarenale drepte poate apărea mult mai lateral decât dorsal față de vena cavă caudală.
Dimensiunile ultrasonografice craniocaudale (lungime) și ventrodorsale (grosime) ale glandelor suprarenale la dihorii sănătoși sunt de 5,4-9,8 mm și 2,3-3,6 mm pentru glanda suprarenală stângă și de 5,8-10,5 mm și 2,2-3,8 mm pentru suprarenala dreaptă. Forma normală a glandelor variază de la alungit la ovoid, ușor bilobată sau dreptunghiulară.
Glandele suprarenale anormale la dihorii cu hiperadrenocorticism recunosc o creștere semnificativă în grosime. O lungime considerabil mai mare de obicei se înregistrează la glandele suprarenale stângi anormale, dar nu și la cele drepte, fapt ce poate fi explicat prin faptul că polul cranial al glandei suprarenale drepte se regăsește dorsal de vena cavă, în timp ce polul caudal este de regulă dorsolateral sau lateral față de vena cavă caudală, fiind greu de obținut astfel o imagine longitudinală ce cuprinde întreaga glandă. Dimensiunea glandelor fără modificări la animalele sănătoase era de obicei aproape identică cu cea a glandelor normale de la dihorii cu hiperadrenocorticism, cu excepția lungimii glandei drepte. Mai mult, dificultățile în măsurarea cu acuratețe a lungimii glandei drepte pot conduce la rezultate diferite.
Ultrasonografia are o specificitate crescută în identificarea glandelor anormale la dihorii cu simptomatologie de hiperadrenocorticism, după stabilirea reperelor anatomice de referință. Glandele suprarenale pot fi considerate anormale atunci când prezintă o formă rotunjită, pol cranial și/sau caudal mărit, structură heterogenă, ecogenitate crescută și/sau mineralizări.

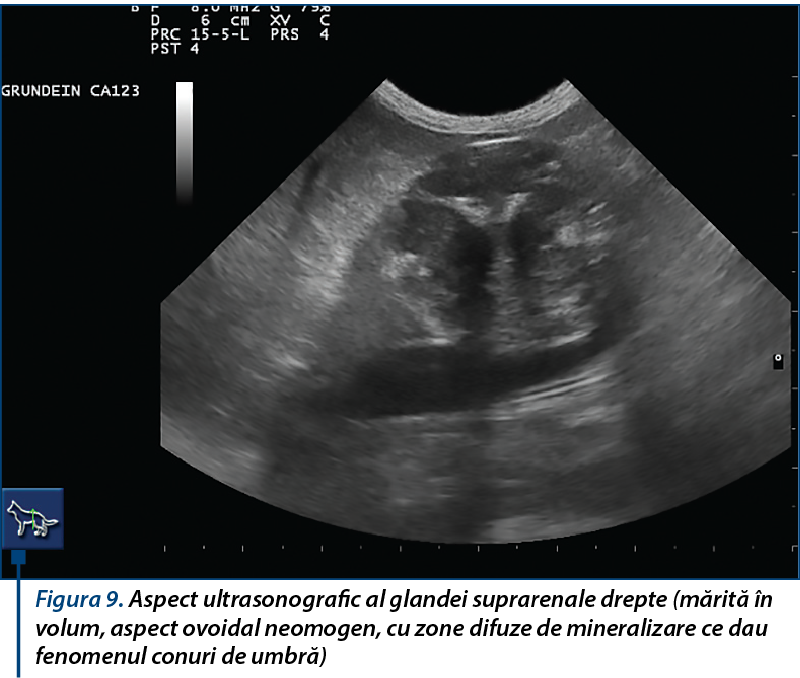
O formă, structură și ecogenitate ecografică normală a glandei suprarenale a dihorului nu exclud posibilitatea unei leziuni, suspiciunea și confirmarea diagnosticului de hiperadrenocorticism la dihor fiind rezultatul coroborării examenului clinic, biochimic, imagistic cu răspunsul terapeutic.
Bibliografie
2. Besso JG, Tidwell AS, Gliatto JM. Retrospective review of the ultra- sonographic features of adrenal lesions in 21 ferrets. Vet Radiol Ultrasound 2000;41:345-352.
3. Boscaro M, Barzon L, Fallo F, et al. Cushing’s disease. Lancet 2001;357:783-791.
4. de Wit M, Schoemaker NJ, vd Hage MH, et al. Oestrusverschijnselen bij de geovariectomeerde fret. TijdschrDiergeneeskd 2001;126:526-528.
5. Gould WJ, Reimers TJ, Bell JA, et al. Evaluation of urinary corti- sol: creatinine ratios for the diagnosis of hyperadrenocorticism associated with adrenal gland tumors in ferrets. J Am Vet Med Assoc 1995;206:42-46.
6. Holmes RL. The adrenal glands of the ferret, Mustela putorius. J Anatomy 1961; 95:325-336.
7. Lacroix A, Hamet P, Boutin JM. Leuprolide acetate therapy in luteinizing hormone-dependent Cushing’s syndrome. N Engl J Med1999;341:1577-1581.
8. Lawrence HJ, Gould WJ, Flanders JA, et al. Unilateral adrenalecto- my as a treatment for adrenocortical tumors in ferrets: Five cases (1990-1992). J Am Vet Med Assoc 1993;203:267-270.
9. Lipman NS, Marini RP, Murphy JC, et al. Estradiol-17-secreting adrenocortical tumor in a ferret. J Am Vet Med Assoc 1993;203:1552-1555.
10. Myers NC 3rd, Bruyette DS. Feline adrenocortical diseases: Part I - hyperadrenocorticism. Semin Vet Med Surg (Small Anim) 1994;9:137-143.
11. Neuwirth L, Collins B, Calderwood-Mays M, et al. Adrenal ultrasonography correlated with histopathology in ferrets. Vet Radiol Ultrasound 1997; 38:69-74.
12. Neuwirth L, Isaza R, Bellah J, et al. Adrenal neoplasia in seven ferrets. Vet Radiol Ultrasound 1993;34:340-346.
13. O’Brien T, Paul-Murphy J, Dubielzig RR. Ultrasonography of adrenal glands in normal ferrets. Vet Radiol Ultrasound 1996; 37:445-448.
14. Paul-Murphy J, O’Brien RT, Spaeth A, et al. Ultrasonography and fine needle aspirate cytology of the mesenteric lymph node in normal domestic ferrets (Mustela putorius furo.) Vet Radiol Ultrasound 1999;40:308-310.
15. Petrie A, Watson P. Statistics for Veterinary and Animal Science.Oxford: Blackwell Scientific Publications, 1999:19-24.
16. Reese S, Frings B. Die abdominale Ultraschalluntersuchung beim Frettchen (Mustela putorius furo L.1758). Tierärztl Prax2004;32:182-189.
17. Rijnberk A. Adrenals. In: Rijnberk A, ed. Clinical Endocrinology of Dogs and Cats; an Illustrated Text. Dordrecht: Kluwer Academic Publishers, 1996:61-94.
18. Rosenthal KL, Peterson ME, Quesenberry KE, et al. Hyperadrenocorticism associated with adrenocortical tumor or nodular hyperplasia of the adrenal glands in ferrets: 50 cases (1987-1991). J Am Vet Med Assoc 1993;203:271-275.
19. Rosenthal KL, Peterson ME. Evaluation of plasma androgen and estrogen concentrations in ferrets with hyperadrenocorticism. J Am Vet Med Assoc 1996;209:1097-1102.
20. Rosenthal KL. Adrenal gland disease in ferrets. Vet Clin North Am Small Anim Pract 1997;27:401-418.
21. Schoemaker NJ, Schuurmans M, Moorman H, et al. Correlation between age at neutering and age at onset of hyperadrenocorticism in ferrets. J Am Vet Med Assoc 2000;216:195-197.
22. Schoemaker NJ, Teerds KJ, Mol JA, et al. The role of luteinizing hormone in the pathogenesis of hyperadrenocorticism in neutered ferrets. Mol Cell Endocrinol 2002;197:117-125.
23. Schoemaker NJ, Wolfswinkel J, Mol JA, et al. Urinary glucocorticoid excretion in the diagnosis of hyperadrenocorticism in ferrets. Domest Anim Endocrinol 2004;27:13-24.
24. Swinscow TDV (revised by Campbell MJ). Statistics at Square One. 9th (online) edition. Southampton: BMJ Publishing Group, 1997:27.
25. Tidwell AS, Penninck DG, Besso JG. Imaging of adrenal gland disorders. Vet Clin North Am Small Anim Pract 1997;27:237-254.
26. Wagner RA, Bailey EM, Schneider JF, et al. Leuprolide acetate treatment of adrenocortical disease in ferrets. J Am Vet Med Assoc 2001;218:1272-1274.
27. Weiss CA, Scott MV. Clinical aspects and surgical treatment of hyperadrenocorticism in the domestic ferret: 94 cases (1994-1996). J Am Anim Hosp Assoc 1997;33:487-493.