CERCETARE
Implicaţiile polimorfismelor genei MTHFR în etiologia schizofreniei
Implications of MTHFR gene polymorphism in the etiology of schizophrenia
Abstract
Aims. The present study aims to identify mutations in the MTHFR gene, which may represent a risk factor for schizophrenia, generating a genetic susceptibility for this disorder, as well as the association between genes polymorphism and the age of onset of the disease.Method. The study includes 62 patients hospitalized in the Psychiatric Clinic I from Cluj-Napoca and the Mental Health Center of Cluj-Napoca, during 1.04.2011 and 1.11.2011, diagnosed with schizophrenia according to the ICD-10 and DSM-IVTR criteria, and a control group of 60 healthy subjects, chosen randomly, with no personal or familial history of mental illness, not related to patients in the study. The presence and intensity of positive and negative symptoms have been evaluated using the general scale PANSS (Positive and Negative Syndrome Scale), and the CGI severity scale (Clinical Global Impression) and the GAF (Global Assessment Functioning) were also used. The isolation and purification of DNA were performed at the Department of Biochemistry using Qiagen method.
Results. MTHFR gene mutation in the C677T position was more common in patients with schizophrenia versus the control group, the number of heterozygotes being significantly increased. The evaluation of gene MTHFR A1298C position does not have statistical significance, but we found a significant association between this mutation and schizophrenia. Heterozygotes patients with A1298C mutation had an earlier age of onset of the disease as compared to patients with AA homozygotes, with a significant statistical association. Instead, the correlation was devoid of significance in the case of C667T mutation, whith no correlation with the age of onset of schizophrenia. No significant association was found between heredo-colateral psychiatric antecedents (AHC) and C667T gene mutation. Instead, the A1298C mutation and AHC were less frequent in heterozygotes patients compared to wild-type homozygotes patients, but also in this case the correlation was devoid of significance.
Conclusions. MTHFR C677T polymorphism is involved in the pathogenesis of schizophrenia and hetrozygotes with a1298C mutation have a younger age of onset of the disease.
Keywords
polymorphismMTHFRschizophreniaRezumat
Obiective. Studiul de față are ca scop identificarea mutațiilor în gena MTHFR, care pot reprezenta un factor de risc pentru apariția schizofreniei, participând la crearea susceptibilității genetice pentru această tulburare, precum și asocierea dintre polimorfismele genei și vârsta de debut a bolii.Metodologie. Studiul include 62 de pacienți internați în Clinica de Psihiatrie I din Cluj-Napoca și Centrul de Sănătate Mintală din Cluj-Napoca, în perioada 1.04.2011-1.11.2011, diagnosticați cu schizofrenie conform criteriilor ICD-10 și DSM-IV, și un lot-martor care a cuprins 60 de subiecți voluntari, sănătoși, aleși aleatoriu, fără istoric personal și familial de boală psihică, fără relații de familie cu pacienții din studiu. Prezența și intensitatea simptomelor negative, pozitive și generale a fost evaluată utilizând scala PANSS (Positive and Negative Syndrome Scale), s-au evaluat de asemenea severitatea bolii, utilizând scala CGI (Clinical Global Impression), și funcționalitatea globală, utilizând scala GAF (Global Assessment Functioning). Izolarea și purificarea ADN-ului s-au efectuat la Catedra de Biochimie prin metoda Qiagen.
Rezultate. Mutația genei MTHFR în poziția C677T a fost mult mai frecventă la lotul de pacienți cu schizofrenie comparativ cu lotul-martor, numărul heterozigoților fiind semnificativ crescut. Evaluarea mutației genei MTHFR în poziția A1298C nu are semnificație statistică, nefiind găsită o asociere între această mutație și schizofrenie. Pacienții heterozigoți cu mutația A1298C au avut o vârstă de debut a bolii mai tânără comparativ cu pacienții homozigoți AA, existând o asociere semnificativă statistic. În schimb, corelația fost lipsită de semnificație statistică în cazul mutației C667T, la care nu s-a găsit nicio asociere cu vârsta de debut a schizofreniei. Nu a fost găsită nicio corelație statistică între AHC și mutația genei C667T. În schimb, la mutația A1298C, antecedentele heredocolaterale psihiatrice (AHC) au existat în număr mic la pacienții heterozigoți față de subiecții sănătoși, dar și în acest caz corelația a fost lipsită de semnificație statistică.
Concluzii. Polimorfismul MTHFR C677T este implicat în patogeneza schizofreniei, iar heterozigoții cu mutația A1298C au o vârstă de debut mai tânără.
Cuvinte Cheie
MTHFRpolimorfismschizofrenieIntroducere
Schizofrenia reprezintă o afecțiune cu o etiologie insuficient cunoscută, cu debut la vârstă tânără, morbiditate crescută, cu severitate și evoluție influențate atât de factori genetici, cât și de factori socioculturali(1). Prin impactul deosebit pe care deteriorarea personalității prin această boală îl are asupra funcționalității familiale, sociale și interpersonale a individului, conducând la dificultăți de încadrare la locul de muncă și de integrare în societate, precum și prin costurile economice crescute de îngrijire a acestor bolnavi, cercetarea schizofreniei are o importanță deosebită(2). Agregarea familială fiind mare, ar explica necesitatea introducerii diagnosticului genetic al acesteia.Schizofrenia este considerată cea mai devastatoare dintre psihoze, afectând 1% din populație, indiferent de rasă, etnie sau zonă geografică și fără a avea un determinism legat de sex(1). Vârsta de debut este 18-25 de ani la bărbați, respectiv 26-45 de ani la femei. 20% dintre cazuri apar după 40 de ani, majoritatea fiind femei(3). Bărbații au o evoluție mai proastă decât femeile, a căror stare se înrăutățește după menopauză. 90% dintre bărbați și 25% dintre femei dezvoltă boala înainte de 30 de ani (este o boală a adultului tânăr)(4,5). Schizofrenicul prezintă o scădere a ratei de supraviețuire cu 10 ani, ca urmare a sărăciei, complicațiilor bolii (halucinațiile și ideile delirante pot determina acte de violență), a unei rate crescute de suicid (de 10%), precum și ca urmare a apariției unor efecte secundare la administrarea medicației antipsihotice(6,7).
Elucidarea etiologiei și fiziopatologiei schizofreniei este extrem de importantă, în special în elaborarea unor strategii terapeutice și de prevenire a bolii(8). Schizofrenia este o afecțiune care implică intricarea atât a factorilor genetici, cât și a celor de mediu (complicații obstetricale, nașteri distocice, infecții gripale cu retrovirusuri în primele luni de sarcină) sau cu factori socioculturali (părinți schizofrenogeni, asimetria maritală, sciziunea familială). Un individ poate fi purtătorul unei predispoziții genetice, dar această vulnerabilitate se poate exprima și doar în prezența unor factori de mediu care ar putea produce mutații sau ar putea influența expresia genetică(9). Cercetări recente sugerează o implicare a mecanismelor de metilare, dependente de metabolismul homocisteinei, în aceste procese. Prin urmare, cercetarea asocierii activității metilen tetra-hidro-folat reductazei (MTHFR), principala enzimă care limitează viteza de reacție în ciclul homocisteinei, cu riscul de apariție și evoluție clinică a schizofreniei, este de o importanță deosebită(10).
Enzima MTHFR joacă un rol central în metabolismul acidului folic, prin transformarea ireversibilă a 5,10-MTHF (metilenetetrahidrofolatul) în 5-MTHF, forma circulantă predominantă a acidului folic. 5-MTHF are un rol crucial în one-carbone metabolism, precum și în metilarea ADN-ului(11). Donarea unui grup metil al homocisteinei în vederea generării S-adenosylmetioninei (SAM) reprezintă sursa majoră de grupări metil în creier și un donator major al grupărilor metil în vederea sintezei ADN-ului, a proteinelor, a neurotransmițătorilor, hormonilor și fosfolipidelor(12,13,14). Astfel, polimorfismele genei MTHFR pot crește nivelul de homocisteină serică, rezultatul fiind o depreciere a metilării ADN-ului, constituind factori de risc pentru schizofrenie și alte tulburări neuropsihice(15). Metilarea ADN-ului este o modificare epigenetică ce controlează multe procese biologice, printre care dezvoltarea embrionară, inactivarea cromozomului X și exprimarea genelor(16,17). Metilarea este predeterminată genetic și influențată de gene cum ar fi MTHFR și altele implicate în ciclul one-carbon(18). Astfel, grupurile metil necesare pentru metilare sunt sintetizate de novo sau furnizate în alimentație în primul rând de acidul folic. Modelele de metilare incorecte pot afecta embriogeneza, ducând la malformații de dezvoltare sau moarte embrionară(19). Astfel, modelele de metilare corecte ale ADN-ului sunt importante nu doar în embriogeneză, ci și pe parcursul vieții, influențând susceptibilitatea pentru bolile psihice(20).
Ipoteză de lucru/obiective
Material și metodă
Au fost invitate să participe la studiu 78 de persoane selectate din rândul pacienților care s-au prezentat la internare în Clinica Psihiatrie I din Cluj-Napoca și Centrul de Sănătate Mintală din Cluj-Napoca, în perioada 1.04.2011-1.11.2011. Pacienților li s-a cerut acordul de a participa la studiu, li s-a explicat scopul studiului și li s-a solicitat să semneze un formular de consimțământ. În final, 62 de pacienți au semnat consimțământul informat. Criteriile de includere în studiu au fost: diagnosticul de schizofrenie conform criteriilor ICD-10(21) și DSM IV-TR(22), vârsta peste 18 ani, capacitatea de a înțelege și de a semna consimțământul informat și etnia română. Au fost excluși participanții cu: comorbidități psihiatrice (de exemplu, utilizare nocivă sau dependență la alcool ori droguri ilicite, deteriorare cognitivă clinic manifestă, întârziere în dezvoltarea mintală, tulburare schizoafectivă etc.) sau somatice semnificative (de exemplu, accident vascular cerebral, boli autoimune etc.), tratament medicamentos care este posibil să influențeze tabloul clinic și pacienți care erau incapabili să înțeleagă instrucțiunile sau să ofere consimțământul informat la momentul prezentării.
Lotul-martor a cuprins 60 de subiecți voluntari, sănătoși, aleși aleatoriu, fără istoric personal și familial de boală psihică, fără relații de familie cu pacienții din studiu. Voluntarii au semnat și ei un formular de consimțământ informat înainte de includerea în studiu.
Evaluarea clinică
Bolnavii au efectuat un examen psihiatric complet. Prezența și intensitatea simptomelor negative, pozitive și generale au fost evaluate utilizând scala PANSS (Positive and Negative Syndrome Scale)(23). S-au evaluat, de asemenea, severitatea bolii, utilizând scala CGI (Clinical Global Impression)(24), și funcționalitatea globală, utilizând scala GAF (Global Assessment Functioning)(25).
Determinările genetice
Participanților li s-au recoltat 2 ml de sânge venos din plica cotului pe EDTA, iar probele de sânge au fost transportate în aceeași zi și prelucrate la Catedra de Biochimie de la Universitatea de Medicină și Farmacie „Iuliu Hațieganu“ Cluj-Napoca, unde s-au efectuat izolarea și purificarea ADN prin metoda Qiagen.
Genotiparea s-a realizat, de asemenea, la Catedra de Biochimie de la Universitatea de Medicină și Farmacie „Iuliu Hațieganu“ Cluj-Napoca. Au fost determinate polimorfismele genei MTHFR 677C>T și 1298A>C prin Polymerase Chain Reaction (PCR). Pentru PCR de secvențializare s-a utilizat kitul ABI Prism BigDye®Terminator v3.1 Cycle Sequencing (Applied Biosystems, SUA), folosind ca ADN‑matriță produșii de PCR purificați.
Purificarea produșilor obținuți prin PCR de secvențializare s-a făcut conform protocolului descris în prospectul kitului ABI Prism Big Dye®Terminator v3.1 Cycle Sequencing (Applied Biosystems, SUA). Secvențializarea propriu-zisă pentru evidențierea mutațiilor punctiforme C677T și A1298C de la nivelul genei MTHFR s-a realizat utilizând aparatul ABI PRISM TM 310 Genetic Analyser (Applied Biosytems, SUA). Analiza cromatogramelor s-a efectuat folosind softul ABI Prism® DNA Sequencing Analysis.
Analiza statistică
Pentru descrierea distribuției datelor au fost calculați parametrii de centralitate adecvați pentru datele cantitative și proporțiile, exprimate procentual, pentru cele calitative. Eventualele diferențe între loturi au fost testate prin utilizarea testului t-Student pentru variabilele cantitative și a testului c2, respectiv Fisher Exact, pentru variabilele cantitative. Prelucrarea statistică a datelor a fost realizată utilizând pachetul de aplicații Statistical Pack for Social Sciences – SPSSTM, versiunea 15.0.
Rezultate
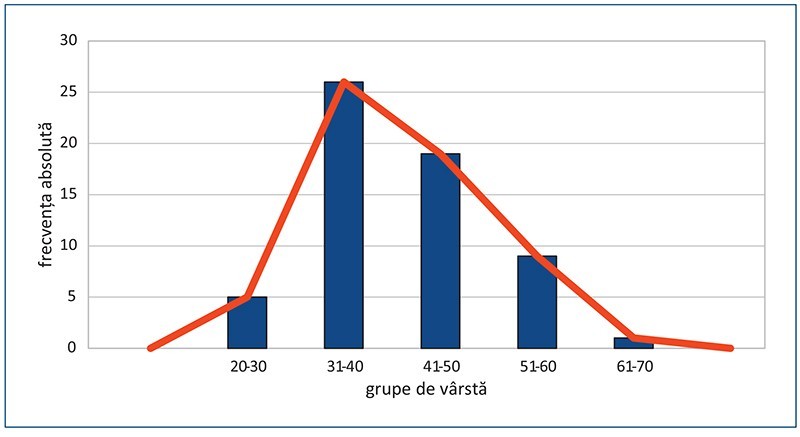
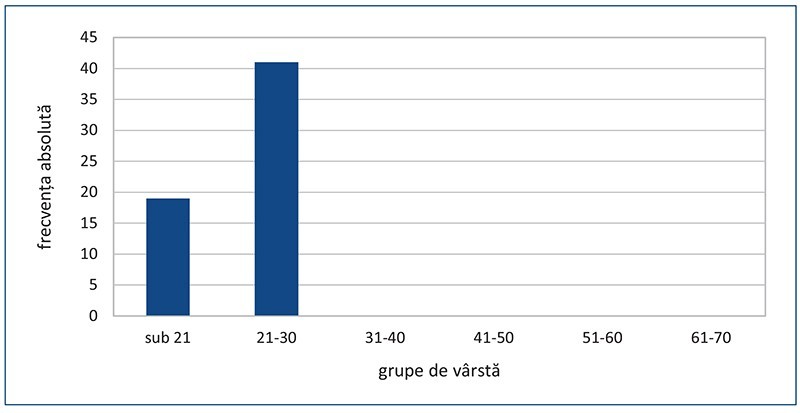
În studiul de față, intervalul de vârstă de debut al bolii a fost 21-30 de ani, cu o vârstă medie de debut al bolii de 22,08 ani. Distribuția pe grupe de vârstă de debut al bolii este prezentată în figura 2.
Distribuția pe sexe la lotul de pacienți cu schizofrenie comparativ cu lotul-martor este reprezentată în figurile 3 și 4.
Forma clinică cea mai frecventă a schizofreniei a fost schizofrenia paranoidă (N=48, 80%) și apoi cea de schizofrenie nediferențiată (N=12, 20%).
Mutația C677T și susceptibilitatea pentru boală
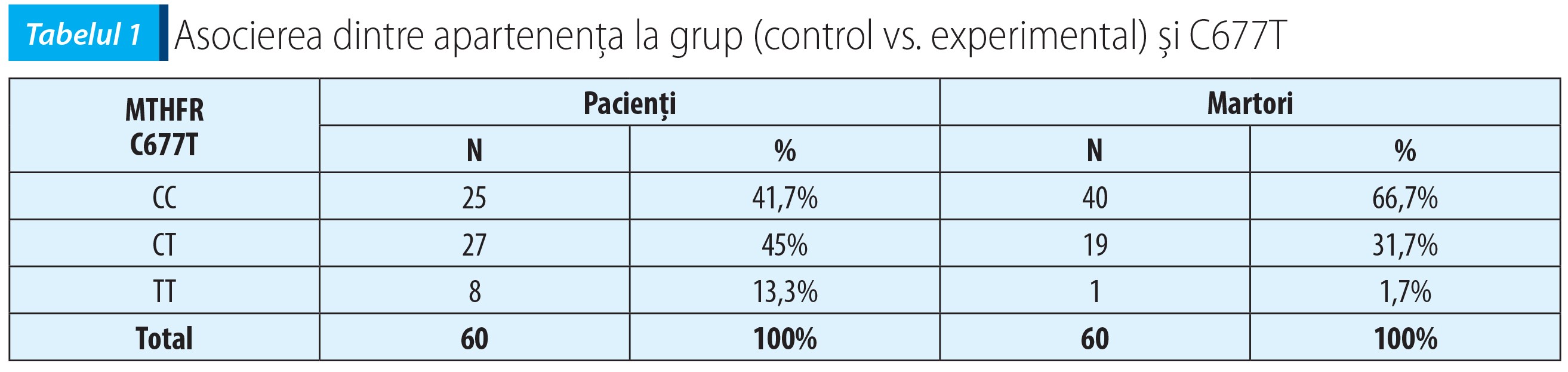
Evaluarea prezenței genotipului modificat (CT+TT) la lotul de pacienți comparativ cu lotul-martor a arătat că mutația genei MTHFR în poziția 677 a fost mult mai frecventă la lotul de bolnavi (58,3%) față de lotul-martor (33,4%) – χ²(2, N=60)=10,29, p=0,006 (vezi tabelul 1).
Mutația A1298C și susceptibilitatea pentru boală
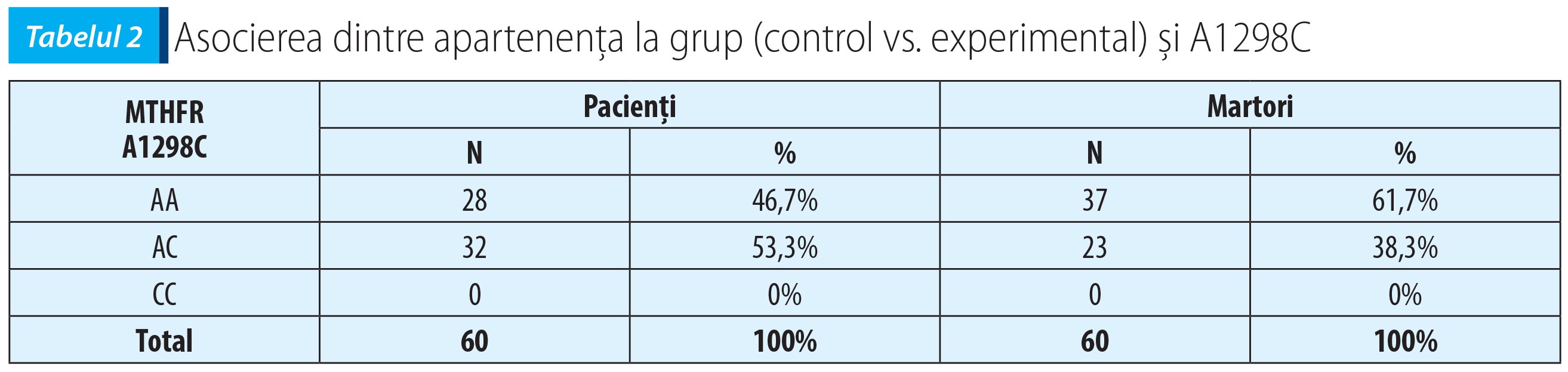
Evaluarea genotipului modificat (AC+CC) la lotul de pacienți comparativ cu lotul-martor a arătat că mutația genei MTHFR în poziția 1298 nu are semnificație statistică, deși se observă că un număr mai mare de pacienți au avut genotipul modificat (53,3%), comparativ cu lotul-martor (38,3%) – χ²(2, N=60)=2,71, p=0,099 (vezi tabelul 2).
Vârsta debutului bolii psihice
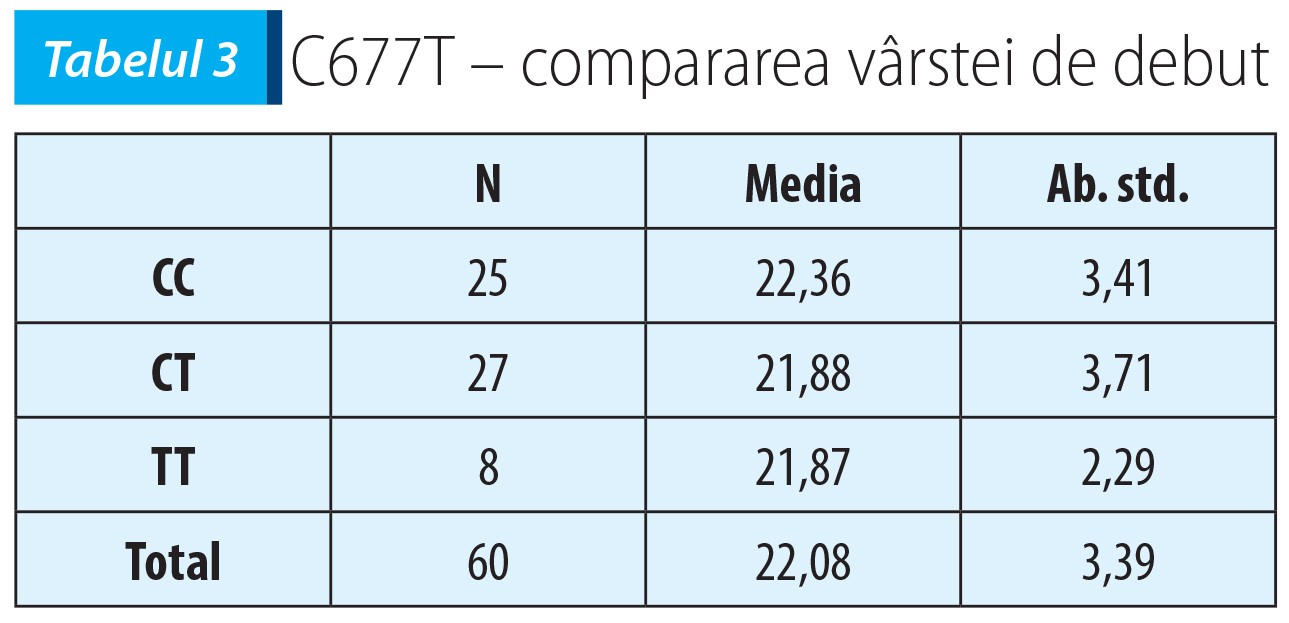
Mutațiile MTHFR C677T nu se asociază cu vârsta de debut a schizofreniei (F(df=2, N=59)=0,13, p=0,871) (vezi tabelul 3).
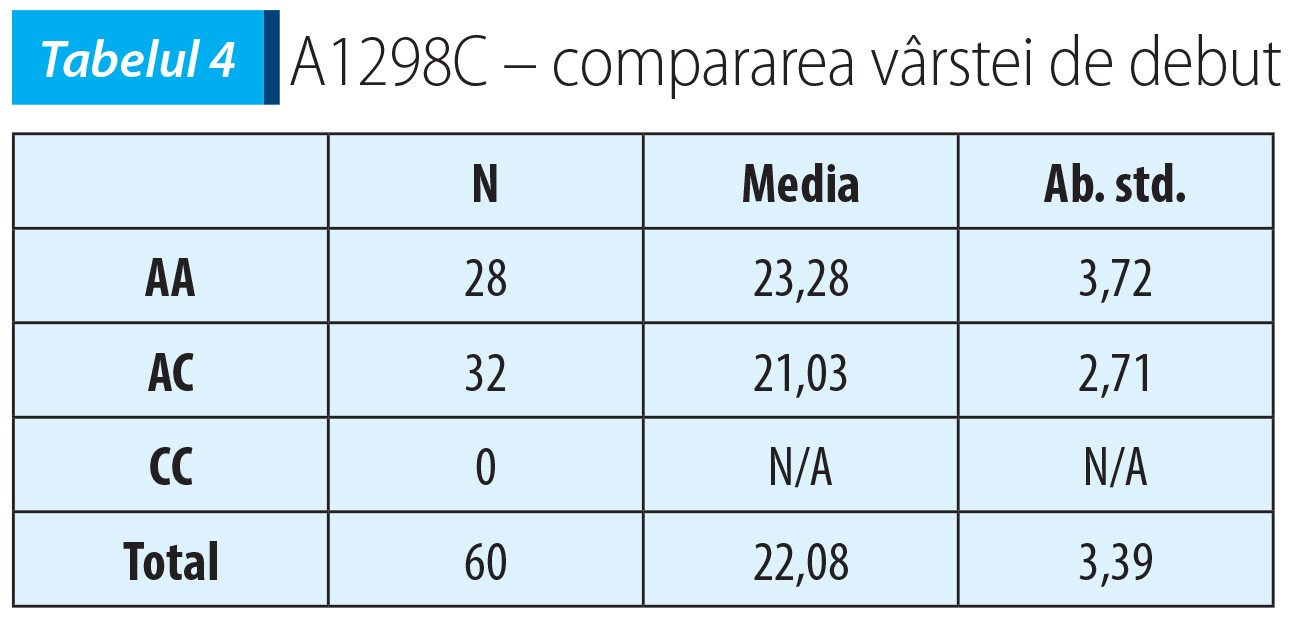
În cazul mutației MTHFR A1298C, boala a debutat semnificativ mai devreme la pacienții care au alela C, respectiv la heterozigoți AC, comparativ cu pacienții homozigoți AA (t(58)=-2,70, p=0,009) – vezi tabelul 4.
Antecedentele heredocolaterale psihiatrice
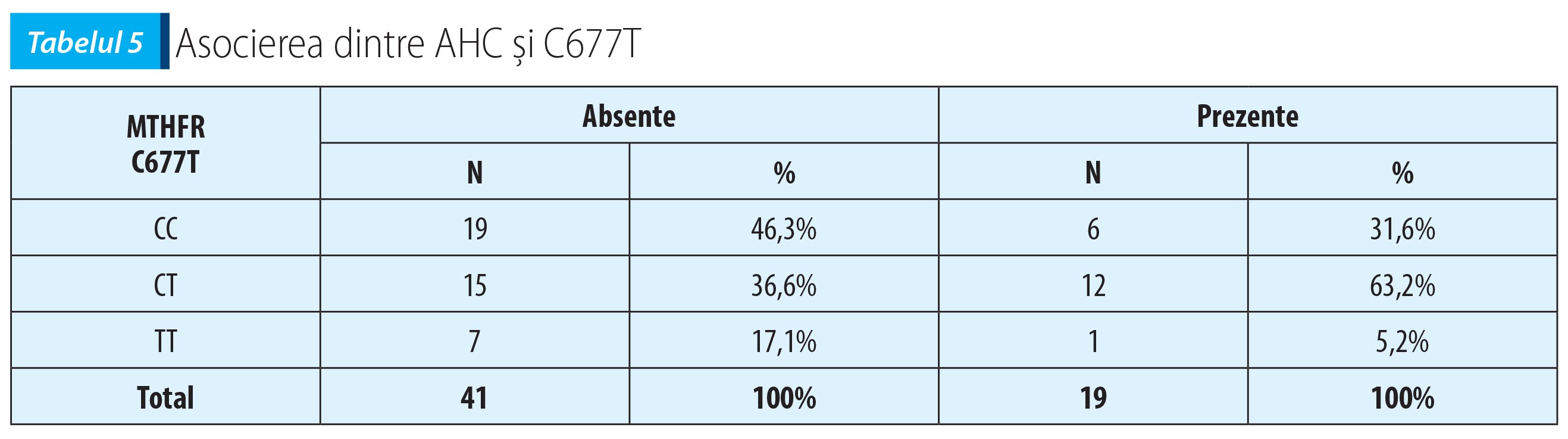
Datele noastre au arătat că nu există o asociere semnificativă între AHC de schizofrenie și mutația genei MTHFR în poziția C667T – χ²(2, N=60)=4,07, p=0,130 (vezi tabelul 5).
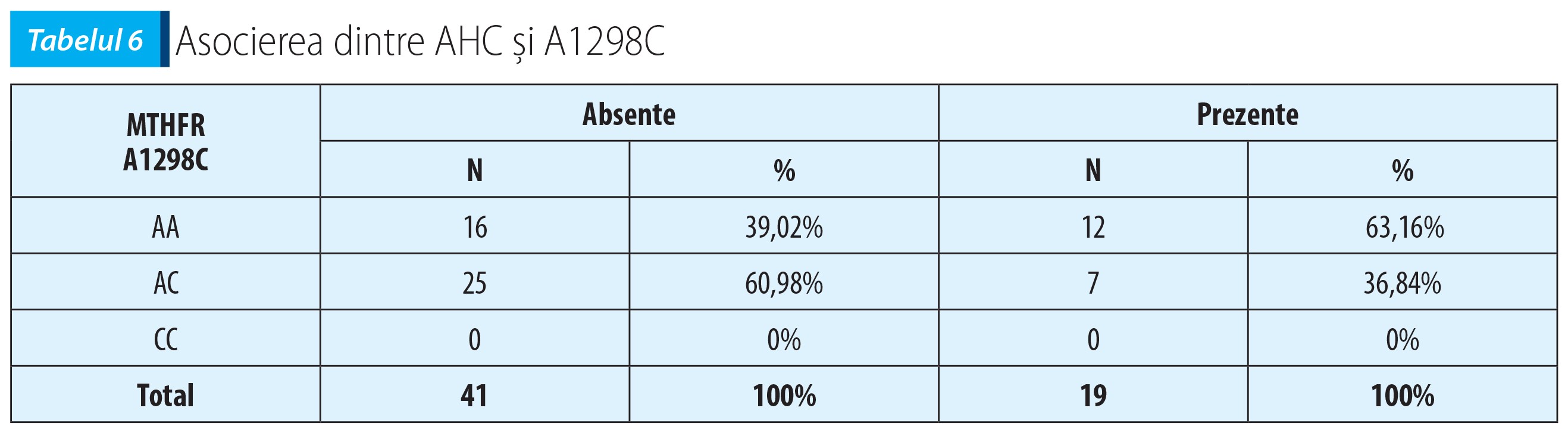
Evaluarea AHC la pacienții heterozigoți AC comparativ cu pacienții homozigoți CC și cei homozigoți fără genotip modificat AA a arătat că nu există o asociere semnificativă între AHC și mutația genei MTHFR în poziția A1298C – χ²(1, N=60)=3,03, p=0,081 (vezi tabelul 6).
Discuții
În studiul de față am demonstrat că mutația genei MTHFR în poziția C677T a fost mult mai frecventă la lotul de pacienți cu schizofrenie comparativ cu lotul-martor, numărul heterozigoților fiind semnificativ crescut, ceea ce sugerează implicarea polimorfismului MTHFR C667T în patogeneza bolii. Evaluarea mutației genei MTHFR în poziția A1298C nu are semnificație statistică, nefiind găsită o asociere între această mutație și schizofrenie.Pacienții heterozigoți cu mutația A1298C au avut o vârstă de debut a bolii mai scăzută comparativ cu pacienții homozigoți AA, existând o asociere semnificativă statistic. În schimb, corelația fost lipsită de semnificație statistică în cazul mutației C667T, la care nu s-a găsit nicio asociere cu vârsta de debut a schizofreniei.
AHC au existat în număr mare la pacienții heterozigoți (12 din 27 de pacienți având una sau mai multe rude cu psihoze) față de homozigoți (1 din 8 pacienți) și cei cu genă normală (6 din 25 de pacienți), dar fără o legătură semnificativă statistic între AHC și mutația genei C667T. În schimb, la mutația A1298C, AHC au existat în număr mic la pacienții heterozigoți (7 din 32 de pacienți având una sau mai multe rude cu psihoze), față de pacienții normali (12 din 28 de pacienți), dar și în acest caz corelația a fost lipsită de semnificație statistică.
Datele obținute în studiul de față pledează pentru rolul mutației genei MTHFR în poziția 677 în etiopatogenia schizofreniei. Studiul efectuat este în concordanță cu o serie de studii din literatură. Metaanaliza lui Peerbooms și colab. (2011), efectuată pe 29502 pacienți, arată că mutația C667T a genei MTHFR este asociată semnificativ cu bolile psihice: schizofrenia, tulburarea afectivă bipolară și tulburarea depresivă(26,27). Un studiu efectuat pe pacienți arabi și pe cei din Egipt cu schizofrenie și tulburare afectivă bipolară, comparativ cu un lot-martor de persoane sănătoase, a dovedit prevalența crescută a polimorfismului genei MTHFR la pacienții cu schizofrenie comparativ cu lotul-martor, asociind acest polimorfism cu riscul crescut de a dezvolta schizofrenie(28). Metaanalizele lui Zintzaras(29) și Cohen-Woods au indicat corelații între genotipul TT al polimorfismului MTHFR C677T și susceptibilitatea pentru schizofrenie. De asemenea, Kempisty a constatat că genotipul TT al aceluiași polimorfism se corelează cu schizofrenia(30). Metaanaliza studiilor efectuate de Lewis și colaboratorii(31), Muntjeweerff și colaboratorii(32), Gilbody și colaboratorii(10), Yoshimi și colaboratorii(15) și Peerbooms și colaboratorii(12) a evidențiat asocierea dintre MTHFR C677T și schizofrenie, raportându-se un risc mai crescut de schizofrenie la pacienții cu genotipul TT și purtătorii de alelă T. Lajin și colaboratorii(33) au găsit o asociere semnificativă statistic pentru mutația MTHFR 677TT și schizofrenie. De asemenea, alela C677T (în special, genotipul homozigot sau combinația dintre C677T și alte variante MTHFR, cum ar fi A1298C) poate contribui la hiperhomocisteminemie, asociindu-se cu un risc crescut pentru boli cardiovasculare, migrene, depresie, schizofrenie, boală bipolară, demență, boală Alzheimer și defect de tub neural fetal(34,35,36,37,38,39).
La ora actuală există însă și numeroase studii contradictorii referitoare la implicarea polimorfismului genei MTHFR C677T în schizofrenie. Studiile realizate de Tan și colaboratorii(40) și de Chen și colaboratorii(41) asupra populației chineze nu au găsit nicio corelație semnificativă între mutațiile genei C677T la pacienții cu schizofrenie, comparativ cu lotul-martor, deși frecvența alelei T a fost mai mare în grupul de pacienți cu schizofrenie, respectiv tulburare bipolară. Kim și colaboratorii(42), similar cu rezultatele obținute de Tan și colaboratorii(40), nu a constatat nicio asociere semnificativă între polimorfismul MTHFR C677T și riscul de schizofrenie la populațiile coreeană și caucaziană, dar posibil corelații la populația asiatică. Aceste controverse între studii pot fi explicate prin diferențele demografice, care pot influența asocierea polimorfismelor MTHFR cu tulburările psihice(28,32,43).
De asemenea, sunt studii care demonstrează că homocisteina serică mărită crește riscul de schizofrenie, în special la persoanele cu mutația C677T. Persoanele cu cea mai mare homocisteină serică par să prezinte forma cea mai severă de boală, în special formele heterozigote pentru C677T(44). Enzima MTHFR joacă un rol central în metabolismul acidului folic prin transformarea ireversibilă a 5,10-MTHF (metilenetetrahidrofolatul) în 5-MTHF, forma circulantă predominantă a acidului folic. 5-MTHF are un rol crucial în one-carbone metabolism, precum și în metilarea ADN(45). Donarea unui grup metil al homocisteinei în vederea generării S-adenosylmetioninei (SAM) reprezintă sursa majoră de grupări metil în creier(46). Homocisteina și metaboliții săi pot avea un efect excitotoxic direct asupra receptorilor de glutamat din creier, N-metil-D-aspartat (NMDA), și pot inhiba procesele de metilare la nivelul sistemului nervos central(47,48). Activitatea normală a acestei enzime este de a menține nivelurile circulante ale acidului folic și metioninei și de a reduce nivelurile de homocisteină(49).
Alela C677T este cea mai studiată variantă, aproximativ 50% dintr-o populație poate moșteni o copie (C/T heterozigotă), în timp ce până la 25% pot moșteni două exemplare (T/T homozigote). Deficitul sever de MTHFR cu activitate enzimatică de 0-20% poate provoca întârzieri în dezvoltare, convulsii, disfuncții motorii și chiar tulburări schizofrenice(15,50).
Evaluarea prezenței mutației A>C în poziția 1298 a genei MTHFR indică prezența genotipului modificat la un număr mai mare de pacienți, comparativ cu lotul-martor, datele obținute în studiu fiind în concordanță cu cele din literatură, lipsa asocierii mutației 1298A>C cu schizofrenia fiind găsită în mai multe studii, inclusiv în metaanaliza lui Peerbooms și colaboratorii(26). Alela A1298C, deși este comună, nu poate afecta fundamental riscul pentru boală dacă nu este prezentă în formă homozigotă. Alela A1298C poate să nu aibă un efect atât de profund asupra nivelurilor de homocisteină, dar poate contribui la hiperhomocisteminemie dacă este prezentă împreună cu alela C677T și niveluri scăzute de folat(51).
Există unele studii care asociază varianta C677T cu apariția schizofreniei, a tulburării bipolare sau a tulburării depresive unipolare, în timp ce varianta A1298C a fost asociată numai cu tulburarea bipolară(52,53).
Alte studii ajung la concluzia improbabilității implicării polimorfismului C677T și a alterărilor metabolismului homocisteinei în patogeneza schizofreniei(50).
Din punctul de vedere al debutului bolii la pacienții cu schizofrenie, la cele două subgrupuri studiate cu genotip normal (CC) și modificat (CT+TT) în poziția 677 a genei MTHFR, nu se constată diferențe semnificative statistic legate de vârsta debutului, comparativ cu anumite studii care descriu la pacienții heterozigoți o vârstă de debut al bolii mai mică, studiile lui Toffoli și colaboratorii(18), Peerbooms și colaboratorii(54), Saetre și colaboratorii(55). Un alt studiu al lui Saetre și colaboratorii(56) nu a evidențiat nicio corelație semnificativă între polimorfismul genei MTHFR C667T și vârsta debutului la populația nordică. Studiul realizat de Vares și colaboratorii(57) a arătat asocieri semnificative între polimorfismul genei MTHFR C677T și vârsta de debut în schizofrenie, alela mutantă T fiind asociată cu un debut mai precoce la populația scandinavă și cea chineză. Referitor la implicația mutației A1298C și vârsta de debut al bolii, s-a constatat că boala a debutat semnificativ mai devreme la pacienții cu A1298 - genotip heterozigot, comparativ cu pacienții cu mutația A1298C - genotip normal, ceea ce este în concordanță cu datele din literatură(58).
Din punctul de vedere al antecedentelor heredocolaterale psihiatrice, nu s-a găsit nicio semnificație statistică între AHC și mutațiile C667T și, respectiv, A1298C, datele fiind și ele concordante cu cele din literatură(26,58).
Concluzii
1. La lotul de pacienți psihotici luați în studiu se evidențiază prezența mutației heterozigote pentru poziția 677 la un număr semnificativ de mare de pacienți cu schizofrenie, comparativ cu lotul-martor, numărul heterozigoților fiind semnificativ crescut, ceea ce sugerează implicarea polimorfismului MTHFR în patogeneza bolii.2. Pacienții heterozigoți cu mutația A1298C au avut o vârstă de debut al bolii mai scăzută, iar pacienții heterozigoți cu mutația C677T au avut antecedente heredocolaterale de patologie psihiatrică (una sau mai multe rude cu boli psihice), acest lucru putând explica evoluția mai trenantă a acestor pacienți și posibila lor rezistențăa terapeutică la medicația antipsihotică.
3. Cele mai multe studii se referă la pacienții schizofrenici cu valori crescute ale homocisteinemiei(59) și au ajuns la concluzia că homozigozitatea pentru MTHFR poate fi un factor de risc pentru psihoze, administrarea de acid folic diminuând acest risc(60). Astfel, se recomandă o terapie cu vitamine din grupul B și acid folic, asociată medicației antipsihotice la schizofrenici, chiar în lipsa dozării folatului și a homocisteinei, având în vedere conceptul conform căruia genotipul 677TT poate fi asociat cu creșterea homocisteinei și efectul benefic recunoscut al suplimentării tratamentului cu acid folic asupra activității enzimei MTHFR(61).
Bibliografie
- V. Chiriță, M. Mavros, O. Popescu, Roxana Chiriţă. The role of 677 C>T genetic polymorphism of methylenetetrahydrofolate reductase gene in schizophrenia. Volumul de rezumate al celui de-al 9-lea Congres Modial de Biologie Psihiatrică, Paris, 28.06-2.07.2010: 351-352.
- Procopciuc L.M., Jebeleanu G., Fodoreanu L., Crişan C., Olteanu I. Polimorfismul C677T din genele metilentetrahidrofolat reductazei (MTHFR) și riscul pentru apariţia schizofreniei. Clujul Medical, 2005, vol LXXVIII, nr.4:834-840.
- McGrath J., Saha S., Chant D., Welham J. (2008). Schizophrenia: a concise overview of incidence, prevalence, and mortality. Epidemiol Rev 30:67-76.doi:10.1093/epirev/mxn001.
- Falkenburg J., Tracy DK (2014). Sex and schizophrenia: a review of gender differences. Psychosis, doi: 10.1080/17522439. 2012. 733405.
- L. Fodoreanu, L. Procopciuc, C. Crişan. Studiul clinic privind implicarea polimorfismului genei MTHFR în schizofrenie şi depresii. Rev. Română de Psihiatrie, vol. VII, 2005, 110-113.
- L.M. Procopciuc, L. Fodoreanu, C. Crişan, I. Olteanu. Polimorfismul 102T/C din gena 5HT-2A și riscul pentru schizofrenie. Corelaţii cu fenotipul clinic. Clujul Medical, vol. 82, nr.1, anul2009, 109-113.
- Bertolino A., Caforio G., Blasi G., et al. Interaction of COMT (Val(108/158)Met) genotype and olanzapine treatment on prefrontal cortical function in patients with schizophrenia. Am J Psychiatry, 2011, 161(10):1798-805.
- Mărginean C., Fodoreanu L., Dragomir I. Particularităţi ale factorilor impicaţi în conduita suicidară. Rev. Med. Chir. Soc. Medici și Naturalişti, Iaşi, 2006, 110:121-126.
- Z. Ozbek, C.I. Kucukali, E. Ozkok et al. Effect of the methylenetetrahydrofolate reductase gene polymorphisms on homocysteine, folate and vitamin B12 in patients with bipolar disorder and relatives, Progress in Neuro-Psychopharmacology and Biological Psychiatry, vol. 32, no. 5, p. 1331-37, 2008.
- Schizophrenia International Research Society, 2012.
- S. Gilbody, S. Lewis and T. Lightfoot. Methylenetetrahydrofolate reductase (MTHFR) genetic polymorphisms and psychiatric disorders: a HuGE review, American Journal of Epidemiology, vol. 165, no. 1, p. 1-13, 2007.
- S.M. Arzaghi, A. Hossein-Nezhad, S.V. Shariat, A. Ghodsipour, J. Shams and B. Larijani. C677T Methylenetetrahydrofolate reductase (MTHFR) gene polymorphism in schizophrenia and bipolar disorder: an association study in Iranian population, Iranian Journal of Psychiatry, 2011.
- O.L.J. Peerbooms, J. van Os, M. Drukker et al. Meta-analysis of MTHFR gene variants in schizophrenia, bipolar disorder and unipolar depressive disorder: evidence for a common genetic vulnerability? Brain, Behavior, and Immunity, vol. 25, no. 8, pp. 1530-43, 2011.
- C. Sugden. One-carbon metabolism in psychiatric illness, Nutrition Research Reviews, vol. 19, no. 1, pp. 117-36, 2006.
- M.O. Krebs, A. Bellon, G. Mainguy, T.M. Jay, and H. Frieling. One-carbon metabolism and schizophrenia: current challenges and future directions, Trends in Molecular Medicine, vol. 15, no. 12, p. 562-70, 2009.
- A. Yoshimi, B. Aleksic, Y. Kawamura et al. Gene-wide association study between the methylenetetrahydrofolate reductase gene (MTHFR) and schizophrenia in the Japanese population, with an updated meta-analysis on currently available data, Schizophrenia Research, vol. 124, no. 1-3, p. 216-22, 2010.
- T.W. Bredy, Y.E. Sun and M.S. Kobor. How the epigenome contributes to the development of psychiatric disorders, Developmental Psychobiology, vol. 52, no. 4, p. 331-42, 2010.
- S.M. Stahl. Methylated spirits: epigenetic hypotheses of psychiatric disorders, CNS Spectrums, vol. 15, no. 4, 2010, p. 220-230.
- Toffoli G, De Mattia E. Pharmacogenetic relevance of MTHFR polymorphisms. Pharmacogenomics, 2008 Sep; 9(9):1195-206.
- S. Gilbody, S. Lewis and T. Lightfoot. Methylenetetrahydrofolate reductase (MTHFR) genetic polymorphisms and psychiatric disorders: a HuGE review, The American Journal of Epidemiology, vol. 165, no. 1, p. 1-13, 2007.
- D.K. Lahiri, B. Maloney and N.H. Zawia. The LEARn model: an epigenetic explanation for idiopathic neurobiological diseases, Molecular Psychiatry, vol. 14, no. 11, p. 992–1003, 2009.
- World Health Organization. ICD-10 Classification of mental and Behavioural Disorder: Clinical Descriptions and Diagnostic Guidelines. Geneva, Switzerland: World Health Organization, 1992.
- American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders. 4th ed. Washington, DC: American Psychiatric Association, 2003.
- Stanley R. Kay, Lewis A. Opler, Abraham Fiszbein, Paul M. Ramirez, Mark Opler, Leonard White. PANSS (Positive and Negative Syndrome Scala).
- Guy W, editor. ECDEU Assessment Manual for Psychopharmacology. Rockville, MD: US Department of Heath, Education, and Welfare Public Health Service Alcohol, Drug Abuse, and Mental Health Administration; 1976, CGI-S (Clinical Global Impresion).
- Montalvo V. Barnhart, 2005 U.S. Dist. LEXIS 44133 (W.D.N.Y. 2005). GAF(Global Assessment of Functioning).
- Peerbooms OLJ, van Os J, Drukker M, Kenis G, Hoogveld L. MTHFR in Psychiatry Group, de Hert M, Delespaul, P van Winkel R, Rutten BPF. Meta-analysis of MTHFR gene variants in schizophrenia, bipolar disorder and unipolar depressive disorder: evidence for a common genetic vulnerability? Brain Behav Immun 2010, Dec 24.
- Liu A., Menon S., Colson N.J., et al. Analysis of the MTHFR C677T variant with migraine phenotypes. BMC Res Notes. 2010 Jul 28; 3:213. doi: 10.1186/1756-0500-3-213. PMID: 20663228.
- Mohamed A. El-Hadidy, Hanaa M. Abdeen, Sherin M. Abd El-Aziz and Mohammad Al-Harrass. MTHFR Gene Polymorphism and Age of Onset of Schizophrenia and Bipolar Disorder, Biomed Res Ins., 2014.
- E. Zintzaras. C677T and A1298C methylenetetrahydrofolate reductase gene polymorphisms in schizophrenia, bipolar disorder and depression: a meta-analysis of genetic association studies, Psychiatric Genetics, vol. 16, no. 3, p. 105-15, 2006.
- B. Kempisty, A. Mostowska, I. Górska et al. Association of 677C>T polymorphism of methylenetetrahydrofolate reductase (MTHFR) gene with bipolar disorder and schizophrenia, Neuroscience Letters, vol. 400, no. 3, p. 267-71, 2006.
- S.J. Lewis, S. Zammit, D. Gunnell and G.D. Smith. A meta-analysis of the MTHFR C677T polymorphism and schizophrenia risk, The American Journal of Medical Genetics B: Neuropsychiatric Genetics, vol. 135, no. 1, p. 2-4, 2005.
- J.W. Muntjewerff, R.S. Kahn, H.J. Blom and M. den Heijer. Homocysteine, methylenetetrahydrofolate reductase and risk of schizophrenia: a metaanalysis, Molecular Psychiatry, vol. 11, no. 2, pp. 143-49, 2006.
- B. Lajin, A.A. Sakur, R. Michati and A. Alachkar. Association between MTHFR C677T and A1298C, and MTRR A66G polymorphisms and susceptibility to schizophrenia in a Syrian study cohort, Asian Journal of Psychiatry, vol. 5, no. 2, p. 144-49, 2012.
- Trimmer EE. Methylenetetrahydrofolate reductase: biochemical characterization and medical significance. Curr Pharm Des. 2013; 19(14):2574-93. Review, PubMed PMID: 23116396.
- Schwahn B, Rozen R. Polymorphisms in the methylenetetrahydrofolate reductase gene: clinical consequences. Am J Pharmacogenomics. 2001; 1(3):189-201. Review, PMID: 12083967.
- Gilbody S, Lewis S, Lightfoot T. Methylenetetrahydrofolate reductase (MTHFR) genetic polymorphisms and psychiatric disorders: a HuGE review. Am J Epidemiol. 2007 Jan 1, 165(1):1-13. PubMed PMID: 17074966.
- Weisberg IS, Jacques PF, Selhub J, et al. The 1298A–>C polymorphism in methylenetetrahydrofolate reductase (MTHFR): in vitro expression and association with homocysteine. Atherosclerosis. 2001Jun; 156(2):409-15. PMID: 11395038.
- National Library of Medicine Genetics Home Reference; http://ghr.nlm.nih.gov/gene/MTHFR. Accessed: October 1, 2014.
- Ames BN, Elson-Schwab I, Silver EA. High-dose vitamin therapy stimulates variant enzymes with decreased coenzyme binding affinity (increased K(m)): relevance to genetic disease and polymorphisms. Am J Clin Nutr. 2002 Apr; 75(4):616-58. Review: PMID: 11916749.
- E.C. Tan, S.A. Chong, L.C. Lim et al. Genetic analysis of the thermolabile methylenetetrahydrofolate reductase variant in schizophrenia and mood disorders, Psychiatric Genetics, vol. 14, no. 4, p. 227-231, 2004.
- Z. Chen, Y. Liu, D. Zhang et al. C677T methylenetetrahydrofolate reductase gene polymorphisms in bipolar disorder: an association study in the Chinese population and a meta-analysis of genetic association studies, Neurosci Lett. 2009 Jan 2; 449(1):48-51.
- S.M. Arzaghi, A. Hossein-Nezhad, S.V. Shariat, A. Ghodsipour, J. Shams and B. Larijani. C677T Methylenetetrahydrofolate reductase (MTHFR) gene polymorphism in schizophrenia and bipolar disorder: an association study in Iranian population, Iranian Journal of Psychiatry, vol. 6, no. 1, p. 1-6, 2011, Neuroscience Letters, vol. 449, no. 1, p. 48–51, 2009.
- Bjornsson Fallin and A.P. Feinberg. An integrated epigenetic and genetic approach to common human disease, Trends in Genetics, vol. 20, no. 8, p. 350-8, 2004.
- G.L. Cantoni. S-Anenysylmethionine: a new intermediate formed enzymatically from 1-methionine and adenosine triphosphate, The Journal of Biological Chemistry, vol. 204, p. 403-16, 1953.
- T. Bottiglieri, K. Hyland and E.H. Reynolds. The clinical potential of ademetionine (S-adenosylmethionine) in neurological disorders, Drugs, vol. 48, no. 2, p.137-52, 1994.
- G. L. Cantoni. S-Anenysylmethionine: a new intermediate formed enzymatically from 1-methionine and adenosine triphosphate, The Journal of Biological Chemistry, vol. 204, p. 403-16, 1953.
- S. Cohen-Woods, I. Craig, D. Gaysina et al. The Bipolar Association Case-Control Study (BACCS) and meta-analysis: no association with the 5,10-methylenetetrahydrofolate reductase gene and bipolar disorder, The American Journal of Medical Genetics B: Neuropsychiatric Genetics, vol. 153, no. 7, p. 1298-304, 2010.
- R. Rozen. Molecular genetics of methylenetetrahydrofolate reductase deficiency, Journal of Inherited Metabolic Disease, vol. 19, no. 5, p. 589-94, 1996.
- Arinami T., Zamada N. Methylentetrahydrofolate reductase variant and schizophrenia/ depression. Am. J. Med. Genet. 74(5): 526-8, 1997.
- Botto L.D., Yang Q. 5,10-Methylenetetrahydrofolate reductase gene variants and congenital anomalies: HuGE review. Am J Epidemiol. 2000 May 1; 151(9):862-77. Review, PMID: 10791559.
- Nazki F.H., Sameer A.S., Ganaie B.A. Folate: metabolism, genes, polymorphisms and the associated diseases. Gene. 2014 Jan 1; 533(1):11-20. doi: 10.1016/j.gene.2013.09.063. Review. PMID: 24091066.
- V. Rai. Evaluation of methylenetetrahydrofolate reductase gene variant (C677T) as risk factor for bipolar disorder, Cellular and Molecular Biology, vol. 57, p. OL1558–OL1566, 2011.
- Kunugi H, Fukuda R et al. (1998). C677T polymorphism in methylentetrahydropholate reductase gene and psychoses. Mol. Psychiatry. 3 (5): 435-7.
- O. Peerbooms, B.P.F. Rutten, J. Decoster et al. No association between MTHFR C677T or A1298C and age at onset of schizophrenia, The American Journal of Medical Genetics B, vol. 153, no. 7, p. 1362-3, 2010.
- P. Saetre, M. Vares, T. Werge et al. Methylenetetrahydrofolate reductase (MTHFR) C677T and A1298C polymorphisms and age of onset in schizophrenia: a combined analysis of independent samples, The American Journal of Medical Genetics B, vol. 156, no. 2, p. 215-24, 2011.
- P. Saetre, J. Grove, A.D. Borglum et al. Methylenetetrahydrofolate reductase (MTHFR) C677T polymorphism and age at onset of schizophrenia: no consistent evidence for an association in the nordic population, The American Journal of Medical Genetics B: Neuropsychiatric Genetics, vol. 159, no. 8, p. 981-86, 2011.
- M. Vares, P. Saetre, H. Deng et al. Association between methylenetetrahydrofolate reductase (MTHFR) C677T polymorphism and age of onset in schizophrenia, The American Journal of Medical Genetics B: Neuropsychiatric Genetics, vol. 153, no. 2, p. 610-18, 2010.
- Kempisty B, Bober A, Luczak M, Czerski P, Szczepankiewicz A, Hauser J, Jagodziński PP. Distribution of 1298A>C polymorphism of methylenetetrahydrofolate reductase gene in patients with bipolar disorder and schizophrenia. Eur Psychiatry 2007; 22(1):39-43.
- Susser E, Brown A.S. Schizophrenia and impaired homocysteine metabolism: a possible association. Biol. Psychiatry 44(2); 1998, 141-3.
- Bjelland, Invar, Tell, GS, Stein Emil Vollset et al. (2003). Folate, Vitamin B12, Homocysteine, and the MTHFR 677CT Polymorphism-Depression. Arch. Gen. Psychiatry. 60: 618-26.
- Regland B, Germgard T, Gottfries CG, Ggrenfeld B, Koch-Schmidt A.C. Homozygous thermolabile methylenete-trahydropholate reductase in schizophrenia-like psychosis, J. Neural Transmission. 104(8-9):931-41, 1997.
Articole din ediția curentă
SKEPSIS
Strategii de prevenţie a tulburărilor psihice
Dana-Cristina Herţa
Prevenția tulburărilor psihice presupune intervenții care reduc incidența, prevalența și recurența tulburărilor psihice, scad durata simptomelor, reduc afecțiunile care cresc riscul pentru tulburări psihice, previn sau întârzie recurențele și scad impactul individual, familial și social al tulburărilor psihic...
REVIEW
Istoria psihoterapiei (2)
Radu Vraşti
La sfârșitul „Secolului luminilor“ apar primele semne de umanizare a concepției despre bolile psihice și, astfel, în 1792, filantropul englez William Tuke (1732 - 1822) înființează prima instituție în care pacienții nu mai sunt legați, iar în 1794, medicul francez Phillippe Pinel (1745 - 1826) introduce la sp...
PSIHOPATOLOGIE
Psihopatologia evoluţionist-culturală, o nouă orientare în știinţele umane
Mircea LĂZĂRESCU
Psihopatologia s-a născut într-o variantă descriptivă în secolul al XIX-lea, prin descrierea semnelor și simptomelor psihice ale pacienților internați în aziluri(1). Bilanțul acestora fiind aproape încheiat, în 1911, K. Jaspers(2) a realizat o primă mare sinteză a psihopatologiei clinice, căreia i-a imprimat ...Articole din edițiile anterioare
REVIEW ARTICLES
Actualităţi în managementul afecţiunilor tiroidiene la femei în perioada sarcinii
Teodora Turtă, Melinda Matyas, Lucia Procopciuc, Daniel Mureşan, Gabriela Caracostea
Afecţiunile tiroidiene sunt printre cel mai frecvent întâlnite patologii la femeile aflate la vârsta fertilă. Homeostazia tiroidiană este importantă atât în dezvoltarea sarcinii, cât şi în obţinerea acesteia, de aceea es...
REVIEW ARTICLES
Factori angiogenici în timpul sarcinii normale şi preeclampsia
Lucia Procopciuc, Georgiana Nemeti, Iulian Goidescu, E. Buzdugan, Gabriela C. Zaharie
Mecanismul patogen al preeclampsiei implică disfuncţia endotelială din cauza angiogenezei deficitare, cu un dezechilibru între factorii circulanţi proangiogenici şi antiangiogenici. Angiogeneza apare atât în condiţii nor...
SINTEZE CLINICE



