Diagnosticul molecular al alergiilor în practica clinică
Molecular diagnosis of allergic diseases in clinical practice
Abstract
Allergy diagnosis is in a transition period, in which allergen extract-based diagnosis is gradually being replaced by tests that use molecular allergen components. The use of recombinant or purified molecular allergens allows the complete validation and standardization in terms of identity, quantity, homogeneity, structure, binding of E immunoglobulins and biological potency of products, these characteristics being extremely difficult to test and standardize when it comes to allergen extracts. The molecular diagnosis is represented in laboratory practice by two main types of tests – singleplex and multiplex. These advances have opened a new era of high-resolution allergy diagnosis and changed our understanding of sensitization profiles and cross-reactivity, thus allowing for a better patient management. The place of molecular diagnosis in allergy diagnosis is still under debate, as there are several possible approaches to it. In order to take advantage of the full potential of molecular diagnosis in clinical practice, a thorough general knowledge of molecular allergology is required, as well as a clear justification for its use. This article presents information about the molecular diagnosis of allergies, notions about cross-reactivity and the main methods of molecular diagnosis, possible approaches to molecular diagnosis in clinical practice, as well as some clinical cases that use molecular diagnosis.Keywords
molecular diagnosisallergy diagnosiscross-reactivitytop-down approachbottom-up approachU-shaped approachclinical practiceRezumat
Diagnosticul alergologic se află într-o perioadă de tranziţie, în care diagnosticul bazat pe extracte alergenice este înlocuit treptat cu testele care utilizează componente alergenice moleculare. Utilizarea alergenelor moleculare recombinate sau purificate permite validarea şi standardizarea completă în ceea ce priveşte identitatea, cantitatea, omogenitatea, structura, legarea imunoglobulinelor E şi potenţa biologică a produselor, aceste caracteristici fiind extrem de dificil de testat şi standardizat pentru produsele pe bază de extracte. Diagnosticul molecular este reprezentat în practica de laborator de două tipuri principale de teste – testele singleplex şi multiplex. Aceste progrese au deschis o nouă eră de diagnostic alergologic de înaltă rezoluţie şi ne-au schimbat înţelegerea profilurilor de sensibilizare şi a reactivităţii încrucişate, permiţând astfel şi un management mai bun al pacientului. Locul diagnosticului molecular în cadrul diagnosticului alergologic este încă dezbătut, fiind posibile mai multe abordări ale acestuia. Pentru a profita de întregul potenţial al diagnosticului molecular în practica clinică, sunt necesare o cunoaştere generală aprofundată a alergologiei moleculare, precum şi o justificare clară pentru utilizarea acesteia. În acest articol sunt prezentate informaţii despre diagnosticul molecular al alergiilor, noţiuni despre reactivitatea încrucişată şi principalele metode de diagnostic molecular, posibile abordări ale diagnosticului molecular în practica clinică, precum şi câteva cazuri clinice care utilizează diagnosticul molecular.Cuvinte Cheie
diagnostic moleculardiagnostic alergologicreactivitate încrucişatăabordarea top-downabordarea bottom-upabordarea în formă de Upractica clinicăIntroducere în diagnosticul alergiilor
Prevalenţa bolilor alergice este în creştere, atât în ţările dezvoltate, cât şi în cele în curs de dezvoltare (Pawankar et al., 2013). Această creştere este problematică mai ales la copii, care poartă cea mai mare povară a tendinţei ascendente care a avut loc în ultimele două decenii. Bolile alergice au o etiologie multifactorială, care include susceptibilitatea genetică, calea de expunere, doza de alergen şi, în unele cazuri, natura sau caracteristicile structurale ale alergenului (Ferreira et al., 2014). Acestea cauzează disfuncţii imune pe termen lung, având la bază inflamaţia, care reprezintă un factor important şi în patogeneza altor boli netransmisibile. Ca urmare a extinderii mari a prevalenţei alergiilor, acestea ar trebui să fie privite ca o problemă majoră de sănătate publică. Dar, în ciuda acestei creşteri, diagnosticul şi managementul pacienţilor alergici au rămas deficitare şi departe de a fi ideale.
Confirmarea alergiei şi identificarea alergenelor cauzatoare sunt esenţiale pentru gestionarea corectă a bolilor alergice. Tehnologiile recombinante în domeniul alergologiei au adus progrese uriaşe în caracterizarea alergenelor şi dezvoltarea produselor de imunoterapie, precum şi în cunoaşterea mecanismelor imune implicate în bolile alergice (Akdis and Akdis, 2007; Matriacardi et al., 2019). Aceste progrese au adus noi oportunităţi de inovaţie în diagnosticul precis al bolilor alergice, ceea ce permite implementarea imunoterapiilor orientate către factorii etiologici ai bolilor alergice, precum şi a măsurilor specifice de reducere a expunerii la alergene.
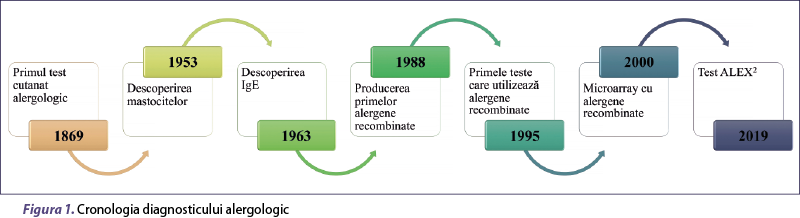
Deşi reacţiile alergice au fost documentate în istoria antică a Greciei şi a Imperiului Roman, observându-se corelaţii între expunerea la polenuri şi episoadele alergice, epoca modernă a studiului alergiilor a luat naştere cu adevărat la începutul anilor 1800, când dr. John Bostock a descris febra fânului (Ramachandran şi Aronson, 2011). În 1869, dr. Charles Blakely a realizat primul test cutanat pentru alergii, prin aplicarea unei cantităţi mici de polen pe o leziune superficială a pielii şi documentarea rezultatelor (Lockey, 1998). Conceptul de imunoterapie a fost introdus în 1911, când Noon a observat că inocularea profilactică cu extract de polen de iarbă a pacienţilor cu febra fânului induce desensibilizarea acestora, cu scăderea sensibilităţii conjunctivale la polenul de iarbă (Noon, 1911). Descoperirea mastocitelor în 1953 a ajutat la identificarea mecanismelor prin care se declanşează răspunsul imun alergic, iar în 1963 au fost descoperite şi imunoglobulinele E (IgE), ceea ce a contribuit în continuare la identificarea patogenezei reacţiilor alergice. Obţinerea primelor alergene recombinate în anii 1980-1990 a permis dezvoltarea exponenţială a testelor in vitro, începând cu panelurile de alergene recombinate în anii 1990 (Lockey, 1998), apoi primele microarray-uri la începutul anilor 2000 şi culminând cu panelurile extinse de alergene (de exemplu, sistemul ALEX2 – figura 1).
Diagnosticul alergologic clasic începe cu un istoric medical detaliat şi cu examenul clinic, ceea ce constituie baza pentru testările ulterioare. În cadrul istoricului medical, se urmăreşte identificarea unei asocieri temporale şi spaţiale între simptome şi expunerea la alergene. Suspiciunea clinică este apoi confirmată prin investigaţii in vivo (teste cutanate sau teste de provocare) sau in vitro (IgE serice specifice sau testul de activare a bazofilelor). Aceste teste utilizează în mod tradiţional paneluri de extracte alergenice din diferite surse, precum polenurile, acarienii din praful de casă, epiteliile de animale, mucegaiurile sau alimentele, care reprezintă amestecuri de alergene şi substanţe nealergenice. Acestea erau şi încă sunt dificil de caracterizat şi standardizat; de asemenea, deoarece aceste amestecuri conţin alergene diferite, este imposibil să se spună la care dintre acestea este sensibilizat pacientul.
Diagnosticul molecular al alergiilor
Diagnosticul bazat pe componente – sau diagnosticul molecular – implică fie separarea componentelor alergenice din sursa alergenică, fie producerea de alergene recombinate; în ambele cazuri se va obţine o moleculă foarte bine definită, caracterizată şi purificată, în concentraţii precise. Diagnosticul molecular prezintă o serie de avantaje faţă de diagnosticul bazat pe extracte alergenice:
-
indică prezenţa unui răspuns imun specific faţă de alergene individuale, deoarece se testează separat componentele moleculare;
-
oferă o rezoluţie diagnostică mai fină, deoarece utilizează proteine înalt definite şi purificate;
-
permite evaluarea riscului indus de sensibilizare, ceea ce este util în special în alergiile alimentare, deoarece alergenicitatea proteinelor din alimente este modificată prin prelucrarea termică a acestora sau prin digestie;
-
permite evidenţierea reactivităţii încrucişate între surse alergenice diferite;
-
permite identificarea corectă a indicaţiilor de imunoterapie alergenică, în funcţie de sensibilizările primare.
Dezavantajele diagnosticului molecular se rezumă la costurile ridicate ale acestuia şi necesarul de echipamente specializate şi personal înalt calificat, atât pentru procesarea probelor, cât şi pentru interpretarea rezultatelor (Matricardi et al., 2016).
Reactivitatea încrucişată
Una dintre cele mai mari provocări pentru medicul alergolog este pacientul cu test cutanat prick (skin prick test; SPT) pozitiv pentru mai multe polenuri şi/sau alergene alimentare. În acest scenariu, diagnosticul molecular poate fi extrem de util, îmbunătăţind rezoluţia diagnosticului convenţional prin adăugarea de informaţii despre sensibilizanţii primari autentici, pentru a-i distinge de sensibilizarea datorată reactivităţii încrucişate.
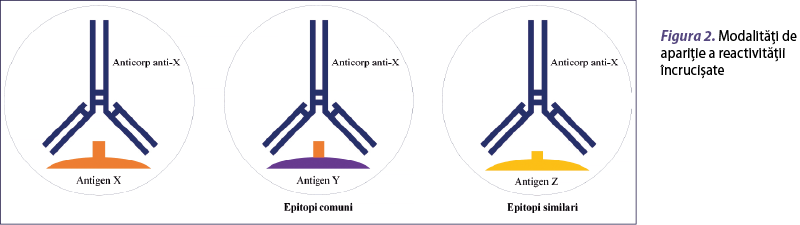
Reactivitatea încrucişată se defineşte ca fiind procesul prin care proteine sau domenii proteice din alergenul sensibilizant primar şi proteine omoloage din alte surse de alergene, aparţinând aceleiaşi familii de proteine, se leagă de anticorpii IgE specifici produşi faţă de alergenul sensibilizant (Aalberse et al., 2001). Pentru apariţia reactivităţii încrucişate este necesar un grad înalt de identitate de structură primară (de obicei, de peste 70%) şi terţiară între proteinele omoloage sau prezenţa unor epitopi identici aparţinând unor proteine diferite (figura 2) (Ferreira et al., 2004; Bublin and Breiteneder, 2020).
Majoritatea alergenelor sunt proteine care aparţin unui număr destul de redus de familii de proteine, fiind grupate în funcţie de asemănările dintre secvenţele şi structurile lor de aminoacizi; exemple de astfel de familii de proteine sunt polcalcinele, profilinele, proteinele legate de patogeneză (PR-10), proteinele nonspecifice de transfer lipidic (nsLTP), albuminele serice, lipocalinele, parvalbuminele (Radauer et al., 2008). Unele alergene sunt specifice speciei şi, astfel, reprezintă markeri de sensibilizare autentică la acea sursă de alergene (Luengo and Cardona, 2014; Kleine-Tebbe şi Jappe, 2017). Un exemplu în acest sens este alergenul Bet v 1 din polenul de mesteacăn, care reprezintă un marker specific al sensibilizării la mesteacăn, dar care prezintă similitudine structurală cu proteine care sunt alergene minore în diferite fructe, legume, seminţe, nuci şi alte polenuri (figura 3) (Wensing et al., 2002).
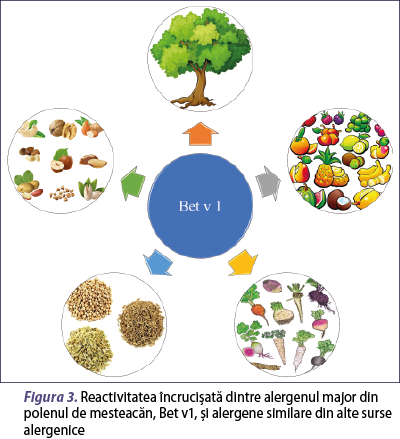
Fiecare pacient este sensibilizat la un set diferit de componente proteice dintr-o anumită sursă alergenică, iar în multe cazuri nu se cunoaşte relevanţa clinică a componentelor care determină reactivitatea încrucişată (van Ree, 2004), deoarece prezenţa IgE specifice pentru un alergen care determină reactivitate încrucişată nu implică întotdeauna simptome clinice. De asemenea, pacienţi sensibilizaţi la acelaşi alergen pot reacţiona la seturi diferite de alergene cu reactivitate încrucişată. Astfel, reactivităţile încrucişate pot complica rezultatele testelor clasice care evaluează sensibilizarea la alergene, făcând identificarea alergenului declanşator al simptomelor o adevărată provocare. Diagnosticul molecular este cel care oferă informaţii despre sensibilizarea la alergene specifică fiecărui pacient şi, astfel, orientează selecţia produsului de imunoterapie. De exemplu, imunoterapia alergenică (AIT) se poate recomanda dacă se confirmă sensibilizarea la alergene specifice speciei, în timp ce în cazul recunoaşterii selective a alergenelor cu reacţie încrucişată, cum ar fi profilinele, indicaţia de AIT este discutabilă (Luengo şi Cardona, 2014).
Metode utilizate în diagnosticul molecular al alergiilor
Diagnosticul molecular este reprezentat în practica de laborator de două tipuri principale de teste, teste singleplex şi multiplex.
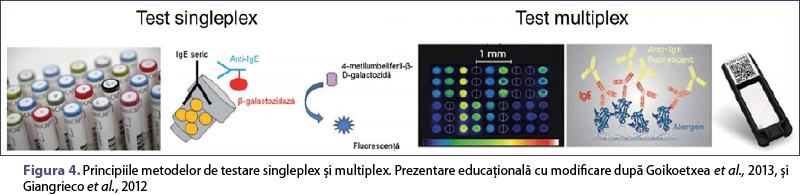
Testul singleplex presupune determinarea IgE pentru un singur alergen (o probă de sânge, un alergen) (Kleine-Tebbe şi Jakob, 2015). Testul se bazează pe o metodă standardizată fluoro-imunochimică sau lumino-imunochimică. Componenta alergenă, cuplată covalent cu un carrier, reacţionează cu anticorpii IgE specifici (sIgE) corespunzători din proba de ser. După spălarea anticorpilor IgE nespecifici, se adaugă anticorpi anti-IgE marcaţi cu anumite enzime. Complexul legat este apoi incubat cu un agent de vizualizare. După oprirea reacţiei, cantitatea de sIgE este determinată cu ajutorul unui analizor fluorometric sau luminometric (Paganelli et al., 1998; Costongs and Bas, 1997).
Testul multiplex este un tip de imunoanaliză cu detecţie fluorimetrică (figura 4), care determină simultan concentraţiile de sIgE pentru un panel mai mare de componente alergenice. Diferenţa este reprezentată de carrierul elementelor alergenice şi metoda de detecţie: moleculele alergene (componentele) sunt imobilizate pe un substrat solid într-un format de microarray şi pentru achiziţia finală a imaginii este utilizat un scaner de microarray. Rezultatele obţinute trebuie analizate cu ajutorul unui software specializat (Martínez-Aranguren et al., 2014).
Alegerea alergenului testat cu testul singleplex se bazează pe anamneză, constatările clinice despre pacient şi pe SPT. Testele multiplex pot determina simultan sIgE pentru numeroase molecule alergenice (112 pentru ISAC) sau extracte şi molecule alergenice (296 pentru ALEX2) (tabelul 1), dar, în plus faţă de profilurile de sensibilizare, este obţinută şi o listă de molecule nesemnificative clinic.
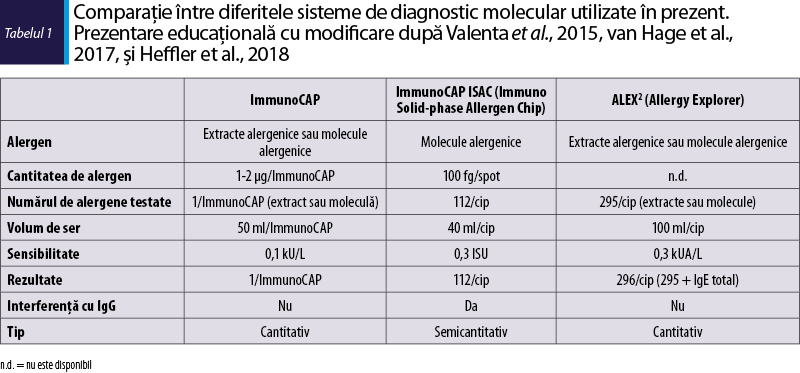
Rezultatele testelor alergenice moleculare pot fi exprimate cantitativ (ImmunoCAP şi ALEX) sau semicantitativ (ISAC) în unităţi ISU, adică unităţi standardizate ISAC pentru IgE specifice, care sunt standardizate în conformitate cu standardul IgE al Organizaţiei Mondiale a Sănătăţii (OMS 75/502) (Thorpe et al., 2014). Acurateţea diagnosticului molecular variază în funcţie de tipul de alergene, iar sensibilitatea diagnosticului este mai mare decât specificitatea acestuia. Pentru alergenele alimentare, sensibilitatea este cuprinsă între 66% şi 100%, iar specificitatea variază de la 0% la 95% (testele de provocare cu alimente în dublu‑orb, controlat cu placebo, au fost utilizate ca standard de aur pentru diagnosticul alergiilor alimentare) (Klemans et al., 2015). Acurateţea diagnosticului molecular pentru aeroalergene este dificil de determinat, deoarece nu există un standard de aur, dar rezultatele pot fi comparate cu cele obţinute prin alte metode de determinare a IgE specifice care utilizează extracte alergenice sau cu rezultatele SPT.
Interpretarea testelor alergologice moleculare trebuie făcută cu mare atenţie şi necesită o bună cooperare între specialiştii din laboratorul clinic şi medicii alergologi. Aceasta este influenţată de diferite aspecte apărute în fazele preanalitice, analitice şi postanalitice ale diagnosticului. În faza preanalitică trebuie să se ţină cont de simptomele clinice prezentate de pacient şi dacă un test de tip multiplex este cu adevărat necesar, având în vedere costurile ridicate ale unui astfel de test şi posibilitatea obţinerii unor rezultate redundante. De asemenea, este important de ştiut că o concentraţie de sIgE serice variază în funcţie de expunerea la alergen şi că este indicat ca testarea să se facă în decursul a două până la şase luni de la expunerea la respectivul alergen (Dodig şi Čepelak, 2018). În ceea ce priveşte faza analitică, trebuie să se ţină cont de faptul că sensibilitatea şi specificitatea testelor moleculare nu sunt aceleaşi pentru toate moleculele alergenice. Pentru interpretarea corectă a rezultatelor (faza postanalitică) este de reţinut că o concentraţie ridicată a sIgE pentru un anumit alergen sugerează sensibilizare, dar nu dovedeşte că acea moleculă este cauza simptomelor (Alessandri et al., 2017).
Buletinele de analiză necesită un comentariu interpretativ din partea specialistului de laborator, pentru a facilita interpretarea clinică a numeroaselor informaţii conţinute de buletin. De aceea, este foarte importantă investiţia atât în instruirea specialiştilor din laborator, cât şi a specialiştilor alergologi, încât aceste analize costisitoare să fie utilizate raţional. Pentru un alergolog cu experienţă, diagnosticul molecular poate contribui semnificativ la o abordare personalizată a bolii alergice. În caz contrar, această metodă poate fi doar o utilizare inutilă a unor teste costisitoare.
Metode de utilizare a diagnosticului molecular în alergii
În prezent există mai multe răspunsuri posibile la întrebarea „Cum ar trebui integrată abordarea moleculară în diagnosticarea pacientului alergic?” Aceste noi tehnologii necesită o experienţă de utilizare de mai mulţi ani înainte de a fi complet integrate în practica clinică. Mai mult, doar practica clinică zilnică poate dezvălui avantajele şi limitările lor în diferite situaţii. Medicii alergologi care practică abordarea moleculară ca parte a diagnosticului alergologic se încadrează într-una din două situaţii: cei care urmăresc o integrare a testelor moleculare într-un proces tradiţional de diagnosticare care include şi utilizarea extractelor de alergene, respectiv cei care preferă să omită în general utilizarea extractelor şi se bazează în primul rând pe un diagnostic molecular sistematic. Prima categorie preferă, astfel, utilizarea testelor singleplex, adică o metodă inductivă bazată pe alegerea de către medic a alergenului/alergenelor care se testează. Această abordare a fost denumită „de sus în jos”, sau „top-down” (de la simptome la molecule), şi conţine o primă etapă în care se evaluează istoricul clinic şi se efectuează teste in vivo (SPT) sau in vitro (IgE) cu extracte şi doar apoi urmează etapa moleculară (figura 5a). Cei din a doua categorie preferă să folosească paneluri largi de alergene moleculare, care oferă o viziune largă şi analitică a profilului de sensibilizare al pacientului. Aceasta poate fi definită ca abordare „de jos în sus”, sau ”bottom-up” (de la molecule la simptome), în care istoricul clinic este precedat de testele moleculare (figura 5b) (Matricardi et al., 2016). În tabelele 2 şi 3 se regăsesc mai multe argumente pentru aceste abordări.
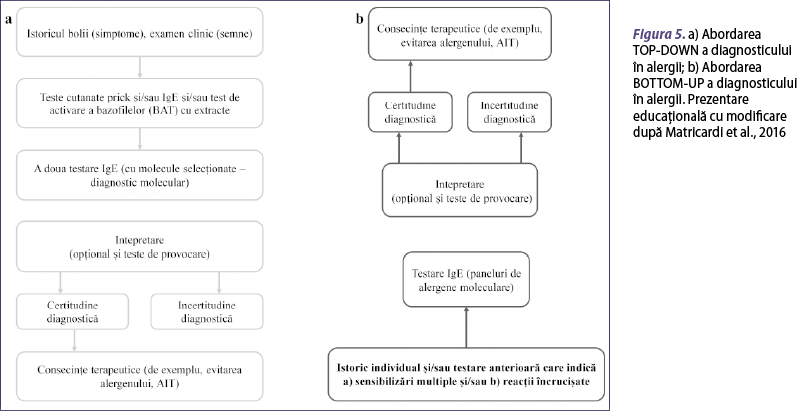


Dezbaterea privind cele două abordări diagnostice ale alergologiei moleculare este încă deschisă. Academia Europeană de Alergologie şi Imunologie Clinică (EAACI) recomandă integrarea celor două abordări într-una singură, numită „în formă de U” (figura 6) (Matricardi et al., 2016). Pacientul este supus, la fel ca în diagnosticul clasic, istoricului clinic, examenului fizic, testelor cutanate sau IgE cu extracte şi cu alergene moleculare selecţionate, în funcţie de istoricul clinic şi de rezultatele testelor cu extracte. Apoi se evaluează răspunsurile IgE la alergenele moleculare provenite din acele surse de alergene la care au fost detectate sensibilizări clinic relevante prin cele două etape anterioare de diagnostic. La unii pacienţi se poate demonstra sensibilizarea IgE prin reactivitate încrucişată, caz în care se recomandă investigarea în continuare a pacientului pentru consecinţele clinice potenţiale ale acestor sensibilizări, prin: (1) testarea sensibilizării IgE la alte molecule din aceeaşi familie, dar cu reactivitate încrucişată limitată (de exemplu, proteinele de depozitare din seminţe); (2) extinderea istoricului clinic cu întrebări legate de simptome declanşate de alte surse de alergene care conţin celelalte molecule din aceeaşi familie. Argumentele în favoarea acestei abordări „în formă de U” se regăsesc în tabelul 4.


Exemple de utilizare a diagnosticului molecular în practica clinică
Caz clinic 1
Pacientul BL, de 4 ani
Simptome: congestie nazală, strănut, prurit nazal şi conjunctival.
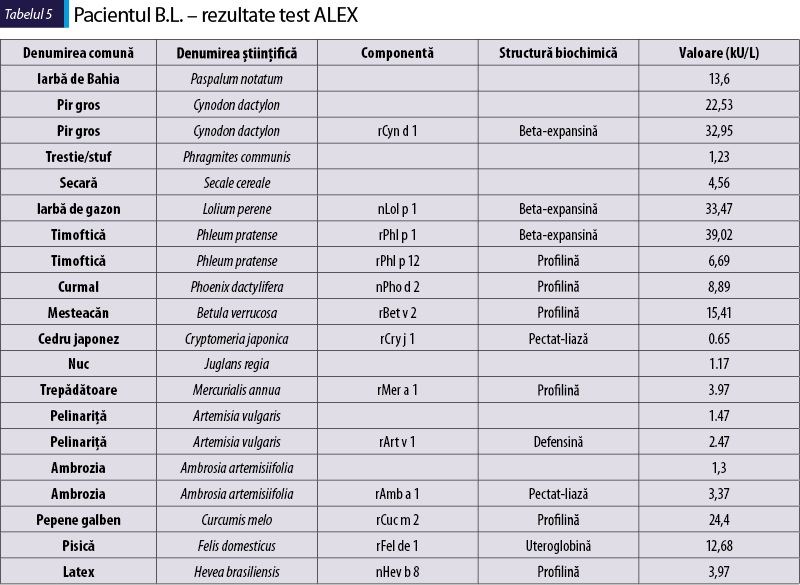
Sensibilizare la alergenele din tabelul 5
-
graminee – cu niveluri ridicate de IgE specific la beta-expansină, un alergen major şi marker de sensibilizare primară pentru graminee (Cyn d 1, Lol p 1 şi Phl p 1 dau reacţii încrucişate);
-
ambrozia şi pelinariţa (cosensibilizare) cu IgE la Amb a 1 şi Art v 1, alergene majore, dar fără IgE pentru Amb a 4 (o defensină care reacţionează încrucişat cu Art v 1);
-
profilinele (Phl p 12, Pho p 2, Bet v 2, Mer a 1, Cuc m 2, Hev b 8, Cuc m 2, Mer a 1) sunt componente cu reactivitate încrucişată şi au adesea relevanţă clinică redusă în bolile alergice;
-
pisică – Fel d 1 este un alergen major şi un marker principal de sensibilizare în cazul alergiei la pisică.
Diagnostic: rinoconjunctivită alergică, alergie primară la polen de graminee, ambrozia, pelinariţă şi epitelii de pisică.
Caz clinic 2
Pacienta P.I., de 29 de ani
Simptome: congestie nazală, strănut, prurit nazal şi conjunctival; prurit faringian şi edem al buzelor la consumul de măr crud.
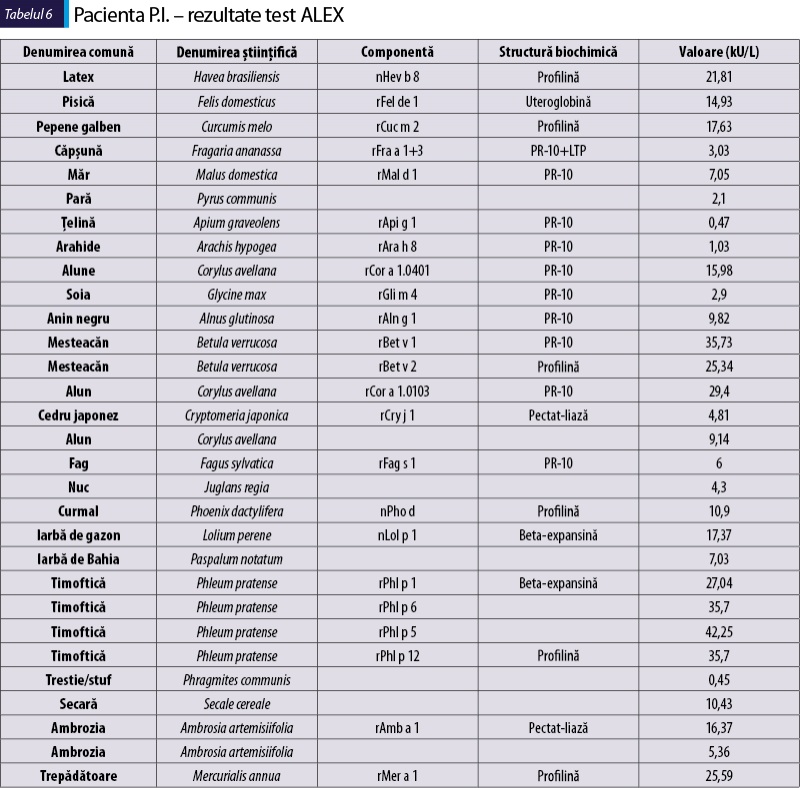
Sensibilizare la alergenele din tabelul 6
-
mesteacăn – Bet v 1 este un alergen major şi indică sensibilizare primară; ca proteină ce aparţine familiei PR-10, va provoca simptome orale sau creşterea IgE la diferite fructe, nuci, polen care conţin proteine similare (arin: Aln g 1, alun: Cor a 1, fag: Fag s 1, soia: Gly m 4, arahide: Ara h 8, ţelină: Api g 1, măr: Mal d 1);
-
graminee – Phl p 1 şi 5 sunt alergene majore şi markeri primari de sensibilizare pentru graminee (Cyn d 1, Lol p 1, Phl p 1 reacţionează încrucişat). Phl p 5 are valoare prognostică, indicând severitatea şi evoluţia de la rinită alergică la astm. Phl p 6 arată un grad ridicat de reactivitate încrucişată cu Phl p 5;
-
ambrozia – Amb a 1 este un alergen major (Cry j 1 reacţionează încrucişat cu Amb a 1);
-
profilinele – Phl p 12, Pho p 2, Bet v 2, Mer a 1, Cuc m 2, Hev b 8, Cuc m 2, Mer a 1 sunt componente cu reactivitate încrucişată şi au adesea relevanţă clinică redusă în bolile alergice;
-
pisică – Fel d 1 este un alergen major şi un marker principal de sensibilizare în cazul alergiei la pisică.
Diagnostic: rinoconjunctivită alergică, alergie primară la polen de mesteacăn, graminee, ambrozia şi epitelii de pisică; sindrom de alergie orală
Caz clinic 3
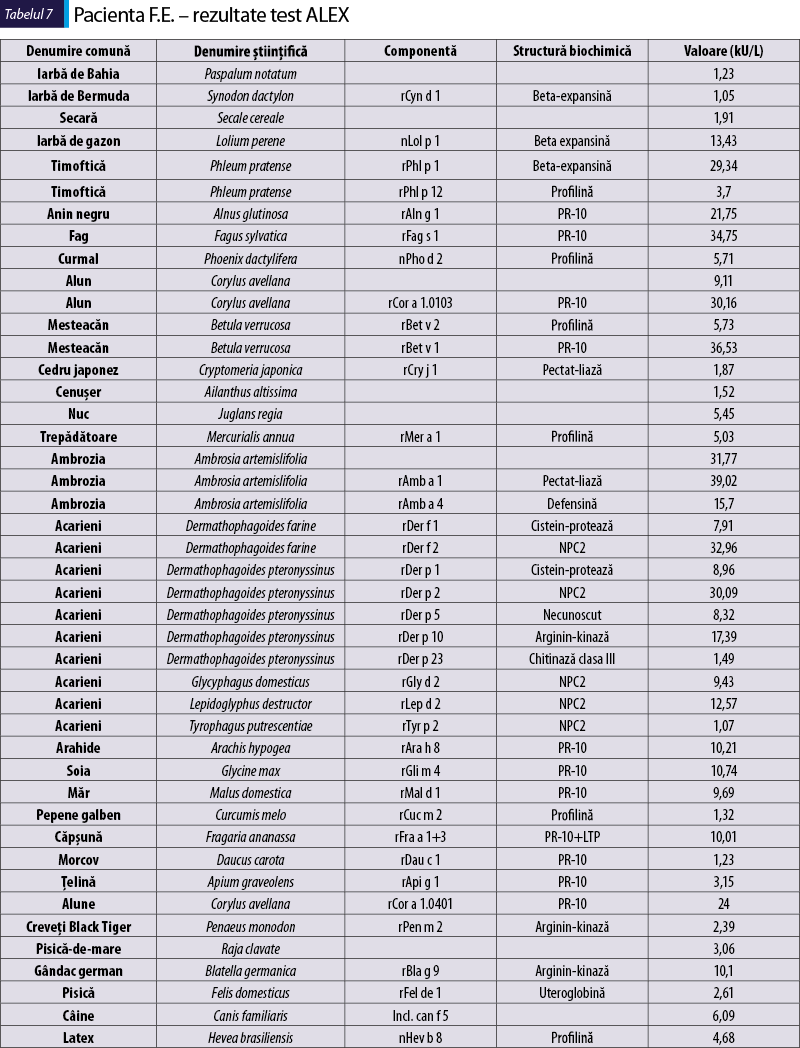
Pacienta F.E., de 42 de ani
Simptome: congestie nazală, strănut, prurit nazal şi conjunctival; prurit faringian şi edemul buzelor la consumul de morcov crud şi ţelină.
Sensibilizare la alergenele din tabelul 7
-
mesteacăn – Bet v 1 este un alergen major şi indică sensibilizare primară; ca proteină din familia PR-10, va provoca simptome orale sau va induce sinteza IgE la diverse fructe, nuci, polenuri care conţin proteine similare (arin: Aln g 1, alun: Cor a 1, fag: Fag s 1, soia: Gly m 4, arahide: Ara h 8, ţelină: Api g 1, măr: Mal d 1);
-
graminee – Phl p 1 şi Phl p 5 sunt alergene majore şi markeri primari de sensibilizare pentru graminee (Cyn d 1, Lol p 1 şi Phl p 1 sunt alergene cu reactivitate încrucişată);
-
ambrozia – Amb a 1 este un alergen major (Cry j 1 este, de asemenea, o pectat-liază care are reactivitate încrucişată cu Amb a 1);
-
profilinele – Phl p 12, Pho p 2, Bet v 2, Mer a 1, Cuc m 2, Hev b 8 sunt componente cu reactivitate încrucişată şi au adesea relevanţă clinică redusă în bolile alergice;
-
acarienii din praful de casă – alergene majore care au reactivitate încrucişată cu proteinele din alte surse care aparţin aceleiaşi familii (familia NPC2, familia arginin-kinazei) (gândac de bucătărie: Bla g 9);
-
pisică – Fel d 1 este un alergen major şi un marker principal de sensibilizare pentru alergia la pisică;
-
câine – Can f 5 este un alergen major şi un marker principal de sensibilizare pentru alergia la câine.
Diagnostic: rinoconjunctivită alergică, alergie primară la polen de mesteacăn, graminee, ambrozia, epitelii de pisică şi câine, la acarienii din praful de casă; sindrom de alergie orală.
Caz clinic 4
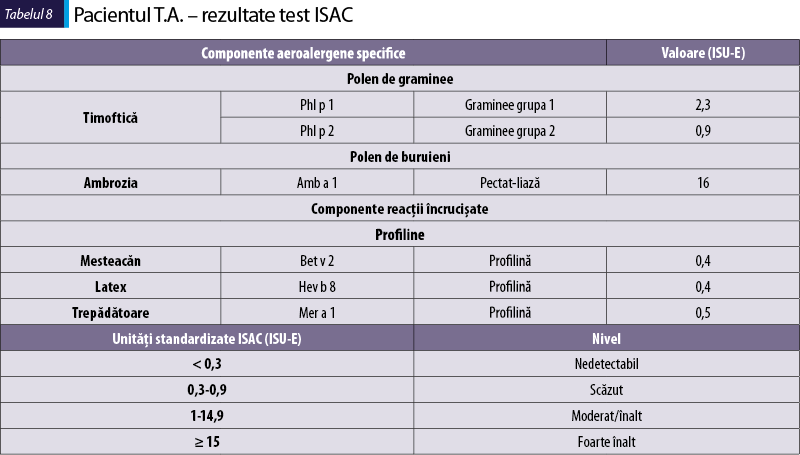
Pacientul T.A., de 39 de ani
Simptome: prurit cutanat, rash cutanat, obstrucţie nazală, strănut, rinoree apoasă.
Istoric: urticarie cronică, rinoconjunctivită alergică, alergie alimentară, reacţii adverse la medicamente (paracetamol).
Sensibilizare la alergenele din tabelul 8
-
ambrozia – Amb a 1 este un alergen major;
-
graminee – Phl p 1 şi Phl p 2 sunt alergene majore şi markeri primari de sensibilizare la timoftică; pot reacţiona încrucişat cu proteine similare din alte graminee;
-
profiline – Bet v 2, Mer a 1 şi Hev b 8 sunt componente cu reactivitate încrucişată şi au relevanţă clinică redusă în bolile alergice; pot provoca reacţii la alimente de origine vegetală, precum citrice, pepene galben, banane, roşii.
SPT pozitiv pentru acarienii din praful de casă, epitelii de pisică şi câine, mucegaiuri; alergenele alimentare nu se corelează cu rezultatele ISAC – posibilă intoleranţă la histamină?
Diagnostic: rinoconjunctivită alergică, alergie primară la polen de graminee, ambrozia; urticarie spontană cronică.
Caz clinic 5
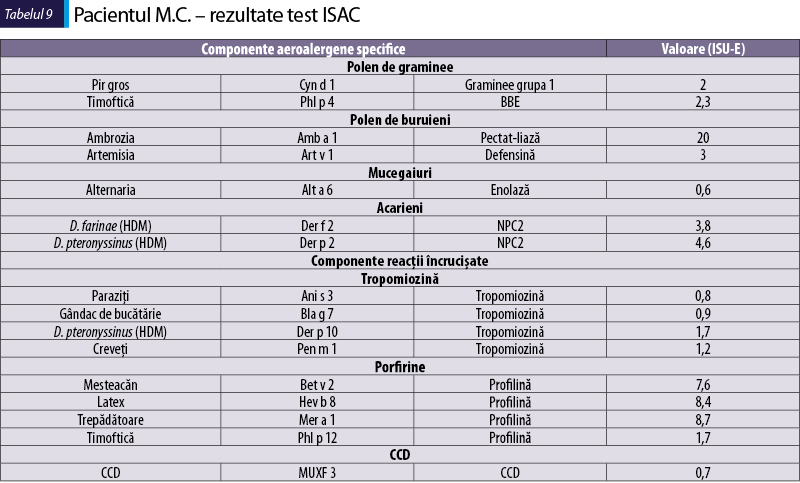
Pacientul M.C., de 63 de ani
Simptome: erupţie maculo-papulară pruriginoasă în plăci, asociată cu dificultăţi de respiraţie după consumul de carne de porc şi cârnaţi.
Istoric: urticarie acută, rinoconjunctivită alergică, intoleranţă la histamină, toxocarioză, psoriasis.
Sensibilizare la alergenele din tabelul 9
-
ambrozia şi pelinariţă – Amb a 1 şi Art v 1 sunt alergene majore;
-
profilinele – Bet v 2, Hev b 8, Mer a 1 şi Phl p 12 sunt componente cu reactivitate încrucişată şi au adesea o relevanţă clinică redusă în bolile alergice;
-
acarienii din praful de casă – Der f 2 şi Der p 2 sunt alergene majore care pot da reacţii încrucişate; Der p 10, o tropomiozină, poate da reacţie încrucişată cu
-
Ani s 3, Bla g 7 şi Pen m 1;
-
răspunsul IgE la Cyn d 1 şi Phl p 4 se poate datora CCD (determinanţi carbohidraţi cu reactivitate încrucişată).
Diagnostic: rinoconjunctivită alergică, alergie primară la polenul de ambrozia şi pelinariţă, la acarienii din praful de casă; toxocarioză, posibilă intoleranţă la histamină.
Caz clinic 6
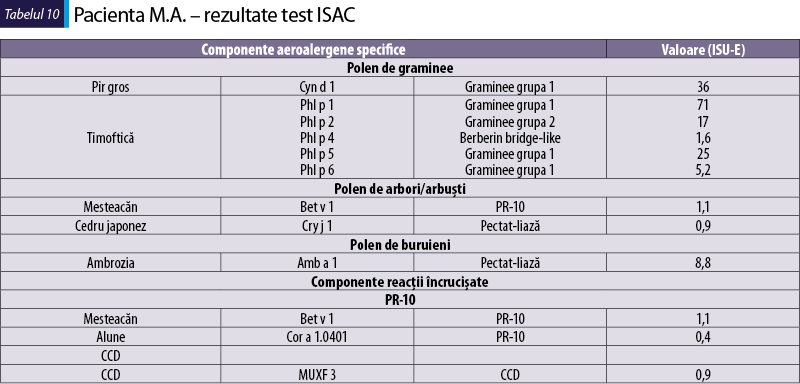
Pacienta M.A., de 16 ani
Simptome: congestie nazală, strănut, prurit nazal şi conjunctival.
Sensibilizare la alergenele din tabelul 10
-
mesteacăn – Bet v 1 este un alergen major şi indică sensibilizare primară (poate da reacţie încrucişată cu Cor a 1);
-
graminee – alergene majore şi markeri de sensibilizare primară (Phl p 1 şi Phl p 5) şi alergene minore (Phl p 2, Phl p 4, Phl p 6);
-
ambrozia – Amb a 1 este un alergen major (Cry j 1 este tot o pectat-liază care poate da reacţie încrucişată cu Amb a 1);
-
răspunsul IgE la Phl p 4 se poate datora CCD.
Diagnostic: rinoconjunctivită alergică, alergie primară la polen de mesteacăn, graminee şi ambrozia; necesită evaluarea IgE seric cu inhibiţia prealabilă a CCD pentru confirmarea sensibilizării la Phl p 4.
Concluzii
Diagnosticul molecular al alergiilor este încă limitat de câţiva factori, precum disponibilitatea alergenului (în prezent nu sunt cunoscute şi nici disponibile comercial toate componentele alergenice moleculare de interes), costul mai ridicat (echipamente şi personal calificat) al testării şi de faptul că informaţiile vaste obţinute prin diagnosticul molecular trebuie să fie corect structurate şi interpretate pentru a fi utile în diagnosticul şi managementul pacienţilor alergici.
Atât abordarea TOP-DOWN (de la simptome la molecule), cât şi cea BOTTOM-UP (de la molecule la simptome) prezintă o serie de avantaje şi dezavantaje. Abordarea „în formă de U”, recomandată de EAACI, reprezintă un compromis acceptabil între aceste două abordări, având şi scopul de a face alergologia moleculară mai accesibilă medicilor alergologi.
Bibliografie
-
Aalberse RC, Akkerdaas J, Van Ree R. Cross-reactivity of IgE antibodies to allergens. Allergy. 2001 Jun;56(6):478-90. doi: 10.1034/j.1398-9995.2001.056006478.x. PubMed PMID: 11421891
-
Akdis M, Akdis CA. Mechanisms of allergen-specific immunotherapy. Journal of Allergy and Clinical Immunology. 2007 Apr 1;119(4):780-9. doi: 10.1016/j.jaci.2007.01.022. PubMed PMID: 17321578
-
Alessandri C, Ferrara R, Bernardi ML, Zennaro D, Tuppo L, Giangrieco I, Tamburrini M, Mari A, Ciardiello MA. Diagnosing allergic sensitizations in the third millennium: why clinicians should know allergen molecule structures. Clin Transl Allergy. 2017 Dec;7(1):1-9. doi: 10.1186/s13601-017-0158-7. PubMed PMID: 28725346. PubMed Central PMCID: PMC5513363
-
Bublin M, Breiteneder H. Cross-reactivities of non-homologous allergens. Allergy. 2020 May;75(5):1019-22. doi: 10.1111/all.14120. PubMed PMID: 31745998
-
Costongs GM, Bas BM. The first fully automated allergy analyser UniCAP: comparison with IMMULITE for allergy panel testing. Eur J Clin Chem Clin Biochem. 1997 Nov;35(8):885-888
-
Dodig S, Čepelak IČ. The potential of component-resolved diagnosis in laboratory diagnostics of allergy. Biochem Med (Zagreb). 2018 Jun 15;28(2):257-65. doi: 10.11613/BM.2018.020501. PubMed PMID: 29666553. PubMed Central PMCID: PMC5898957
-
Ferreira F, Hawranek T, Gruber P, Wopfner N, Mari A. Allergic cross-reactivity: from gene to the clinic. Allergy. 2004 Mar;59(3):243-67. doi: 10.1046/j.1398-9995.2003.00407.x. PubMed PMID: 14982506
-
Ferreira F, Wolf M, Wallner M. Molecular approach to allergy diagnosis and therapy. Yonsei Med J. 2014 Jul 1;55(4):839-52. doi: 10.3349/ymj.2014.55.4.839. PubMed PMID: 24954310
-
Giangrieco I, Rafaiani C, Liso M, Palazzo P, Pomponi D, Tuppo L, Crescenzo R, Tamburrini M, Mari A, Ciardiello MA. Allergens in allergy diagnosis: a glimpse at emerging new concepts and methodologies. Transl Med UniSa. 2012 Sep;4:27. PubMed PMID: 23905060. PubMed Central PMCID: PMC3728798
-
Goikoetxea MJ, Sanz ML. Immunology Committee of SEAIC, Barber D, Caballero Molina T, de la Calle Toral A, Escribano Mora L, García Martinez JM, Labrador M, López Hoyos M, Martínez Quesada J, Monteseirin Mateo J. Recommendations for the use of in vitro methods to detect specific immunoglobulin E: are they comparable. J Investig Allergol Clin Immunol. 2013;23(7):448-54. PubMed PMID: 24654308
-
Heffler E, Puggioni F, Peveri S, Montagni M, Canonica GW, Melioli G. Extended IgE profile based on an allergen macroarray: a novel tool for precision medicine in allergy diagnosis. World Allergy Organ J. 2018 Dec;11(1):1-8. doi: 10.1186/s40413-018-0186-3. PubMed PMID: 29743964. PubMed Central PMCID: PMC5918992
-
Kleine-Tebbe J, Jakob T. Molecular allergy diagnostics using IgE singleplex determinations: methodological and practical considerations for use in clinical routine. Allergo J Int. 2015 Oct 1;24(6):185-97. doi: 10.1007/s40629-015-0067-z. PubMed PMID: 27069839. PubMed Central PMCID: PMC4792337
-
Kleine-Tebbe J, Jappe U. Molecular allergy diagnostic tests: development and relevance in clinical practice. Allergologie Select. 2017;1(2):169. doi: 10.5414/ALX01617E. PubMed PMID: 30402615. PubMed Central PMCID: PMC6040004
-
Klemans RJ, van Os-Medendorp H, Blankestijn M, Bruijnzeel-Koomen CA, Knol EF, Knulst AC. Diagnostic accuracy of specific IgE to components in diagnosing peanut allergy: a systematic review. Clin Exp Allergy. 2015 Apr;45(4):720-30. doi: 10.1111/cea.12412. PubMed PMID: 25226880
-
Lockey RF. Allergens and allergen immunotherapy. CRC press; 1998 Sep 30
-
Luengo O, Cardona V. Component resolved diagnosis: when should it be used?. Clin Transl Allergy. 2014 Dec 1;4(1):28. doi: 10.1186/2045-7022-4-28. PubMed PMID: 25250172. PubMed Central PMCID: PMC4171720
-
Martínez-Aranguren R, Lizaso MT, Goikoetxea MJ, García BE, Cabrera-Freitag P, Trellez O, Sanz ML. Is the determination of specific IgE against components using ISAC 112 a reproducible technique?. PLoS One. 2014 Feb 6;9(2):e88394. doi: 10.1371/journal.pone.0088394. PubMed PMID: 24516646. PubMed Central PMCID: PMC3916438
-
Matricardi PM, Dramburg S, Potapova E, Skevaki C, Renz H. Molecular diagnosis for allergen immunotherapy. J Allergy Clin Immunol. 2019 Mar 1;143(3):831-43. doi: 10.1016/j.jaci.2018.12.1021. PubMed PMID: 30850070
-
Matricardi PM, Kleine-Tebbe J, Hoffmann HJ, Valenta R, Hilger C, Hofmaier S, Aalberse RC, Agache I, Asero R, Ballmer-Weber B, Barber D. EAACI Molecular Allergology User’s Guide. Pediatr Allergy Immunol. 2016 May;27:1-250. doi: 10.1111/pai.12563. PubMed PMID: 27288833
-
Noon L. Prophylactic inoculation against hay fever. Lancet. 1911:1572-3
-
Paganelli R, Ansotegui IJ, Sastre J, Lange CE, Roovers MH, De Groot H, Lindholm NB, Ewan PW. Specific IgE antibodies in the diagnosis of atopic disease: Clinical evaluation of a new in vitro test system, UniCAPTM, in six European allergy clinics. Allergy. 1998 Aug;53(8):763-8. doi: 10.1111/j.1398-9995.1998.tb03972.x. PubMed PMID: 9722225
-
Pawankar R, Canonica GW, Holgate ST, Lockey RF, Blaiss MS. WAO white book on allergy: update 2013. World Allergy Organization. 2013;248. ISBN-13: 978-0-615-92916-3
-
Radauer C, Bublin M, Wagner S, Mari A, Breiteneder H. Allergens are distributed into few protein families and possess a restricted number of biochemical functions. Journal of Allergy and Clinical Immunology. 2008 Apr 1;121(4):847-52. doi: 10.1016/j.jaci.2008.01.025. PubMed PMID: 18395549
-
Ramachandran M, Aronson JK. John Bostock’s first description of hayfever. J R Soc Med. 2011 Jun;104(6):237-40. doi: 10.1258/jrsm.2010.10k056. PubMed PMID: 21659398. PubMed Central PMCID: PMC3110966
-
Thorpe SJ, Heath A, Fox B, Patel D, Egner W. The 3rd International Standard for serum IgE: international collaborative study to evaluate a candidate preparation. Clin Chem Lab Med. 2014 Sep 1;52(9):1283-9. doi: 10.1515/cclm-2014-0243. PubMed PMID: 24807170
-
Valenta R, Hochwallner H, Linhart B, Pahr S. Food allergies: the basics. Gastroenterology. 2015 May 1;148(6):1120-31. doi: 10.1053/j.gastro.2015.02.006. PubMed PMID: 25680669. PubMed Central PMCID: PMC4414527
-
van Hage M, Hamsten C, Valenta R. ImmunoCAP assays: Pros and cons in allergology. J Allergy Clin Immunol. 2017 Oct 1;140(4):974-7. doi: 10.1016/j.jaci.2017.05.008. PubMed PMID: 28552762
-
van Ree R. Clinical importance of cross-reactivity in food allergy. Curr Opin Allergy Clin Immunol. 2004 Jun 1;4(3):235-40. doi: 10.1097/00130832-200406000-00017. PubMed PMID: 15126948
-
Wensing M, Akkerdaas JH, van Leeuwen WA, Stapel SO, Bruijnzeel-Koomen CA, Aalberse RC, Bast BJ, Knulst AC, van Ree R. IgE to Bet v 1 and profilin: cross-reactivity patterns and clinical relevance. J Allergy Clin Immunol. 2002 Sep 1;110(3):435-42. doi: 10.1067/mai.2002.126380. PubMed PMID: 12209091