Wheat allergy is a common pathology among pediatric patients, but can also be found in adults and has the potential to generate different clinical manifestations that vary depending on the mode of exposure and theunderlying immunological mechanisms. Its prevalence varies by age and region, and in Europe it has been estimated to be under 1%. Feeding practices (breastfeeding, early introduction of foods into the diet) seem to have a significant effect on the risk of food sensitization. However, most studies investigating the potential role of external factors that may influence the risk of developing wheat allergy have yielded inconclusive results in this regard. Sensitization to wheat, as evidenced by serological determinations, is common, but measuring specific IgE for
wheat proteins seems notto be a strong indicator for predicting clinical reactivity or prognosis in children with suspected wheat allergy, and the role of wheat’s molecular components, other than ω-5 gliadin, has not been fully characterized to date. The diagnosis of wheat allergy is based on the patient’s history, allergy workup through skin prick testing, and determination of specific IgE for wheat components, along with oral challenge tests. The prognosis of IgE-mediated wheat allergy in children is generally favorable, with most tolerating wheat consumption by school age. Patients who have a history of anaphylaxis before the age of 3 years oldand patients with a higher level of specific IgE antibodies for wheat or ω-5 gliadin appear to have a higher risk of persistent wheat allergy. Although the main method of managing these patients tends to be the avoidance of wheat and wheat-based foods, recently, oral immunotherapy for wheat proteins has shown promising results. Further studies are necessary to establish the best protocols for inducing sustained tolerance in children allergic to wheat.
Diagnosticul molecular în alergia la grâu
Molecular diagnosis in wheat allergy
First published: 28 martie 2024
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.8.1.2024.9441
Abstract
Rezumat
Alergia la grâu este o patologie frecventă în rândul pacienţilor pediatrici, dar poate fi întâlnită şi la adulţi, având potenţialul de a genera diverse manifestări clinice care variază în funcţie de modalitatea de expunere şi de mecanismele imunologice subiacente.
Prevalenţa sa variază în funcţie de vârstă şi de regiune, iar în Europa a fost estimată a fi sub 1%. Practicile de alimentaţie (alăptarea, introducerea precoce a alimentelor în dietă) par să aibă un efect important asupra riscului de sensibilizare la alimente. Totuşi, cele mai multe studii care au investigat rolul potenţial al factorilor externi ce pot influenţa riscul de a dezvolta alergie la grâu au obţinut rezultate încă neconcludente în acest sens. Sensibilizarea la grâu obiectivată prin determinări serologice este frecventă, însă dozarea IgE specifice pentru proteinele din grâu pare să fie o sursă îndoielnică în predictibilitatea reactivităţii clinice sau a prognosticului la copiii cu suspiciune de alergie la grâu, iar rolul componentelor moleculare ale grâului, altele decât gliadina ω-5, nu a fost pe deplin caracterizat până în acest moment. Diagnosticul alergiei la grâu are la bază istoricul pacientului, evaluarea alergologică prin testarea cutanată prick şi determinarea IgE specifice pentru componentele grâului, alături de testele de provocare orală. Prognosticul alergiei IgE-mediate la grâu la copii este în general favorabil, majoritatea tolerând consumul de grâu până la vârsta şcolară. Pacienţii care au istoric de anafilaxie înainte de vârsta de 3 ani şi pacienţii cu un nivel mai ridicat al titrului de anticorpi IgE specifici pentru grâu sau ω-5 gliadină par să aibă un risc mai mare de persistenţă a alergiei la grâu. Deşi principala metodă de management al acestor pacienţi tinde să fie evitarea grâului şi a alimentelor pe bază de grâu, în ultimul timp imunoterapia orală la proteine din grâu a obţinut rezultate promiţătoare. Studii suplimentare sunt necesare pentru stabilirea celor mai bune protocoale în inducerea toleranţei susţinute la copiii alergici la grâu.
Introducere
Alergia la grâu reprezintă o provocare semnificativă pentru domeniul sănătăţii publice. Diagnosticul precis şi prompt al alergiei la grâu este esenţial pentru gestionarea eficientă şi prevenirea reacţiilor alergice potenţial severe. Cu toate acestea, diagnosticarea alergiilor alimentare, şi în special a alergiei la grâu, poate fi dificilă din cauza naturii eterogene a simptomelor şi a posibilelor reacţii încrucişate cu alţi alergeni. Recent, progresele în tehnologiile de diagnostic molecular au oferit noi perspective şi metode care promit o precizie sporită a diagnosticului şi prognosticului reacţiilor alergice induse de grâu.
Grâul consumat la nivel global se distinge prin capacitatea sa de a se dezvolta într-o varietate de zone climatice şi prin valoarea sa nutriţională semnificativă, ceea ce contribuie la includerea atât de frecventă în dieta umană. În ciuda beneficiilor sale, grâul poate fi sursa unui spectru larg de tulburări alergice, natura şi severitatea acestor tulburări variind în funcţie de modalitatea de expunere şi de mecanismele imunologice implicate(1). Printre manifestările alergiei la grâu care implică un mecanism mediat IgE, se regăsesc reacţiile imediate de tip urticarie, angioedem sau chiar anafilaxie, inclusiv anafilaxia la grâu indusă de efort (WDEIA), alergiile respiratorii de tipul astmului brutarului sau urticaria de contact. Pe de altă parte, există tulburări induse de grâu ce implică mecanisme non-IgE-mediate, care includ sindromul de enterocolită indusă de proteinele alimentare şi esofagita eozinofilică. Cu un substrat imunologic distinct de aceste forme de alergie, boala celiacă este o afecţiune autoimună care este gestionată în conformitate cu protocoalele gastroenterologice în majoritatea ţărilor(1,2).
În momentul actual există puţine informaţii disponibile legate de predictibilitatea reactivităţii clinice sau a prognosticului bazate pe componente moleculare în cazul grâului(3).
Epidemiologie
Prevalenţa alergiilor alimentare variază în diferitele regiuni ale lumii, posibil din cauza diferenţelor de vârstă pentru introducerea alimentelor solide în dietă sau a obiceiurilor alimentare, precum şi sensibilizării la polen(3).
Prevalenţa alergiei la grâu variază între 0,4% şi 4%, în funcţie de vârstă şi de sex, iar în Europa a fost raportată ca fiind <1%, în mai multe publicaţii(1,4).
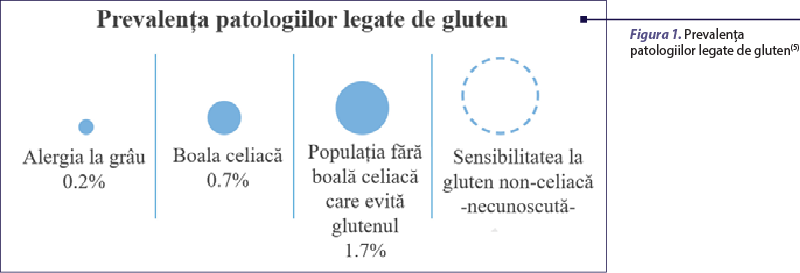
În ţări precum Germania, Japonia, Finlanda şi în rândul preşcolarilor din Statele Unite, alergia la grâu este a treia ca frecvenţă, după alergia la proteina laptelui de vacă şi alergia la ou(1). Potrivit unui studiu recent, alergia la grâu diagnosticată de un medic a fost de 0,9% în rândul copiilor cu vârsta cuprinsă între 1 şi 4 ani(3).
Patogeneza
Consumul de grâu poate induce mai multe tipuri de afecţiuni, diferite din punct de vedere etiopatogenic şi clinic. Manifestările alergice IgE-mediate induse de proteinele grâului includ: alergia la grâu cu manifestări de severitate variabilă, de la urticarie la anafilaxie, anafilaxia la grâu indusă de efort, alergia respiratorie, implicit astmul brutarului şi urticaria de contact, iar afecţiunile non-IgE-mediate, includ sindromul de enterocolită indus de proteine alimentare şi esofagita eozinofilică (figura 2).
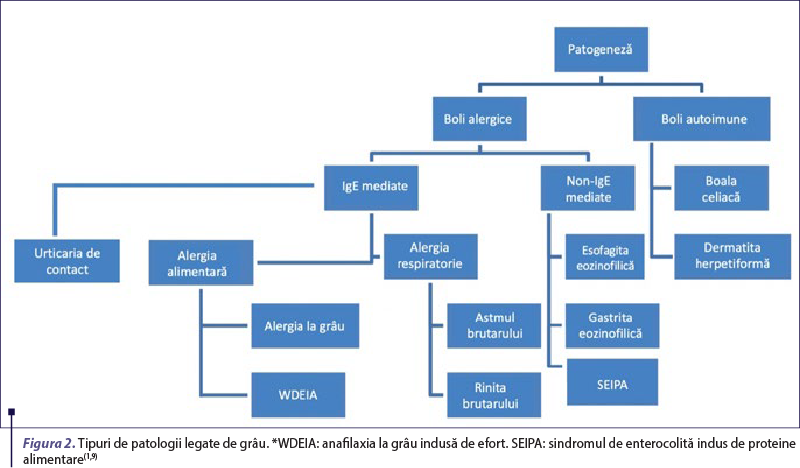
În ceea ce priveşte reacţiile IgE-mediate, acestea pot fi declanşate de mai multe proteine din grâu, inclusiv de gluten. Recunoaşterea alergenilor din grâu de către anticorpii de tip IgE declanşează activarea celulelor efectoare, care susţin inflamaţia alergică. Manifestările clinice sunt diverse, cu simptome variind de la reacţii sistemice locale şi uşoare până la severe, şi se pot exprima la nivel gastrointestinal, respirator, cutanat sau cardiovascular(6).
Boala celiacă este o afecţiune cronică autoimună a intestinului subţire, indusă de gluten, fiind influenţată de factori genetici şi de mediu. Aceasta se caracterizează prin prezenţa anticorpilor serologici specifici, cum ar fi: IgA anti-transglutaminază, IgA anti-endomisium (EMA) şi IgG anti-gliadină deamidată. Factorii de risc genetici sunt legaţi de expresia moleculelor MHC clasa II, şi anume HLA-DQ2 şi HLA-DQ8. În contextul acestei predispoziţii genetice, consumul de gluten poate declanşa răspunsuri imunologice care duc la inflamaţie intestinală, enteropatie, atrofie a vilozităţilor intestinale, putând produce astfel leziuni profunde în ţesutul intestinal şi simptomatologie variată, cum ar fi, de exemplu, dureri abdominale, meteorism abdominalşi scaune diareice(7). Dermatita herpetiformă (DH) este cea mai frecventă manifestare dermatologică a bolii celiace. Erupţia este caracterizată prin vezicule mici şi papule extrem de pruriginoase pe coate, pe genunchi şi pe fese, care pot fi ascunse de excoriaţii. Diagnosticul se bazează pe caracteristicile clinice şi este confirmat prin biopsie cutanată care arată depuneri granulare IgA patognomonice. De obicei, leziunile DH răspund la dieta fără gluten, iar apariţia de novo sau persistenţa DH la un pacient cu boală celiacă tratată ridică suspiciunea de expunere continuă la gluten(7,8).
Căi de expunere şi surse alergenice
Sensibilizarea la proteinele din grâu poate să apară prin ingestia alimentului, inhalarea făinii de grâu sau a prafului rezultat în urma procesării cerealelor (expunere profesională) ori prin contactul cutanat direct cu produse ce conţin proteine din grâu(4). Persoanele aflate la risc de expunere ocupaţională sunt brutarii, cofetarii, muncitorii fabricilor de patiserie, morarii şi manipulatorii de cereale(10).
Alergenii responsabili de inducerea reacţiilor alergice se găsesc într-o varietate de produse alimentare: produse de panificaţie, patiserie, paste, cereale tip musli, bulgur, griş, cuşcuş. Grâul este utilizat în industria alimentară ca agent de îngroşare şi umplutură în producerea de mezeluri, deserturi, îngheţată şi smântână. De asemenea, proteinele de grâu hidrolizate intră în compoziţia produselor cosmetice, precum cele de îngrijire a tenului sau balsamul de păr(10–12).
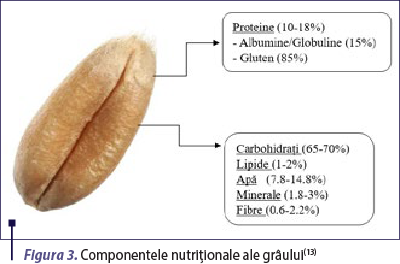
Familia de proteine ale grâului
Grâul aparţine tribului Triticeae din familia ierburilor Poaceae, împreună cu secara şi orzul, iar cele mai multe proteine din grâu sunt membri ai superfamiliei prolaminelor. Acestea au omologie structurală atât între ele, cât şi cu proteinele corespunzătoare din secară şi orz(4).
Proteinele din grâu sunt împărţite pe scară largă în gluten şi proteine nonglutenice. Proteinele glutenice sunt proteine de stocaj din superfamilia prolaminelor, sunt insolubile în apă şi constituie cea mai pare parte din structura grâului. Cuprind gliadinele (solubile în alcool) şi gluteninele (solubile în acizi slabi). Acestea au, de asemenea, rolul de a face făina de grâu potrivită pentru coacere(4).
Gliadinele şi gluteninele se împart, la rândul lor, în alfa- şi beta-gliadină, gama-gliadină, omega-gliadină, respectiv glutenine cu greutate moleculară mare şi glutenine cu greutate moleculară mică. În categoria proteinelor nonglutenice, încadrăm albuminele şi globulinele, care sunt, de asemenea, împărţite în inhibitori ai amilazei, proteine de transfer lipidic (LTP) şi proteine „avenina-like” (figura 4)(4,6,11).
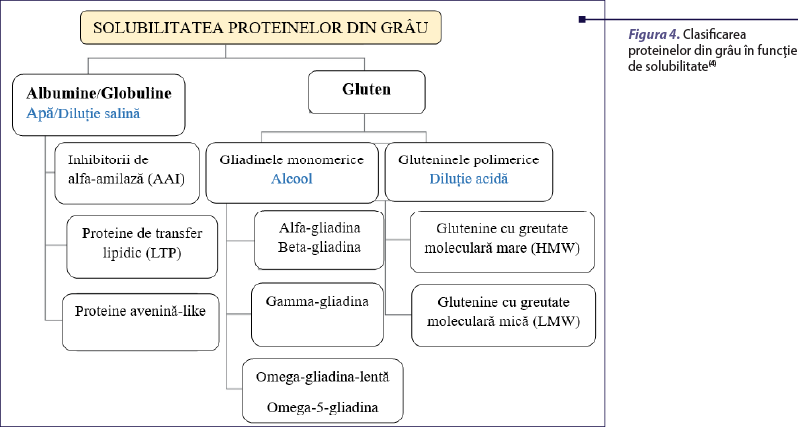
Fiecare dintre aceste fracţiuni conţine proteine care au fost asociate cu manifestări clinice, dar până acum nu există o definiţie consensuală a alergenilor majori şi minori din componenţa grâului. De asemenea, puţine sunt cunoscute despre modificarea alergenicităţii ca urmare a procesării şi preparării termice(4).
Componentele moleculare
Organizaţia Mondială a Sănătăţii (OMS) şi Subcomitetul pentru Nomenclatura Alergenilor a Uniunii Internaţionale a Societăţilor Imunologice (IUIS) au identificat şi publicat oficial 28 de componente alergenice pentru grâu. Dintre acestea, 18 au expunere prin ingestie şi 10 prin inhalare(14).
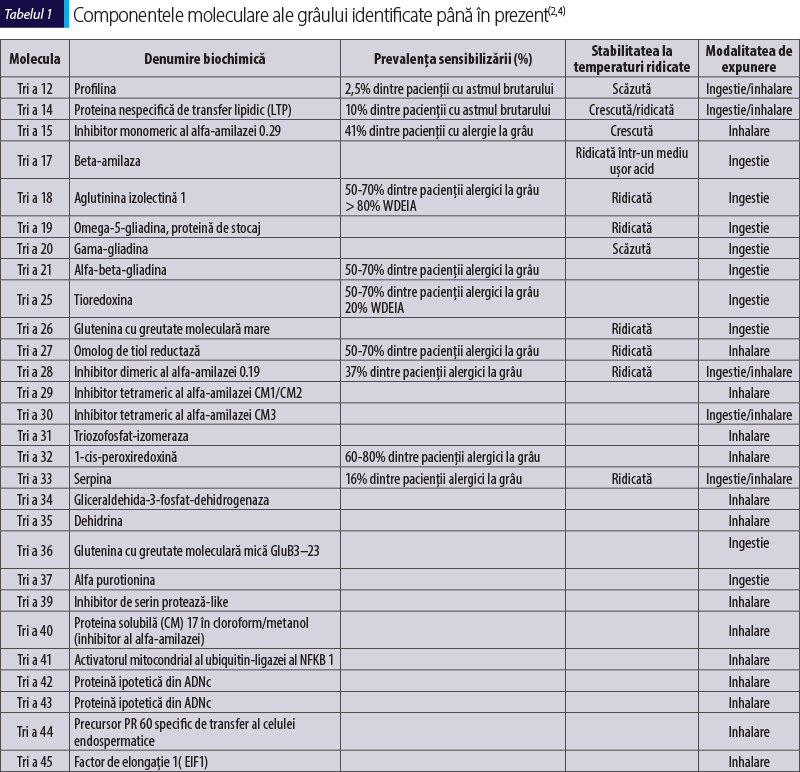
Relevanţa clinică a componentelor moleculare
Sensibilizarea la Tri a 17, 19, 20, 26 şi 37 la pacienţii cu alergie IgE-mediată la grâu poate indica un risc de reacţii imediate severe, în cazul unei expuneri accidentale(2).
Molecula cel mai bine caracterizată din bobul grâu este omega-5 gliadina (Tri a 19), care este un alergen major în anafilaxia la grâu indusă de efort (WDEIA). Este, de asemenea, un alergen important în alergia la grâu IgE-mediată a copilului mic, în dermatita atopică, dar şi în patologia astmului brutarului. Sensibilizarea la Tri a 19 la sugarii şi copiii alergici la grâu nu numai că indică posibilitatea unei reacţii severe în cursul testului de provocare orală (TPO), dar poate indica şi persistenţa alergiei la grâu la vârstă adultă(2,4). Numeroase studii afirmă că sensibilizarea la Tri a 19 la pacienţii cu antecedente de reactivitate clinică la grâu ar putea fi o indicaţie pentru evitarea TPO, întrucât aceşti indivizi pot fi expuşi unui risc înalt de a dezvolta anafilaxie(15).
De-a lungul timpului, şi alte proteine, precum Tri a 21, 26 şi 36, au fost raportate ca markeri importanţi în WDEIA, pe lângă Tri a 19(2,4).
În ceea ce priveşte patologia astmului brutarului, Tri a 27 şi Tri a 28 sunt considerate a fi cei mai importanţi alergeni implicaţi, iar asocierea dintre Tri a 27, 28, 29, 39şi 32 pare să ofere cea mai înaltă sensibilitate şi specificitate pentru diagnostic(4,16).
Reactivitatea încrucişată
Pacienţii cu alergie la grâu descoperă adesea că pot avea manifestări clinice şi după consumul altor cereale, de exemplu orz sau secară, şi mai puţin după consumul de ovăz(10). Această reactivitate încrucişată poate fi justificată din punct de vedere taxonomic, deoarece grâul, orzul şi secara aparţin aceleiaşi familii. Aceste cereale conţin multiple proteine cu potenţial înalt de reactivitate încrucişată. Cele mai studiate dintre acestea sunt prolaminele gama-70 şi gama-35 secalinele (Sec c 20) din secară şi gama-3 hordeina (Hor v 21) din orz, care reacţionează încrucişat cu ω-5 gliadina, sugerând, conform publicaţiilor de specialitate, că şi secara şi orzul pot provoca, de asemenea, simptome la pacienţii cu alergie la grâu sau anafilaxie la grâu, indusă de efort(2,17). De asemenea, a fost confirmat faptul că afla-purotioninele din grâu-orz-secară au o secvenţă de aminoacizi similară în proporţie de peste 80%(18).
Pacienţii cu alergie la polenul de graminee pot avea şi sensibilizare la grâu, fapt datorat omologiei structurale dintre cele două entităţi, demonstrată a fi fără relevanţă clinică, dar care reprezintă substratul a numeroase rezultate fals pozitive. Până la 65% dintre pacienţii cu alergie la polen de graminee au rezultate fals pozitive când sunt testaţi cutanat cu extract de grâu sau la determinări serologice pentru grâu(11).
Evaluarea alergologică
Evaluarea alergologică a reacţiilor imunologice induse de grâu este complexă (figura 5) şi se face într-o manieră particularizată, în funcţie de scenariul clinic din care face parte pacientul.
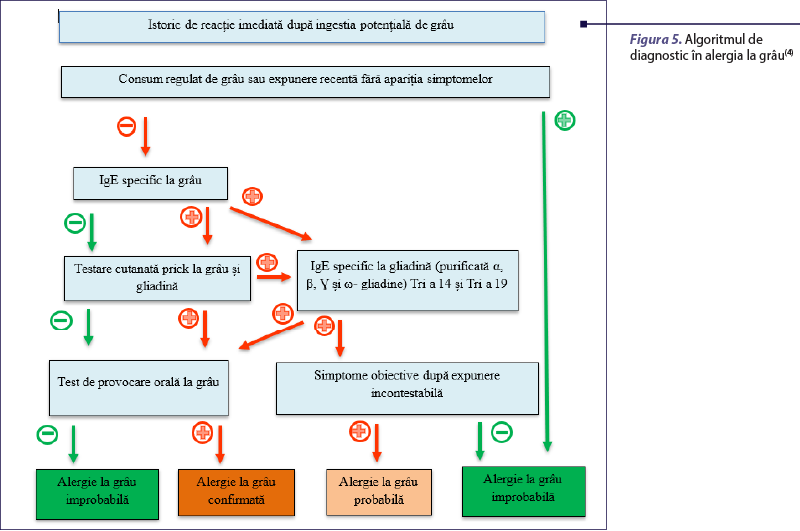
A. Diagnosticul reacţiilor IgE-mediate cuprinde un istoric bine conturat, completat ulterior de investigaţii in vivo şi in vitro. Anamneza trebuie să evidenţieze alergenul declanşator, forma de preparare termică (crud, semigătit, gătit), cantitatea totală ingerată, intervalul de timp până la declanşarea simptomelor şi prezenţa cofactorilor, precum efortul fizic sau administrarea de antiinflamatoare nesteroidiene(19). Următorul pas este reprezentat de testarea cutanată prick, care se poate efectua cu extract standardizat din grâu sau cu soluţie din făină de grâu, ambele metode având o specificitate scăzută (tabelul 2)(20).
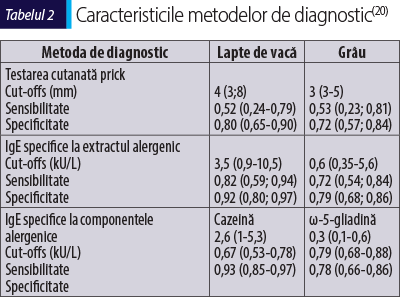
Extractele de grâu disponibile pe piaţă conţin doar albumine şi globuline (proteine solubile în apă/soluţie salină diluată), astfel că utilitatea lor în evaluarea sensibilizării IgE-mediate prin testare cutanată este inferioară faţă de a celor folosite în diagnosticul alergiilor la alte alimente, cum ar fi lapte, ou sau arahide. Specificitatea se poate îmbunătăţi prin testarea cutanată cu extract de ω-5-gliadină sau alte tipuri de gliadine, dar în prezent aceste soluţii nu sunt disponibile pentru testarea de rutină(11).
Pentru demonstrarea sensibilizării la proteinele din grâu, este utilă dozarea IgE specifice la extract de grâu, gliadine, Tri a 14 şi Tri a 19. Un aspect important de reţinut este faptul că determinarea IgE specifice la extract de grâu are specificitate scăzută, sensibilitate crescută şi nu poate prezice obţinerea toleranţei după o perioadă de evitare sau severitatea reacţiei în momentul reintroducerii alimentului(9,11). Precizia diagnosticului este sporită prin determinarea nivelului Tri a 14 (nsLTP;proteine nespecifice de transfer lipidic), instrument care permite diferenţierea dintre pacienţii sensibilizaţi la grâu şi cei sensibilizaţi la polenul de graminee, însă sensibilitatea este scăzută(1,4). Ca şi în cazul celorlalte alergii cu trigger alimentar, testul de provocare orală rămâne „gold standard” şi este executat cel mai frecvent în forma simplu orb. Se recomandă ca testul să fie iniţiat cu o doză mică de proteină din grâu (1-50 mg), cu creşterea progresivă la interval de o oră (timp de absorbţie mai lent al grâului), până la atingerea unei doze cumulative de 0,5-1 g de proteină de grâu(11). Pacienţii cu istoric de reacţie severă trebuie să fie supuşi unui test de provocare la cel puţin doi ani distanţă de reacţia iniţială(19).
B. Diagnosticul anafilaxiei la grâu induse de efort (WDEIA) este dificil de stabilit şi este frecvent îngreunat de numărul scăzut de cazuri raportate, precum şi de lipsa de experienţă a clinicienilor în ceea ce priveşte recunoaşterea afecţiunii(9). WDEIA este confundată cu alte patologii întâlnite mai des în practica clinică, precum urticaria sau anafilaxia idiopatică, fapt care explică perioada îndelungată (32-62 de luni) până la stabilirea diagnosticului de certitudine. Istoricul înalt sugestiv este prima etapă de diagnostic şi este definit de apariţia clasică a simptomatologiei în timpul sau la scurt timp după efectuarea activităţii fizice intense, precedată de consumul produselor din grâu cu câteva minute până la 4 ore înaintea debutului(9,11). Recent, a fost descris un nou subtip de WDEIA indus de sensibilizarea percutanată la proteinele de grâu hidrolizate din produsele cosmetice. De regulă, pacienţii dezvoltă iniţial leziuni de contact şi ulterior WDEIA manifestată prin angioedem palpebral, dar şi anafilaxie după ingestia de grâu, în prezenţa unui cofactor(21). De asemenea, există raportări de cazuri şi studii de mici dimensiuni care demonstrează că şi alţi cofactori (infecţiile, utilizarea antiinflamatoarelor nesteroidiene, consumul de alcool sau stresul) pot induce reacţii de hipersensibilitate postingestie de grâu, în aceeaşi măsură ca efortul fizic, fie că sunt asociaţi sau nu cu acesta(22). Datele anamnestice sunt ulterior completate cu testarea cutanată prick la extractul standardizat din grâu şi la cel din gluten. Studiul condus de Brockow et al. a demonstrat că testarea cutanată prick la extractul din gluten prezintă specificitate şi sensibilitate superioare în comparaţie cu extractul din grâu, o testare cutanată pozitivă fiind concordantă în procentaj de 100% cu un nivelul de IgE specific la ω-5-gliadină(23). În plus, pentru a îmbunătăţi specificitatea tehnicii, se poate opta şi pentru testare cutanată la ω-5-gliadină dizolvată în etanol, un rezultat pozitiv demonstrând o concordanţă de 89% cu nivelul de IgE specific la ω-5-gliadină(4,23). Pentru pacienţii sensibilizaţi pe cale cutanată, este utilă testarea cu produse care conţin proteină de grâu hidrolizată (dacă este posibil, se va utiliza chiar produsul implicat în reacţie) sau cu proteină de grâu hidrolizată pură(21).
Investigaţia in vivo necesară completării diagnosticului este dozarea nivelului de IgE specifice la extractul de grâu, gluten, ω-5-gliadină (Tri a 19), Tri a 14 şi alte gliadine(21). Determinarea IgE specifice la extractul de grâu şi gluten se asociază cu sensibilitate mică, de 48%, respectiv 56%. Un rol central în susţinerea diagnosticului de WDEIA este deţinut de nivelul crescut al IgE specifice la ω-5-gliadină. Este demonstrat faptul că un nivel mai mare de 0,89 kU/L este suficient pentru a confirma diagnosticul, cu o specificitate de 96% şi sensibilitate de 78%. Totuşi, nu a fost demonstrată o corelaţie fidelă între nivelul IgE specifice şi nivelul-prag necesar să declanşeze o reacţie sau severitatea reacţiei(11,22).
În majoritatea cazurilor, corelarea datelor anamnestice cu cele ale testării cutanate prick şi/sau IgE specifice este suficientă pentru a stabili diagnosticul. Totuşi, când pacientul are un istoric incert, este utilă efectuarea testului de provocare orală, urmat de exerciţiu fizic intens. Este o procedură dificil de executat, având în vedere imposibilitatea controlării exacte a cantităţii de alergen ingerate sau a intensităţii efortului fizic şi deci riscul crescut de a induce o reacţie sistemică. Mai mult, un test de provocare negativ nu exclude o WDEIA, tocmai din cauza reproductibilităţii slabe a reacţiei index(9). Testul de provocare la gluten este preferat, deoarece poate induce un nivel crescut plasmatic de gliadină şi permite stabilirea dozei-prag declanşatoare pentru fiecare pacient, însoţită sau nu de cofactori(23). Există centre care folosesc drept cofactori consumul de aspirină sau de alcool în locul exerciţiului fizic (figura 6).
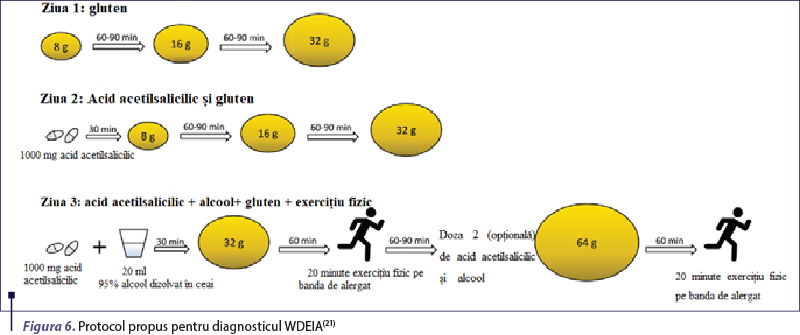
Un astfel de studiu este cel condus de Faihs et al., în care 40% dintre pacienţi au dezvoltat o reacţie uşoară chiar şi fără efort fizic asociat, având drept cofactor doar administrarea de acid salicilic(21).
C. Diagnosticul astmului/rinitei brutarului implică o anamneză profesională amănunţită, care trebuie să fie centrată pe identificarea oricărei simptomatologii compatibile cu astm sau rinită nou instalate la un muncitor expus la o cantitate adecvată de alergen. Istoricul trebuie să cuprindă şi detalii despre locurile de muncă şi expunerile anterioare. Excluderea altor patologii similare este esenţială şi în diagnosticul diferenţial trebuie să fie incluse astmul indus de expunerea la alţi alergeni (secară, orz şi orez), precum şi alte tipuri de rinită (medicamentoasă, rinită alergică cu sensibilizare la alţi alergeni). Astfel, pentru a certifica implicarea grâului ca factor declanşator al simptomatologiei, este imperioasă demonstrarea existenţei proteinelor din grâu în praful din mediul de muncă, prin diferite metode de specialitate. Este demonstrat că riscul de sensibilizare este minim pentru o expunere la o cantitate alergenică de 0,2 mg/m3 sau de 0,5 mg/m3 de praf inhalat şi creşte direct proporţional cu doza de alergen şi timpul de expunere(9). În ceea ce priveşte testele serologice, determinarea IgE specifice la cele cinci componente (Tri a 27, Tri a 28, Tri a 29, Tri a 39 şi Tri a 32) se asociază cu o acurateţe diagnostică ridicată(24). În plus, studiul condus de Kampen et al. a evidenţiat valorile minime cut-off ale dozării IgE specifice la extract de grâu (2,32 kU/L) şi testării cutanate prick cu extract de grâu (dimensiunea papulei de 5 mm). Aceste niveluri au fost asociate cu ovaloare predictivă pozitivă de 100%(25). Cel care stabileşte diagnosticul de certitudine este testul de provocare bronşică. Acesta poate fi efectuat prin nebulizarea soluţiilor apoase de făină disponibile comercial, administrate în concentraţii crescânde (0,01, 0,1, 1, 10 şi 100 mg/mL) sau prin inhalarea prafului de făină de grâu (disponibil comercial sau obţinut de la locul de muncă) introdus în capsule prin intermediul unui dispozitiv de tip spinhaler. Testul este considerat pozitiv când se înregistrează o scădere de cel puţin 20% a volumului expirator maxim pe secundă sau o creştere de trei ori a hiperreactivităţii bronşice, însoţită de creşterea numărului de eozinofile în spută(9).
D. Diagnosticul urticariei de contact se face preponderent pe baza istoricului medical de leziuni urticariene apărute pe suprafaţa de aplicare a produselor cosmetice care conţin proteine de grâu hidrolizate. Istoricul poate fi completat cu testarea cutanată prick la proteine sau cu test de provocare cutanată, prin aplicarea unei creme care conţine proteine de grâu hidrolizate(4).
Cu toate că nu sunt menţionate în cele patru tablouri clinice tipice induse de proteinele din grâu, există şi cazuri descrise de reacţii non-IgE-mediate al căror algoritm de diagnostic trebuie avut în vedere. Diagnosticul esofagitei eozinofilice are la bază datele de istoric clinic (disfagie şi impactarea alimentelor la copii mari şi adulţi; regurgitări, falimentul creşterii şi dificultate în diversificarea cu alimente solide, dureri abdominale şi vărsături la sugari şi copiii mici), coroborate cu cele obţinute prin endoscopie digestivă superioară (biopsie esofagiană care să documenteze prezenţa a cel puţin 15 eozinofile/câmp). Demonstrarea alergenului declanşator este dificilă, având în vedere că testarea cutanată prick şi dozarea nivelului IgE specifice la posibilul aliment au specificitate şi sensibilitate scăzute, cu precădere pentru cei mai frecvenţi triggeri: laptele şi grâul. Cu toate că asocierea dintre testarea cutanată prick şi patch creşte sensibilitatea şi specificitatea, standardul de aur rămâne dieta de eliminare, urmată la distanţă de opt săptămâni de efectuarea endoscopiei digestive superioare. Similar esofagitei eozinofilice, gastroenterita eozinofilică este diagnosticată prin existenţa simptomelor sugestive (greaţă, vărsături, saţietate precoce la cei cu inflamaţie predominant gastrică; malabsorbţie şi enteropatie cu pierdere de proteine la cei cu inflamaţie predominant duodenală) şi a biopsiei care relevă inflamaţia eozinofilică. Probele biopsice trebuie să fie prelevate din cinci-şase arii ale fiecărui segment afectat, iar prezenţa a 30 eozinofile/câmp (biopsie gastrică), respectiv 50 eozinofile/câmp (biopsie duodenală), are valoare diagnostică. Şi pentru această afecţiune tardivă, testarea alergologică nu este suficient de sensibilă sau specifică pentru a ghida modificările necesare din dietă(9).
Prognostic şi perspective terapeutice
Prognosticul alergiei la grâu este în general bun şi asociază o rată mare de rezoluţie spontană, simptomatologia persistând până la vârsta adultă în doar 10% din cazuri(4,11). Într-un studiu japonez retrospectiv, au fost evaluaţi factorii care se asociază cu persistenţa alergiei la grâu. Astfel, s-a demonstrat că pacienţii cu un episod de anafilaxie până la vârsta de 3 ani, cuniveluri mari ale IgE specifice la extractul de grâu sau ω-5-gliadină, au un risc crescut de alergie persistentă(1,26). De regulă, un nivel mare al IgE specifice la extractul de grâu se corelează cu obţinerea tardivă a toleranţei, iar cei cu un nivel normal depăşesc alergia până la vârsta de 3 ani. Pacienţii ar trebui investigaţi serologic în mod periodic, cu scopul de a decide momentul oportun pentru testul de provocare menit să certifice dobândirea toleranţei. Anafilaxia indusă de grâu dependentă de efort şi astmul brutarului sunt cele două scenarii clinice care nu se asociază cu rezoluţie spontană(4).
În ceea ce priveşte posibilitatea efectuării imunoterapiei orale, actualmente nu există produse standardizate disponibile(4). Până acum, există puţine studii care au evaluat siguranţa şi eficacitatea imunoterapiei pe termen lung (tabelul 3)(1).

Făina de grâu conţine o cantitate mică de proteine comparativ cu arahidele sau laptele, astfel că este necesară administrarea de doze mari în cursul imunoterapiei, fapt ce duce la o aderenţă scăzută(27). Pentru a înlătura acest inconvenient, s-au încercat protocoale bazate pe gluten vital („vital wheat gluten”) într-un lot de 46 de pacienţi, cu vârsta cuprinsă între 4,2 şi 22,3 ani. Rezultatele preliminarii au demonstrat obţinerea desensibilizării (cu ajutorul dozelor scăzute sau crescute de gluten vital) la 50% dintre pacienţi, la un an de la iniţierea tratamentului, pe când utilizarea doar a dozelor mici de gluten vital a indus desensibilizarea în 30% din cazuri şi nonreactivitate susţinută în 13% din cazuri(27). Având în vedere că aceste rezultate sunt inferioare în comparaţie cu cele ale imunoterapiei la alte alimente (de exemplu, ou), a fost sugerată utilizarea unor doze mai mari, pe o perioadă mai îndelungată, sau chiar ambele, pentru a obţine pe viitor rezultate similare(27).
Concluzii
Alergia la grâu este o patologie frecventă în rândul pacienţilor pediatrici, dar poate fi întâlnită şi la adulţi, având potenţialul de a genera diverse manifestări clinice, care variază în funcţie de modalitatea de expunere la alergen. În prezent, resursele care ar putea oferi indicii privind predictibilitatea reactivităţii clinice sau a prognosticului bazată pe componentele moleculare în cazul grâului sunt limitate. Molecula cel mai bine caracterizată în acest sens rămâne omega-5 gliadina, care tinde spre specificitate înaltă pentru reactivitatea clinică şi persistenţa alergiei în viaţa de adult. Diagnosticul molecular în alergia la grâu poate fi unul dificil şi de cele mai multe ori trebuie însoţit de suportul altor metode diagnostice, însă progresele în tehnologiile de diagnostic molecular oferă perspectiva unei mai mari precizii a diagnosticului şi a prognosticului reacţiilor alergice induse de grâu.
Autor corespondent: Elena-Camelia Berghea, e-mail: bcamelia@gmail.com
Conflict de interese: niciunul declarat.
Suport financiar: niciunul declarat.
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
-
Ricci G, Andreozzi L, Cipriani F, Giannetti A, Gallucci M, Caffarelli C. Wheat Allergy in Children: A Comprehensive Update. Medicina (Kaunas). 2019;55(7). doi:10.3390/medicina55070400.
-
https://www.thermofisher.com/phadia/wo/en/resources/allergen-encyclopedia/whole-allergens.html?key=f4.
-
Mäkelä MJ, Eriksson C, Kotaniemi‐Syrjänen A, et al. Wheat allergy in children – new tools for diagnostics. Clinical & Experimental Allergy. 2014;44(11):1420-1430. doi:10.1111/cea.12393.
-
Dramburg S, Hilger C, Santos AF, et al. EAACI Molecular Allergology User’s Guide 2.0. Pediatric Allergy and Immunology. 2023;34(S28). doi:10.1111/pai.13854.
-
Jansson-Knodell CL, Rubio-Tapia A. Gluten-related Disorders From Bench to Bedside. Clinical Gastroenterology and Hepatology. 2024;22(4):693-704.e1. doi:10.1016/j.cgh.2023.09.042.
-
Cabanillas B. Gluten-related disorders: Celiac disease, wheat allergy, and nonceliac gluten sensitivity. Crit Rev Food Sci Nutr. 2020;60(15):2606-2621. doi:10.1080/10408398.2019.1651689.
-
Escudero-Hernández C, Peña AS, Bernardo D. Immunogenetic Pathogenesis of Celiac Disease and Non-celiac Gluten Sensitivity. Curr Gastroenterol Rep. 2016;18(7):36. doi:10.1007/s11894-016-0512-2.
-
Nguyen CN, Kim SJ. Dermatitis Herpetiformis: An Update on Diagnosis, Disease Monitoring, and Management. Medicina (B Aires). 2021;57(8):843. doi:10.3390/medicina57080843.
-
Cianferoni A. Wheat allergy: diagnosis and management. J Asthma Allergy. 2016;9:13-25. doi:10.2147/JAA.S81550.
-
Quirce S, Boyano-Martínez T, Díaz-Perales A. Clinical presentation, allergens, and management of wheat allergy. Expert Rev Clin Immunol. 2016;12(5):563-572. doi:10.1586/1744666X.2016.1145548.
-
Czaja-Bulsa G, Bulsa M. What Do We Know Now about IgE-Mediated Wheat Allergy in Children? Nutrients. 2017;9(1):35. doi:10.3390/nu9010035.
-
Yagami A, Aihara M, Ikezawa Z, et al. Outbreak of immediate-type hydrolyzed wheat protein allergy due to a facial soap in Japan. Journal of Allergy and Clinical Immunology. 2017;140(3):879-881.e7. doi:10.1016/j.jaci.2017.03.019.
-
Khalid A, Hameed A, Tahir MF. Wheat quality: A review on chemical composition, nutritional attributes, grain anatomy, types, classification, and function of seed storage proteins in bread making quality. Front Nutr. 2023;10:1053196. doi:10.3389/fnut.2023.1053196.
-
WHO/IUIS. Triticum aestivum (Wheat): WHO/IUIS Allergen Nomenclature Sub-Committee. [updated May 12, 2020; cited 2021 February 1, 2021] www.allergen.org.
-
Ito K, Futamura M, Borres MP, et al. IgE antibodies to ω‐5 gliadin associate with immediate symptoms on oral wheat challenge in Japanese children. Allergy. 2008;63(11):1536-1542. doi:10.1111/j.1398-9995.2008.01753.x.
-
Sander I, Rihs HP, Doekes G, et al. Component-resolved diagnosis of baker’s allergy based on specific IgE to recombinant wheat flour proteins. Journal of Allergy and Clinical Immunology. 2015;135(6):1529-1537. doi:10.1016/j.jaci.2014.11.021.
-
Palosuo K, Alenius H, Varjonen E, Kalkkinen N, Reunala T. Rye γ‐70 and γ‐35 secalins and barley γ‐3 hordein cross‐react with ω‐5 gliadin, a major allergen in wheat‐dependent, exercise‐induced anaphylaxis. Clinical & Experimental Allergy. 2001;31(3):466-473. doi:10.1046/j.1365-2222.2001.01023.x.
-
Pahr S, Constantin C, Papadopoulos NG, et al. α-Purothionin, a new wheat allergen associated with severe allergy. Journal of Allergy and Clinical Immunology. 2013;132(4):1000-1003.e4. doi:10.1016/j.jaci.2013.05.016.
-
Longo G, Berti I, Burks AW, Krauss B, Barbi E. IgE-mediated food allergy in children. The Lancet. 2013;382(9905):1656-1664. doi:10.1016/S0140-6736(13)60309-8.
-
Santos AF, Riggioni C, Agache I, et al. EAACI guidelines on the diagnosis of IgE‐mediated food allergy. Allergy. 2023;78(12):3057-3076. doi:10.1111/all.15902.
-
Faihs V, Kugler C, Schmalhofer V, et al. Wheat‐dependent exercise‐induced anaphylaxis: subtypes, diagnosis, and management. JDDG: Journal der Deutschen Dermatologischen Gesellschaft. 2023;21(10):1131-1135. doi:10.1111/ddg.15162.
-
Christensen MJ, Eller E, Mortz CG, Brockow K, Bindslev-Jensen C. Exercise Lowers Threshold and Increases Severity, but Wheat-Dependent, Exercise-Induced Anaphylaxis Can Be Elicited at Rest. J Allergy Clin Immunol Pract. 2018;6(2):514-520. doi:10.1016/j.jaip.2017.12.023.
-
Brockow K, Kneissl D, Valentini L, et al. Using a gluten oral food challenge protocol to improve diagnosis of wheat-dependent exercise-induced anaphylaxis. Journal of Allergy and Clinical Immunology. 2015;135(4):977-984.e4. doi:10.1016/j.jaci.2014.08.024.
-
Raulf M, Quirce S, Vandenplas O. Addressing Molecular Diagnosis of Occupational Allergies. Curr Allergy Asthma Rep. 2018;18(1):6. doi:10.1007/s11882-018-0759-9.
-
Van Kampen V, Rabstein S, Sander I, et al. Prediction of challenge test results by flour‐specific IgE and skin prick test in symptomatic bakers. Allergy. 2008;63(7):897-902. doi:10.1111/j.1398-9995.2008.01646.x.
-
Koike Y, Yanagida N, Sato S, et al. Predictors of Persistent Wheat Allergy in Children: A Retrospective Cohort Study. Int Arch Allergy Immunol. 2018;176(3-4):249-254. doi:10.1159/000489337.
-
Nowak-Węgrzyn A, Wood RA, Nadeau KC, et al. Multicenter, randomized, double-blind, placebo-controlled clinical trial of vital wheat gluten oral immunotherapy. Journal of Allergy and Clinical Immunology. 2019;143(2):651-661.e9. doi:10.1016/j.jaci.2018.08.041.
-
Rodríguez del Río P, Díaz-Perales A, Sanchez-García S, et al. Oral immunotherapy in children with IgE-mediated wheat allergy: outcome and molecular changes. J Investig Allergol Clin Immunol. 2014;24(4):240-248.
-
Sato S, Utsunomiya T, Imai T, et al. Wheat oral immunotherapy for wheat-induced anaphylaxis. J Allergy Clin Immunol. 2015;136(4):1131-3.e7. doi:10.1016/j.jaci.2015.07.019.
-
Khayatzadeh A, Gharaghozlou M, Ebisawa M, Shokouhi Shoormasti R, Movahedi M. A Safe and Effective Method for Wheat Oral Immunotherapy. Iran J Allergy Asthma Immunol. 2016;15(6):525-535.
-
Rekabi M, Arshi S, Bemanian MH, et al. Evaluation of a new protocol for wheat desensitization in patients with wheat-induced anaphylaxis. Immunotherapy. 2017;9(8):637-645. doi:10.2217/imt-2017-0011.
Articole din ediţiile anterioare
Diagnosticul molecular al alergiilor în practica clinică
Prevalenţa bolilor alergice este în creştere, atât în ţările dezvoltate, cât şi în cele în curs de dezvoltare (Pawankar et al., 2013).
Abordarea diagnostică moleculară în aspergiloza bronhopulmonară alergică
Aspergiloza bronhopulmonară alergică (ABPA) este o afecţiune care apare la pacienţi cu astm sau fibroză chistică şi care prezintă teste cutanate de...
Sensibilizarea la acarienii din praful de casă – o interpretare moleculară
Acarienii din praful de casă reprezintă principala cauză de alergie respiratorie, iar reactivitatea atopică la produsele lor este una dintre cele m...
Alergia la grâu – aspecte clinice şi de management
Alergia la cereale este printre cele mai comune forme de alergie alimentară. Răspunsurile imunologice induse de proteinele din cereale pot fi IgE ş...