Reacţiile de hipersensibilitate la terapia antiretrovirală
Hypersensitivity reactions induced by antiretroviral agents
Abstract
Drugs hypersensitivity reactions in HIV-infected patients are induced by both antiretroviral agents and antibiotic therapy for oportunistic infections. The most frequently involved agents are abacavir, nevirapine and co-trimoxazole as prophylactic treatment. The incidence of drug hypersensitivity reactions in HIV-infected patients is higher than in general population, the skin reaction being 100 more frequent in these cases. The most common manifestations of drug hypersensitivity reactions are cutaneous reactions and hepatotoxicity, both having an immune mechanism. The occurence of hypersensitivity reactions in HIV infected patients is related to a complex association of factors: chronic treatment, drugs association, cytokine profile in HIV‑infected patients, oxidative stress, drug metabolism alteration, genetic predisposition. The complex management of patients with hypersensitivity reactions requiers good knowledge of risk factors for such kind of reactions, metabolism and pharmacokinetic of recommended drugs, in order to prevent consequent hypersensitivity reactions. Genetic screening for abacavir hypersensitivity is an optimal method for diagnosis and prevention of hypersensitivity reactions in Caucasian population. Strict avoidance of culprit drug is mandatory in case of abacavir hypersensitivity and nevirapine hepatotoxicity; desensitization is possible in case of co-trimoxazole-induced reactions.Keywords
hypersensitivity reactionsantiviralsabacavirnevirapinemHIV infectionRezumat
Reacțiile de hipersensibilitate (HS) la pacienții cu infecție HIV se datorează atât terapiei antiretrovirale, cât și tratamentului antibiotic pentru infecțiile oportuniste. Cele mai multe reacții de HS sunt observate după abacavir, nevirapină și după terapia profilactică cu co-trimoxazol. Frecvența de apariție a reacțiilor de HS la pacienții cu infecție HIV este mult mai mare decât în populația generală, cele cutanate fiind de 100 de ori mai frecvente. Manifestările clinice cel mai frecvent observate sunt cele cutanate, urmate de reacțiile hepatice. Se consideră că aceste reacții sunt imunologic mediate, apariția lor fiind determinată de mai mulți factori: tratamentul cronic, asocierile medicamentoase, profilul citokinic al pacienților infectați cu virusul HIV, stresul oxidativ, alterarea metabolismului medicamentelor, precum și predispoziția genetică. Abordarea pacientului cu reacții de hipersensibilitate este complexă și implică recunoașterea factorilor de risc, cunoașterea metabolismului și a parametrilor farmacocinetici ai medicamentelor utilizate, în vederea prevenirii unor posibile reacții de HS. Screeningul genetic pentru determinarea hipersensibilității la abacavir reprezintă o metodă eficientă de diagnostic și prevenire a reacțiilor de HS în populația caucaziană. Evitarea absolută a medicamentului incriminat este recomandată în caz de hipersensibilitate la abacavir și hepatotoxicitate la nevirapină, iar desensibilizarea este posibilă în cazul co-trimoxazolului.Cuvinte Cheie
reacție de hipersensibilitateantiviraleabacavirnevirapinăinfecție HIVVirusul HIV și terapia antiretrovirală
Virusul HIV este la ora actuală cel mai studiat virus, întrucât, în absența tratamentului antiretroviral, infecția cu HIV progresează spre stadiul de boală (SIDA), caracterizat prin limfopenie marcată și risc de infecții cu germeni oportuniști(1). HIV aparține genului lentivirus, fiind un virus cu ARN. Există până în prezent două genotipuri virale – HIV-1, care este cel mai răspândit, și HIV-2, care se regăsește mai ales la persoanele infectate în regiunea Africa de Vest.
HIV afectează în principal celulele CD4+, în special limfocitele T și macrofagele(2). După pătrunderea în organism, HIV se leagă de receptorul CD4 de pe celulele-țintă prin intermediul proteinei gp120. Însă, pentru internalizarea virusului în celulă, sunt necesari și coreceptorii pentru chemokine: CXCR4 și CCR5(2,3). Ulterior are loc replicarea virală în celulele recent infectate, celule care sunt lizate pentru a elibera noile particule virale cu potențial infectant, ceea ce determină depleția celulelor CD4+ în primii ani după infecție (3-10 ani). În timp, prin pierderea limfocitelor T-helper se pierde capacitatea organismului de a face față infecțiilor cu germeni care, în condiții normale, nu determină infecții severe(3).
Ciclul de replicare al virusului implică o serie de enzime și receptori care pot constitui ținte ale tratamentului antiretroviral. Până în prezent sunt aprobate o serie de clase de medicamente cu efect antiretroviral, care pot fi utilizate în diferite combinații.
- Inhibitori nucleozidici de revers transcriptază: abacavir, didanosină, emtricitabină, lamivudină, stavudină, tenofovir, zidovudină, adefovir dipivoxil, entecavir, telbivudină.
- Inhibitori non-nucleozidici de revers transcriptază: efavirenz și nevirapină.
- Inhibitori de protează: amprenavir, atazanavir, darunavir, fosamprenavir, indinavir, lopinavir, nelfinavir, ritonavir, saquinavir, timpranavir.
- Inhibitori ai fuziunii celulare: enfurvitida.
- Inhibitori CCR5: maraviroc.
- Inhibitori de integrază: ratelgravir(1,4).
Combinarea a trei medicamente cu efect sinergic antiretroviral din cel puțin două clase diferite reprezintă așa-numitul tratament înalt activ antiretroviral (highly active antiretroviral therapy – HAART). Acest tratament este eficient în reducerea viremiei și restabilirea nivelului de limfocite T, fără să determine eradicarea infecției, ceea ce necesită un tratament cronic pe viață(1,3,4).
Reacțiile de hipersensibilitate induse de medicamente la pacienții cu HIV
Reacțiile adverse medicamentoase reprezintă o problemă de sănătate publică și un factor important în cercetarea farmacologică. Reacțiile adverse de tip B, cele imprevizibile, care reprezintă aproximativ 20% din totalul reacțiilor adverse, au la bază mecanisme imunologice(5,6). În limbajul uzual, reacțiile de tip B sunt considerate reacții alergice, însă ele pot avea și alte mecanisme imunologice, astfel încât comitetul de experți recomandă utilizarea termenului de „reacție de hipersensibilitate“, în locul celui de alergie medicamentoasă(5). În această definiție sunt incluse atât reacțiile IgE mediate, cât și manifestările de organ, non-IgE mediate (necroză hepatică, sindrom Stevens-Johnson).
Reacțiile de hipersensibilitate la pacienții cu HIV sunt mai frecvent întâlnite, ca urmare a expunerii de lungă durată la un număr mare de medicamente, dar și din cauza alterării sistemului imunitar(7). De fapt, reacțiile adverse reprezintă principalul motiv de întrerupere a HAART în primul an de tratament, și nu eșecul terapeutic(7). Aproximativ 80% dintre pacienții cu infecție HIV dezvoltă reacții adverse în cursul tratamentului. Această frecvență mare are mai multe cauze:
- HIV este o afecțiune cronică ce necesită tratament pe întreaga durată de viață.
- Regimurile terapeutice asociază mai multe medicamente, atât antiretrovirale, cât și antibiotice și antifungice, care pot genera o serie de interacțiuni de ordin farmacocinetic și farmacodinamic.
- Utilizarea medicamentelor de generație nouă, cu efecte adverse necunoscute, din timpul trialurilor clinice.
- Utilizarea unor doze mari de medicamente, uneori de ordinul gramelor.
- Alterarea metabolismului medicamentelor.
- Disfuncționalitatea sistemului imun la pacienții cu HIV și profilul citokinic aparte.
- Predispoziția genetică(7,8,9).
Medicamentele incriminate în producerea reacțiilor de hipersensibilitate (HS) la pacienții cu HIV sunt diferite, iar frecvența de apariție a acestora s-a modificat în timp(8). La început, reacțiile de HS au fost mai frecvent întâlnite după administrarea antibioticelor utilizate în profilaxia infecțiilor oportuniste, cum ar fi co-trimoxazolul sau medicația antituberculoasă. Dezvoltarea terapiei antiretrovirale a redus utilizarea acestor antibiotice în timp, astfel încât au scăzut frecvența și durata expunerii la această terapie. Coopman și colab.(10) au raportat o frecvență a reacțiilor de HS între 3% și 20%, cele cutanate fiind mai frecvent întâlnite. Reacțiile cutanate sunt de 100 de ori mai frecvente la pacienții cu HIV decât în populația generală. În ceea ce privește HAART, nu există studii privind incidența reacțiilor alergice induse de terapia antiretrovirală, datele fiind raportate individual pentru fiecare medicament în parte(8).
Imunopatogeneza reacțiilor de hipersensibilitate induse de medicamente la pacienții cu HIV
Patogeneza reacțiilor de HS la pacienții cu infecție HIV nu este pe deplin cunoscută, însă aceste reacții apar în urma expunerii la un agent cauzal la un pacient cu susceptibilitate genetică. Au fost propuse cel puțin două ipoteze privind mecanismele de producere a reacțiilor de HS: mecanismul indus de haptenă și mecanismul independent de haptenă. Aceste mecanisme nu se exclud reciproc(11).
Prima teorie sugerează că medicamentul, prin intermediul unui metabolit reactiv, devine imunogenic și se leagă ireversibil, covalent, de o proteină. Complexul astfel format este prezentat prin intermediul moleculelor HLA celulelor T(12). Cea de-a doua ipoteză sugerează că medicamentul propriu-zis activează direct, fără o procesare antigenică prealabilă, celulele T prin intermediul receptorilor specifici de pe suprafața acestora sau prin intermediul MHC. Acest mecanism mai este cunoscut și ca interacțiunea farmacologică cu receptorul imun (modelul p-i)(13). Mecanismul descris explică în parte reacțiile de hipersensibilitate induse de abacavir, carbamazepină sau sulfametoxazol.
Recent s-a emis încă o ipoteză, cea a repertoriului de peptide alterate („altered-peptide repertoire hypothesis“)(14). Astfel, medicamentele cu moleculă mică se leagă noncovalent de anumite regiuni de legare a antigenului la nivelul moleculelor HLA de clasă I. Această legare determină modificări conformaționale la nivelul locului de legare a antigenului, alterând astfel secvența de peptide. Individul poate să nu fie tolerant la această nouă secvență de prezentare a peptidelor, ceea ce generează un răspuns diferit al celulelor T. Cel mai sugestiv exemplu este abacavirul, care se leagă de un loc specific la nivelul moleculei HLA-B* 57:01, modificând reactivitatea acestei molecule(15) și care devine moleculă non self pentru celulele T CD8+, determinând un răspuns autoimun(14,15). Însă acest mecanism nu explică în totalitate de ce doar 55% dintre pacienții HLA-B* 57:01 pozitivi dezvoltă reacții de HS la abacavir(16), ceea ce întărește ipoteza asocierii mai multor mecanisme imunologice în producerea acestor reacții.
Manifestările clinice ale HS induse de medicamente la pacienții cu HIV
Manifestările clinice ale reacțiilor de HS induse de medicamente sunt similare atât pentru compușii de primă generație, cât și pentru medicamentele recent aprobate. Manifestările cutanate sunt cel mai frecvent întâlnite, fiind extrem de variate. Dintre acestea, exantemul maculo-papular este cel mai frecvent raportat(17). Au fost, de asemenea, descrise reacții urticariene, epidermoliză toxică (TEN) sau sindrom Stevens-Johnson (SSJ). Reacții cutanate au fost descrise pentru toate antiretroviralele aprobate în tratamentul HIV(12,18), însă ele sunt mai frecvent observate după administrarea inhibitorilor non-nucleozidici de revers transcriptază (INNRV)(8,18).
Exantemul maculo-papular se caracterizează prin erupție maculo-papulară eritematoasă, pruriginoasă, neînsoțită de febră, diseminată, care afectează în principal trunchiul și extremitățile proximale. Leziunile pot conflua în timp și se pot transforma în leziuni pustulo-veziculare. Exantemul maculo-papular apare de obicei în intervalul 2-10 săptămâni după inițierea tratamentului antiretroviral sau la 1-2 zile după reexpunere. În momentul întreruperii tratamentului, leziunile se remit în 1-2 săptămâni fără sechele. Asocierea altor semne (edem, descuamare tegumentară, febră, afectarea mucoaselor) sau afectarea de organ reprezintă semne de alarmă și arată riscul dezvoltării unor reacții sistemice severe(19). Exantemul maculo-papular a fost descris atât după administrarea de HAART, cât și secundar terapiei antibiotice profilactice cu beta lactamice (cefalosporine, amoxicilină sau ampicilină) sau sulfonamide (co-trimoxazol).
Reacțiile IgE mediate sau urticaria tardivă sunt rareori descrise în asociere cu terapia antiretrovirală(7,12). Apariția acestora necesită întreruperea tratamentului antiretroviral și administrare sistemică de antihistaminice H1, cu asociere de corticosteroizi în cazurile severe.
Sindromul Stevens-Johnson (SSJ) și epidermoliza toxică (TEN) reprezintă afecțiuni cutanate cu potențial letal, rata mortalității fiind situată în jur de 22%(20). Sunt considerate două entități ale aceleiași boli, diferența între SSJ și TEN constând în procentul de descuamare tegumentară (mai puțin de 10% în SSJ și peste 30% în TEN)(21). Apar după 1-3 săptămâni de la inițierea tratamentului antiretroviral. Din cauza descuamării tegumentare, infecțiile cutanate reprezintă principala complicație a SSJ și TEN(12). Vindecarea se produce în aproximativ 3-6 săptămâni de la întreruperea tratamentului incriminat, de cele mai multe ori (peste 50% dintre cazuri) cu sechele cronice: hiperpigmentare, leziuni ale mucoaselor, tulburări de vedere și chiar pierderea acesteia(7,21). Tratamentul SSJ și TEN se face în secțiile de terapie intensivă, sub strictă supraveghere, dar este un tratament simptomatic după întreruperea medicamentului incriminat. Apariția acestor reacții contraindică reluarea tratamentului cu medicamentul incriminat.
Manifestările cutanate sunt observate și în cadrul sindromului DRESS (Drug Reaction with Eosinophilia and Systemic Symptoms). Însă în acest caz se asociază și manifestări sistemice, care reprezintă criterii de diagnostic pozitiv: febră ridicată, edem facial, eritrodermie cu dermatită exfoliativă consecutivă, limfadenopatii, eozinofilie, limfocite circulante atipice în periferie și afectare hepatică. Pot să apară și alte manifestări sistemice severe: pancreatită, pneumonie, hepatită acută, insuficiență renală, dar foarte rar apare afectarea mucoaselor, care este caracteristică SSJ și TEN(22,23). Sindromul DRESS apare, ca și SSJ și TEN, în intervalul 2-6 săptămâni de la inițierea tratamentului antiretroviral. Este necesară recunoașterea sindromului pentru a putea opri prompt tratamentul antiretroviral incriminat. Există însă riscul evoluției sindromului și după oprirea acestuia. Tratamentul constă în administrare de corticosteroizi topic și sistemic, recuperarea fiind completă, de obicei fără sechele(22).
Reacțiile de hipersensibilitate induse de antiretrovirale se pot manifesta și prin afectare hepatică. Deși unele modificări ale transaminazelor pot fi puse pe seama infecției concomitente cu virusul B sau C, ele pot fi și consecința unui mecanism imun de hipersensibilitate indus de tratamentul antiretroviral sau a toxicității mitocondriale(8,24). Dintre antiretrovirale, INNRT sunt mai frecvent asociați cu apariția reacțiilor de hipersensibilitate hepatică prin mecanism imun, dintre aceștia cu precădere nevirapina. Aceasta induce creșterea transaminazelor la aproximativ 7% dintre pacienți, iar la 1% dintre ei poate să apară hepatită acută(25). Afectarea hepatică apare mai ales la femei, la pacienți cu IMC<18,5 kg/m2, cu viremie<20000 copii/ml, AST<75 UI, albumine<35 g/l(26).
În afară de INNRT, reacții de hipersensibilitate mediate imun care afectează ficatul au fost descrise și după administrarea de abacavir, inhibitori de protează (fosamprenavir și darunavir) sau maraviroc(27,28). Reacțiile hepatice imun mediate apar aproximativ la 4-6 săptămâni după inițierea tratamentului antiretroviral, iar cele care apar ulterior se consideră a avea alt mecanism (toxicitate mitocondrială sau sunt consecința interacțiunilor de ordin farmacocinetic)(8). În cazul INNRT, în special al nevirapinei, afectarea hepatică se poate asocia cu cea cutanată, acestea din urmă precedând leziunile hepatice(26). Pentru nevirapină, abacavir și maraviroc, FDA a emis atenționare de monitorizare suplimentară (black box warning)(28).
Antivirale implicate în producerea reacțiilor de hipersensibilitate
1. Inhibitori nucleozidici de revers transcriptază (INRT)
Sunt primele antiretrovirale utilizate în tratamentul infecției HIV. Ca urmare a dificultăților în titrarea dozelor și a toxicității pe termen lung, zidovudina, stavudina și didanozina sunt mai puțin utilizate ca medicație de primă linie în țările dezvoltate.
Abacavirul este cel mai frecvent incriminat în producerea reacțiilor de hipersensibilitate, care apar la 5-9% dintre pacienți(7), în primele 6 săptămâni după inițierea tratamentului. Clinic se manifestă prin febră, rash cutanat, simptome generale, simptome digestive sau respiratorii, acest tablou constituind așa-numitul sindrom de reacție de hipersensibilitate indusă de abacavir (HRS – Hypersensitivity Reaction Syndrome)(8,29). Complexul simptomatic descris trebuie diferențiat de rash-ul cutanat sau urticaria fără manifestări sistemice, care poate apărea la până în 70% dintre cazurile tratate cu abacavir(30). SSJ și TEN sunt mult mai rar asociate cu administrarea de abacavir, dar au fost descrise câteva cazuri(18).
Rash-ul cutanat este de cele mai multe ori ușor sau moderat, nu necesită oprirea tratamentului cu abacavir. Însă apariția sindromului de hipersensibilitate obligă la întreruperea tratamentului, cu remiterea simptomelor în 72 de ore, de obicei fără tratament de suport(7). Dacă se întrerupe tratamentul cu abacavir, acesta nu mai trebuie reluat. Există riscul de apariție a sindromului de HS în câteva ore de la reluarea tratamentului, care poate evolua spre șoc anafilactic(18,31). Reacția de hipersensibilitate nu poate fi prevenită prin administrare de prednisolon(32).
Reacția de HS indusă de abacavir are determinism genetic, fiind asociată cu prezența HLA-B*5701(16). Întrucât Mallal și colab.(16) au evidențiat această asociere puternică între prezența alelei și toxicitatea abacavirului, s-a pus problema dacă este necesar screeningul genetic anterior începerii tratamentului cu abacavir. Astfel, Rauch și colab. au investigat frecvența de apariție a reacției de HS într-o cohortă și au observat absența acestui efect advers la cei cu HLA-B*5701 negativ(33). Screeningul prospectiv a redus incidența reacțiilor de HS de la 8% la 2%(33) și a întreruperii tratamentului cu abacavir de la 10,2% la 0,73%(34). Aceste date susțin necesitatea testării prezenței alelei HLA-B*5701 în practica clinică de rutină.
Zidovudina poate induce de asemenea reacție de HS, caracterizată prin rash maculo-papular, eritem cutanat, febră, vasculită leucocitoclastică, uneori putând să apară TEN(35). Utilizarea zidovudinei a scăzut semnificativ în ultimii ani, astfel încât aceste reacții sunt rar întâlnite acum.
Tenofovir, care este un antiretroviral de primă linie în tratamentul HIV, poate induce rash maculo-papular cu localizare pe față, trunchi și extremități în 5-7% dintre cazuri(36). La fel, emtricitabina poate induce rash cutanat ușor sau moderat în 17-30% dintre cazuri, doar 1% dintre acestea necesitând întreruperea tratamentului(7).
2. Inhibitori non-nucleozidici de revers transcriptază
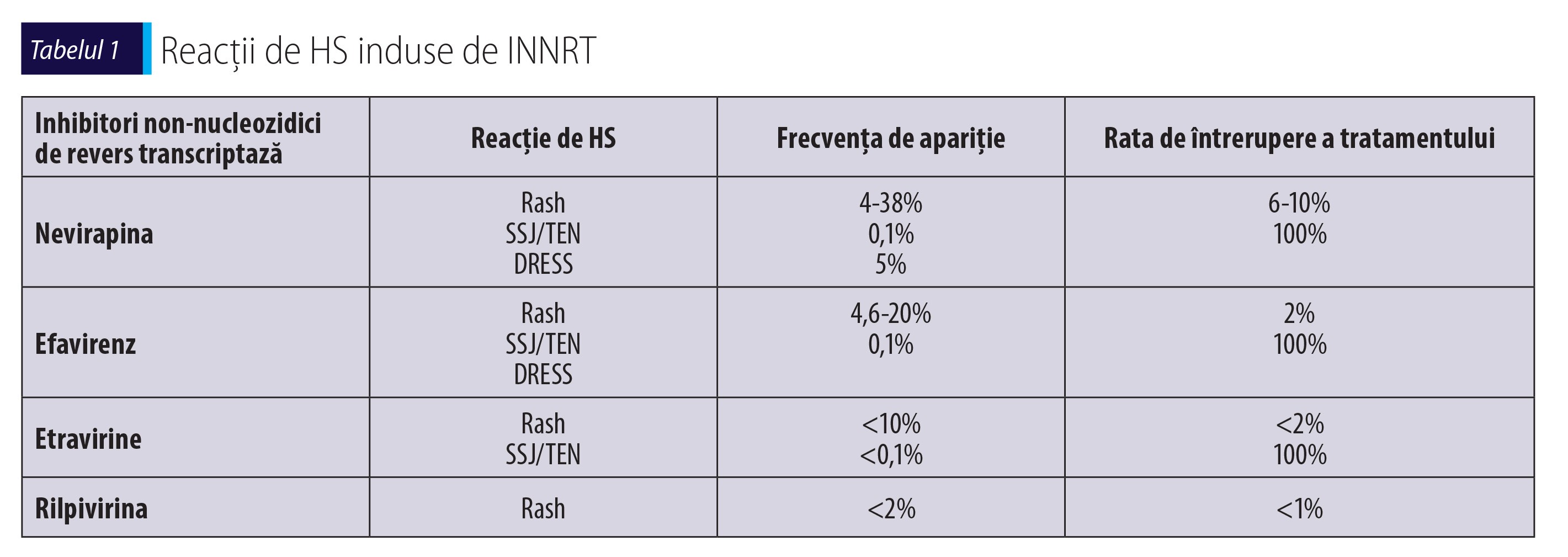
Atât compușii de primă generație, cât și cei din generația a doua sunt asociați cu producerea reacțiilor de HS, dar acestea sunt mai frecvent observate după administrarea nevirapinei. Frecvența de apariție și necesitatea întreruperii tratamentului sunt prezentate în tabelul 1.
Cel mai frecvent observată manifestare este rash-ul maculo-papular, care apare în 15-38% dintre cazuri, în primele două săptămâni de tratament(12). La 5% dintre pacienți se poate asocia cu febră sau cu hepatotoxicitate, însă de cele mai multe ori este benign și autolimitat(37). Sub 1% (0,35%) dintre pacienți pot dezvolta reacții severe (SSJ sau TEN)(12,18). Reacțiile cutanate apar mai frecvent la femei, la unele rase (hispanici, asiatici), la cei cu viremie necontrolată sau cu un număr mare de limfocite CD+(38). Reacții severe de HS asociate cu hepatotoxicitate au fost descrise și la persoanele neinfectate, în condițiile administrării acesteia ca terapie profilactică postexpunere, de aceea noile recomandări terapeutice exclud această indicație pentru nevirapină(39).
Dacă este o formă ușoară de rash, fără simptome sistemice sau afectare de organ, se recomandă continuarea tratamentului, însă escaladarea dozelor trebuie făcută mai lent și doar după remiterea simptomelor cutanate. În cazul SSJ/TEN se recomandă întreruperea de urgență a nevirapinei. Terapia profilactică cu antihistaminice H1 sau corticosteroizi nu este eficientă – din contră, poate crește severitatea reacției(32).
La fel ca și în cazul abacavirului, reacțiile de HS induse de nevirapină au un determinism genetic legat de moleculele HLA. Reacțiile de HS care asociază rash și hepatotoxicitate sunt legate de prezența alelei HLA-DRB1*01:01 în populația caucaziană. Manifestările cutanate induse de nevirapină se asociază cu HLA-B*35:05 la asiatici și cu HLA-Cw4 în toate populațiile, dar mai ales la rasa neagră. HLA-B*58:01 și HLA-DRB1*01:02 se asociază cu hepatotoxicitate la populația sud-africană, în timp ce prezența alelei HLA-C*04:01 crește riscul de SSJ/TEN în unele populații. HLA-DRB1*01 se asociază cu reacțiile de HS induse atât de nevirapină, cât și de efavirenz, sugerând astfel un mecanism comun al reacțiilor de HS induse de aceste antiretrovirale(40).
Efavirenz este la ora actuală cel mai utilizat analog non-nucleozidic. Reacțiile de HS sunt mai rar întâlnite la efavirenz decât la nevirapină. Rash-ul cutanat apare de obicei în primele 11 zile de la inițierea tratamentului și este ușor‑moderat(12). Tratamentul cu efavirenz poate fi continuat dacă se asociază antihistaminice H1 și corticosteroizi topici și remite astfel în 4 săptămâni(41). Este contraindicată continuarea tratamentului cu efavirenz în cazul reacțiilor severe (SSJ/TEN, DRESS). Au fost descrise și cazuri izolate de alte manifestări de HS, cum ar fi: pneumonie de hipersensibilitate, nefrită interstițială, hepatită severă. Nu au fost identificați factori de risc pentru apariția reacțiilor de HS la efavirenz, cu excepția prezenței alelei HLA-DRB1*01 pentru rash-ul cutanat(40).
Au fost descrise și reacții încrucișate de HS între nevirapină și efavirenz(42). Dar, în studiul lui Manosuthi W. et al.(43), 91,8% dintre pacienții cu rash indus de nevirapină și limfocite T CD4 sub 200 celule/ml au tolerat tratamentul cu nefavirenz. De asemenea, au fost descrise cazuri de pacienți care au tolerat tratamentul cu nevirapină după întreruperea efavirenzului, ca urmare a reacțiilor cutanate(12). Astfel, efavirenzul poate constitui o opțiune terapeutică la pacienții cu rash indus de nevirapină, mai ales în situațiile în care resursele terapeutice sunt limitate.
Etravirina este un INNRT de generația a doua, care determină reacții de HS cutanate mai rar decât compușii de primă generație. În general, rash-ul cutanat apare în primele două săptămâni de tratament, este ușor moderat și nu este necesară întreruperea tratamentului cu etravirină(12,44).
Rilpivirina produce mult mai rar reacții de HS cutanată, în general rash cutanat. Nu au fost descrise reacții severe după administrare de rilpivirină(45).
3. Inhibitori de protează (IP)
Toți inhibitorii de protează se asociază cu apariția rash-ului cutanat, însă foarte rar cu reacții severe (SSJ, TEN sau DRESS). Frecvența de apariție a reacțiilor de HS este variabilă, între 5% și 19% în funcție de compus, fiind mai frecvent observate la compușii de generația a doua (fosamprenavir, atazanavir, tipranavir, daranavir)(7). De obicei, rash-ul cutanat este ușor‑moderat și nu necesită întreruperea tratamentului(12).
Fosamprenavirul și metabolitul activ al acestuia, amprenavir, produc cel mai frecvent rash cutanat (19%, respectiv 28%), în primele trei săptămâni de tratament(7,18). Uneori se pot asocia febră și creșterea transaminazelor. Întreruperea tratamentului antiretroviral se recomandă doar în cazurile severe (sub 1%). Aceste antiretrovirale au o structură sulfonarilaminică, astfel încât pot determina reacții de hipersensibilitate încrucișate cu sulfonamidele antimicrobiene. Nu se recomandă utilizarea lor la pacienții cu alergie cunoscută la sulfamide(46).
Atazanavir poate determina forme ușoare și moderate de rash maculo-papular la 6% dintre pacienți. Uneori se poate asocia cu icter și cu creșterea transaminazelor și a bilirubinei(18,47). Au fost descrise și cazuri izolate de reacții severe care au necesitat întreruperea tratamentului cu atazanavir în 0,4% din cazurile tratate(7).
Lopinavir/ritonavir pot determina o serie de reacții cutanate în primele săptămâni de tratament. Frecvența de apariție a rash-ului maculo-papular este de 2-4%(18,47). Au fost descrise și reacții cutanate severe (exantem pustulos sau reacții de HS cu afectare de organ), care au necesitat întreruperea tratamentului cu lopinavir/ritonavir(7,41). Apariția reacțiilor de HS nu se corelează cu nivelul viremiei, numărul de limfocite T CD4 sau cu stadiul bolii(7).
Darunavir, un antiretroviral recent aprobat pentru tratamentul infecției cu HIV-1, determină rash maculo-papular ușor/moderat, cu evoluție autolimitată în 1-7% dintre cazuri. Au fost descrise și cazuri de HS severă (SSJ și eritem multiform) care au necesitat întreruperea tratamentului, dar acestea sunt rare (0,3% dintre pacienți). Aceste date provin din studiile clinice de fază II sau III(7,18,47).
Tipranavir este un antiretroviral IP care se administrează în asociere cu ritonavir. Acesta determină rash maculo-papular sau urticarie la 8-10% dintre pacienți. De obicei este ușor‑moderat, formele severe care au necesitat întreruperea tratamentului fiind raportate mai rar (0,5% dintre cazuri)(7,48). Uneori poate fi însoțit de dureri articulare, odinofagie sau prurit generalizat. Apare mai târziu decât în cazul altor IP (în medie, după 50 de zile de la inițierea tratamentului) și recuperarea se face mai lent, în câteva săptămâni(7). Tipranavir conține o grupare sulfamidică în structura sa, astfel încât pacienții cu alergie la sulfamidele antimicrobiene nu ar trebui să urmeze tratament cu tipranavir(18,46). Rash-ul cutanat a fost observat mai frecvent la femeile care urmau tratament hormonal cu etinilestradiol(48).
4. Inhibitorii fuziunii celulare
Enfuvirtida este singurul compus care aparține acestei clase aprobat pentru tratamentul HIV sub formă injectabilă. Aceasta determină reacții cutanate locale la locul injectării aproape la toți pacienții (98,3%). Reacțiile locale apare încă din prima săptămână de administrare, sunt ușoare sau moderate și nu afectează activitatea pacientului. Doar în 4,4% dintre cazuri este necesară întreruperea tratamentului(49). Reacțiile de HS apar în mai puțin de 1% dintre cazuri în prima săptămână de tratament. Pot asocia, pe lângă rash cutanat, febră și hepatită acută(50).
5. Inhibitori de integrază
Ratelgravir este primul inhibitor de integrază aprobat pentru tratamentul HIV-1. Rareori a fost raportat rash cutanat maculo-papular sau generalizat, ușor sau moderat, care nu a necesitat întreruperea tratamentului(18). Multe dintre episoadele raportate au fost la pacienți care urmau tratament cu ratelgravir și INRT, respectiv IP(51). Recent însă au fost raportate și cazuri severe de HS, SSJ și DRESS la femei de rasă neagră(12,52).
Dolutegravir și elvitegravir sunt inhibitori de integrază recent aprobați. Pentru dolutegravir au fost raportate cazuri de HS manifestată prin rash cutanat, uneori asociat cu afectare hepatică în sub 1% din cazuri(18,53).
6. Inhibitori de CCR-5
Maraviroc este singurul inhibitor de CCR-5 aprobat în tratamentul infecției HIV. Poate determina prurit cutanat în 3,8% dintre cazuri. Manifestările cutanate preced afectarea hepatică. Din aceste considerente, la pacienții cu rash, eozinofilie și niveluri crescute de IgE trebuie evaluată funcția hepatică(7,47).
Diagnosticul și tratamentul reacțiilor de HS
Diagnosticul și managementul reacțiilor de HS reprezintă o provocare pentru medicul curant, date fiind regimurile terapeutice complexe. Nu întotdeauna ultimul medicament introdus în schema terapeutică este cel responsabil de apariția reacțiilor de HS. Reacțiile de HS pot fi tardive și apar chiar și la 6-12 săptămâni de la inițierea tratamentului antiretroviral(18). Întreruperea terapiei antiretrovirale, dar mai ales a terapiei antibiotice profilactice, poate pune viața pacientului în pericol. De asemenea, întreruperea tratamentului în vederea efectuării testelor cutanate patch nu este posibilă în toate cazurile, mai ales la cei cu nivel scăzut de limfocite T CD4(12,18).
Întrucât majoritatea reacțiilor descrise sunt reacții de HS întârziată, opțiunile diagnostice sunt relativ limitate și nu toate și-au dovedit eficacitatea în trialurile clinice. De multe ori, reacțiile de HS pot mima din punct de vedere clinic o afecțiune inflamatorie sau infecțioasă, ceea ce poate conduce la erori de diagnostic, inclusiv la supradiagnosticarea unei reacții alergice(54). Un exemplu în acest sens îl reprezintă diagnosticarea HS la abacavir la 2-7% dintre pacienții care nu au primit acest antiretroviral(55). De aceea, recunoașterea clinică a simptomatologiei, în special a celei cutanate, și cunoașterea riscului de progresie spre reacții severe amenințătoare de viață reprezintă o primă etapă în diagnosticul reacțiilor de HS induse de antiretrovirale.
Astfel, diagnosticul presupune o anamneză detaliată, inclusiv informații legate de debutul reacției de HS și dispariția acesteia după întreruperea tratamentului antiretroviral, examen clinic și teste de laborator. Testele patch sunt cele mai utile pentru diagnosticul reacțiilor tardive de HS, însă nu sunt standardizate, nu sunt accesibile în toate centrele medicale(5) și nu se cunoaște cu exactitate sensibilitatea testului pentru majoritatea medicamentelor(5,56).
Pentru a exclude o reacție fals pozitivă, ar trebui testată atât substanța activă, cât și excipienții separat, deși hipersensibilitatea la aceștia este foarte rară. Nu s-a stabilit cu exactitate concentrația optimă de testare. Ghidurile de diagnostic recomandă concentrații de 1-10% pentru substanța pură și de 30% în cazul utilizării formei comerciale. Dacă sunt descrise reacții severe, se recomandă concentrații de testare mai mici(54). Testarea patch se recomandă a fi efectuată după 4-6 săptămâni de la rezoluția leziunilor cutanate, după întreruperea terapiei cortizonice sistemice timp de o lună și a celei topice cu o săptămână anterior testării.
Din păcate, rezultate pozitive prin patch test, în evidențierea implicării unui antiretroviral în producerea reacțiilor de HS, s-au obținut doar pentru abacavir. Sensibilitatea testării patch la abacavir este de 87%, astfel încât un test negativ nu exclude diagnosticul de hipersensibilitate(16). În prezent, testul patch pentru abacavir se utilizează doar în trialuri clinice, pentru a crește rata de precizie a diagnosticului pozitiv, nefiind un test diagnostic validat pentru identificarea pacienților naivi care pot urma tratament cu abacavir. Pentru celelalte antiretrovirale, testarea patch și-a dovedit utilitatea diagnostică dacă manifestările prezentate erau severe, de tipul sindrom DRESS sau exantemului pustulos generalizat, și mai puțin în SSJ și TEN(7). Rata de sensibilitate raportată a fost sub 50% și este specifică pentru fiecare antiretroviral în parte(54,57).
Screeningul genetic și-a dovedit eficiența în reducerea reacțiilor de HS induse de abacavir. Testarea anterior începerii tratamentului cu abacavir a redus incidența reacțiilor de HS și a ratei de întrerupere a tratamentului cu abacavir. Această metodă de diagnostic este eficientă mai ales la populația caucaziană, unde prevalența alelei este de 6-8%, și mai puțin importantă în populația afro-americană(58). Valoarea predictivă negativă a testării genetice este de 100% la toate populațiile(7,16). În prezent, screeningul genetic pentru HLA-B*5701 se practică de rutină doar în țările dezvoltate(33,59). Pentru alte antiretrovirale, cum ar fi nevirapina, screeningul genetic nu este util, întrucât există multiple corelații ale alelelor HLA cu diferite fenotipuri și cu rasa pacienților(18).
Managementul reacțiilor de HS este determinat de severitatea acestora. În formele ușoare sau moderate se recomandă antihistaminice H1 și continuarea tratamentului în cele mai multe situații. În formele severe cu afectare de organ (DRESS, SSJ și TEN) se recomandă corticosteroizi – în general, prednison și alte imunosupresoare – și oprirea imediată a antiretroviralului incriminat(7,18).
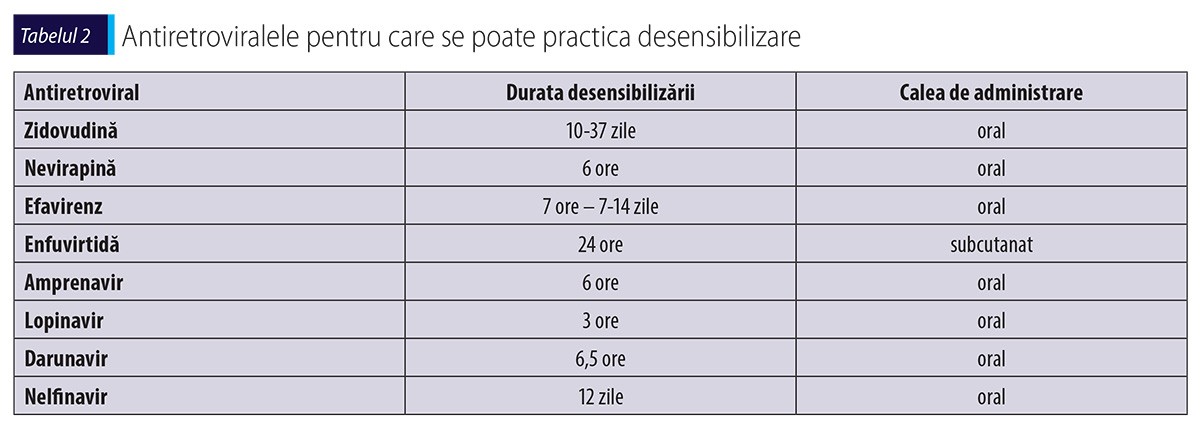
Testul de provocare și desensibilizarea trebuie avute în vedere dacă situația clinică o impune și medicamentul este imperios necesar în schema terapeutică, neexistând alternativă. Testul de provocare se poate face dacă manifestarea de HS a fost ușoară sau moderată, fără interesare sistemică(41,47). Este strict contraindicat în cazul hipersensibilizării la abacavir și în forme severe, cum ar fi SSJ sau TEN induse de alte antiretrovirale. Au fost studiate mai multe protocoale de desensibilizare, cele mai eficiente fiind prezentate în tabelul 2(18,35,50,60).
Întreruperea tuturor antiretroviralelor în vederea efectuării testului de provocare poate cauza rezistență la antiretrovirale, ca urmare a faptului că aceste medicamente au farmacocinetică diferită. De aceea, clinicianul trebuie să știe foarte bine când este necesară întreruperea tratamentului sau când acesta poate fi continuat, precum și situațiile care permit reluarea tratamentului sau înlocuirea antiretroviralului cu un altul asemănător, fără să apară reacții încrucișate. Nu se cunoaște cu exactitate care ar fi intervalul optim de scoatere a antiretroviralelor din schema terapeutică. INNRT au un timp de înjumătățire mai lung și se recomandă întreruperea acestora înaintea INRT cu 4-7 zile, evitând astfel apariția rezistenței la INNRT. Cele mai multe studii au avut în vedere nevirapina, ca INNRT(59). La pacienții care prezintă coinfecție B nu se recomandă întreruperea antiretroviralelor care acționează asupra virusului hepatitic B, deoarece poate apărea insuficiența hepatică acută(7,59).
Concluzii
Reacțiile de HS sunt mai frecvent întâlnite la pacienții cu infecție HIV decât în populația generală. Cercetarea farmacologică și descoperirea unor noi compuși pot crește incidența reacțiilor de HS. Reacțiile de HS observate la pacienții cu infecție HIV pot fi determinate atât de tratamentul antiretroviral, cât și de tratamentul antibiotic și antifungic. Antiviralele determină în general reacții de HS tardive, mediate de limfocitele T. Cercetările recente au stabilit rolul moleculelor HLA în producerea acestor reacții imun mediate. Asocierea hipersensibilității la abacavir cu prezența alelei HLA-B*5701 reprezintă un succes al translaționării cercetării fundamentale în practica clinică.
Din fericire, majoritatea reacțiilor de HS descrise sunt cu localizare cutanată și cu evoluție benignă, uneori autolimitată. Întreruperea imediată a tratamentului incriminat și tratamentul adecvat al reacției de HS sunt esențiale pentru un prognostic bun. Identificarea agentului cauzal este importantă pentru prevenirea unei reexpuneri și pentru utilizarea optimă a antiretroviralelor în schemele terapeutice ulterioare. Desensibilizarea este posibilă și indicată în cazul unor antiretrovirale, când nu există alte posibilități terapeutice.
Bibliografie
- Chinen J, Shearer WT. Secondary immunodeficiencies, including HIV infection. J Allergy Clin Immunol. 2010;125(2 Suppl 2):S195-203.
- Shetty N. Immunology. Introductory textbook. New Age International Publishers, New Dehli, 2005.
- Craig CR, Stitzel RE. Modern pharmacology with clinical application. Lippincott Williams & Wilkins, 2004.
- Bruton LL, Chabner BA, Knollmann BC (ed). Goodman and Gilman’s – The Pharmacological Basis of Therapeutics. 12th edition, Mc Graw Hill International Edition, 2011.
- Demoly P, Adkinson NF, Brockow K, et al. International Consensus on drug allergy. Allergy. 2014;69(4):420–437.
- Uetrecht J, Naisbitt DJ. Idiosyncratic adverse drug reactions: current concepts. Pharmacological reviews. 2013;65(2):779–808.
- Borras-Blasco J, Navarro-Ruiz A, Borras C, et al. Adverse cutaneous reactions associated with the newest antiretroviral drugs in patients with human immunodeficiency virus infection. J Antimicrob Chemother. 2008;62:879–888.
- Pirmohamed M. HIV and drug hypersensitivity. In Pichler WJ. Drug Hypersensitivity. S. Karger AG, Swizerland 2007.
- Manzardo C, Zaccarelli M, Agüero F, et al. Optimal timing and best antiretroviral regimen in treatment-naive HIV-infected individuals with advanced disease. J Acquir Immune Defic Syndr 2007;46 Suppl 1:9-18.
- Coopman SA, Johnson RA, Platt R, Stern RS. Cutaneous disease and drug reactions in HIV infection. N Engl J Med. 1993;328:1670–1674.
- Wheatley LM, Plaut M, Schwaninger JM, et al. Report from the National Institute of Allergy and Infectious Diseases workshop on drug allergy. J Allergy Clin Immunol. 2015;136(2):262-71.e2.
- Milpied-Homsi B, Moran EM, Phillips EJ. Antiviral drug allergy. Immunol Allergy Clin North Am. 2014;34(3):645-62.
- Pichler WJ, Beeler A, Keller M, et al. Pharmacological interaction of drugs with immune receptors: the p-i concept. Allergol Int. 2006; 55:17–25.
- Norcross M, Luo S, Lu L, et al. Abacavir induces loading of novel self-peptides into HLA-B*57: 01: an autoimmune model for HLA-associated drug hypersensitivity. AIDS. 2012;26(11):F21-9.
- Ostrov DA, Grant BJ, Pompeu YA, et al. Drug hypersensitivity caused by alteration of the MHC-presented self-peptide repertoire. Proc Natl Acad Sci USA. 2012;109:9959–64.
- Mallal S, Phillips E, Carosi G, et al. PREDICT-1 Study Team. HLA-B*5701 screening for hypersensitivity to abacavir. N Engl J Med. 2008;358:568–579.
- Hernández-Salazar A, Rosales SP, Rangel-Frausto S, et al. Epidemiology of adverse cutaneous drug reactions. A prospective study in hospitalized patients, Arch Med Res, 2006;37:899-902.
- Yunihastuti E, Widhani A, Karjadi TH. Drug hypersensitivity in human immunodeficiency virus-infected patient: challenging diagnosis and management. Asia Pac Allergy. 2014;4(1):54-67.
- Breathnach SM, Hinter H. Adverse Drug Reactions and the Skin. Oxford Blackwell Scientific Publications, 1992.
- Mockenhaupt M, Viboud C, Dunant A, et al. Stevens-Johnson syndrome and toxic epidermal necrolysis: assessment of medication risks with emphasis on recently marketed drugs. The EuroSCAR-study. J Invest Dermatol. 2008;128:35–44
- Bastuji-Garin S, Rzany B, Stern RS, et al. Clinical classification of cases of toxic epidermal necrolysis, Stevens-Johnson syndrome, and erythema multiforme. Arch Dermatol. 1993;129:92–96.
- Shepherd GM. Hypersensitivity reactions to drugs: evaluation and management. Mt Sinai J Med 2003:70:113-125.
- Roujeau JC. Clinical heterogeneity of drug hypersensitivity. Toxicology 2005;209: 123-129.
- Rivero A, Mira JA, Pineda JA. Liver toxicity induced by non-nucleoside reverse transcriptase inhibitors. J Antimicrob Chemother 2007; 59:342–346.
- Moyle G. The emerging roles of non-nucleoside reverse transcriptase inhibitors in antiretroviral therapy. Drugs. 2001;61(1):19-26.
- Sanne I, Mommeja-Marin H, Hinkle J, et al. Severe hepatotoxicity associated with nevirapine use in HIV-infected subjects. J Infect Dis. 2005;191(6):825-829.
- Johnson S, Chan J, Bennett C. Hepatotoxicity after prophylaxis with a nevirapine-containing antiretroviral regimen. Ann Intern Med 2002; 137: 146-147.
- Nunez M. Clinical syndromes and consequences of antiretroviral-related hepatotoxicity. Hepatology 2010; 52:1143–1155.
- Hetherington S, McGuirk S, Powell G, et al. Hypersensitivity reactions during therapy with the nucleoside reverse transcriptase inhibitor abacavir. Clin Ther. 2001;23:1603–1614.
- Symonds W, Cutrell A, Edwards M, et al. Risk factor analysis of hypersensitivity reactions to abacavir. Clin Ther. 2002;24:565–573.
- Escaut L, Liotier JY, Albengres E, et al. Abacavir rechallenge has to be avoided in case of hypersensitivity reaction. AIDS. 1999;13:1419–1420.
- Wit FW, Wood R, Horban A, et al. Prednisolone does not prevent hypersensitivity reactions in antiretroviral drug regimens containing abacavir with or without nevirapine. AIDS. 2001;15:2423–2429.
- Rauch A, Nolan D, Martin A, et al. Prospective genetic screening decreases the incidence of abacavir hypersensitivity reactions in the Western Australian HIV cohort study. Clin Infect Dis., 2006; 43:99-102.
- Zucman D, Truchis P, Majerholc C, et al. Prospective screening for human leukocyte antigen-B*5701 avoids abacavir hypersensitivity reaction in the ethnically mixed French HIV population, J Acquir Immune Defic Syndr 2007;45;1-3.
- Duque S, de la Puente J, Rodríguez F, et al. Zidovudine-related erythroderma and successful desensitization: a case report. J Allergy Clin Immunol. 1996;98:234–235.
- Lockhart SM, Rathbun RC, Stephens JR, et al. Cutaneous reactions with tenofovir disoproxil fumarate: a report of nine cases, Acquir Immune Defic Syndr 2007; 21:1370-1373.
- Montessori V, Press N, Harris M, et al. Adverse effects of antiretroviral therapy for HIV infection. CMAJ. 2004;170:229–238.
- de Maat MM, ter Heine R, Mulder JW, et al. Incidence and risk factors for nevirapine-associated rash. Eur J Clin Pharmacol. 2003;59:457–462.
- Centers for Disease Control and Prevention (CDC). Serious adverse events attributed to nevirapine regimens for postexposure prophylaxis after HIV exposures--worldwide, 1997-2000. MMWR Morb Mortal Wkly Rep. 2001;49:1153–1156.
- Vitezica ZG, Milpied B, Lonjou C, et al. HLA-DRB1*01 associated with cutaneous hypersensitivity induced by nevirapine and efavirenz, Acquir Immune Defic Syndr, 2008;22:540-541.
- Temesgen Z, Beri G. HIV and drug allergy. Immunol Allergy Clin North Am. 2004;24:521–531.
- Clarke S, Harrington P, Barry M, Mulcahy F. The tolerability of efavirenz after nevirapine-related adverse events. Clin Infect Dis. 2000;31:806–807.
- Manosuthi W, Thongyen S, Chumpathat N, et al. Incidence and risk factors of rash associated with efavirenz in HIV-infected patients with preceding nevirapine-associated rash. HIV Med. 2006;7:378–382.
- Croxtall JD. Etravirine: a review of its use in the management of treatment-experienced patients with HIV-1 infection. Drugs. 2012;72:847–869.
- Molina JM, Clumeck N, Redant K, et al. Rilpivirine vs. efavirenz in HIV-1 patients with baseline viral load 100,000 copies/ml or less: week 48 phase III analysis. AIDS. 2013;27:889–897.
- Schnyder B, Pichler WJ. Allergy to sulfonamides. J Allergy Clin Immunol. 2013;131:256–257.
- Chaponda M, Pirmohamed M. Hypersensitivity reactions to HIV therapy. Br J Clin Pharmacol. 2011;71:659–671.
- Gathe J, Cooper DA, Farthing C et al. Efficacy of the protease inhibitors tipranavir plus ritonavir in treatment-experienced patients: 24-week analysis from the RESIST-1 trial. Clin Infect Dis 2006; 43:1337–1346
- Maggi P, Ladisa N, Cinori E et al. Cutaneous injection site reactions to long-term therapy with enfuvirtide. J Antimicrob Chemother 2004; 53: 678–681.
- Shahar E, Moar C, Pollack S. Successful desensitization of enfuvirtide induced skin hypersensitivity reaction. AIDS 2005;19:451-452.
- Grinsztejn B, Nguyen BY, Katlama C et al. Safety and efficacy of the HIV-1 integrase inhibitor raltegravir (MK-0518) in treatment experienced patients with multidrug-resistant virus: a phase II randomised controlled trial. Lancet 2007; 369: 1261–1269.
- Perry ME, Almaani N, Desai N, et al. Raltegravir-induced Drug Reaction with Eosinophilia and Systemic Symptoms (DRESS) syndrome‑implications for clinical practice and patient safety. Int J STD AIDS. 2013; 24:639–642.
- Walmsley SL, Antela A, Clumeck N, et al. SINGLE Investigators. Dolutegravir plus abacavir-lamivudine for the treatment of HIV-1 infection. N Engl J Med 2013;369:1807-18.
- Shear NH, Milpied B, Bruynzeel DP, Phillips EJ. A review of drug patch testing and implications for HIV clinicians. AIDS. 2008;22(9):999-1007.
- Hernandez J, Cutrell A, Bonny T, et al. Diagnosis of abacavir hypersensitivity reactions among patients not receiving abacavir in two blinded studies. Antivir Ther 2003; 8:L88.
- Barbaud A, Goncalo M, Bruynzeel D, Bircher A. Guidelines for performing skin tests with drugs in the investigation of cutaneous adverse drug reactions. Contact Dermat 2001;45:321–328.
- Phillips EJ, Mallal SA. Pharmacogenetics of drug hypersensitivity. Pharmacogenomics. 2010;11:973–987.
- Phillips EJ, Chung WH, Mockenhaupt M, et al. Drug hypersensitivity: pharmacogenetics and clinical syndromes. J Allergy Clin Immunol 2011;127(3 Suppl):S60-6.
- Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents: developed by the HHS panel on antiretroviral guidelines foradults and adolescents – A Working Group of the Office of AIDS Research Advisory Council (OARAC) [Internet]. Rockville (MD): AIDS info; c2014 [updated 2014 Jan 17; cited 2014 Jan 1]. Available from: http://aidsinfo.nih.gov/ContentFiles/ AdultandAdolescentGL.pdf.
- Marcos Bravo MC, Ocampo Hermida A, Moreno Rodilla E. Hypersensitivity reactions to antiretroviral agents in HIV-infected patients. Med Clin (Barc). 2007;128(2):61-69.

