Recomandări cu privire la vaccinarea copiilor alergici
Recommendations regarding vaccination of allergic children
Abstract
Vaccination plays an essential role in the prevention of infectious diseases worldwide. However, the presence of allergies in children has raised concerns about the safety of vaccine administration. The EAACI guidelines support specialists with concrete recommendations for the assessment and practical approach to these particular categories of children, so that the risks are reduced. Children with sensitization to one of the components of the vaccine are at risk of developing an allergic reaction to the vaccination, but the incidence rate of this type of reaction is low. EAACI recommendations support vaccination of allergic children, given that the benefits of standard and optional immunization outweigh the associated risks.Keywords
vaccinationvaccine safetyallergic childrenEAACI recommendationsRezumat
Vaccinarea joacă un rol esenţial în prevenirea bolilor infecţioase la nivel mondial. Cu toate acestea, prezenţa alergiilor la copii a generat îngrijorări legate de siguranţa administrării vaccinurilor. Ghidurile EAACI vin în sprijinul medicilor specialişti cu recomandări concrete pentru evaluarea şi abordarea practică a acestei categorii speciale de copii, în aşa fel încât riscurile să fie reduse. Copiii cu sensibilizare la unul dintre componentele vaccinurilor prezintă riscul de a dezvolta o reacţie alergică la vaccinare, însă rata de incidenţă a acestui tip de reacţii este scăzută. Recomandările EAACI vin în sprijinul vaccinării copiilor alergici, luând în considerare faptul că beneficiile imunizării standard şi opţionale depăşesc riscurile asociate.Cuvinte Cheie
vaccinaresiguranţă vaccinuricopii alergicirecomandări EAACIIntroducere
Imunizarea copiilor este o măsură indispensabilă de sănătate publică, eficientă în prevenţia bolilor infecţioase. Pacienţii alergici sunt încurajaţi să practice aceleaşi măsuri publice de imunizare ca şi cei nonalergici, cu excepţia cazurilor foarte rare în care riscurile asociate vaccinării depăşesc beneficiile(1).
Alergia la diverse componente regăsite în vaccinuri nu este de neglijat în populaţia pediatrică, întrucât 2,5% dintre aceştia sunt diagnosticaţi cu alergie la ou şi 2,2% cu alergie la proteina laptelui de vacă(2,3,4). Însă evitarea imunizării copiilor prin prisma temerilor nejustificate legate de posibilitatea unei reacţii alergice după administrarea unui vaccin se poate concretiza într-o acoperire incompletă a imunoprofilaxiei, cu riscurile sale consecutive. Deşi reacţiile sistemice severe sunt foarte rare, afectând mai puţin de 1/100000 de persoane, acestea pot fi importante din punctul de vedere al managementului pacientului, copiii cu sensibilizare la un vaccin sau la diverse componente ale acestuia prezentând un risc crescut de reacţie(1). Evaluarea alergologică în cazul acestor copii este de o importanţă semnificativă.
Principalele alergene implicate în reacţiile postvaccinale
Reacţii alergice postvaccinale au fost raportate pentru toate tipurile de vaccinuri, dar reprezintă doar o mică parte din evenimentele adverse survenite după imunizare.
Un istoric dovedit de reacţie alergică severă la unele componente dintr-un vaccin poate fi considerat contraindicaţie pentru primirea dozelor suplimentare din respectivul vaccin(5). Astfel, cunoaşterea tuturor ingredientelor din compoziţia acestuia este crucială pentru identificarea inductorului incriminat într-o reacţie alergică(1).
Componentele unui vaccin includ atât antigenul împotriva căruia se doreşte imunizarea, cât şi alte elemente constitutive, precum stabilizatori, adjuvanţi, conservanţi sau antibiotice utilizate în prevenţia contaminării(1,6). Principalele alergene implicate în reacţiile de hipersensibilitate sunt descrise în amănunt, în următoarele paragrafe(1).
Gelatina utilizată în constituirea vaccinurilor este o proteină hidrolizată parţial, derivată din ţesutul conjunctiv al animalelor de origine bovină sau porcină, fiind inclusă ca stabilizator în mai multe vaccinuri, în concentraţii variate, de la 15 la 155000 µg/doză. S-au raportat anafilaxii postvaccinare atribuite gelatinei după administrarea de vaccinuri împotriva rujeolei, oreionului şi rubeolei (ROR), varicelei, encefalitei sau gripei.
Proteinele din ou, în special ovalbumina reziduală din oul de găină, poate fi prezentă în diferite concentraţii în vaccinul pentru febră galbenă, gripă, ROR, encefalită transmisă de căpuşă şi în unele vaccinuri antirabice, toate acestea fiind preparate în medii cu celule embrionare de ou de găină. Concentraţia proteinelor din ou nu este, de obicei, raportată şi poate varia în funcţie de marca de vaccin, loturi şi protocoalele de cultivare. Concentraţiile de proteină de ou sunt, de obicei, mai crescute la vaccinurile preparate pe ou de găină embrionat (vaccinul pentru gripă, febră galbenă sau rabie) şi sunt mai mici în cazul vaccinurilor obţinute pe culturi de fibroblaşti din embrion de găină (ROR, encefalita transmisă de căpuşe)(7).
Proteinele laptelui de vacă pot fi de asemenea utilizate în concentraţii foarte scăzute ca stabilizatori sau ca emulgatori în unele mărci de vaccinuri împotriva difteriei, tetanosului, pertussis (DTP) şi în vaccinul antipoliomielitic oral (VPO)(1). Unele vaccinuri ar putea conţine proteine din lapte pentru a preveni degradarea virusurilor. De asemenea, s-a raportat că mediile de cultură utilizate pentru vaccinul împotriva Chlostridium tetani, Corynebacterium diphteriae şi Bordetella pertussis ar putea fi suplimentate cu aminoacizi obţinuţi prin hidroliza proteinelor din lapte(7).
Tiomersalul şi fenoxietanolul pot provoca de obicei reacţii locale întârziate, de tipul reacţiilor de contact sau exantemului maculopapulos, fără raportări de cazuri de anafilaxie(1).
Compuşii de aluminiu, precum fosfatul şi hidroxidul de aluminiu, sunt utilizaţi ca adjuvanţi în vaccinuri şi pot induce hipersensibilitate de tip IV. Nodulii subcutanaţi se pot dezvolta şi se remit treptat, dar pot persista o perioadă foarte lungă (chiar ani întregi). Factorul de risc pentru sensibilizarea la vaccinurile cu conţinut de aluminiu pare să fie dependent de doza de aluminiu, de numărul de vaccinuri administrate şi de tipul de compus, întrucât hidroxidul de aluminiu pare să fie mai susceptibil în a induce sensibilizare, faţă de fosfatul de aluminiu(1).
Neomicina şi alte antibiotice, prezente în cantitate foarte scăzută, pot teoretic să inducă anafilaxie la pacienţii sensibilizaţi, însă asocierea sensibilizării la neomicină şi reacţiile IgE-mediate severe la vaccinuri este slab susţinută în literatură, mai frecvente fiind cazurile de dermatită de contact indusă de neomicină(1).
Latexul natural uscat se regăseşte în dopul flacoanelor de vaccin sau în pistonul seringilor şi reprezintă un risc teoretic pentru pacienţii sensibilizaţi la latex. Totuşi, incidenţa evenimentelor severe este scăzută, în literatură fiind raportat un singur caz de anafilaxie cauzat de cauciucul din dopul unui vaccin împotriva hepatitei B. În plus, utilizarea latexului natural în domeniul medical a scăzut treptat, materialul fiind înlocuit cu produşi sintetici, cu alergenicitate scăzută(1).
Proteinele din drojdie (Saccharomyces cerevisiae) pot fi regăsite în vaccinurile împotriva hepatitei B (până la 25 mg/doză), în vaccinurile cu papilomavirus uman (<7 mcg/doză), dar posibil şi în vaccinul conjugat pneumococic, în unele vaccinuri meningococice şi în cele orale împotriva febrei tifoidei(1).
Polietilenglicolul (PEG sau macrogol – E1521) este un excipient care se regăseşte în multe preparate, inclusiv în vaccinurile ARNm COVID-19 (Pfizer/BioNTech şi Moderna). Aceştia sunt produşi solubili în apă, obţinuţi prin polimerizarea oxidului de etilenă cu apa. În formularea medicamentului, termenul „PEG” este utilizat în combinaţie cu o valoare numerică ce indică greutatea moleculară (GM) a acestuia; astfel, până la valoarea de 400 GM reprezintă substanţele lichide, între 1000 şi 2000 GM reprezintă substanţele vâscoase şi peste 3000 reprezintă GM forma solidă. Sensibilizarea la PEG poate fi provocată prin mai multe căi de expunere, inclusiv orală, intramusculară, intraarticulară şi intravenoasă, dar mecanismele imunologice implicate în anafilaxia la PEG şi PS nu sunt pe deplin înţelese(8). Dermatita de contact indusă de PEG pare a fi rară. Într-un studiu care a vizat 309 pacienţi cu ulcere cronice ale picioarelor, doar doi subiecţi au avut test patch pozitiv la PEG(9,10).
Polisorbaţii (PS 80) sunt stabilizatori, solubilizatori şi emulgatori utilizaţi în mod obişnuit în alimente, cosmetice şi în diverse formule de medicamente, fiind astfel expuse populaţiei pe scară largă. Acesta se regăseşte în vaccinul cu vector viral produs de AstraZeneca, dar şi în unele vaccinuri antigripale. S-a sugerat reactivitatea încrucişată între PEG şi PS, pe baza similitudinii lor structurale, ambele fiind polimeri ai oxidului de etilenă(9), însă s-a demonstrat că pacienţii cu sensibilizare la PEG tolerează vaccinul ce conţine PS. De asemenea, au fost raportate reacţii de hipersensibilitate pentru medicamente care conţin agenţi tensioactivi polietoxilati neionici, inclusiv vaccinul papilomavirus uman cu PS 80(10).
EDTA disodic reprezintă un acid poliaminocarboxilic care este conţinut în vaccinul produs de AstraZeneca, dar şi în alimente, în cosmetice şi în alte produse farmaceutice, drept conservanţi şi stabilizatori. Au fost raportate cazuri de dermatită de contact la pacienţii care au folosit produse cosmetice cu EDTA şi soluţie pentru lentilele de contact. Anafilaxia la EDTA este rară, dar a fost raportată la un pacient cu test de activare bazofilică pozitiv la EDTA, cu antecedente de anafilaxie la medii de radiocontrast şi la anestezice locale care conţineau EDTA ca excipient(10).
Tipuri de reacţii adverse asociate vaccinării
În funcţie de momentul apariţiei, reacţiile adverse postvaccinale pot fi imediate sau tardive, iar raportându-ne la localizarea acestora, ele se clasifică în reacţii locale sau sistemice.
Cele mai frecvente reacţii adverse la vaccinuri sunt cele uşoare, locale, precum eritemul, edemul sau durerea, şi cele generale, dintre care reţinem febra, frisonul, cefaleea, mialgiile sau starea de greaţă. Ele nu impun probleme deosebite de management şi sunt adesea autolimitante(11).
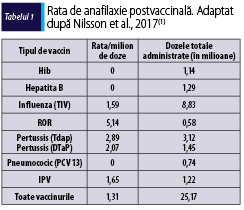
Reacţiile alergice la vaccinuri sunt rare, dar importante din punctul de vedere al managementului pacientului. Incidenţa reacţiilor anafilactice severe la vaccinuri variază între 0,5 şi 1 la 100000 de doze administrate. Mortalitatea prin anafilaxie secundară vaccinării este de aproximativ 1 la 50 de milioane de doze(6).
Reacţiile locale sunt uşoare şi deseori autolimitante. Reacţiile locale extinse sunt mai rare şi de obicei apar după 24-72 de ore de la vaccinare. Locul administrării injecţiei are, de asemenea, un rol important în asocierea cu reacţii locale, injectarea la nivelul braţului prezentând un risc mai mare de reacţie locală decât injectarea la nivelul coapsei(1).
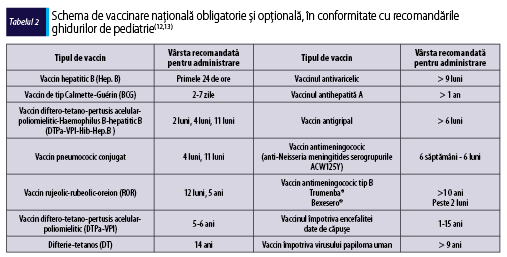
Schema naţională de vaccinare pentru populaţia pediatrică
Vaccinurile obligatorii se efectuează în conformitate cu Calendarul Naţional de Vaccinare, primul vaccin fiind administrat încă din primele zile de viaţă. Vaccinurile obligatorii şi opţionale disponibile în România sunt prezentate în tabelul 2.
Reacţii adverse raportate frecvent, în funcţie de tipul de vaccin
Vaccinul DTPa
Riscul de reacţie de hipersensibilitate imediată sistemică postvaccinare este mic, rata de anafilaxie raportată pentru vaccinul DTPa fiind cuprinsă între 0,9 şi 2 la un milion de doze administrate(14,15). Cazeina, o proteină din laptele de vacă, a fost suspectată drept cauză a reacţiilor anafilactice în imunizarea cu vaccin DTPa la copiii cu valori ridicate ale IgE-urilor specifice pentru laptele de vacă. Urme de cazeină au fost decelate în vaccinuri DTPa preparate în medii derivate din proteinele laptelui de vacă, însă legătura de cauzalitate între prezenţa acestei proteine şi reacţiile alergice raportate nu a fost demonstrată. De asemenea, majoritatea copiilor sensibilizaţi la proteinele laptelui de vacă tolerează administrarea vaccinului DTPa, aşadar nu s-a putut formula o recomandare împotriva vaccinării cu DTPa a copiilor cu acest tip de sensibilizare(16).
Alte studii au raportat existenţa IgE-urilor specifice pentru componentele vaccinului DTPa. Nivelul seric al acestora a fost mai crescut în cazul copiilor atopici, însă este un eveniment tranzitoriu, fiind semnificativ scăzut la vârsta de 2 ani şi jumătate(17).
Vaccinul antigripal
Vaccinul antigripal cu virus inactivat conduce cel mai frecvent la reacţii adverse uşoare, precum durerea la locul de injectare, febră şi mialgii. Acesta este considerat sigur pentru copiii cu astm, un studiu demonstrând lipsa unei creşteri semnificative a exacerbărilor astmatice după vaccinare la copiii cu vârsta de peste 3 ani(18). Vaccinul antigripal cu virus viu atenuat este considerat sigur la copiii cu vârsta cuprinsă între 2 şi 17 ani, cunoscuţi cu astm uşor-moderat, însă datele sunt limitate în ceea ce priveşte copiii cu astm sever(19).
Dacă evaluăm conţinutul în ovalbumină, vaccinul antigripal cu virus inactivat conţine o cantitate scăzută de proteină (<0,12 mcg/ml) şi poate fi administrat în siguranţă copiilor sensibilizaţi la acest alergen. Cantitatea de ovalbumină prezentă în vaccinul antigripal cu virus viu atenuat este mai mare (0,24 mcg în doza de 0,2 ml), însă studiile au arătat că administrarea vaccinului antigripal cu virus viu atenuat nu a condus la reacţii sistemice la copiii alergici la ou şi doar 1,6% au prezentat reacţii uşoare autolimitante. La pacienţii alergici la ou se preferă totuşi administrarea vaccinului injectabil, şi nu a celui intranazal, întrucât acesta din urmă conţine o cantitate mai mare de ovalbumină(7). Ghidurile britanice precizează că alergia la ou nu reprezintă o contraindicaţie pentru vaccinarea cu vaccin antigripal cu virus viu atenuat, decât în cazul în care copilul prezintă în antecedente anafilaxie cu necesitatea internării în secţia de terapie intensivă(1,20).
Vaccinul rujeolic-rubeolic-oreion (ROR)
Administrarea acestui vaccin a fost considerată problematică la copiii cu alergie la ou, deoarece conţine virus viu atenuat produs pe culturi de celule embrionare de ou de găină, putându-se decela urme de ovalbumină în conţinutul vaccinului. Studiile însă nu au demonstrat o creştere a incidenţei reacţiilor de hipersensibilitate pentru acest vaccin, un procentaj foarte mic de copii (1,6%) prezentând o reacţie de tip imediat, dar nicio reacţie ameninţătoare de viaţă(21). În Europa, prevalenţa anafilaxiei datorate imunizării cu ROR a copiilor este estimată la 1,2 cazuri la un milion de doze. În Statele Unite ale Americii a fost estimată o incidenţă de 3,5 cazuri la 1000000 de doze. Interesant este faptul că majoritatea reacţiilor alergice la ROR se observă la pacienţi fără alergie la ou – prin urmare, este probabil ca în aceste cazuri de anafilaxie factorul incriminat să fie o altă componentă a vaccinului - de exemplu, gelatina. Datele disponibile nu indică niciun risc suplimentar pentru copiii alergici la ou comparativ cu cei nonalergici care aleg să efectueze vaccinul ROR(7). Aşadar, copiii alergici la ou pot fi vaccinaţi în siguranţă cu vaccinul ROR în cabinetul medicului de familie sau în ambulatoriu(1).
Vaccinul antipneumococic şi antimeningococic
Aceste vaccinuri nu prezintă contraindicaţii pentru copiii alergici, decât în cazul în care există o sensibilizare documentată la componentele vaccinului sau o reacţie la vaccin în antecedente(1).
Vaccinul BCG
Cele mai multe reacţii postvaccinale în cazul acestui vaccin sunt reacţiile adverse de tip infecţios. Au fost raportate reacţii de hipersensibilitate uşoare, cel mai adesea locale, de tip tumefacţie şi durere la locul injectării sau limfadenită, în timp ce reacţiile sistemice sunt extrem de rare(22).
Vaccinul antihepatitic B
Vaccinul antihepatitic B este produs pe culturi de drojdie de bere, în consecinţă poate conţine antigene reziduale din Saccharomyces cerevisiae. De aceea, s-a considerat că rarele cazuri de anafilaxie raportate după vaccinare au fost cauzate de hipersensibilitatea la drojdia de bere(1).
Vaccinul împotriva febrei galbene
Necesitatea vaccinării împotriva febrei galbene se află într-un plan ascendent, consecutiv creşterii numărului de persoane care călătoresc în zone endemice. Vaccinul împotriva febrei galbene conţine proteină din ou în concentraţie de 0,13-0,61 mcg/ml. Riscul de anafilaxie în acest caz este cuprins între 0,42 şi 1,8/100000 de doze. Au fost însă raportate cazuri ale unor pacienţi alergici la ou care au tolerat administrarea graduală a acestui vaccin, fără dezvoltarea reacţiilor sistemice(23).
Vaccinul anti-HPV
Este un vaccin cu virus inactiv. Cele mai frecvente reacţii adverse sunt febra, cefaleea şi reacţiile locale. Rata de anafilaxie este rară (2,6/100000 de doze), fiind implicată sensibilizarea prealabilă a pacienţilor la unul dintre componentele vaccinului, precum drojdia sau PS 80. În prezent nu este clar dacă pacienţii dezvoltă anticorpi specifici de tip IgE pentru antigenele HPV injectate(24).
Vaccinul împotriva encefalitei induse de căpuşă
Deşi înainte de 1998 riscul unei reacţii sistemice severe era de 1/50000, din cauza poligelinei (o gelatină conţinută în vaccin), rata de anafilaxie a scăzut dramatic în ultimii ani, la 0,08-0,24/100000 de doze, prin înlocuirea gelatinei cu albumina serică umană(25).
Identificarea pacienţilor la risc şi contraindicaţiile acestora pentru imunizare
Identificarea riscului unei reacţii sistemice severe prin consult anterior imunizării este importantă în vederea reducerii incidenţei acestor reacţii. Există foarte puţine situaţii care să contraindice imunizarea. Pacienţii care au prezentat o reacţie sistemică severă la prima administrare a unui vaccin au un risc mai crescut de a prezenta o reacţie severă şi la următoarea administrare a aceluiaşi vaccin şi reprezintă o categorie de pacienţi care ar trebui evaluaţi alergologic înainte de a relua imunizarea. Reacţiile locale de tip întârziat, de obicei cauzate de tiomersal, neomicină sau aluminiu, nu sunt considerate contraindicaţii ale unei administrări ulterioare a aceluiaşi vaccin, deoarece beneficiul imunizării depăşeşte riscul adus de o reacţie locală.
Copiii care au un istoric de o reacţie de hipersensibilitate la unul dintre componentele vaccinului au un risc crescut de a dezvolta o reacţie alergică la imunizare.
Legislaţia Uniunii Europene a stabilit că o concentraţie de 2 µg/ml de proteină de ou este cantitatea maximă permisă, care s-a demonstrat a fi sigură la pacienţii alergici la ou(7). Aşadar, aceşti copii pot primi vaccinul ROR în condiţii standard. Vaccinul antigripal (cu conţinut scăzut în ovalbumină, sub 0,12 mcg/ml) poate fi administrat la pacienţii alergici la ou, fără anafilaxie în antecedente, în condiţii standard. La pacienţii alergici la ou, cu un episod de anafilaxie în istoric, vaccinul antigripal poate fi administrat în doză unică, într-un mediu cu personal medical pregătit în recunoaşterea semnelor anafilaxiei şi cu supraveghere postvaccinală de minimum o oră(1).
Copiii alergici la gelatină ar trebui să fie imunizaţi cu un vaccin care nu conţine gelatină; în caz contrar, se recomandă administrarea în doze fracţionate, după efectuarea unui test cutanat prick.
Pacienţii sensibilizaţi la drojdie pot primi vaccinuri care conţin proteine din drojdie, în urma evaluării alergologice. Medicul specialist alergolog poate lua decizia de a măsura titrul IgE specifice pentru drojdie sau efectuarea de teste cutanate prick şi poate lua decizia de administrare fracţionată a acestor vaccinuri (vaccinul antihepatitic B şi vaccinul împotriva HPV).
Copiii cu alergie la latex vor fi vaccinaţi într-un mediu sigur, evitându-se utilizarea produselor care conţin latex (mănuşi, seringi şi alte materiale medicale), însă, dacă istoricul acestora este sugestiv numai pentru o reacţie de contact la latex, aceştia pot fi vaccinaţi în condiţii standard. Copiii sensibilizaţi la neomicină sau la aluminiu nu au contraindicaţie de vaccinare(6).
O abordare specială o necesită pacienţii cu mastocitoză, care asociază un risc ridicat de degranulare mastocitară nespecifică, unul dintre acestea putând fi reprezentat ca răspuns la diverşi stimuli, inclusiv de procesul de vaccinare. De aceea, se recomandă vaccinarea în doză unică, evitarea administrării mai multor vaccinuri concomitent şi supravegherea medicală de aproximativ 30 de minute postadministrare(1) .
Atopia şi istoricul familial de alergie sau astm nu reprezintă contraindicaţii pentru vaccinare.
Managementul pacienţilor pediatrici cu hipersensibilitate la vaccin
Reacţiile alergice la vaccinuri sunt rare, dar pot pune viaţa în pericol. Toate centrele de vaccinare trebuie să deţină obligatoriu o trusă de urgenţă care include clasele de medicaţie necesare: adrenalină, antihistaminice, corticosteroizi pentru administrare sistemică, beta-2 agonişti inhalatori, posibilitatea de intervenţie rapidă, administrare de oxigen şi acces la defibrilator, pentru pacienţii la risc(1). Există însă posibilitatea frecventă ca pacienţii să poarte eticheta de „alergic” fără a fi documentată sensibilizarea şi, prin lipsa administrării vaccinurilor, să constituie o grupă de risc pentru infecţii severe. În acest context este recomandată evaluarea alergologică la pacienţii care prezintă anafilaxie la administrarea primei doze dintr-un vaccin, pentru determinarea inductorului reacţiei şi pentru stabilirea oportunităţii administrării celei de-a doua doze(5).
Conform recomandărilor europene, în situaţia în care se decelează inductorul reacţiei, pentru doza de rapel va fi ales un vaccin care nu conţine respectivul alergen. În cazul în care acest lucru nu este posibil, revaccinarea se va realiza numai dacă este absolut necesar. Dacă testele cutanate sunt negative, se poate administra o doză fracţionată în două serii, cu administrare la interval de 30 de minute (10% şi, respectiv, 90%). Dacă testele cutanate sunt pozitive, se poate aplica un protocol de desensibilizare cu doze progresiv crescânde, administrate la 15-30 de minute (0,05 ml dintr-o diluţie de 1:10, 0,05 ml, 0,1 ml, 0,15 ml, 0,2 ml, 0,5 ml din vaccinul nediluat). În ambele situaţii se impune abord venos, cu supraveghere de minimum 60 de minute şi posibilitatea de a interveni în cazul unei anafilaxii(1).
Recomandări referitoare la vaccinarea împotriva SARS-CoV-2 a copiilor alergici
Apariţia sindromului respirator acut sever cu coronavirus 2 (SARS-CoV-2) a adus o povară semnificativă asupra sănătăţii publice în întreaga lume. Începând cu aprilie 2022, numărul cazurilor confirmate de boală cu COVID-19 la nivel global au ajuns la jumătate de miliard de persoane(26). Copiii reprezintă aproximativ 20% din cazurile raportate până în primăvara anlui 2021(27). Datele actuale arată că populaţia pediatrică dezvoltă o formă de boală mai puţin severă în comparaţie cu populaţia adultă, însă în mai multe centre din Europa şi din Statele Unite au fost identificate cazuri severe cu evoluţie către sindromul inflamator multisistemic la copii, care au fost asociate cu infecţia cu SARS-CoV-2(27).
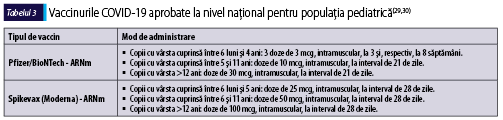
Principalele vaccinuri împotriva COVID-19 recomandate de EMA (European Medicines Agency) sunt prezentate în tabelul 2. FDA (Food and Drug Administration) a autorizat vaccinurile Moderna şi Pfizer-BioNTech împotriva COVID-19 inclusiv pentru copiii cu vârsta de peste 6 luni în Statele Unite. În Europa, EMA a propus, de asemenea, aprobarea utilizării acestor vaccinuri la copiii cu vârsta mai mică de 5 ani(28).
Recomandările actuale ale EAACI susţin efectuarea vaccinului anti-COVID-19 la copiii cu alergii cunoscute la oricare aliment sau medicament, fără legătură cu excipienţii vaccinului, restricţiile actuale referindu-se doar la persoanele cu reacţii severe la prima doză de vaccin sau la excipienţii săi.(26)
Până în momentul de faţă, există puţine date cu privire la reacţiile alergice la copiii cu vaccinuri ARNm. Majoritatea raportărilor referitoare la reacţiile alergice la vaccinul anti-COVID-19 provin de la pacienţi adulţi şi, prin urmare, putem doar extrapola aceste constatări la copiii sub 16 ani(26).
Alergene incriminate în reacţiile alergice induse de un vaccin anti-COVID-19
Principalele molecule implicate în reacţiile alergice la un vaccin anti-COVID-19 sunt PEG şi PS 80. În vaccinurile de tip ARNm utilizate în prezent la populaţia pediatrică se regăseşte PEG, frecvent utilizat ca aditiv, cu o greutate moleculară de 2000 g/mol (PEG 2000), diferită de cea utilizată în preparatele comercializate în prezent.(27)
Riscul unei reacţii postvaccinale cu un vaccin anti-COVID-19
În timp ce publicaţiile iniţiale au arătat că rata reacţiilor alergice imediate induse de vaccinurile anti-SARS-CoV-2 este mare, rata de reactivitate a scăzut semnificativ în primul an de utilizare a vaccinurilor. O metaanaliză din 2021, care a inclus peste 20000 de pacienţi în studii clinice şi peste 500000 de subiecţi din baze de date guvernamentale, a demonstrat că rata de incidenţă a reacţiilor alergice severe imediate la o doză iniţială din oricare tip de vaccin anti-COVID-19 este de 7,91 la un milion de doze administrate(31).
Nu există studii referitoare la reactivitatea imună la cea de-a doua doză de vaccin a persoanelor cu o reacţie la prima doză, care să includă copii mai mici de 16 ani. Studii efectuate la populaţia adultă cu reacţie imediată la primul vaccin ARNm anti-COVID-19 au raportat o rată scăzută de reacţie secundară la acelaşi vaccin. O metaanaliză recentă realizată pe 22 de studii efectuate asupra a 1366 de pacienţi a raportat că riscul repetării unei reacţii alergice imediate la vaccin este de 0,16%, iar în cazurile cu reacţie severă la prima doză, riscul de repetare a anafilaxiei este de 4,95%. Riscul de reacţie imediată nonseveră în rândul populaţiei generale este de 13,6%(32).
Abordarea alergologică pentru vaccinarea anti-COVID-19
În 2021, un grup internaţional multidisciplinar de experţi a elaborat recomandări GRADE cu privire la evaluarea şi gestionarea reacţiilor alergice imediate la vaccinurile ARNm anti-COVID-19, actualizate în 2022. În consecinţă, este recomandată ca posibilă vaccinarea copiilor, în ciuda unei alergii preexistente la excipienţii vaccinului, şi chiar revaccinarea copiilor care au prezentat o reacţie alergică la prima doză de vaccin. Există o recomandare fermă împotriva testării cutanate în prealabil utilizând vaccinul sau componente ale acestuia. În cazul pacienţilor care prezintă o reacţie de tip imediat la administrarea primei doze de vaccin, se recomandă consult alergologic în vederea determinării oportunităţii administrării celei de-a doua doze. De asemenea, aceasta va fi administrată într-un cadru spitalicesc, sub strictă supraveghere a personalului instruit în recunoaşterea şi gestionarea anafilaxiei(26). Nu se recomandă administrarea de rutină a premedicaţiei cu antihistaminice H1 sau corticosteroid sistemic la persoanele cunoscute cu alergii severe sau nonsevere, înainte de administrarea vaccinului împotriva COVID-19(33).
Aşadar, pacienţii pediatrici cu multiple alergii alimentare, inclusiv cu anafilaxie în antecedente la un anumit aliment, cu alergii respiratorii sau alte afecţiuni atopice, nu prezintă un risc mai mare de a dezvolta o reacţie alergică la vaccinurile anti-COVID-19 şi pot efectua vaccinul în orice cadru medical de vaccinare(34).
Concluzii
Copiii cu sensibilizare la unul dintre componentele vaccinurilor prezintă riscul de a dezvolta o reacţie alergică la vaccinare, însă rata de incidenţă a acestui tip de reacţii este scăzută. Sunt necesare identificarea şi evaluarea alergologică a acestor pacienţi pentru a asigura derularea fără incidente a schemelor de imunizare. Anumite precauţii trebuie luate în considerare în cazul pacienţilor cu risc crescut. Recomandările EAACI vin în sprijinul vaccinării copiilor alergici, inclusiv a acelora cu reacţii anafilactice în antecedente, la oricare tip de alergen, alimentar, respirator sau medicamentos, luând în considerare faptul că beneficiile imunizării standard şi opţionale depăşesc riscurile asociate. Aceleaşi măsuri de vaccinare se aplică şi în cazul vaccinului anti-SARS-CoV-2 şi se menţine recomandarea fermă de vaccinare, chiar dacă persoana prezintă o reacţie alergică la doza iniţială de vaccin, cu indicaţia însă de a se face administrarea într-un cadru spitalicesc.
Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
- Nilsson L, Brockow K, Alm J, Cardona V, Caubet JC, Gomes E, Jenmalm MC, Lau S, Netterlid E, Schwarze J, Sheikh A, Storsaeter J, Skevaki C, Terreehorst I, Zanoni G. Vaccination and allergy: EAACI position paper, practical aspects. Pediatr Allergy Immunol. 2017 Nov;28(7):628-640. doi: 10.1111/pai.12762.
- Peters RL, Dharmage SC, Gurrin LC, Koplin JJ, Ponsonby AL, Lowe AJ, Tang ML, Tey D, Robinson M, Hill D, Czech H, Thiele L, Osborne NJ, Allen KJ; HealthNuts study. The natural history and clinical predictors of egg allergy in the first 2 years of life: a prospective, population-based cohort study. J Allergy Clin Immunol. 2014 Feb;133(2):485-91. doi: 10.1016/j.jaci.2013.11.032. Epub 2013 Dec 25. PMID: 24373356.
- Høst A, Halken S, Jacobsen HP, Christensen AE, Herskind AM, Plesner K. Clinical course of cow’s milk protein allergy/intolerance and atopic diseases in childhood. Pediatr Allergy Immunol. 2002;13(s15):23-8. doi: 10.1034/j.1399-3038.13.s.15.7.x. PMID: 12688620.
- Caffarelli C, Giannetti A, Rossi A, Ricci G. Egg Allergy in Children and Weaning Diet. Nutrients. 2022 Apr 7;14(8):1540. doi: 10.3390/nu14081540. PMID: 35458102; PMCID: PMC9025129.
- Kelso JM. Update on vaccination guidelines for allergic children. Expert Rev Vaccines. 2009 Nov;8(11):1541-6. doi: 10.1586/erv.09.107.
- Echeverría-Zudaire LA, Ortigosa-del Castillo L, Alonso-Lebrero E, Álvarez-García FJ, Cortés-Álvarez N, García-Sánchez N, Martorell-Aragonés A. Consensus document on the approach to children with allergic reactions after vaccination or allergy to vaccine components. Allergol Immunopathol (Madr). 2015 May-Jun;43(3):304-25. doi: 10.1016/j.aller.2015.01.004.
- Franceschini F, Bottau P, Caimmi S, Crisafulli G, Lucia L, Peroni D, Saretta F, Vernich M, Povesi Dascola C, Caffarelli C. Vaccination in children with allergy to non active vaccine components. Clin Transl Med. 2015 Feb 14;4:3. doi: 10.1186/s40169-014-0043-0.
- Banerji A, Wolfson AR, Wickner PG, Cogan AS, McMahon AE, Saff R, Robinson LB, Phillips E, Blumenthal KG. COVID-19 Vaccination in Patients with Reported Allergic Reactions: Updated Evidence and Suggested Approach. J Allergy Clin Immunol Pract. 2021 Jun;9(6):2135-2138. doi: 10.1016/j.jaip.2021.03.053.
- Sellaturay P, Gurugama P, Harper V, Dymond T, Ewan P, Nasser S. The Polysorbate containing AstraZeneca COVID-19 vaccine is tolerated by polyethylene glycol (PEG) allergic patients. Clin Exp Allergy. 2022 Jan;52(1):12-17. doi: 10.1111/cea.14064.
- Barbaud A, Garvey LH, Arcolaci A, Brockow K, Mori F, Mayorga C, Bonadonna P, Atanaskovic-Markovic M, Moral L, Zanoni G, Pagani M, Soria A, Jošt M, Caubet JC, Carmo A, Mona AA, Alvarez-Perea A, Bavbek S, Benedetta B, Bilo MB, Blanca-López N, Bogas HG, Buonomo A, Calogiuri G, Carli G, Cernadas J, Cortellini G, Celik G, Demir S, Doña I, Dursun AB, Eberlein B, Faria E, Fernandes B, Garcez T, Garcia-Nunez I, Gawlik R, Gelincik A, Gomes E, Gooi JHC, Grosber M, Gülen T, Hacard F, Hoarau C, Janson C, Johnston SL, Joerg L, Kepil Özdemir S, Klimek L, Košnik M, Kowalski ML, Kuyucu S, Kvedariene V, Laguna JJ, Lombardo C, Marinho S, Merk H, Meucci E, Morisset M, Munoz-Cano R, Murzilli F, Nakonechna A, Popescu FD, Porebski G, Radice A, Regateiro FS, Röckmann H, Romano A, Sargur R, Sastre J, Scherer Hofmeier K, Sedláčková L, Sobotkova M, Terreehorst I, Treudler R, Walusiak-Skorupa J, Wedi B, Wöhrl S, Zidarn M, Zuberbier T, Agache I, Torres MJ. Allergies and COVID-19 vaccines: An ENDA/EAACI Position paper. Allergy. 2022 Aug;77(8):2292-2312. doi: 10.1111/all.15241.
- Dreskin SC, Halsey NA, Kelso JM, Wood RA, Hummell DS, Edwards KM, Caubet JC, Engler RJ, Gold MS, Ponvert C, Demoly P, Sanchez-Borges M, Muraro A, Li JT, Rottem M, Rosenwasser LJ. International Consensus (ICON): allergic reactions to vaccines. World Allergy Organ J. 2016 Sep 16;9(1):32. doi: 10.1186/s40413-016-0120-5.
- Centrul Naţional de Supraveghere şi Control al Bolilor Transmisibile – Calendarul National de Vaccinare. www.cnscbt.ro, www.cnscbt.ro/index.php/calendarul-national-de-vaccinare. Accessed 10 Dec. 2022.
- Burlea M. Recomandări de vaccinare în pediatrie. Bucureşti, Amaltea, 2012.
- McNeil MM, Weintraub ES, Duffy J, Sukumaran L, Jacobsen SJ, Klein NP, Hambidge SJ, Lee GM, Jackson LA, Irving SA, King JP, Kharbanda EO, Bednarczyk RA, DeStefano F. Risk of anaphylaxis after vaccination in children and adults. J Allergy Clin Immunol. 2016 Mar;137(3):868-78. doi: 10.1016/j.jaci.2015.07.048.
- Nakayama T, Onoda K. Vaccine adverse events reported in post-marketing study of the Kitasato Institute from 1994 to 2004. Vaccine. 2007 Jan 5;25(3):570-6. doi: 10.1016/j.vaccine.2006.05.130.
- Wood RA. Allergic reactions to vaccines. Pediatr Allergy Immunol. 2013 Sep;24(6):521-6.
- Nilsson L, Grüber C, Granström M, Björkstén B, Kjellman NI. Pertussis IgE and atopic disease. Allergy. 1998 Dec;53(12):1195-201. doi: 10.1111/j.1398-9995.1998.tb03841.x.
- Cates CJ, Rowe BH. Vaccines for preventing influenza in people with asthma. Cochrane Database Syst Rev. 2013 Feb 28;2013(2):CD000364. doi: 10.1002/14651858.CD000364.pub4. Accessed 10 December 2022.
- Ambrose CS, Dubovsky F, Yi T, Belshe RB, Ashkenazi S. The safety and efficacy of live attenuated influenza vaccine in young children with asthma or prior wheezing. Eur J Clin Microbiol Infect Dis. 2012 Oct;31(10):2549-57. doi: 10.1007/s10096-012-1595-9. Epub 2012 Mar 14. PMID: 22410646; PMCID: PMC3456911.
- Turner PJ, Southern J, Andrews NJ, Miller E, Erlewyn-Lajeunesse M; SNIFFLE-2 Study Investigators. Safety of live attenuated influenza vaccine in young people with egg allergy: multicentre prospective cohort study. BMJ. 2015 Dec 8;351:h6291. doi: 10.1136/bmj.h6291. PMID: 26645895; PMCID: PMC4673102.
- Cronin J, Scorr A, Russell S, McCoy S, Walsh S, O’Sullivan R. A review of a paediatric emergency department vaccination programme for patients at risk of allergy/anaphylaxis. Acta Paediatr. 2012 Sep;101(9):941-5. doi: 10.1111/j.1651-2227.2012.02737.x. Epub 2012 Jun 12. PMID: 22612789.
- Grange JM. Complications of bacille Calmette-Guérin (BCG) vaccination and immunotherapy and their management. Commun Dis Public Health. 1998 Jun;1(2):84-8. PMID: 9644119.
- Rutkowski K, Ewan PW, Nasser SM. Administration of yellow fever vaccine in patients with egg allergy. Int Arch Allergy Immunol. 2013;161(3):274-8. Accessed 10 Apr. 2022.
- Brotherton JM, Gold MS, Kemp AS, McIntyre PB, Burgess MA, Campbell-Lloyd S; New South Wales Health HPV Adverse Events Panel. Anaphylaxis following quadrivalent human papillomavirus vaccination. CMAJ. 2008 Sep 9;179(6):525-33. doi: 10.1503/cmaj.080916. Epub 2008 Sep 1. PMID: 18762618; PMCID: PMC2527382.
- Zent O, Hennig R. Post-marketing surveillance of immediate allergic reactions: polygeline-based versus polygeline-free pediatric TBE vaccine. Vaccine. 2004 Dec 16;23(5):579-84. doi: 10.1016/j.vaccine.2004.07.016. PMID: 15542177.
- Munblit D, Greenhawt M, Brough HA, Pushkareva A, Karimova D, Demidova A, Warner JO, Kalayci O, Sediva A, Untersmayr E, Rodriguez Del Rio P, Vazquez-Ortiz M, Arasi S, Alvaro-Lozano M, Tsabouri S, Galli E, Beken B, Eigenmann PA. Allergic diseases and immunodeficiencies in children, lessons learnt from COVID-19 pandemic by 2022: A statement from the EAACI-section on pediatrics. Pediatr Allergy Immunol. 2022 Oct;33(10):e13851. doi: 10.1111/pai.13851.
- Liotti L, Bianchi A, Bottau P, Caimmi S, Crisafulli G, Franceschini F, Mori F, Paglialunga C, Saretta F, Caffarelli C. COVID-19 Vaccines in Children with Cow’s Milk and Food Allergies. Nutrients. 2021 Jul 30;13(8):2637. doi: 10.3390/nu13082637.
- EMA Recommends Approval of Comirnaty and Spikevax COVID-19 Vaccines for Children from 6 Months Age – European Medicines Agency. European Medicines Agency, 19 Oct. 2022, www.ema.europa.eu/en/news/ema-recommends-approval-comirnaty-spikevax-covid-19-vaccines-children-6-months-age. Accessed 10 Dec. 2022.
- Rezumatul caracteristicilor produsului. www.ema.europa.eu/en/documents/product-information/comirnaty-epar-product-information. Accessed 8 March 2023.
- Rezumatul caracteristicilor produsului. www.ema.europa.eu/en/medicines/human/EPAR/spikevax. Accessed 8 March 2023.
- Gao P, Cai S, Liu Q, Du M, Liu J, Liu M. Effectiveness and Safety of SARS-CoV-2 Vaccines among Children and Adolescents: A Systematic Review and Meta-Analysis. Vaccines (Basel). 2022 Mar 10;10(3):421. doi: 10.3390/vaccines10030421.
- Chu DK, Abrams EM, Golden DBK, Blumenthal KG, Wolfson AR, Stone CA Jr, Krantz MS, Shaker M, Greenhawt M. Risk of Second Allergic Reaction to SARS-CoV-2 Vaccines: A Systematic Review and Meta-analysis. JAMA Intern Med. 2022 Apr 1;182(4):376-385.
- Greenhawt M, Abrams EM, Shaker M, Chu DK, Khan D, Akin C, Alqurashi W, Arkwright P, Baldwin JL, Ben-Shoshan M, Bernstein J, Bingemann T, Blumchen K, Byrne A, Bognanni A, Campbell D, Campbell R, Chagla Z, Chan ES, Chan J, Comberiati P, Dribin TE, Ellis AK, Fleischer DM, Fox A, Frischmeyer-Guerrerio PA, Gagnon R, Grayson MH, Horner CC, Hourihane J, Katelaris CH, Kim H, Kelso JM, Lang D, Ledford D, Levin M, Lieberman J, Loh R, Mack D, Mazer B, Mosnaim G, Munblit D, Mustafa SS, Nanda A, Oppenheimer J, Perrett KP, Ramsey A, Rank M, Robertson K, Sheikh J, Spergel JM, Stukus D, Tang MLK, Tracy JM, Turner PJ, Whalen-Browne A, Wallace D, Wang J, Waserman S, Witry JK, Worm M, Vander Leek TK, Golden DBK. The Risk of Allergic Reaction to SARS-CoV-2 Vaccines and Recommended Evaluation and Management: A Systematic Review, Meta-Analysis, GRADE Assessment, and International Consensus Approach. J Allergy Clin Immunol Pract. 2021 Oct;9(10):3546-3567. doi: 10.1016/j.jaip.2021.06.006.
- Vaccine Advice for Children with Allergies And/or Asthma, 2021/2022 COVID-19 Vaccines. Sept. 2021, www.bsaci.org/wp-content/uploads/2021/10/BSACI-vaccine-recommendations-for-children. Accessed 8 March 2023.