Rolul diagnosticului molecular în anafilaxie
The role of molecular diagnosis in anaphylaxis
Abstract
Anaphylaxis is a severe, potentially fatal allergic reaction, characterized by the acute onset of symptoms involving various systems and organs, and requiring immediate medical intervention. The incidence of anaphylaxis has increased in recent years, and its diagnosis is often delayed or omitted, being confused with asthma or urticaria, which sometimes leads to delayed administration of appropriate treatment with intramuscular adrenaline. Patients treated with new chemotherapeutic agents and humanized monoclonal antibodies show non-classical symptoms of anaphylaxis, and some clonal pathologies of mast cells may lead to confusion with idiopathic or hymenoptera-induced anaphylaxis. This article describes the pathophysiological mechanisms of anaphylaxis, as well as its characteristic phenotypes, endotypes and biomarkers. Updating the knowledge regarding the diagnosis of anaphylaxis will allow the prompt establishment of the diagnosis and the correct management of symptoms, thereby increasing patient’s safety and decreasing morbidity and mortality.Keywords
anaphylaxisbiomarkersendotypephenotypeprecision medicinecomponent-resolved diagnosisfood allergyvenom allergydrug allergymastocytosisRezumat
Anafilaxia reprezintă o reacţie alergică severă, cu potenţial letal, caracterizată prin debutul acut al simptomelor şi care necesită intervenţie medicală imediată. Incidenţa anafilaxiei a crescut în ultimii ani, iar diagnosticul acesteia este frecvent întârziat sau omis, fiind confundată cu astmul sau urticaria, ceea ce duce uneori la întârzierea administrării tratamentului adecvat cu adrenalină intramusculară. Pacienţii trataţi cu noi agenţi chimioterapici şi anticorpi monoclonali umanizaţi prezintă simptome nonclasice de anafilaxie, iar unele patologii clonale ale mastocitelor pot duce la confuzii cu anafilaxia idiopatică sau indusă de himenoptere. În acest articol sunt descrise mecanismele fiziopatologice ale anafilaxiei, precum şi fenotipurile, endotipurile şi biomarkerii caracteristici. Actualizarea cunoştinţelor despre diagnosticul anafilaxiei va permite stabilirea promptă a diagnosticului şi gestionarea corectă a simptomelor, alături de creşterea siguranţei pacienţilor, cu reducerea morbidităţii şi mortalităţii.Cuvinte Cheie
anafilaxiebiomarkeriendotipfenotipmastocitozăalergie alimentarăalergie la veninalergie la medicamenteIntroducere
Anafilaxia reprezintă cea mai severă manifestare clinică a reacţiilor alergice sistemice acute, din cauza asocierii sale cu moartea subită, fie prin colaps cardiovascular, fie prin asfixiere provocată de edemul laringian. Simptomele anafilaxiei pot fi similare celor întâlnite în unele afecţiuni frecvente, precum astmul şi urticaria, iar hipotensiunea poate fi absentă, ceea ce duce la un diagnostic incorect sau întârziat în 80% dintre cazuri. Publicaţiile recente arată o incidenţă globală a anafilaxiei între 50 şi 112 episoade la 100 000 de persoane-ani, în timp ce prevalenţa estimată pe durata vieţii este de 0,3‑5,1%, fiind mai frecventă la sexul feminin. S-a observat faptul că manifestările reapar la 26,5‑54,0% dintre pacienţii cu anafilaxie într-un interval de timp de 1,5 ani până la 25 de ani. În ciuda tendinţei de creştere a timpului de spitalizare din cauza anafilaxiei, mortalitatea rămâne scăzută, fiind estimată la 0,05-0,51 la un milion de persoane/an pentru anafilaxia la medicamente, la 0,03-0,32 pentru anafilaxia la alimente şi la 0,09-0,13 pentru cea indusă de veninurile de himenoptere (Cardona et al., 2020). Anafilaxia poate fi unul dintre cele mai traumatizante evenimente din viaţa unui pacient, cu sechele de lungă durată. Scopul acestui material este de a redefini fenotipurile şi endotipurile anafilaxiei în lumina noilor informaţii din literatura de specialitate, facilitând astfel recunoaşterea simptomelor, gestionarea imediată şi corectă a situaţiei şi luarea celei mai bune decizii pentru a îmbunătăţi calitatea vieţii pacienţilor (Jimenez-Rodriguez et al., 2018).
Anafilaxia – definiţie şi criterii de diagnostic
Anafilaxia reprezintă cea mai severă formă a unei reacţii alergice. În momentul de faţă, în literatura de specialitate sunt folosite diferite definiţii pentru anafilaxie. Definiţiile mai vechi susţin implicarea mai multor organe în această afecţiune, dar observaţii mai recente arată că simptomele severe pot fi prezente doar într-un singur sistem de organe (LoVerde et al., 2017). Mulţi autori definesc anafilaxia drept o reacţie gravă, cu potenţial letal, însă literatura de specialitate indică faptul că evenimentele letale sau aproape letale sunt rare chiar şi atunci când boala nu este tratată corespunzător (Reber et al., 2017). Semnele cutanate sunt absente la 10‑20% dintre cazuri, lucru frecvent întâlnit în anafilaxia fatală, ceea ce poate duce la întârzieri în recunoaşterea ei (Poziomkowska-Gęsicka et al., 2020). Prin urmare, Organizaţia Mondială a Alergiilor (World Allergy Organization; WAO) a propus următoarea definiţie: „Anafilaxia este o reacţie de hipersensibilitate sistemică severă, care are de obicei un debut rapid şi poate provoca moartea. Anafilaxia severă se caracterizează prin afectarea căilor respiratorii, a funcţiei respiratorii şi/sau circulatorii, cu potenţial de a pune viaţa în pericol şi poate apărea fără modificări caracteristice la nivel cutanat sau modificări caracteristice şocului circulator” (Cardona et al., 2020). Criteriile de diagnostic pentru anafilaxie, conform recomandărilor Academiei Europene pentru Alergologie şi Imunologie Clinică din 2021, sunt cele din tabelul 1.

Sistemul WAO de evaluare a reacţiilor alergice sistemice
Sistemul de clasificare WAO, conceput iniţial pentru a clasifica reacţiile sistemice datorate imunoterapiei alergenice, a fost adaptat pentru reacţii sistemice de orice cauză (tabelul 2).
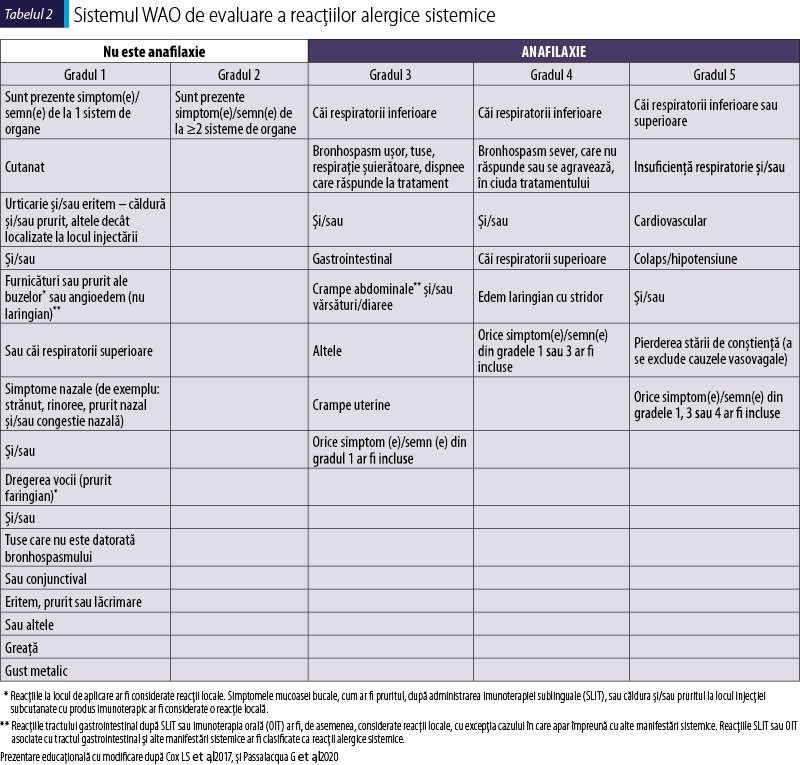
În această clasificare doar gradele 3-5 ar fi în concordanţă cu definiţia anafilaxiei, în timp ce gradele 1-2 reprezintă non‑anafilaxie. În domeniul pediatric pot fi luate în considerare şi unele simptome suplimentare, precum salivarea sau simptomele neurologice (Cardona et al., 2020; Cox et al., 2017). Diagnosticul diferenţial al anafilaxiei include criza de astm, angioedemul localizat, sincopa şi atacurile de anxietate/panică (tabelul 3) (Cardona et al., 2020; Passalacqua et al., 2020).
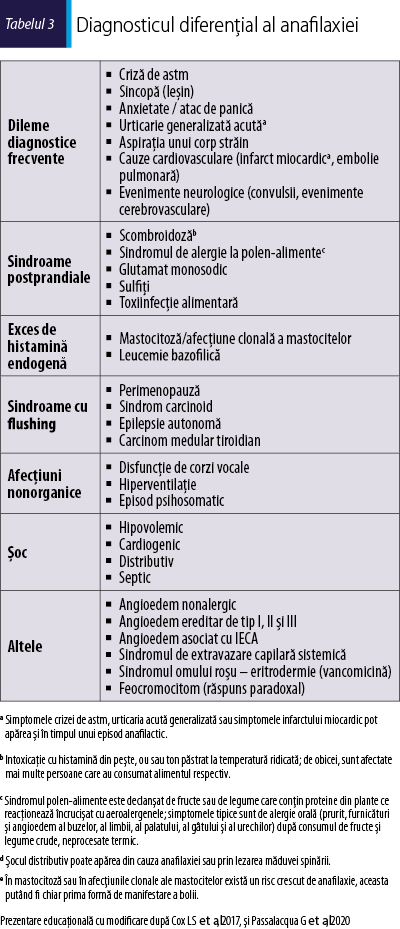
Având în vedere imposibilitatea de a prezice evoluţia manifestării, toate reacţiile anafilactice trebuie tratate cu adrenalină intramusculară, pentru a reduce riscul de deces (Alvarez-Perea et al., 2017).
Factori şi cofactori ai anafilaxiei
Profilul factorilor declanşatori ai anafilaxiei este dependent de vârstă şi variază între diferite zone geografice. Cele mai frecvente grupuri de factori declanşatori la nivel mondial sunt alimentele, veninul de insecte şi medicamentele (figura 1).
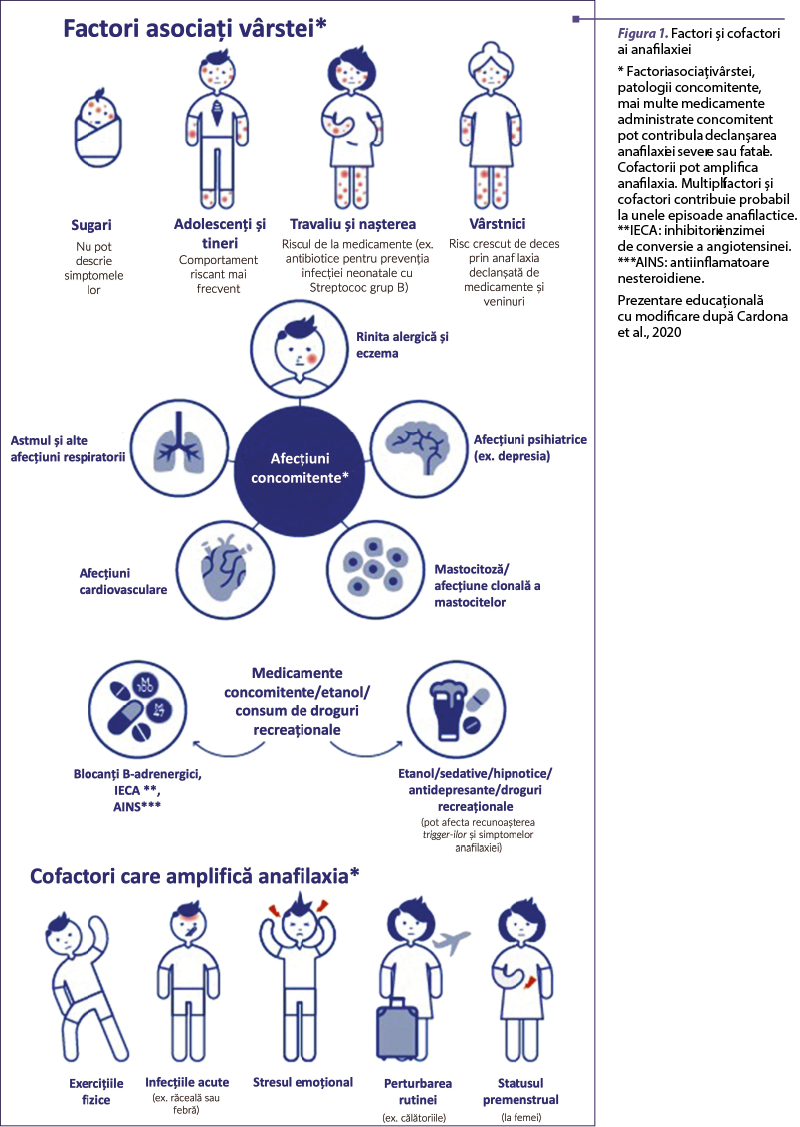
Cei mai frecvenţi factori declanşatori ai anafilaxiei alimentare la copii sunt oul de găină (la sugari şi la preşcolari), laptele de vacă, grâul şi arahidele. Anafilaxia alimentară a pacientului adult variază în funcţie de regiune şi de expunerea la alimentele locale (Conrado et al., 2021). În Europa Centrală, cei mai frecvenţi factori declanşatori ai anafilaxiei alimentare sunt arahidele, nucile, seminţele (susan şi grâu) şi crustaceele. În sudul Europei sunt implicate frecvent alimentele vegetale care conţin proteine de transfer lipidic, frecvent asociate cu cofactori. Anafilaxia indusă de veninuri prezintă la rândul său caracteristici regionale, în funcţie de distribuţia speciilor de himenoptere care o declanşează (Turner et al., 2016). Anafilaxia medicamentoasă este cel mai frecvent declanşată de antibiotice şi antiinflamatoare nesteroidiene (AINS), cu variaţii la nivel mondial în funcţie de vârstă şi de zona geografică (Xing et al., 2018). Principala cauză de deces prin anafilaxie la adulţi este reprezentată de medicamente. Au fost identificate şi substanţe medicamentoase noi implicate în declanşarea reacţiilor anafilactice, precum substanţe biologice care conţin alfa-gal (cetuximab), molecule mici sau chimioterapice noi (olaparib). Acestea pot fi induse de asemenea şi de dezinfectanţi (clorhexidină) sau excipienţi (polietilenglicol, metilceluloză). Alte grupuri de factori declanşatori sunt: latexul din cauciuc natural, lichidul seminal, substanţele de contrast, coloranţii medicali şi o varietate de substanţe utilizate în intervenţiile chirurgicale (suxametoniu, rocuroniu, tiopental, propofol, opioide, protamină, clorhexidină, substituenţii de plasmă). Rezultatul şi severitatea unei reacţii anafilactice nu depind doar de factorul declanşator şi de doza acestuia, ci şi de prezenţa cofactorilor, care pot influenţa debutul şi severitatea reacţiei. De asemenea, tulburările mastocitare ar trebui excluse chiar şi atunci când se găseşte un factor declanşator, mai ales în cazul anafilaxiei induse de înţepăturile de himenoptere (Cardona et al., 2020).
Fiziopatologia anafilaxiei
În 2003, WAO a propus două clasificări ale anafilaxiei pe baza mecanismului fiziopatologic implicat în reacţie. Termenul de „anafilaxie alergică” denotă reacţii mediate de un mecanism imunologic corespunzător căilor clasice de reacţii de hipersensibilitate (RHS) descrise de Gell şi Coombs; termenul de „anafilaxie nonalergică” denotă reacţii mediate de alte mecanisme (de exemplu, activarea directă de către bradikinină sau complement), care sunt de obicei declanşate de agenţi sau de evenimente care induc activarea bruscă a mastocitelor sau a bazofilelor (Jimenez-Rodriguez et al., 2018). Anafilaxia IgE-mediată este considerată mecanismul clasic şi cel mai frecvent; este declanşată de interacţiunea unui alergen (de obicei o proteină) cu complexul IgE alergen specific – receptor de înaltă afinitate (FcεRI) exprimat predominant pe mastocite şi bazofile, urmată de eliberarea mediatorilor de sinteză preformaţi şi de novo. Anafilaxia non-IgE-mediată poate fi imunologică sau nonimunologică. Cele mai relevante mecanisme imunologice non-IgE mediate implicate în anafilaxie sunt activarea sistemului complement (anafilatoxine, C3a şi C5a), sistemul kininelor şi sistemul coagulării, sau anafilaxia IgG-mediată (figura 2) (Kow et al., 2019; Cardona et al., 2020).
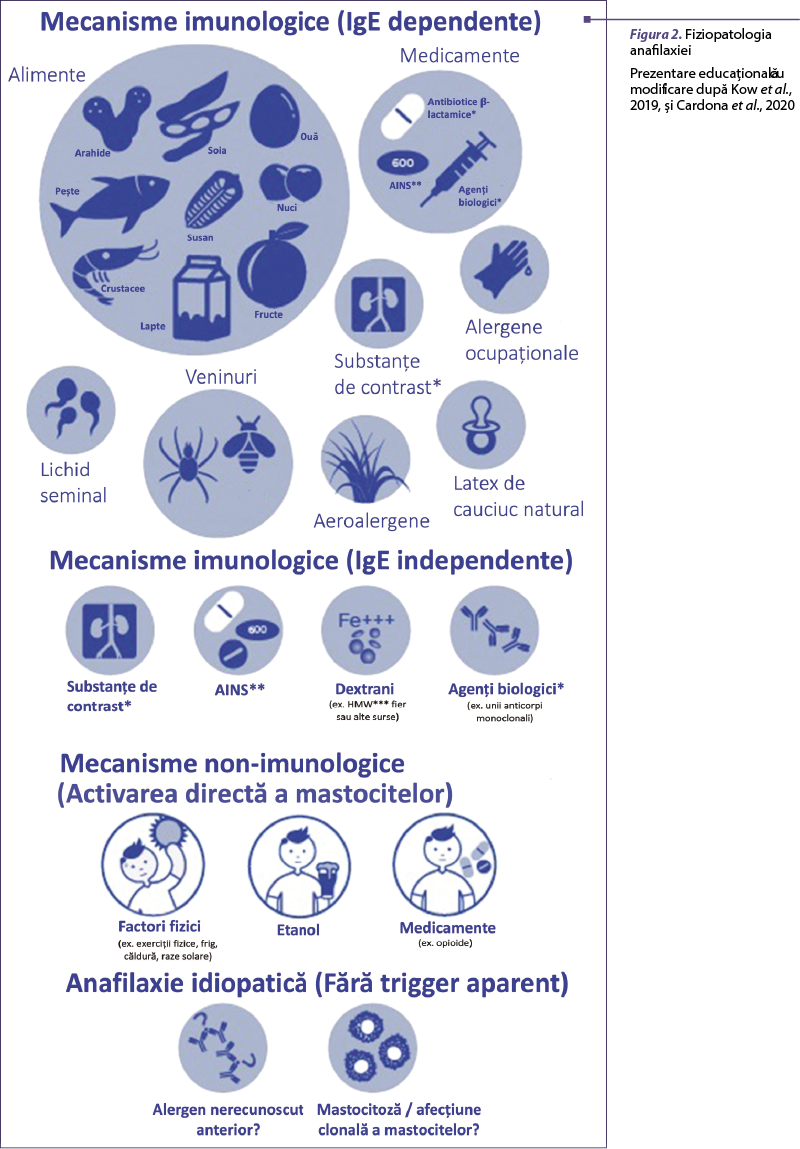
Recent, a fost publicat un document care propune o nouă abordare, bazată pe medicina de precizie, prin intermediul fenotipurilor. Această nouă clasificare cuprinde RHS clasice descrise de Gell şi Coombs, precum şi reacţii în afara clasificării (Jimenez-Rodriguez et al., 2018) (figura 3).
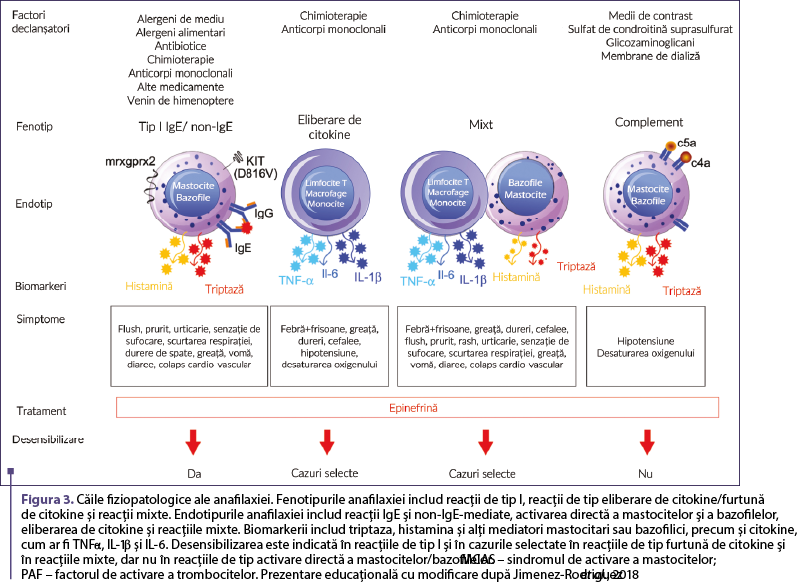
Anafilaxia: fenotipuri, endotipuri şi biomarkeri
Fenotipurile sunt definite prin prezentarea clinică, iar endotipurile se referă la mecanismele celulare şi moleculare ale reacţiilor de hipersensibilitate (RHS) definite de biomarkerii diagnostici (testarea cutanată, triptaza, IgE, interleukina IL-6 şi altele). Fenotipurile anafilaxiei sunt clasificate, după prezentarea lor clinică, în reacţii de tip I, reacţii de eliberare a citokinelor (REC), reacţii mixte şi, în cele din urmă, reacţii de tip bradikinină şi complement (Simionescu et al., 2021). Endotipurile corespunzătoare care stau la baza acestor fenotipuri includ mecanisme IgE şi non-IgE-mediate, mecanisme mediate de citokine, procese mixte şi activarea directă a celulelor imune fie de complement, fie de bradikinină, aşa cum reiese din figura 3 (Jimenez-Rodriguez et al., 2018).
Reacţiile de tip I
Anafilaxia mediată de IgE este mecanismul principal care stă la baza anafilaxiei alergice. Complexul IgE antigen-alergen specific se leagă de receptorul FcεRI de pe mastocite şi/sau bazofile, activează şi degranulează aceste celule, eliberând astfel mediatori preformaţi, enzime şi citokine, facilitând totodată sinteza mediatorilor inflamatori de novo. O cale alternativă similară este cea mediată de complexele IgG, care se leagă de receptorul cu afinitate scăzută (FcγRIII) de pe macrofage, stimulând astfel eliberarea de PAF (în loc de histamină). PAF determină agregarea trombocitelor şi eliberarea de tromboxan A2 şi serotonină, cu puternic efect vasoconstrictor; acţionează direct asupra celulelor endoteliale vasculare pentru a creşte permeabilitatea vasculară; scade debitul cardiac, ceea ce poate produce hipotensiune şi disfuncţii cardiace; şi creşte contracţia musculaturii netede a căilor respiratorii, a intestinului şi a uterului. Anticorpii monoclonali IgG himerici (mAbs), cum ar fi rituximab, s-au dovedit a induce anafilaxie chiar şi în absenţa IgE, sugerând anafilaxie IgG-dependentă (Sawaguchi et al., 2012). Rapoarte recente cu privire la activarea directă a mastocitelor, independentă de cea IgE-mediată, indică faptul că receptorul uman cuplat cu proteina G – MRGPRX2 – poate fi receptorul multor medicamente şi proteine cationice, cum ar fi antibioticele din grupul quinolonelor (de exemplu, ciprofloxacină, levofloxacină), relaxantele musculare (de exemplu, atracuroniu, rocuroniu), icatibantul şi alţi compuşi ai tetrahidroizochinolinei (THIQ). Eliberarea mediatorilor mastocitari şi bazofilici provoacă înroşirea feţei, prurit, urticarie, angioedem, dispnee, wheezing, greaţă, vărsături, diaree, hipotensiune arterială, desaturarea oxigenului şi colaps cardiovascular. Factorii declanşatori comuni pentru aceste reacţii includ alimentele, medicamentele, latexul, veninul de himenoptere şi alergenele din mediu. Cele mai frecvente alergene alimentare sunt arahidele, laptele, ouăle, nucile, crustaceele, fructele şi legumele; antibioticele (β-lactamice), antiinflamatoarele nesteroidiene (AINS), chimioterapicele (platina şi taxanii), anticorpii monoclonali himerici umanizaţi, relaxantele musculare şi produsele imunoterapice reprezintă alergene comune atât la copii, cât şi la adulţi (Jimenez-Rodriguez et al., 2018).
Reacţii de eliberare a citokinelor (REC)
Fenotipul REC este provocat de eliberarea de mediatori proinflamatori, precum factorul de necroză tumorală alfa (TNF-α), IL-1β şi IL-6, iar celulele lor ţintă (endotip) includ monocite, macrofage, mastocite şi alte celule imune cu receptor Fc gama (FcγR) – un participant esenţial în multe funcţii efectoare ale sistemului imunitar, inclusiv eliberarea mediatorilor inflamatori şi citotoxicitatea celulară dependentă de anticorpi. Declanşatorii acestor reacţii includ anticorpii monoclonali himerici, umanizaţi şi umani şi agenţii chimioterapeutici. Simptomele includ frisoane, febră şi durere; acestea răspund la administrarea de ibuprofen şi fluide şi au fost corelate clinic cu concentraţii plasmatice crescute de IL-6. REC-urile nu sunt, de obicei, la fel de severe ca reacţiile de tip furtună de citokine. Reacţiile de tip furtună de citokine reprezintă complicaţii sistemice acute, severe şi potenţial letale datorate producţiei masive de citokine şi chemokine, care joacă un rol patologic în dezvoltarea simptomelor sistemice. IL-6 şi alte citokine inflamatorii, precum IL-8, TNF-α, interferonul gama (IFN-γ) şi IL-1β, induc inactivarea cadherinei, care mediază aderenţa celulară, ceea ce duce la creşterea permeabilităţii capilare şi la extravazare vasculară; de asemenea, induce formarea factorului tisular (tromboplastină) pe suprafaţa monocitelor, cu activarea ulterioară a căii de coagulare extrinsecă. Efectele citokinelor inflamatorii joacă un rol patologic în dezvoltarea durerii, a hipoxiei tisulare, a hipotensiunii arteriale, a disfuncţiei miocardice şi, în cele din urmă, a coagulării intravasculare diseminate (DIC) şi a disfuncţiei multiorganice. IL-6 este un excelent biomarker al reacţiilor de tip furtună de citokine, dată fiind corelaţia sa cu severitatea reacţiei şi longevitatea sa în ser. Acest fenotip se caracterizează prin frisoane, febră şi stare generală de rău, urmate de hipotensiune arterială, desaturare şi colaps cardiovascular. Premedicaţia cu inhibitori antiinflamatori COX-1 şi corticosteroizi poate reduce intensitatea acestor simptome, dar nu protejează de reacţii severe (Jimenez-Rodriguez et al., 2018).
Reacţii mixte (tip I/REC)
Reacţiile mixte apar sub forma unui amestec de fenotipuri de tip I şi REC şi, de obicei, sunt observate în timpul chimioterapiei şi/sau al RHS la anticorpi monoclonali, în care simptomele reacţiilor IgE-mediate (eritem, prurit, urticarie, angioedem, dispnee, wheezing, greaţă, vărsături, diaree, hipotensiune arterială, desaturare, colaps cardiovascular) se suprapun cu simptomele secundare eliberării de citokine şi chemokine proinflamatorii (frisoane, febră, stare generală de rău, hipotensiune arterială, desaturare şi colaps cardiovascular), făcând astfel imposibilă diferenţierea între mecanisme (Jimenez-Rodriguez et al., 2018).
Reacţii asemănătoare cu cele mediate de bradikinină/complement
Aceste reacţii implică activarea directă a mastocitelor şi a altor celule imune prin activarea complementului, precum şi activarea directă şi indirectă a căii intrinseci de coagulare. Complexele imune pot activa sistemul complementului, generând anafilatoxinele C3a şi C5a, care se pot lega de receptorii pentru complement, rezultând în eliberarea de histamină, leucotriene şi prostaglandine, care pot induce înroşirea feţei, urticarie, hipoxie, vasodilataţie şi hipotensiune arterială. Acest mecanism a fost descris pentru vancomicină, substanţe de radiocontrast, membrane de dializă şi medicamente suspendate în anumite vehicule lipidice, precum Cremophor EL, polisorbat 80 şi polietilen glicol. De asemenea, complementul poate avea un rol important în anafilaxia indusă de veninurile de himenoptere, exacerbând reacţia IgE-mediată ca urmare a activării complementului de către proteazele prezente în venin. Calea moleculară a reacţiilor mediate de bradikinină implică o creştere a concentraţiei heparinei şi a sistemului de contact derivat din factorul XII, ceea ce are ca rezultat producerea bradikininei şi creşterea permeabilităţii vasculare (clinic, apar hipotensiune arterială şi desaturare). Aceste simptome au fost asociate cu contaminarea heparinei cu sulfat de condroitină suprasulfatat (Jimenez-Rodriguez et al., 2018).
Rolul biomarkerilor în diagnosticul anafilaxiei
Triptaza
Triptaza este o serin-protează şi cel mai abundent mediator format şi depozitat în mastocitele şi bazofilele umane. Activităţile in vitro ale triptazei mature includ generarea de anafilatoxine ale complementului, inactivarea fibrinogenului, stimularea mai multor tipuri celulare şi amplificarea răspunsului alergic (Jimenez-Rodriguez et al., 2018). Triptaza matură eliberată din mastocite şi bazofile poate fi detectată în ser la câteva minute după simptomele iniţiale ale anafilaxiei. Această creştere este tranzitorie, valorile revenind la normal de obicei în 24 până la 48 de ore. Triptaza prezintă două izoforme, codificate de gene separate şi secretate ca proenzime inactive din mastocitele în repaus: α-protriptaza şi β-protriptaza. Spre deosebire de α-protriptază, β-protriptaza este stocată în forma sa matură în granulele mastocitare şi eliberată după degranularea acestora ca teramer legat de heparină şi sulfat de condroitină. Prin urmare, triptaza serică măsurată în timpul anafilaxiei este reprezentată predominant din izoforma β. Concentraţia serică mai mare de 11,4 ng/ml indică activarea acută a mastocitelor/bazofilelor. Cu toate acestea, pacienţii cu niveluri bazale scăzute ale triptazei pot avea creşteri în timpul anafilaxiei care nu depăşesc intervalul normal (Beck et al., 2019). Specificitatea triptazei este ridicată, dar sensibilitatea sa este redusă, deoarece este eliberată din diferite subseturi de mastocite şi bazofile, în funcţie de factorul declanşator. Nivelurile de triptază sunt mai scăzute în mastocitele din mucoase decât în mastocitele cutanate şi perivasculare, iar reacţiile anafilactice la medicamentele intravenoase pot provoca creşteri mai mari şi mai persistente decât cele provocate de factori declanşatori orali, cum ar fi alimentele (Jimenez-Rodriguez et al., 2018). Nivelurile totale de triptază pot fi crescute (>20 ng/ml) la majoritatea pacienţilor cu mastocitoză sistemică – o tulburare clonală asociată cu mutaţii ale tirozin kinazei membranare; valori crescute se observă şi în alte afecţiuni, cum ar fi tulburări hematologice (leucemie mielocitară acută, sindroame mielodisplazice), tulburări imunologice (sindrom hipereozinofilic), insuficienţă renală severă sau afecţiuni genetice precum triptasemia familială – o boală caracterizată recent, care este asociată cu afectare multisistemică din cauza expresiei a mai mult de două gene de α-triptază (Boehm et al., 2019). Dacă se suspectează anafilaxia, prelevarea de sânge pentru măsurarea triptazei trebuie făcută între primele 30 de minute şi 3 ore de la iniţierea reacţiei, pentru a determina valoarea maximă a triptazei. Creşterile se corelează cu hipotensiunea şi susţin diagnosticul de anafilaxie, deşi nivelurile normale nu exclud diagnosticul (Jimenez-Rodriguez et al., 2018).
Testarea cutanată
Testarea cutanată se poate face în decurs de două până la şase săptămâni după anafilaxie, din cauza pierderii temporare a activităţii cutanate în urma anafilaxiei şi a restaurării complete, care poate dura până la şase săptămâni (Castells, 2017, Jimenez-Rodriguez et al., 2018). Testele cutanate sunt foarte specifice pentru reacţiile de tip I (dovada implicării IgE şi a mastocitelor) la alimente, medicamente (de exemplu, platine, antibiotice β-lactamice, relaxante musculare) şi veninuri de himenoptere. Deoarece extractele actuale pentru testarea cutanată ar putea să nu conţină toate componentele alergenice, după un rezultat negativ al testului cutanat, standardul de aur pentru a demonstra absenţa sensibilizării la alimente şi medicamente este testul de provocare. Testarea cutanată este sigură pentru pacienţii cu antecedente de anafilaxie şi mastocitoză, cu o condiţie: comorbidităţile, cum ar fi astmul, să fie controlate şi administrarea de medicamente, cum ar fi beta‑blocantele şi inhibitorii enzimei de conversie a angiotensinei (IECA), să fie întreruptă înainte de testare (Brockow et al., 2021). Pacienţii cu reacţii asemănătoare furtunii de citokine şi activarea complementului vor avea probabil rezultate negative ale testelor cutanate, ceea ce indică lipsa participării IgE, dar pacienţii cu reacţii mixte pot avea rezultate pozitive la testele cutanate (Jimenez-Rodriguez et al., 2018).
Serologie şi IgE specific
Performanţa diagnostică a demonstraţiei nivelurilor crescute de IgE alergen-specific ar putea fi superioară testelor cutanate, din pricina eterogenităţii, a lipsei de evaluare a potenţei şi a variabilităţii între loturi şi producători de extracte alergenice. Diagnosticul molecular a permis progresul recent în medicina de precizie, prin identificarea anticorpilor IgE specifici direcţionaţi împotriva diferitelor componente (Varney et al., 2019).
IgE specifice pentru medicamente
IgE specifice pentru penicilină au o sensibilitate scăzută, această investigaţie fiind rezervată în prezent pacienţilor cu anafilaxie aproape fatală, la care testarea cutanată poate fi considerată nesigură. S-a demonstrat că IgE specifice pentru platine au o sensibilitate mai mică şi o specificitate mai mare decât testele cutanate. Un avantaj major al IgE specifice pentru platine este capacitatea de a detecta anticorpii IgE la scurt timp după reacţie, fără a fi nevoie de a aştepta câteva săptămâni pentru a determina sensibilizarea prin testele cutanate, această aştepta putând afecta răspunsul la tratamentul oncologic. Un alt avantaj este detectarea reactivităţii încrucişate, care se observă la pacienţii cu IgE specifice pentru carboplatină şi cisplatină, care reacţionează la oxaliplatină (Jimenez-Rodriguez et al., 2018).
Testul de activare a bazofilelor
Evaluarea directă a mastocitelor umane este dificilă, fiind limitată la obţinerea, prin biopsie, a specimenelor de ţesuturi specifice, neexistând mastocite circulante mature. Din acest motiv, bazofilele pot reprezenta un surogat pentru mastocite. Activarea bazofilelor in vitro cu alergene alimentare, venin de himenoptere sau medicamente şi măsurarea markerilor de activare de suprafaţă sau a eliberării mediatorilor (histamină sau leucotriene) se consideră că reflectă sensibilizarea şi activarea mastocitelor tisulare. Testele de activare a bazofilelor cu alergene medicamentoase precum platinele au relevat corelaţii între expresia mai crescută a CD203c, respectiv sensibilizarea CD63 şi severitatea reacţiei (Castells, 2017).
Diagnosticul molecular
Progresele în medicina de precizie au făcut posibilă identificarea şi caracterizarea unor molecule prezente în extractele de alergene, iar acest lucru a dus la utilizarea pe scară tot mai largă a diagnosticului molecular în alergologie, care a revoluţionat înţelegerea profilurilor de sensibilizare şi a reactivităţii încrucişate şi a îmbunătăţit capacitatea de a identifica fenotipuri clinice specifice (Dodd et al., 2021). De asemenea, a permis determinarea riscului relativ al severităţii reacţiilor în cazuri specifice, cum ar fi alergiile la soia, arahide şi alune, precum şi prezicerea severităţii reacţiei alergice – ca în cazul Ara h 1, 2 şi 3, asociate cu anafilaxia indusă de arahide, spre deosebire de pacienţii cu IgE specifice pentru Ara h 8, 9 şi 10, care sunt asociate cu sindromul de alergie orală provocat de reactivitatea încrucişată cu alergenele din polenul unor arbori şi care s-ar putea să nu se încadreze la risc de anafilaxie. Au fost observate, de asemenea, variaţii geografice ale profilului de sensibilizare (Salter et al., 2020). Studiile arată că diagnosticul molecular a oferit o specificitate mai mare, dar o sensibilitate mai scăzută în cazul alimentelor; prin urmare, utilizarea sa este complementară în excluderea unei alergii alimentare. În caz de alergie la himenoptere, acesta a devenit un instrument foarte util pentru a face distincţia între sensibilizarea autentică şi reactivitatea încrucişată, deoarece veninul acestora conţine alergene cu potenţial de reactivitate încrucişată între albină şi viespe, cum ar fi Api m 2 şi Ves v 2 (hialuronidaze), Api m 5 şi Ves v 3 (dipetidilpeptidaze), Api m 12 şi Ves v 6 (vitelogenine) şi alergene specifice pentru veninul albinelor (Api m 1, Api m 3, Api m 4 şi Api m 10), respectiv pentru cel al viespilor (Ves v 1 şi Ves v 5); aceşti markeri permit discriminarea în situaţiile clinice în care pacienţii au un profil de sensibilizări multiple. Diagnosticul molecular este util şi în cazul anafilaxiei alimentare induse de cofactori, al anafilaxiei întârziate la carnea roşie şi al anafilaxiei idiopatice (Kuhlen, 2018).
Concluzii
Anafilaxia este cea mai gravă dintre toate reacţiile alergice, având potenţial letal. Manifestările clinice nu includ întotdeauna modificări la nivelul pielii şi al mucoaselor, iar hipotensiunea şi şocul pot să nu fie prezente, astfel încât diagnosticul ei este întârziat frecvent sau este stabilit eronat ca astm ori urticarie. Diagnosticul de anafilaxie trebuie luat în considerare când apar simptome în două sau mai multe organe
şi/sau modificări bruşte ale semnelor vitale la pacienţii cu sau fără expunere evidentă la alergene. Astfel, pentru a identifica şi trata prompt anafilaxia, un nou sistem de clasificare bazat pe medicina de precizie, folosind fenotipuri, endotipuri şi biomarkeri, a extins clasificarea Gell şi Coombs. Simptomele atipice, precum durerea, frisoanele, rigorul şi febra, au fost recunoscute ca parte a unei noi expresii fenotipice a anafilaxiei în timpul reacţiei la medicamente precum chimioterapice şi anticorpi monoclonali. Nivelul de triptază, detectabil de la 30 de minute până la 3 ore după declanşarea unei reacţii anafilactice, este cel mai bun biomarker în prezent, putând identifica şi pacienţii cu tulburări clonale ale mastocitelor. Valoarea adăugată a diagnosticului molecular în anafilaxie constă în faptul că permite caracterizarea profilului de sensibilizare şi excluderea reactivităţii false la panalergene, precum şi prezicerea riscului asociat cu alergenul incriminat. Extinderea cunoştinţelor cu privire la prezentarea, cauzele şi factorii declanşatori ai anafilaxiei în rândul furnizorilor de servicii medicale va îmbunătăţi diagnosticul şi gestionarea acesteia, va creşte siguranţa pacienţilor şi va reduce morbiditatea şi mortalitatea.
Bibliografie
-
Alvarez-Perea A, Kase Tanno L, Baeza ML. How to manage anaphylaxis in primary care. Clin Transl Allergy. 2017; 7: 45. doi: 10.1186/s13601-017-0182-7. PMID: 29238519
-
Beck SC, Wilding T, Buka RJ, Baretto RL, Huissoon AP, Krishna MT. Biomarkers in Human Anaphylaxis: A Critical Appraisal of Current Evidence and Perspectives. Front Immunol. 2019; 10: 494. doi: 10.3389/fimmu.2019.00494. PMID: 31024519
-
Boehm T, Reiter B, Ristl R, Petroczi K, Sperr W, Stimpfl T, Valent P, Jilma P, Massive release of the histamine‐degrading enzyme diamine oxidase during severe anaphylaxis in mastocytosis patients. Allergy. 2019; 74(3): 583–593. doi: 10.1111/all.13663. PMID: 30418682
-
Boldeanu ES, Avram M, Rezmeriţă L. Sindromul de activare mastocitară, tablou clinic şi criterii de diagnostic. Alergologia Medichub 2021 DOI: 10.26416/Aler.5.1.2021.4445
-
Brockow K, Plata-Nazar K, Lange M, Nedoszytko B, Niedoszytko M, Valent P. Mediator-Related Symptoms and Anaphylaxis in Children with Mastocytosis. Int J Mol Sci. 2021; 22(5): 2684. doi: 10.3390/ijms22052684, PMID: 33799959
-
Cardona V, Ansotegui IJ, Ebisawa M, El-Gamal Y, Fernandez Rivas M, Fineman S, Geller M, Gonzalez-Estrada A, Greenberger PA, Sanchez Borges M, Senna G, Sheikh A, Tanno LK, Thong BY, Turner PJ, Worm M. World allergy organization anaphylaxis guidance 2020. World Allergy Organ J. 2020 Oct 30;13(10):100472. PMID: 33204386. doi: 10.1016/j.waojou.2020.100472.
-
Castells M. Diagnosis and management of anaphylaxis in precision medicine. J Allergy Clin Immunol. 2017 Aug;140(2):321-333. doi: 10.1016/j.jaci.2017.06.012. PMID: 28780940
-
Conrado AB, Ierodiakonou D, Gowland MH, Boyle RJ, Turner PJ. Food anaphylaxis in the United Kingdom: analysis of national data, 1998-2018. BMJ. 2021; 372: n251. doi: 10.1136/bmj.n251. PMID: 33597169
-
Cox LS, Sanchez-Borges M, Lockey RF. World Allergy Organization Systemic Allergic Reaction Grading System: Is a Modification Needed? J Allergy Clin Immunol Pract. 2017; 5(1):58-62.e5. doi: 10.1016/j.jaip.2016.11.009. PMID: 28065342
-
Dodd A, Hughes A, Sargant N, Whyte AF, Soar J, Turnere PJ. Evidence update for the treatment of anaphylaxis. Resuscitation. 2021; 163: 86–96. PMID: 33895231. doi: 10.1016/j.resuscitation.2021.04.010
-
Jimenez-Rodriguez TW, Garcia-Neuer M, Alenazy LA, Castells M. Anaphylaxis in the 21st century: phenotypes, endotypes, and biomarkers. J Asthma Allergy. 2018 Jun 20;11:121-142. doi: 10.2147/JAA.S159411. PMID: 29950872
-
Kow ASF, Chik A, Soo K, Khoo LW, Abas F, Tham CL. Identification of Soluble Mediators in IgG-Mediated Anaphylaxis via Fcγ Receptor: A Meta-Analysis. Front Immunol. 2019; 10: 190. doi: 10.3389/fimmu.2019.00190, PMID: 30809224
-
Kuhlen JL, Virkud YV. Pathogenesis, Newly Recognized Etiologies, and Management of Idiopathic Anaphylaxis. Discov Med; 2015; 19(103): 137–144. PMID: 25725228
-
LoVerde D, Iweala OI, Eginli A, Krishnaswamy G. Anaphylaxis. Chest. 2018; 153(2): 528–543. doi: 10.1016/j.chest.2017.07.033, PMID: 28800865
-
Muraro A, Worm M, Alviani C, Cardona V, DunnGalvin A, Garvey LH, Riggioni C, de Silva D, Angier E, Arasi S, Bellou A. EAACI guideline: Anaphylaxis (2021 update). Allergy. 2021 Aug 3. doi: 10.1111/all.15032, PMID: 34343358
-
Passalacqua G, Bagnasco D, Canonica GW. 30 years of sublingual immunotherapy. Allergy. 2020; 75:1107–1120, doi.org/10.1111/all.14113
-
Poziomkowska-Gęsicka I, Kurek M. Clinical Manifestations and Causes of Anaphylaxis. Analysis of 382 Cases from the Anaphylaxis Registry in West Pomerania Province in Poland. Int J Environ Res Public Health. 2020; 17(8): 2787. doi: 10.3390/ijerph17082787. PMID: 32316622
-
Reber LL, Hernandez JD, Galli SJ. The pathophysiology of anaphylaxis. Allergy Clin Immunol. 2017; 140(2): 335–348. Doi: 10.1016/j.jaci.2017.06.003, PMID: 28780941
-
Salter SM, Marriott RJ, Murray K, Stiles SL, Bailey P, Mullins RJ,. Sanfilippoe FM. Increasing anaphylaxis events in Western Australia identified using four linked administrative datasets. World Allergy Organ J. 2020; 13(11): 100480. doi: 10.1016/j.waojou.2020.100480, PMID: 33294113
-
Sawaguchi M, Tanaka S, Nakatani Y, Harada Y, Mukai K, Matsunaga Y. Role of mast cells and basophils in IgE responses and in allergic airway hyperresponsiveness. J Immunol. 2012; 88:1809–18. doi: 10.4049/jimmunol.1101746, PMID: 22250079
-
Simionescu AA, Stanescu AM, Popescu FD. State-of-the-Art on Biomarkers for Anaphylaxis in Obstetrics. Life (Basel). 2021; 11(9): 870. doi: 10.3390/life11090870. PMID: 34575019
-
Turner PJ, Campbell DE. Epidemiology of severe anaphylaxis: can we use population-based data to understand anaphylaxis? Curr Opin Allergy Clin Immunol. 2016; 16(5): 441–450. doi: 10.1097/ACI.0000000000000305, PMID: 27490124
-
Varney VA, Nicholas A, Warner A, Sumar N. IgE-Mediated Systemic Anaphylaxis And Its Association With Gene Polymorphisms Of ACE, Angiotensinogen And Chymase. J Asthma Allergy. 2019; 12: 343–361. doi: 10.2147/JAA.S213016, PMID: 31632094
-
Xing Y, Zhang H, Sun S, Ma X, Pleasants RA, Tang H, Zheng H, Zhai S, Wang T. Clinical features and treatment of pediatric patients with drug-induced anaphylaxis: a study based on pharmacovigilance data. Jur J Pediatr. 2018; 177(1): 145–154. doi: 10.1007/s00431-017-3048-z, PMID: 29168013





