Proctocolita alergică indusă de proteine alimentare – actualităţi de diagnostic şi tratament
Food protein-induced allergic proctocolitis: update of diagnosis and treatment
Abstract
Food protein-induced allergic proctocolitis (FPIAP) is a benign entity characterized by inflammatory changes of the distal portion of the large intestine, generated by hypersensitivity reactions non-IgE mediated, induced by various food proteins. Cow’s milk proteins are the most commonly incriminated. It typically starts in the first weeks or months of life, with stools containing fresh blood, with or without mucus, in an apparently healthy child. The diagnosis is mostly based on clinical data, although various invasive or noninvasive investigations can be used for the differential diagnosis. Treatment consists of a diet that excludes suspected dietary protein. It is a self-limiting condition, most often the resolution of symptoms occurring around the age of 1-year-old.Keywords
dietary proteinsfresh bloodelimination dietRezumat
Proctocolita alergică indusă de proteine alimentare (PAIPA) este o entitate benignă caracterizată de modificări inflamatorii la nivelul porţiunii distale a intestinului gros, generate de reacţii de hipersensibilitate non-IgE mediate, induse de diverse proteine alimentare. Proteinele laptelui de vacă sunt cel mai frecvent incriminate. PAIPA debutează tipic în primele săptămâni sau luni de viaţă cu scaune care conţin sânge proaspăt, cu sau fără mucus, care apar la un copil aparent sănătos. Diagnosticul se stabileşte în principal pe criterii clinice, metodele actuale de investigare invazive sau neinvazive fiind utile mai ales pentru diagnosticul diferenţial. Tratamentul constă în dieta de excludere a proteinei alimentare suspectate. Este o afecţiune autolimitantă, cel mai adesea rezoluţia simptomatologiei având loc în jurul vârstei de 1 an.Cuvinte Cheie
proteine alimentaresânge proaspătdietă de excludereIntroducere
Numeroase afecţiuni pediatrice gastrointestinale sunt generate de reacţii de hipersensibilitate cu mecanisme imune induse de alimente(1). Proctocolita alergică indusă de proteine alimentare (PAIPA), cunoscută şi sub denumirile de proctocolită alergică (PA), proctocolită eozinofilică sau colită alergică, reprezintă cea mai frecventă cauză de scaune sangvinolente în primii ani de viaţă(2). În ciuda prevalenţei crescute, mecanismul imunopatologic este încă incomplet elucidat(3).
Epidemiologie
Un studiu recent publicat indică o incidenţă a PAIPA de 17%, procentaj care cuprinde cazurile cu sângerare gastrointestinală dovedită. Valoarea înregistrată este mai mare decât alte estimări publicate până acum. Autorii subliniază posibilitatea supradiagnosticării, factorii cauzatori fiind lipsa de confirmare a diagnosticului prin test de provocare sau utilizarea testului de hemoragie ocultă în scaun, în ciuda lipsei de validare a acestuia(4).
Datele privind prevalenţa PAIPA nu sunt numeroase, iar rezultatele obţinute sunt extrem de variabile, ca urmare a diferenţelor metodologice în identificarea cazurilor(4). Se estimează valori între 18% şi 64% în rândul copiilor cu sângerare rectală(5). Trebuie subliniat şi în acest caz faptul că doar 72,4% dintre cazurile suspectate au avut rezultat pozitiv la testul de provocare orală desfăşurat între două şi trei luni de la excluderea din dietă a proteinei incriminate. Aşadar, fără efectuarea testării, prevalenţa poate fi supraestimată(6).
PAIPA debutează cu precădere la copiii cu vârstă mai mică de 6 luni. Cei mai mulţi sunt diagnosticaţi în jurul vârstei de 2 luni. Au fost descrise cazuri rare de PAIPA la copii mai mari (cu vârste de peste 1,5 sau 2 ani) sau chiar la adulţi(4,2). De asemenea, a fost înregistrată o uşoară predominanţă în rândul copiilor de sex masculin (61,6%)(6).
Patogeneză
PAIPA face parte din categoria alergiilor alimentare non-IgE mediate, celulele T având un rol important în medierea reacţiei(3). În ciuda varietăţii extrem de mari a proteinelor alimentare la care este expus constant tractul gastrointestinal, alergiile alimentare apar ca o excepţie, şi nu ca o regulă, ca urmare a instalării toleranţei orale faţă de antigenele alimentare(7). În procesul de obţinere a toleranţei imunologice, limfocitele reglatorii Th3, care sunt limfocite T CD4 cu fenotip similar limfocitelor T reglatorii convenţionale, ambele produc TGF-β şi IL-10, dar limfocitele Th3 sintetizează şi IL-4. Celulele Th3 se dezvoltă din limfocite T CD4 naive sub acţiunea TGF-β şi au rol important în inducerea toleranţei orale faţă de antigene non-self. Se consideră că flora comensală a tractului gastrointestinal este de asemenea implicată în generarea acestor celule. Ca urmare, administrarea de probiotice nou-născuţilor potenţial atopici ar putea preveni sensibilizarea. Datele obţinute din studii indică, în cazul copiilor cu alergii alimentare multiple, un deficit în a produce numărul normal de limfocite tolerogene, fapt care se traduce prin lipsa de dezvoltare a toleranţei orale şi apariţia sensibilizărilor la alergene alimentare(8). Acest fenomen pare a fi important şi în apariţia PAIPA.
Au fost înregistrate date privind activitatea diverselor citokine în patogeneza PAIPA. TNF-α (tumor necrosis factor-α), moleculă care alterează joncţiunile intercelulare şi afectează bariera intestinală, prezintă niveluri crescute în biopsiile de mucoasă colonică ale copiilor cu PAIPA. De asemenea, TGF-β a înregistrat niveluri semnificativ scăzute în mucoasa duodenală a copiilor de vârstă mai mare diagnosticaţi cu PAIPA(2).
Deşi există ipoteze, mecanismul prin care proteinele alimentare induc inflamaţie doar la nivelul colonului distal este necunoscut(9). O caracteristică definitorie a PAIPA este prezenţa infiltratelor eozinofilice dense la nivelul mucoasei intestinale, cu precădere în lamina propria(10). Este bine cunoscută implicarea eozinofilelor atât în generarea inflamaţiei, cât şi în răspunsurile imune înnăscute şi adaptative, prin interacţiunile stabilite cu limfocitele T şi celulele prezentatoare de antigen, dar şi prin intermediul numeroşilor mediatori preformaţi sau nou sintetizaţi pe care îi eliberează(9,11).
Factori alimentari declanşatori
Alimentele care provoacă PAIPA pot varia în funcţie de tipul de alimentare a sugarului, exceptând laptele de vacă (60-100% dintre pacienţii implicaţi în studii PAIPA), cel mai frecvent trigger pentru PAIPA, indiferent de tipul de alimentare (alăptare/formule de lapte)(5,11).
Aproximativ jumătate dintre pacienţii care dezvoltă PAIPA sunt alimentaţi exclusiv cu lapte matern şi dezvoltă simptome prin trecerea alergenelor din alimentaţia mamei în lapte(5,12).
Alte alimente care pot provoca PAIPA sunt soia (5‑6%; din formulă pe bază de soia), oul (15‑16%), grâul (7%) şi porumbul (2‑5%; prin laptele matern). Aproximativ 8% dintre pacienţi prezintă triggeri alimentari multipli(1,5,11,12).
Date clinice
Principalele manifestări clinice menţionate în studii sunt prezenţa striurilor de sânge şi mucus, cu scaune normal formate sau cu consistenţă uşor scăzută şi, mai rar, meteorism, dureri abdominale, vărsături intermitente şi tranzit intestinal încetinit, dificil sau dureros(5,11).
Majoritatea pacienţilor cu PAIPA au o stare generală bună, fără alterarea dispoziţiei, şi un examen clinic normal, fără stagnare staturală sau ponderală(5,11,12).
Diagnostic
Diagnosticul PAIPA are la bază istoricul de sângerare rectală, excluderea infecţiilor şi a altor cauze de sângerare rectală şi răspunsul la o dietă de eliminare, care de obicei duce la o rezolvare clinică a sângerării macroscopice în decurs de 72-96 de ore şi la reapariţia simptomelor după testul de provocare orală. Pierderile oculte de sânge pot persista mai mult timp. Documentele de referinţă cu privire la diagnosticul acestei afecţiuni nu recomandă testarea cutanată prick sau patch, dozarea IgE (exceptând situaţia în care pacientul asociază dermatită atopică sau alte manifestări atopice) sau a altor biomarkeri, precum IgG şi IgG4, întrucât valoarea lor diagnostică în alergiile mediate non-IgE nu este suficient de bine studiată(6,13,14).
Testarea hemoragiilor oculte din scaun reprezintă o metodă neinvazivă care pune în evidenţă sângerarea rectală secundară proctocolitei alergice, cu o sensibilitate înaltă (84%), dar specificitate redusă (66%). Prin urmare nu este recomandată de rutină în stabilirea acestui diagnostic(15). Detectarea prezenţei granulelor eozinofilice în materiile fecale este o altă metodă de diagnostic cu specificitate redusă, care nu poate realiza o diferenţiere clară între proctocolita şi enterocolita alergică sau alte tipuri de colită nespecifică(16). Calprotectina fetală cu valori crescute indică prezenţa inflamaţiei la nivelul mucoasei intestinale sau a sângerării pe tractul gastrointestinal, fără să poată preciza mecanismul sau cauza inflamaţiei şi, din acest motiv, dozarea ei de rutină nu este recomandată(11,17).
Ecografia şi ecografia Doppler color pot demonstra prezenţa inflamaţiei la nivelul colonului când suspiciunea clinică a fost ridicată. Se pot identifica o vascularizaţie mai abundentă şi pereţi intestinali îngroşaţi(11).
Investigaţiile invazive pot fi necesare pentru excluderea diagnosticelor diferenţiale, când elementele clinice nespecifice nu permit acest lucru. Sigmoidoscopia şi colonoscopia vor arăta leziuni nespecifice, precum eritem focal cu pierderea desenului vascular, ulceraţii sau nodularitate difuză, iar biopsia demonstrează prezenţa infiltratului eozinofilic la nivelul mucoasei intestinale şi al laminei proprii(18).
Diagnostic diferenţial
Diferenţierea PAIPA se face într-o primă etapă de restul cauzelor de sângerare rectală. Cele mai importante sunt:
infecţiile gastrointestinale – trebuie luate în considerare când tabloul clinic include febră, dureri abdominale şi tenesme, în prezenţa unui context epidemiologic;
fisurile anale – cea mai frecventă cauză de hemoragie rectală la pacienţii cu vârsta mai mică de 1 an; examenul clinic stabileşte diagnosticul, iar tratarea constipaţiei duce la ameliorarea patologiei;
invaginaţia intestinală – manifestată prin dureri abdominale severe cu debut brusc, crampe progresive, asociate cu poziţie de flexie a picioarelor pe abdomen şi, uneori, cu letargie;
diverticulul Meckel (anomalie involutivă a canalului omfalo-mezenteric) – caracterizat prin hemoragii rectale nedureroase, la un copil aparent sănătos, deseori asimptomatic, sub vârsta de 6 luni;
enterocolita şi enteropatia alergică induse de proteine alimentare, alte forme de alergie mediată non-IgE se pot manifesta de asemenea prin sângerare rectală, însă sunt asociate cu manifestări clinice variate, precum stagnare ponderală consecutivă malabsorbţiei, vărsături incoercibile, cu sau fără diaree şi deshidratare, până la şoc hipovolemic(3,12).
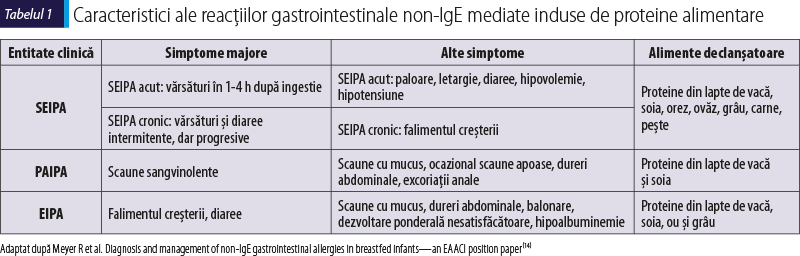
Alte patologii luate în considerare pentru realizarea diagnosticului diferenţial pot fi:
gastroenterita eozinofilică, fiind caracterizată prin inflamaţie cu infiltrat eozinofilic la nivelul pereţilor tractului gastrointestinal;
enterocolita necrotizantă, manifestată clinic în prima lună de viaţă, la sugarii cu boală preexistentă.
Diagnosticul diferenţial al PAIPA poate include, de asemenea, alergiile alimentare mediate IgE, asociate frecvent cu vărsături, diaree, dureri abdominale şi erupţii cutanate, urticarie, dificultăţi de respiraţie, simptome debutate în câteva minute după ingestia alergenului sensibilizant. Hemoragia rectală apare cu o frecvenţă redusă în aceste cazuri(12).
Tratament
Tratamentul actual în PAIPA este reprezentat de excluderea din dieta mamei (copil alăptat la sân) sau a sugarului (copil hrănit cu formulă) a proteinelor alimentare incriminate în declanşarea patologiei.
Pentru sugarul alăptat la sân, primul aliment exclus din dieta mamei va fi laptele de vacă, inclusiv produsele derivate din lapte. Recomandarea actuală este eliminarea tuturor tipurilor de lapte de mamifer, din cauza posibilei reactivităţi încrucişate(11,12). Alternativa terapeutică o reprezintă formulele de lapte praf extensiv hidrolizat sau pe bază de aminoacizi(10). În majoritatea cazurilor, hematochezia dispare sub dieta empirică în primele 72-96 de ore, fiind recomandată reexpunerea la aliment pentru clarificarea diagnosticului. Apariţia simptomelor obligă la introducerea dietei de eliminare a alimentului minimum trei luni(11). Dacă simptomatologia sub dietă persistă mai mult de două săptămâni, se va reevalua dieta mamei, pentru a certifica excluderea completă a surselor de proteine din laptele de vacă. În caz de persistenţă a simptomelor, este recomandată, de asemenea, excluderea proteinelor din soia (posibilă cosensibilizare 10‑40%) şi ulterior a proteinelor din oul de pasăre din dieta mamei. Dacă simptomele nu se remit, este utilă hrănirea cu o formulă de lapte praf pe bază de aminoacizi(10,11). Pentru sugarii cu simptomatologie severă se recomandă de primă intenţie formula de lapte praf pe bază de aminoacizi 3-5 zile, timp în care mama îşi va pompa şi arunca laptele, urmând să se poată relua alăptarea sub dietă de excludere. Pentru sugarii cu simptomatologie uşoară/intermitentă sub dietă de eliminare, se poate alege continuarea alăptării sau trecerea pe formule de lapte praf extensiv hidrolizat sau pe bază de aminoacizi. Prima opţiune prezintă un risc mic de a dezvolta complicaţii (de exemplu, anemie) şi o posibilitate mare ca sugarul să devină asimptomatic după 6 luni. Ca terapie adjuvantă, se pot administra enzime pancreatice(12,19).
Varianta de tratament pentru copiii hrăniţi exclusiv cu lapte praf va fi trecerea pe o formulă extensiv hidrolizată. Chiar dacă aceasta poate modifica culoarea şi consistenţa scaunelor la mulţi sugari, se continuă tratamentul. Aproximativ 5% dintre sugarii cu PAIPA nu răspund la formula extensiv hidrolizată, fiind necesară trecerea pe formule de lapte praf pe bază de aminoacizi(12). Studii limitate sugerează că suplimentarea cu probiotic Lactobacillus rhamnosus GG poate aduce beneficii privind recuperarea şi obţinerea toleranţei alimentare(20). Durata dietei de excludere va fi de 6-12 luni. Nu se indică reintroducerea alimentului mai devreme de 6 luni, din cauza riscului crescut de hematochezie(11).
În strategia terapeutică se va ţine cont de durata hematocheziei, astfel: sub o lună, se aşteaptă rezoluţia spontană fără dietă de eliminare; peste o lună, se adoptă dieta de excludere, cu paşii discutaţi anterior. De asemenea, se va ţine cont şi de patologia asociată, care poate influenţa managementul terapeutic (de exemplu, dermatita atopică)(21,22).
Reintroducerea alimentului în dietă, în majoritatea cazurilor, se face la vârsta de 1 an. Cantitatea reintrodusă treptat în dieta mamei va fi de 30 ml de lapte de vacă sau un produs lactat echivalent, crescând zilnic doza cu 30 ml, timp de cinci zile. Sugarii trataţi cu formulă de lapte extensiv hidrolizat vor trece pe formulă de lapte din proteine din lapte de vacă sau soia. Cei care au fost trataţi cu formulă de lapte pe bază de aminoacizi vor trece timp de două luni pe formulă de lapte extensiv hidrolizat şi apoi se vor reintroduce în dietă 30 ml formulă de lapte cu proteine din laptele de vacă la formula de lapte extensiv hidrolizat, crescându-se doza la 2-3 zile cu încă 30 de ml, până va ajunge să consume o cantitate întreagă de formulă cu proteine din laptele de vacă. În timpul reintroducerii se urmăresc eventuale schimbări clinice, cum ar fi apariţia de scaune cu sânge, diaree, vărsături şi iritabilitate. Dacă reintroducerea laptelui de vacă a eşuat, atunci se va încerca introducerea lui sub formă bine preparată termic (la cuptor). Reapariţia simptomelor de PAIPA impune reluarea dietei de restricţie încă şase luni, cu posibilitatea de a reintroduce alimentul după acest interval de timp(10-12).
Prognosticul PAIPA este favorabil, toleranţa alimentară în majoritatea cazurilor fiind obţinută la vârsta de 1 an, cu posibilitate de extindere la 18 luni – 8 ani în anumite cazuri(11,22). Extrem de rar, PAIPA poate progresa către o alergie alimentară persistentă sau o colită cronică (boală inflamatorie intestinală). PAIPA cu simptomatologie severă (anemie feriprivă, hematochezie de lungă durată) poate fi un factor de risc pentru dezvoltarea patologiilor gastrointestinale funcţionale până la vârsta de 4 ani(23).
Concluzii
PAIPA este o patologie frecvent întâlnită în practica clinică a gastroenterologiei pediatrice şi a alergologiei pediatrice. În prezent, diagnosticul se pune pe baza tabloului clinic, iar tratamentul constă în eliminarea proteinelor alimentare din dieta mamei şi/sau a sugarului. Sunt necesare studii suplimentare pentru a clarifica mecanismul fiziopatologic şi pentru îmbunătăţi diagnosticarea patologiei şi managementul terapeutic al acesteia.
Abrevieri:
PAIPA – proctocolită alergică indusă de proteinele alimentare;
FPIAP – Food Protein-Induced Allergic Proctocolitis.
Bibliografie
-
Sánchez-Salguero CA. Food Protein-Induced Proctocolitis. The shadow of allergic disorders. Allergologia et Immunopathologia, 2018;46(1), 1–2.
-
Ozen A, Gulcan EM, Saricoban HE, Ozkan F, Cengizlier R. Food Protein-Induced Non-Immunoglobulin E-Mediated Allergic Colitis in Infants and Older Children: What Cytokines Are Involved? International Archives of Allergy and Immunology. 2015;168(1), 61–68.
-
Boné J, Claver Á, Guallar I, Plaza AM. Allergic proctocolitis, food-induced enterocolitis: immune mechanisms, diagnosis and treatment. Allergologia et Immunopathologia. 2009;37(1), 36–42.
-
Martin VM, Virkud YV, Seay H, Hickey A, Ndahayo R, Rosow R, Southwick C, Elkort M, Gupta B, Kramer E, Pronchick T, Reuter S, Keet C, Su KW, Shreffler WG, Yuan Q. Prospective Assessment of Pediatrician-Diagnosed Food Protein–Induced Allergic Proctocolitis by Gross or Occult Blood. Journal of Allergy and Clinical Immunology: In Practice. 2020;8(5), 1692-1699.
-
Chebar Lozinsky A, de Morais M. Eosinophilic colitis in infants. Jornal de Pediatria, 2014, 90 (1), 16-21.
-
Gonzaga TA, Alves FA, Cheik MFA, de Barros CP, Rezende ERMA, Segundo GRS. Low efficacy of atopy patch test in predicting tolerance development in non-IgE-mediated cow’s milk allergy. Allergologia et Immunopathologia. 2018;46(3), 241–246.
-
Chehade M, Mayer L. Oral tolerance and its relation to food hypersensitivities. Journal of Allergy and Clinical Immunology. 2005;115(1), 3-12
-
Pérez-Machado MA, Ashwood P, Thomson MA, Latcham F, Sim R, Walker-Smith JA, Murch SH. Reduced transforming growth factor-beta1-producing T cells in the duodenal mucosa of children with food allergy. Eur J Immunol. 2003;33(8), 2307- 2315.
-
Lake AM. Food-Induced Eosinophilic Proctocolitis. Journal of Pediatric Gastroenterology and Nutrition. 2000;30(1), S58-S60.
-
Labrosse R, Graham F, Caubet JC. Non-IgE-mediated gastrointestinal food allergies in children: An update. Nutrients. 2020;12(7), 1–28.
-
Mennini M, Fiocchi AG, Cafarotti A, Montesano M, Mauro A, Villa MP, Di Nardo G. Food protein-induced allergic proctocolitis in infants: Literature review and proposal of a management protocol. World Allergy Organization Journal. 2020;13(10), 100471.
-
Llacouras C. Food protein-induced allergic proctocolitis of infancy. UpToDate. 2019;1–18.
-
Bock SA. AAAAI support of the EAACI position paper on IgG4. J Allergy Clin Immunol. 2010;125(6), 1410.
-
Nowak-Węgrzyn A. Food protein-induced enterocolitis syndrome and allergic proctocolitis. Allergy and Asthma Proceedings. 2015;36(3), 172–184.
-
Concha S, Cabalin C, Iturriaga C, et al. [Diagnostic validity of fecal occult blood test in infants with food protein-induced allergic proctocolitis]. Rev Chil Pediatr. 2018;89(5), 630–637.
-
Chang JW, Wu TC, Wang KS, Huang IF, Huang B, Yu IT. Colon mucosal pathology in infants under three months of age with diarrhea disorders. J Pediatr Gastroenterol Nutr. 2002;35(3), 387–390.
-
Savino F, Castagno E, Viola S. Fecal calprotectin in infants with presumptive allergic colitis. J Pediatr. 2010;157(1), 174‑175.
-
Diaz Del Arco C, Taxonera C, Olivares D, Fernandez Acenero MJ. Eosinophilic colitis: case series and literature review. Pathol Res Pract. 2018;214, 100‑104.
-
Bunik M, Chantry CJ, Howard CR, Lawrence RA, Marinelli KA, Noble L, Powers NG, Taylor JS. ABM clinical protocol #24: Allergic proctocolitis in the exclusively breastfed infant. Breastfeeding Medicine. 2011;6(6), 435‑440.
-
Qamer S, Deshmukh M, Patole S. Probiotics for cow’s milk protein allergy: a systematic review of randomized controlled trials. Eur J Pediatr. 2019;178(8), 1139.
-
Miceli Sopo S, Monaco S, Bersani G, Romano A and Fantacci C. Proposal for management of the infant with suspected food protein-induced allergic proctocolitis. Pediatr Allergy Immunol. 2018;29, 215-218.
-
Meyer R, Chebar Lozinsky A, Fleischer DM, Vieira MC, Du Toit G, Vandenplas Y, Dupont C, Knibb R, Uysal P, Cavkaytar O, Nowak-Wegrzyn A, Shah N, Venter C. Diagnosis and management of Non-IgE gastrointestinal allergies in breastfed infants – An EAACI Position Paper. Allergy: European Journal of Allergy and Clinical Immunology. 2020;75(1), 14–32.
-
Di Nardo G, Cremon C, Frediani S, Lucarelli S, Villa MP, Stanghellini V, La Torre G, Martemucci L, Barbara G. Allergic Proctocolitis Is a Risk Factor for Functional Gastrointestinal Disorders in Children. J Pediatr. 2018;195, 128.





