Asthma is a heterogeneous disease defined by a history of respiratory symptoms that vary in time and intensity, and by a variable limitation of airflow, which can become persistent. Despite a wide range of treatments available for asthma, 5-10% of patients have a poor response to inhaled corticosteroids and require high doses of systemic corticosteroids to control symptoms. Patients who do not respond to conventional asthma therapy may benefit from new biologic therapies, such as anti-IgE, anti-IL-5, and anti-IL-4/IL-13 monoclonal antibodies to control asthma symptoms. For this reason, understanding the immunopathology of asthma is essential. The recent identification of fundamental inflammatory endotypes has facilitated a more granular approach to asthma. The emphasis has shifted to the precise delineation of molecular pathways that cause diseases, and the theoretical basis of endotyping corresponds to the current interest in personalized medicine. With the emergence of a constantly expanding repertoire of biologics, an appropriate classification system with significant biomarkers is needed to capitalize on molecular data and adapt treatment decisions. Therefore, stratification by inflammatory endotype is now considered a central component of the severe asthma management algorithm. This article summarizes the immunopathology of asthma, especially severe asthma, cytokines or receptors targeted by current biologic therapies, and potential new therapeutic targets.
Terapiile biologice în astmul sever – o perspectivă moleculară
Biologics in severe asthma – a molecular perspective
First published: 22 martie 2022
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.6.1.2022.6274
Abstract
Rezumat
Astmul este o boală heterogenă definită printr‑un istoric de simptome respiratorii care variază în timp şi în intensitate, precum şi prin limitarea variabilă a fluxului de aer, care poate deveni persistentă. În ciuda unei game largi de tratamente disponibile pentru astm, 5-10% dintre pacienţi prezintă un răspuns slab la corticosteroizii inhalatori şi necesită doze mari de corticosteroizi sistemici pentru a controla simptomele. Pacienţii care nu răspund la terapia convenţională a astmului pot beneficia de noile terapii biologice, precum anticorpii monoclonali anti-IgE, anti-IL-5 şi anti-IL-4/IL-13, pentru a controla simptomele astmului. Din acest motiv, înţelegerea imunopatologiei astmului este esenţială. Identificarea recentă a endotipurilor inflamatorii fundamentale a facilitat o abordare mai granulară a astmului. Accentul s-a mutat pe delimitarea precisă a căilor moleculare care determină apariţia unor afecţiuni, iar baza teoretică a endotipării corespunde cu interesul actual pentru medicina personalizată. Odată cu apariţia unui repertoriu în continuă expansiune de agenţi biologici, este necesar un sistem de clasificare adecvat, cu biomarkeri semnificativi, pentru a valorifica datele moleculare şi a adapta deciziile de tratament. Prin urmare, stratificarea în funcţie de endotipul inflamator este acum considerată o componentă centrală a algoritmului de management al astmului sever. Acest articol rezumă imunopatologia astmului, în special a astmului sever, citokinele sau receptorii vizaţi de terapiile biologice actuale şi potenţialele noi ţinte terapeutice.
Introducere
Astmul este o boală heterogenă definită printr-un istoric de simptome respiratorii (de exemplu, wheezing, senzaţie de constricţie toracică, dispnee, tuse) care variază în timp şi în intensitate, precum şi prin limitarea variabilă a fluxului de aer, care poate deveni persistentă. Astmul se asociază de obicei cu hiperreactivitatea şi inflamaţia căilor respiratorii, dar acestea nu sunt necesare sau suficiente pentru diagnostic. Diagnosticul astmului se bazează pe un istoric de simptome caracteristice şi pe evidenţierea limitării variabile a fluxului expirator de aer obţinută prin testul de bronhodilatare sau prin alte teste, precum testul de bronhoprovocare, monitorizarea fluxului expirator maximal sau prin observarea răspunsului la tratamentul specific (Reddel et al., 2022). În ciuda unei game largi de tratamente disponibile pentru astm, 5-10% dintre pacienţi prezintă un răspuns slab la corticosteroizii inhalatori şi necesită doze mari de corticosteroizi sistemici pentru a controla simptomele (Heffler et al., 2019). Prin consens, severitatea astmului este evaluată retrospectiv, după cel puţin două-trei luni de la instituirea unui nivel de tratament necesar pentru a controla simptomele şi exacerbările (Reddel et al., 2009). Ghidul GINA (Global Initiative for Asthma) actual nu mai face distincţie între aşa-numitul astm „intermitent” şi cel „uşor persistent”, deoarece această distincţie istorică a fost arbitrară, neexistând dovezi ale unei diferenţe în răspunsul la tratament (GINA, 2021). Astmul sever se defineşte ca fiind astmul care rămâne necontrolat în ciuda tratamentului optimizat cu corticosteroizi inhalatori şi bronhodilatatoare cu durată lungă de acţiune (CSI-BADLA) în doze mari sau care necesită un astfel de tratament pentru a nu deveni necontrolat (Chung et al., 2014). În ciuda disponibilităţii medicamentelor eficiente pentru managementul astmului, exacerbările severe continuă să fie un factor major de risc pentru sănătate, putând duce la rezultate grave, precum spitalizarea sau decesul, exacerbările astmului fiind de trei ori mai probabil să apară la pacienţii cu astm sever necontrolat (Bourdin et al., 2019). Este important să se facă distincţia între astmul sever şi astmul dificil de tratat, care este astm posibil necontrolat din cauza altor factori, cum ar fi tehnica incorectă de inhalare, aderenţa slabă la tratament şi comorbidităţi precum obezitatea şi expunerea la diferiţi factori de mediu (Reddel et al., 2022).
Deşi la prima vedere categoria pacienţilor cu astm sever sau cu astm dificil de tratat pare nesemnificativă, aceştia reprezentând doar 5-10% din totalul pacienţilor cu astm, acest subgrup contribuie în mod substanţial la povara economică a bolii, din cauza exacerbărilor frecvente care necesită îngrijire în cadrul serviciilor de urgenţă şi/sau spitalizare (Barnett şi Nurmagambetov, 2011).
Patogeneza astmului prezintă o heterogenitate marcantă, cu multe fenotipuri, care definesc caracteristicile vizibile, şi endotipuri, care definesc mecanismele patogenetice moleculare (Kaur şi Chupp, 2019). Pacienţii care nu răspund la terapia convenţională a astmului pot beneficia de noile terapii biologice, precum anticorpii monoclonali anti-IgE, anti-IL-5 şi anti-IL-4/IL-13, pentru a controla simptomele astmului. Din acest motiv, înţelegerea imunopatologiei astmului este esenţială. Pentru fenotiparea pacienţilor şi pentru identificarea celor care ar beneficia cel mai mult de pe urma terapiilor biologice, s-a încercat utilizarea unor biomarkeri precum eozinofilele sangvine, imunoglobulinele E (IgE) serice, periostina sau oxidul nitric exhalat (FeNO). Din păcate, aceşti biomarkeri nu au reuşit până în prezent să reflecte în totalitate complexitatea endotipurilor inflamatorii subiacente şi, astfel, s-au dovedit parţial inadecvaţi nu numai pentru alegerea terapiei potrivite pentru pacientul potrivit, ci şi pentru monitorizarea răspunsului la tratament.
Modelul astmului ca entitate unică este acum învechit, datorită unei înţelegeri sporite a heterogenităţii sale subiacente. Astmul a fost iniţial clasificat în două fenotipuri simple: astm alergic, respectiv nonalergic. Pe măsură ce înţelegerea patogenezei bolii, s-au aprofundat şi mecanismele inflamatorii subiacente fiindt caracterizate mai detaliat, iar fenotipurile de astm s-au extins, cuprinzând tot mai multe categorii. În prezent, termenul „astm” este considerat un diagnostic-umbrelă pentru o colecţie de afecţiuni distincte (endotipuri) şi fenotipuri diferite (tineri atopici, persoane cu obezitate, vârstnici), care se manifestă prin wheezing, dispnee, tuse, senzaţie de constricţie toracică şi sunt însoţite de obstrucţie variabilă a fluxului de aer. Până acum câţiva ani, tratamentele erau aplicate universal tuturor pacienţilor cu astm, dar heterogenitatea acestei boli a avut ca rezultat răspunsuri diferite la terapii. S-a observat şi faptul că fenotipurile clinice de astm (de exemplu, astm cu debut în copilărie versus cu debut tardiv, astm alergic versus nonalergic) nu se corelează puternic cu procesele imunopatologice specifice sau cu răspunsul la tratament. Pacienţii cu boală severă, care se consideră că reprezintă 5-10% dintre toţi pacienţii cu astm, au simptome refractare, în ciuda terapiei de mare intensitate. Această populaţie reprezintă o mare parte din morbiditatea şi mortalitatea asociate astmului şi are o nevoie clar nesatisfăcută. Prin urmare, s-au făcut încercări recente de a deconstrui astmul în componentele sale patologice pentru a‑i înţelege heterogenitatea.
Identificarea recentă a endotipurilor inflamatorii fundamentale a facilitat o abordare mai granulară a astmului (tabelul 1) (Kuruvilla et al., 2019). Accentul s-a mutat pe delimitarea precisă a căilor moleculare (endotipuri) care determină apariţia unor afecţiuni, iar baza teoretică a endotipării corespunde cu interesul actual pentru medicina personalizată. Odată cu apariţia unui repertoriu în continuă expansiune de agenţi biologici, este necesar un sistem de clasificare adecvat, cu biomarkeri semnificativi, pentru a valorifica datele moleculare şi a adapta deciziile de tratament. Prin urmare, stratificarea în funcţie de endotipul inflamator este acum considerată o componentă centrală a algoritmului de management al astmului sever.
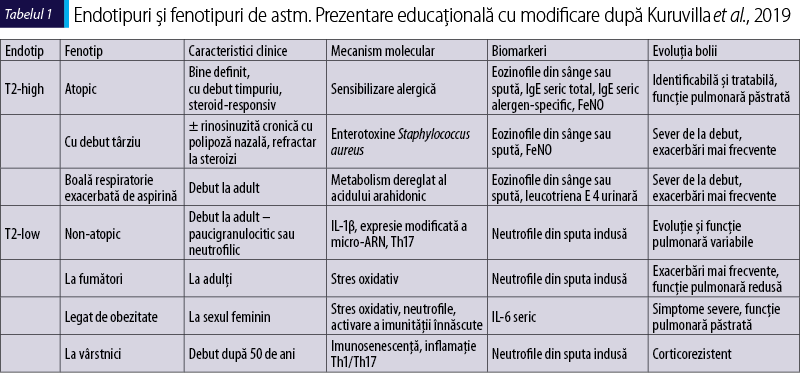
Endotipurile de astm
În linii mari, există două endotipuri de astm: inflamaţie de tip 2 (T2) ridicată (T2-high) şi T2 scăzută (T2-low). Endotipul T2-high, definit printr-un răspuns caracterizat prin citokine de tip T2 (IL-4, IL-5 şi IL-13), este cel mai frecvent şi mai bine înţeles endotip. Conform Registrului Internaţional de Astm Sever, astmul cu endotip T2-high reprezintă aproximativ 70% din cazurile de astm sever (Perez-de-Llano et al., 2020). Cu toate acestea, clasificarea endotipurilor de astm, respectiv a tipurilor de inflamaţie, este în mare parte arbitrară, ambele căi coexistând în diferite proporţii la majoritatea pacienţilor cu astm (Fildan et al., 2019).
Inflamaţia de tip T2-high
Inflamaţia T2-high se dezvoltă ca răspuns la dialogul patologic între răspunsurile imune înnăscute şi cele adaptative. Astmul alergic este declanşat de alergenele inhalate, care sunt preluate în căile respiratorii de către celulele prezentatoare de antigen, inclusiv celulele dendritice. Aceste celule procesează aeroalergenele, prezentând pe suprafaţa lor peptidele alergenice prin intermediul moleculelor de histocompatibilitate (MHC) de clasa a II-a în ganglionii limfatici locoregionali. La acest nivel, moleculele MHC II interacţionează cu receptorul celulelor T (TCR) de pe suprafaţa celulelor T CD4+ naive, rezultând polarizarea pe linia T helper 2 (Th2). Polarizarea este parţial determinată de IL-4, produsă de mastocitele şi bazofilele din regiune. După maturizarea limfocitelor Th2, acestea migrează către căile respiratorii, unde expunerea suplimentară la alergen are ca rezultat formarea unui complex între acesta şi TCR, ceea ce determină eliberarea unor citokine de tip T2 din limfocitele Th2, precum IL-4, IL-5 şi IL-13, ducând la inflamarea căilor respiratorii în aval (Hammad şi Lambrecht, 2021). IL-4 şi IL-13 induc switch-ul izotipic în limfocitele B pentru a produce IgE, care are capacitatea de a lega şi de a activa receptorii specifici de mare afinitate (FcεRI) de pe mastocite şi bazofile. După sensibilizarea iniţială, reexpunerea la alergen rezultă în legarea încrucişată a IgE de receptorii FcεRI, conducând la degranularea mastocitelor şi bazofilelor şi eliberarea de histamină, leucotriene şi prostaglandine, care continuă să promoveze inflamaţia bronşică (Lambrecht şi Hammad, 2015).
Un răspuns similar celui descris anterior, declanşat de imunitatea adaptativă, poate fi indus şi de procese aparţinând imunităţii înnăscute. Alergenele inhalate interacţionează cu epiteliul căilor respiratorii, inducând sinteză de alarmine la acest nivel, inclusiv limfopoietină stromală timică (TSLP), IL-25 şi IL-33 (Hammad şi Lambrecht, 2021). Aceste alarmine promovează eliberarea de citokine din limfocitele Th2, bazofile, mastocite şi celulele ILC2 (celule limfoide înnăscute; innate lymphoid cells 2) (Salter et al., 2019; Bao şi Reinhardt, 2015). Similar cu limfocitele Th2, ILC2 sunt promotori puternici ai inflamaţiei de tip T2-high, prin producerea de IL-5 şi IL-13 (Salter et al., 2019). Atenţia s-a concentrat în ultimul timp pe IL-5, datorită rolului său esenţial în astm. Această citokină este produsă nu doar de eozinofilele mature, ci şi de limfocitele Th2 şi de ILC2. Efectele biologice ale IL-5 sunt mediate prin interacţiunea cu receptorul specific IL-5Rα şi un lanţ β nespecific heterodimer, recunoscut de IL-3 şi GM-CSF (Rossjohn et al., 2000). Când IL-5 este prezent, se leagă de IL-5Rα, care se găseşte din abundenţă pe eozinofile (Varricchi et al., 2016) şi induce formarea unui complex care promovează activarea unei căi de semnalizare intracelulară, care activează în aval proteinele JAK2 şi STAT 1, 3 şi 5, care la rândul lor stimulează transcripţia unor factori implicaţi în proliferarea eozinofilelor sau în inhibarea apoptozei acestora, respectiv în stimularea producerii de citokine de către acestea (Seif et al., 2017). IL-5 este astfel responsabil pentru activarea multor funcţii esenţiale ale eozinofilelor. Eozinofilele îşi exercită efectele asupra căilor respiratorii prin degranulare, inclusiv eliberarea de granule eozinofilice intacte, care conţin proteine granulare eozinofilice care pot leza ţesuturile, precum proteină bazică majoră (MBP), proteină cationică a eozinofilelor (ECP), neurotoxina derivată din eozinofile (EDN) şi peroxidaza eozinofilică (EPX) (Hogan et al., 2008). De asemenea, eozinofilele eliberează depozite extracelulare de ADN care formează o structură denumită capcane extracelulare eozinofilice (EET), asemănătoare capcanelor extracelulare neutrofilice (NETs), printr-un proces denumit EToză. EET-urile au un efect autocrin, promovând degranularea eozinofilelor, dar şi unul paracrin, inducând producţia de IL-6 şi IL-8 din celulele epiteliale (Mukherjee et al., 2018). IL-13 este implicată în inducerea producţiei de mucus, remodelarea căilor respiratorii şi în hiperreactivitatea bronşică (Gour şi Wills-Karp, 2015). Toţi aceşti mediatori menţionaţi anterior contribuie la remodelarea şi hiperreactivitatea căilor respiratorii, precum şi la creşterea producţiei de mucus. Astmul de tip T2-high cuprinde mai multe subtipuri, atât la copii, cât şi la adulţi, cum ar fi astmul alergic cu debut precoce, astmul eozinofilic cu debut tardiv şi boala respiratorie exacerbată de aspirină (Kuruvilla et al., 2019).
Inflamaţia de tip 1, de tip T2-low sau de tip non-T2
Inflamaţia de tip 1, de tip T2-low sau de tip non-T2 reprezintă o altă cale patogenetică a astmului. În acest caz, receptorii de recunoaştere a modelelor (pattern recognition receptors; PRRs) de pe suprafaţa celulelor epiteliale din căile respiratorii, a granulocitelor, a celulelor dendritice şi a limfocitelor T intervin pentru a recunoaşte modelele moleculare asociate leziunilor celulare (damage-associated molecular patterns; DAMPs) şi asociate patogenilor (pathogen-associated molecular patterns; PAMPs) şi induc eliberarea mediatorului în aval. Activarea receptorilor PRR stimulează inflamozomii, care sunt platforme de semnalizare multimoleculare esenţiale pentru apărarea imună. Inflamozomul promovează piroptoza, o formă de moarte celulară programată care apare cel mai frecvent în infecţiile cu agenţi patogeni intracelulari şi care probabil face parte din răspunsul antimicrobian. Una dintre citokinele a căror secreţie este indusă de inflamozomi este IL-1β (Elliott şi Sutterwala, 2015). Secreţia acesteia este mediată de caspaza-1, care clivează IL-1β în izoforma sa secretorie. IL-1β este importantă pentru diferenţierea limfocitelor Th17 şi pentru producţia de IL-17, care este un mediator al inflamaţiei neutrofilice şi care prezintă valori plasmatice crescute la pacienţii cu astm sever cu exacerbări frecvente (Ricciardolo et al., 2017). S-a observat că IL-1β şi caspaza-1 prezintă concentraţii crescute în sputa pacienţilor cu astm sever şi concentraţia acestora se corelează cu severitatea bolii (Kim et al., 2017). S-a observat că şi neutrofilele par să fie implicate în activarea inflamozomului (Wright et al., 2016). ADN-ul extracelular derivat din neutrofile este eliberat în afara acestora, formând o structură asemănătoare reţelelor, pentru a forma capcane extracelulare ale neutrofilelor (neutrophil extracellular traps; NETs), într-un proces cunoscut sub numele de NEToză, care poate fi indus în cadrul unui răspuns înnăscut împotriva invaziei agenţilor patogeni, dar şi în absenţa infecţiei. Neutrofilia în căile respiratorii şi NEToza au ca rezultat activarea inflamozomului, care apoi induce inflamaţie mediată de limfocitele Th17. Astmul de tip T2-low este caracterizat prin inflamaţie neutrofilică sau paucigranulocitară şi lipsă de răspuns la terapia cu corticosteroizi (McGregor et al., 2019). Astmul neutrofilic sever este asociat cu infecţia cronică cu bacterii atipice, fumatul, obezitatea şi cu anomalii subiacente ale musculaturii netede mai puţin cunoscute (Kuruvilla et al., 2019). Deşi există terapii biologice în curs de dezvoltare care vizează astmul de tip T2-low, caracterizarea endotipică a acestuia şi utilizarea biomarkerilor pentru a monitoriza răspunsul la tratament rămân în mare parte necunoscute.
Terapiile biologice disponibile în prezent pentru astmul sever
Practicarea medicinei de precizie în astm este departe de a fi optimă, din cauza înţelegerii incomplete a naturii complexe a imunopatologiei astmului. Categoria pacienţilor cu astm sever este destul de heterogenă şi, ca atare, nu poate fi utilizată o abordare unică pentru a gestiona aceşti pacienţi. Cu toate că majoritatea pacienţilor cu astm sever prezintă inflamaţie de tip T2-high, mecanismele care stau la baza acestei inflamaţii pot varia drastic. Acest aspect poate fi observat şi prin gradul mare de variaţie a răspunsului pacienţilor la terapiile biologice – unii pacienţi au un răspuns extrem de favorabil, alţii prezintă răspuns suboptimal, iar la alţii tratamentul eşuează. Un răspuns bun (de tip super-responder) la terapiile biologice poate fi definit printr-o ameliorare a trei sau mai multe criterii (dintre care cel puţin două criterii majore) pe o perioadă de 12 luni, criterii care se regăsesc în figura 1 (Upham et al., 2021).
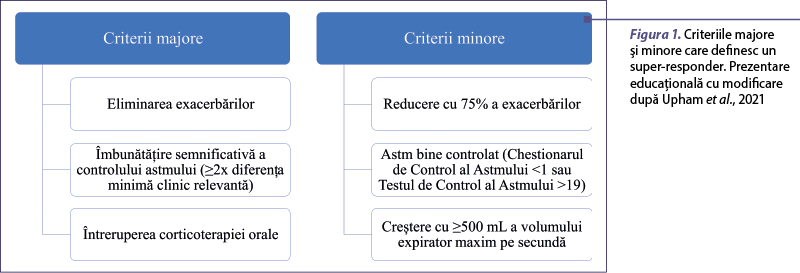
Este nevoie de o mai bună înţelegere a modului în care aceşti super-responderi pot fi identificaţi şi a factorilor determinanţi ai răspunsului favorabil la terapiile biologice. În mod similar, trebuie să identifice mai bine cauzele răspunsurilor suboptimale şi ale eşecurilor la tratament. Căile vizate de terapiile biologice, precum şi biomarkerii care pot fi utilizaţi pentru caracterizarea astmului se regăsesc în figura 2 şi în tabelul 2.
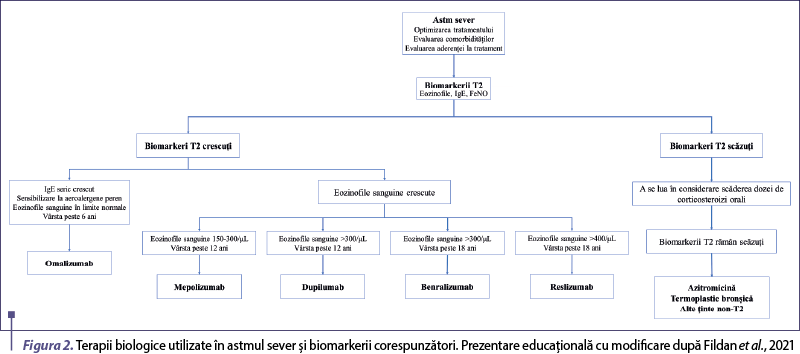
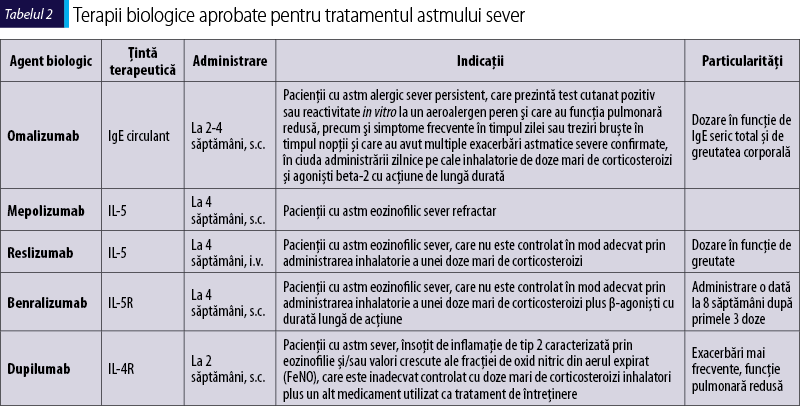
Terapia anti-IgE
IgE este imunoglobulina primară implicată în inflamaţia de tip T2-high. Omalizumab, singurul anticorp monoclonal anti-IgE umanizat prezent pe piaţă, se leagă de regiunea constantă a IgE şi împiedică interacţiunea dintre IgE seric circulant şi receptorii specifici de afinitate înaltă şi scăzută, respectiv FcεRI şi FcɛRII (CD23) (Fahy et al., 1997) de pe suprafaţa mastocitelor şi bazofilelor. Ca rezultat al acestei blocări, omalizumab inhibă toate evenimentele celulare şi moleculare dependente de IgE implicate în calea imunologică a astmului alergic, ducând la scăderea nivelurilor de IgE seric liber şi a densităţii receptorilor pentru IgE de pe mastocite şi bazofile (Menzella et al., 2018). Numeroase studii clinice randomizate şi studii din viaţa reală au arătat că tratamentul astmaticilor cu omalizumab are ca rezultat o reducere dependentă de doză a IgE seric liber, îmbunătăţirea funcţiei pulmonare, reducerea modestă a frecvenţei exacerbărilor şi a numărului de prezentări la urgenţe şi de spitalizări (Hanania et al., 2011; Normansell et al., 2014). Studiile clinice au arătat şi îmbunătăţiri în controlul simptomelor, calitatea vieţii, alături de utilizarea redusă a corticosteroizilor orali (CSO) (Rodrigo et al., 2011; Normansell et al., 2014; Pelaia et al., 2018). O analiză retrospectivă amplă a 25 de studii clinice randomizate a demonstrat o reducere mai mare a frecvenţei exacerbărilor astmului la pacienţii cu eozinofilie sangvină crescută şi niveluri crescute ale FeNO, ceea ce sugerează o inflamaţie eozinofilică (Hanania et al., 2013). Pe baza acestor constatări, se justifică prescrierea de terapie biologică anti-IgE la astmaticii severi cu semne de atopie.
Conform dovezilor disponibile, tratamentul cu omalizumab trebuie continuat fără întrerupere, deoarece nivelurile de IgE şi numărul de receptori FcɛRI cresc la trei-patru săptămâni după întreruperea acestuia, rezultând o înrăutăţire a controlului astmului, în special la pacienţii cu niveluri mai ridicate de eozinofilie, periostină şi FeNO (Teach et al., 2015). Prezenţa acestor biomarkeri pare să fie legată de un răspuns mai bun la omalizumab, dar şi de o pierdere mai rapidă a efectului acestuia după întrerupere (Ledford et al., 2017). Prin urmare, selectarea corectă a pacientului pentru terapie cu omalizumab presupune nu doar un răspuns favorabil pe termen scurt, ci şi o creştere a eficacităţii clinice pe termen lung (până la nouă ani de urmărire) (Humbert et al., 2018), cu un profil cost-eficacitate favorabil la pacienţii cu astm sever, dacă este selectat corect (Menzella et al., 2017).
Ligelizumab (QGE031) este un nou mAb anti-IgE, care a arătat în primele faze ale dezvoltării sale o suprimare mai mare a IgE seric liber în comparaţie cu omalizumab; acelaşi efect a fost observat şi la pacienţii cu niveluri foarte ridicate de IgE (Newcomb et al., 2013). În ciuda datelor iniţiale promiţătoare, studiul de fază 2 CQGE031B2201 nu a satisfăcut rezultatul primar, deoarece superioritatea ligelizumabului faţă de placebo nu a fost demonstrată (Trischler et al., 2021). Deşi ligelizumab are efecte mai puternice decât omalizumab în ceea ce priveşte inhibarea legării IgE la FcεRI, există diferenţe în blocarea legării IgE în raport cu FcεRI şi FcεRII/CD23 între cei doi compuşi. Prin urmare, datele sugerează că diferiţi anticorpi anti-IgE ar putea fi selectiv eficienţi pentru diferite boli IgE-mediate.
Terapia anti-IL-5
Având în vedere rolul IL-5 în declanşarea inflamaţiei eozinofilice, s-a dedus că blocarea acestei citokine poate atenua inflamaţia de tip T2-high. Până în prezent au fost dezvoltaţi trei agenţi biologici care ţintesc IL-5. Mepolizumab şi reslizumab se leagă de IL-5, împiedicând această citokină să promoveze activarea eozinofilelor, iar benralizumab blochează receptorul pentru IL-5, IL-5Rα, rezultând depleţia aproape completă a eozinofilelor periferice prin citotoxicitate mediată celular anticorp-dependentă (ADCC), care implică celule NK. Un studiu realizat în 2000 a arătat că, în ciuda faptului că mepolizumab a dus la scăderea eozinofilelor din sânge şi spută, acest efect nu s-a concretizat în rezultate clinice semnificative la pacienţii cu astm (Leckie et al., 2000). Acelaşi lucru a fost observat în alte studii clinice randomizate, care nu au reuşit să dovedească eficacitatea clinică a anticorpilor monoclonali anti-IL-5, ceea ce a dus la abandonarea eozinofilelor ca ţintă terapeutică timp de mai mulţi ani (Flood-Page et al., 2003). S-a observat apoi că aceste studii iniţiale nu au selectat adecvat pacienţii în funcţie de eozinofilie şi de profilul T2-high, ci au inclus un grup eterogen de pacienţi astmatici cu o varietate de profiluri imunologice, ceea ce a dus la absenţa unui răspuns clinic satisfăcător la tratamentul anti-IL-5 în aceste studii timpurii. Această observaţie a dus la o schimbare esenţială în studiile care evaluează terapia anti-IL-5. Selectând doar pacienţi cu profil T2-high, un studiu din 2009 a raportat că tratamentul cu mepolizumab la pacienţii cu astm sever cu eozinofilie (≥3% eozinofile din spută în ultimele 12 luni) nu a redus doar eozinofilele din sânge şi spută, ci şi numărul de exacerbări (Haldar et al., 2009). Numeroase studii clinice şi din viaţa reală au arătat că administrarea de mepolizumab la pacienţii cu astm sever cu eozinofilie dependenţi de corticosteroizi orali a dus la scăderea administrării acestora, a frecvenţei exacerbărilor, la îmbunătăţirea controlului astmului şi la îmbunătăţirea parametrilor funcţionali respiratori (Pavord et al., 2012; Bel et al., 2014; Domingo Ribas et al., 2021; Koistinen et al., 2022). Pentru a obţine aceste rezultate favorabile ale terapiei cu mepolizumab, este necesară o selecţie atentă a pacienţilor, beneficiind de acest tratament în primul rând pacienţii cu astm sever şi cu eozinofilie. Din acest motiv, eozinofilele din sângele periferic au fost alese iniţial ca biomarker în studiile cu mepolizumab (Ortega et al., 2016), acestea reprezentând una dintre cele mai simple şi practice modalităţi de identificare a inflamaţiei de tip T2-high şi, ca atare, a pacienţilor care pot beneficia de terapia anti-IL-5. Cu toate acestea, ele prezintă dezavantajul de a avea valori fluctuante, din acest motiv eozinofilele din spută putând reprezenta un biomarker mai bun; din păcate, există o lipsă de disponibilitate globală a laboratoarelor care pot determina eozinofilele din spută, ceea ce face dificilă utilizarea acestora ca biomarker pe scară mai largă. Deşi eozinofilia periferică poate prezice răspunsul la agenţii anti-IL-5, ea are un rol limitat în monitorizarea răspunsului la tratament, posibilă datorită eozinopoiezei in situ. Astfel, utilizarea eozinofilelor din spută pentru a monitoriza răspunsul la tratament poate fi mai fiabilă decât utilizarea eozinofilelor periferice. Cu toate acestea, în ciuda multiplelor studii care au arătat beneficii clinice, efectul mepolizumabului a fost incomplet, cu o reducere de aproximativ 50% a frecvenţei exacerbărilor, în ciuda ablaţiei eozinofiliei periferice (Ortega et al., 2020). În afară de eozinofile, în imunopatogeneza astmului sunt implicate şi alte celule efectoare şi citokine care pot fi la fel, dacă nu mai importante decât eozinofilele şi, ca atare, ar trebui vizate.
Reslizumab a fost al doilea agent biologic anti-IL-5 introdus pe piaţă. Studiile clinice randomizate la pacienţii cu astm sever şi cu eozinofilie au arătat că reslizumabul reduce eozinofilele din sânge, frecvenţa exacerbărilor şi îmbunătăţeşte scorul simptomelor şi funcţia pulmonară (Murphy et al., 2017; Wechsler et al., 2020; Bernstein et al., 2020). Este posibil ca pacienţii care nu răspund la regimul cu doză fixă de mepolizumab să poată beneficia de reslizumab ca alternativă (care se dozează în funcţie de greutatea corporală) (Mukherjee et al., 2018). Similar cu mepolizumab, reslizumab pare să aibă cele mai multe dovezi pentru eficacitatea clinică la pacienţii cu eozinofilie periferică.
Benralizumab, un anticorp specific pentru subunitatea α a receptorului pentru IL-5, a fost al treilea agent biologic care vizează calea IL-5. Efectele sale pe frecvenţa exacerbărilor, reducerea eozinofilelor din sângele periferic şi din spută şi pe îmbunătăţirea simptomelor au fost similare cu cele ale celorlalţi agenţi biologici anti-IL-5, cu toate că benralizumab utilizează o abordare alternativă, care vizează IL-5Rα (Sehmi et al., 2018; AlShareef et al., 2022; Miralles López et al., 2022).
Terapia anti-IL-4/IL-13
Pentru a înţelege eficacitatea agenţilor biologici anti-IL-4/IL-13, este important să înţelegem semnalizarea prin receptorii pentru aceste două citokine. Calea de semnalizare pentru IL-13 se realizează prin interacţiunea sa cu receptorul IL-13, care prezintă două subtipuri – IL-13Rα1 şi IL-13Rα2. IL-13Rα1 leagă IL-13 cu afinitate scăzută, dar, când receptorul pentru IL-4 (IL-4Rα1), se uneşte de acesta pentru a forma un heterodimer, IL-13 este legat cu mai mare afinitate. IL-13Rα2 leagă IL-13 cu afinitate mare, dar nu poate transmite semnalul intracelular, deoarece îi lipseşte domeniul citoplasmatic; poate însă acţiona ca un reglator negativ al semnalizării prin IL-13 şi IL-4. Blocarea izolată, fie a IL-4, fie a IL-13, nu s-a dovedit a fi eficientă în tratamentul astmului sever, dar blocarea duală a IL-4 şi IL-13 pare să fie promiţătoare.
În ceea ce priveşte agenţii biologici anti-IL-13, au fost studiaţi lebrikizumab şi tralokinumab. Studiile efectuate la pacienţi cu astm sever cu inflamaţie T2-high (IgE serice totale ≥100 UI/ml şi eozinofilele din sângele periferic ≥140 celule/µl) au arătat că tratamentul cu lebrikizumab a redus frecvenţa exacerbărilor şi a îmbunătăţit parametrii funcţionali respiratori, dar nu a avut niciun efect asupra simptomelor (Liu et al., 2018; Austin et al., 2020; Hanania et al., 2016). Subgrupul de pacienţi cu nivel crescut al periostinei serice (≥50 ng/ml) sau al FeNO a prezentat o îmbunătăţire mai mare a funcţiei pulmonare.
În mod similar, majoritatea studiilor cu tralokinumab nu au prezentat rezultate clinice promiţătoare (Chung, 2018; Zhang et al., 2019; Busse et al., 2019). Astfel, s-a observat că agenţii biologici anti-IL-13 nu sunt eficienţi în tratarea astmului sever, ceea ce se poate datora în primul rând implicării IL-13 în hiperreactivitatea bronşică, nu în inflamaţie şi exacerbări, iar în ceea ce priveşte tralokinumab, deoarece acesta ţinteşte ambele subunităţi ale receptorului pentru IL-13, efectele sale antiinflamatorii pot fi reduse de acţiunea pe subunitatea IL-13Rα2.
Studiile cu privire la terapiile biologice anti-IL-4 au fost, de asemenea, dezamăgitoare. S-a demonstrat că pascolizumab este bine tolerat în studii pe animale şi neutralizează activitatea IL-4 (Hart et al., 2002), dar aceste rezultate promiţătoare nu s-au observat în studiile pe subiecţi umani. Studiile clinice randomizate au demonstrat că tratamentul cu altrakincept, un agent anti-IL-4 nebulizat, la pacienţii cu astm sever a îmbunătăţit semnificativ parametrii funcţionali respiratori şi a redus FeNO, neavând efect asupra exacerbărilor (Borish et al., 1999). În general, agenţii biologici anti-IL-4 nu au avut suficientă eficacitate clinică pentru a justifica investigaţii suplimentare, din acest motiv investigaţiile cu aceste produse au fost întrerupte. Această lipsă a eficacităţii poate fi cauzată parţial de redundanţa datorată IL-13, care semnalizează prin acelaşi heterodimer.
Având în vedere lipsa datelor impresionante obţinute cu agenţii biologici anti-IL-4 şi IL-13 utilizaţi separat, s-a crezut că, poate, ţintirea căii comune ambelor citokine poate avea un efect mai mare. Dupilumab este primul biologic dual IL-4/IL-13 aprobat pentru tratamentul astmului. Acesta vizează receptorul comun IL-4Rα şi astfel blochează semnalizarea atât prin IL-4, cât şi prin IL-13. Un studiu iniţial în care s-a administrat dupilumab la pacienţi cu astm şi eozinofilie (eozinofile din sânge ≥300 celule/µl sau eozinofile din spută ≥3%) a dus la o reducere cu 87% a frecvenţei exacerbărilor. Aceste rezultate impresionante s-au obţinut deşi administrarea BADLA a încetat din săptămâna a patra de tratament, iar administrarea CSI, din săptămânile 6-9. Rezultate similare s-au obţinut şi la pacienţii fără eozinofilie, ceea ce denotă faptul că dupilumab poate fi eficient indiferent de statutul eozinofilic (Wenzel et al., 2013).
Terapia antialarmine
Dezvoltarea produselor biologice antialarmine a fost una dintre cele mai interesante inovaţii în terapia astmului până în prezent.
Tezepelumab este primul anticorp uman IgG2 direcţionat împotriva TSLP. Primul studiu clinic de evaluare a eficacităţii tezepelumabului s-a realizat la pacienţi cu astm uşor şi a relevat o îmbunătăţire semnificativă a parametrilor funcţionali respiratori, o reducere a eozinofilelor în sângele periferic şi în spută, a IgE seric şi a FeNO, precum şi a frecvenţei exacerbărilor (Gauvreau et al., 2014; Marone et al., 2019; Corren et al., 2021). Aceste date sugerează că ţintirea citokinelor din amontele inflamaţiei, precum limfopoietina stromală timică (TSLP), poate fi benefică în multiple endotipuri de astm, atât de tip T2-high, cât şi T2-low.
Agenţii biologici anti-IL-33 au fost iniţial studiaţi pentru alte afecţiuni alergice, precum dermatita atopică şi alergia la alimente (Chen et al., 2019; Chinthrajah et al., 2019). Utilizarea lor s-a asociat cu reduceri semnificative ale eozinofilelor din sângele periferic, ale IgE-ului seric total şi ale citokinelor de tip T2. Numeroase studii clinice randomizate care evaluează efectul agenţilor anti-IL-33 în astm sunt în desfăşurare. Primul dintre acestea a publicat recent rezultate; s-a constatat că administrarea itepekimabului timp de 12 săptămâni a îmbunătăţit controlul astmului şi calitatea vieţii, a redus FeNO, IgE seric total şi concentraţiile serice de periostină şi eotaxină-4 (Wechsler et al., 2021), dar într-o măsură mai mică decât agenţii anti-IL-5 sau anti-IL-4/IL-13. Aceste observaţii sugerează inhibarea incompletă a inflamaţiei de tip T2 prin blocarea IL-33, deoarece căile mediate de alarmine, precum TSLP, rămân active.
Sunt necesare mai multe studii axate pe antialarmine pentru a putea identifica răspunsurile suboptimale sau eşecurile la tratament, precum şi cauzele acestor rezultate, aceste studii putând fi utile şi pentru a evalua ţintirea duală a mecanismelor din amonte şi din aval pentru inflamaţia din astmul sever.
Terapiile biologice în sarcină
Femeile însărcinate care suferă de astm sever reprezintă o categorie aparte de pacienţi. Datele despre utilizarea terapiilor biologice pentru tratamentul afecţiunilor atopice în timpul sarcinii sunt limitate, ceea ce duce la o nesiguranţă în luarea deciziilor clinice. Prin urmare, tratamentul este adesea oprit din cauza lipsei datelor de siguranţă farmacologică. Cu toate acestea, există un risc semnificativ ca astmul şi alte afecţiuni atopice să se agraveze în timpul sarcinii, ceea ce creşte riscul de complicaţii materne, fetale şi neonatale (Abdullah et al., 2020). De asemenea, astmul în sine este o afecţiune care poate scădea fertilitatea, probabil ca urmare a inflamaţiei sistemice, care afectează şi mucoasa uterină şi, astfel, împiedică implantarea eficientă a embrionului. Deşi datele sunt încă limitate, profilurile de siguranţă ale terapiilor biologice au fost evaluate în perioada de preconcepţie, în sarcină şi în timpul alăptării. Omalizumab este agentul biologic cu cel mai extensiv istoric de siguranţă în timpul sarcinii. Un studiu recent a analizat 230 de femei însărcinate cu astm tratat cu omalizumab; nu s-a observat nicio creştere a rezultatelor fetale adverse în comparaţie cu pacienţii care nu au fost trataţi cu omalizumab, ci doar cu terapii convenţionale (Levi-Schaffer et al., 2020). În ceea ce priveşte ceilalţi agenţi biologici utilizaţi în astm (agenţii anti-IL-5 şi anti-IL-4/IL-13), datele sunt extrem de limitate, în principal deoarece femeile însărcinate sunt în mod uzual excluse din studiile clinice. Studiile in vivo pe animale nu sugerează un risc crescut al administrării terapiilor biologice. În prezent se organizează registre ale pacienţilor cu astm sever care se găsesc sub tratament biologic şi prin care se pot urmări efectele la femeile însărcinate în studii prospective. Un astfel de registru pentru evaluarea infertilităţii şi a sănătăţii în sarcină este inclus şi în „Proiectul transfrontalier româno-maghiar cu accent pe diagnosticul în infertilitate, sănătatea în sarcină şi îngrijirea nou-născutului” (HEALTH-PREGN-RO-HU, 2022), condus de Universitatea din Szeged, Ungaria, şi în care Centre for Gene and Cellular Therapies in the Treatment of Cancer – OncoGen este partener. Astfel, deocamdată, recomandarea de a începe sau de a continua tratamentul biologic şi consilierea preconcepţională trebuie făcute de către o echipă multidisciplinară. În acest sens, poziţia Academiei Europene de Alergologie şi Imunologie Clinică este că beneficiile şi riscurile trebuie să fie puse în balanţă, având în vedere cunoştinţele actuale şi riscul de a pierde controlul astmului şi, prin urmare, de a pune în pericol mama şi fătul. Aceste decizii trebuie luate individual şi reprezintă un prototip pentru luarea informată a deciziilor în echipă (Pfaller et al., 2021).
Concluzii
În ciuda opţiunilor noi de tratament şi a diferitelor ţinte terapeutice, managementul astmului sever continuă să fie o provocare. Terapiile biologice au îmbunătăţit opţiunile de tratament pentru pacienţii cu astm sever, dar sunt necesare recomandări de tratament pentru a îmbunătăţi calitatea îngrijirii pacienţilor şi de a promova un tratament sigur şi eficace cu terapii biologice pentru pacienţii cu astm sever. Înţelegerea caracteristicilor fenotipice şi identificarea biomarkerilor ajută la clasificarea endotipului bolii de bază şi la abordarea terapeutică adecvată. Deoarece comparaţiile directe între terapiile biologice lipsesc, sunt necesare date suplimentare pentru a stabili cea mai adecvată opţiune terapeutică. Studiile viitoare ar trebui să se axeze pe evaluarea dozelor adecvate de tratament, a căilor de administrare, pe identificarea biomarkerilor potriviţi, pe selecţia pacienţilor, precum şi pe ţintirea concomitentă a mai multor căi inflamatorii. Înţelegerea mecanismelor moleculare şi a caracteristicilor fenotipice, precum şi identificarea biomarkerilor vor ajuta la ghidarea optimă a tratamentului şi la monitorizarea răspunsului terapeutic, pentru a le asigura o terapie personalizată pacienţilor cu astm sever.
Bibliografie
-
2021 GINA Report, Global Strategy for Asthma Management and Prevention. https://ginasthma.org/gina-reports/. Accesat în 28.02.2022.
-
Abdullah K, Zhu J, Gershon A, Dell S, To T. Effect of asthma exacerbation during pregnancy in women with asthma: a population-based cohort study. Eur Respir J. 2020 Feb 12;55(2):1901335. doi: 10.1183/13993003.01335-2019. PMID: 31772000.
-
AlShareef S, McDonald CF, Lee J. Clinical and Lung Function Outcomes After Anti-IgE or Anti-IL5 Therapy in Severe Asthma. J Asthma Allergy. 2022 Feb 15;15:209-217. doi: 10.2147/JAA.S348137. PMID: 35210787; PMCID: PMC8857973.
-
Austin CD, Gonzalez Edick M, Ferrando RE, Solon M, Baca M, Mesh K, Bradding P, Gauvreau GM, Sumino K, FitzGerald JM, Israel E, Bjermer L, Bourdin A, Arron JR, Choy DF, Olsson JK, Abreu F, Howard M, Wong K, Cai F, Peng K, Putnam WS, Holweg CTJ, Matthews JG, Kraft M, Woodruff PG; CLAVIER Investigators. A randomized, placebo-controlled trial evaluating effects of lebrikizumab on airway eosinophilic inflammation and remodelling in uncontrolled asthma (CLAVIER). Clin Exp Allergy. 2020 Dec;50(12):1342-1351. doi: 10.1111/cea.13731. Epub 2020 Oct 4. PMID: 32909660; PMCID: PMC7756263.
-
Bao K, Reinhardt RL. The differential expression of IL-4 and IL-13 and its impact on type-2 immunity. Cytokine. 2015 Sep;75(1):25-37. doi: 10.1016/j.cyto.2015.05.008. Epub 2015 Jun 11. PMID: 26073683; PMCID: PMC5118948.
-
Barnett SB, Nurmagambetov TA. Costs of asthma in the United States: 2002-2007. J Allergy Clin Immunol. 2011 Jan;127(1):145-52. doi: 10.1016/j.jaci.2010.10.020. PMID: 21211649.
-
Bel EH, Wenzel SE, Thompson PJ, Prazma CM, Keene ON, Yancey SW, Ortega HG, Pavord ID; SIRIUS Investigators. Oral glucocorticoid-sparing effect of mepolizumab in eosinophilic asthma. N Engl J Med. 2014 Sep 25;371(13):1189-97. doi: 10.1056/NEJMoa1403291. Epub 2014 Sep 8. PMID: 25199060.
-
Bernstein JA, Virchow JC, Murphy K, Maspero JF, Jacobs J, Adir Y, Humbert M, Castro M, Marsteller DA, McElhattan J, Hickey L, Garin M, Vanlandingham R, Brusselle G. Effect of fixed-dose subcutaneous reslizumab on asthma exacerbations in patients with severe uncontrolled asthma and corticosteroid sparing in patients with oral corticosteroid-dependent asthma: results from two phase 3, randomised, double-blind, placebo-controlled trials. Lancet Respir Med. 2020 May;8(5):461-474. doi: 10.1016/S2213-2600(19)30372-8. Epub 2020 Feb 14. PMID: 32066536.
-
Borish LC, Nelson HS, Lanz MJ, Claussen L, Whitmore JB, Agosti JM, Garrison L. Interleukin-4 receptor in moderate atopic asthma. A phase I/II randomized, placebo-controlled trial. Am J Respir Crit Care Med. 1999 Dec;160(6):1816-23. doi: 10.1164/ajrccm.160.6.9808146. PMID: 10588591.
-
Bourdin A, Bjermer L, Brightling C, Brusselle GG, Chanez P, Chung KF, Custovic A, Diamant Z, Diver S, Djukanovic R, Hamerlijnck D, Horváth I, Johnston SL, Kanniess F, Papadopoulos N, Papi A, Russell RJ, Ryan D, Samitas K, Tonia T, Zervas E, Gaga M. ERS/EAACI statement on severe exacerbations in asthma in adults: facts, priorities and key research questions. Eur Respir J. 2019 Sep 28;54(3):1900900. doi: 10.1183/13993003.00900-2019. PMID: 31467120.
-
Busse WW, Brusselle GG, Korn S, Kuna P, Magnan A, Cohen D, Bowen K, Piechowiak T, Wang MM, Colice G. Tralokinumab did not demonstrate oral corticosteroid-sparing effects in severe asthma. Eur Respir J. 2019 Jan 31;53(2):1800948. doi: 10.1183/13993003.00948-2018. PMID: 30442714.
-
Chen YL, Gutowska-Owsiak D, Hardman CS, Westmoreland M, MacKenzie T, Cifuentes L, Waithe D, Lloyd-Lavery A, Marquette A, Londei M, Ogg G. Proof-of-concept clinical trial of etokimab shows a key role for IL-33 in atopic dermatitis pathogenesis. Sci Transl Med. 2019 Oct 23;11(515):eaax2945. doi: 10.1126/scitranslmed.aax2945. PMID: 31645451.
-
Chinthrajah S, Cao S, Liu C, Lyu SC, Sindher SB, Long A, Sampath V, Petroni D, Londei M, Nadeau KC. Phase 2a randomized, placebo-controlled study of anti-IL-33 in peanut allergy. JCI Insight. 2019 Nov 14;4(22):e131347. doi: 10.1172/jci.insight.131347. PMID: 31723064; PMCID: PMC6948865.
-
Chung KF, Wenzel SE, Brozek JL, Bush A, Castro M, Sterk PJ, Adcock IM, Bateman ED, Bel EH, Bleecker ER, Boulet LP, Brightling C, Chanez P, Dahlen SE, Djukanovic R, Frey U, Gaga M, Gibson P, Hamid Q, Jajour NN, Mauad T, Sorkness RL, Teague WG. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J. 2014 Feb;43(2):343-73. doi: 10.1183/09031936.00202013. Epub 2013 Dec 12. Erratum in: Eur Respir J. 2014 Apr;43(4):1216. Dosage error in article text. Erratum in: Eur Respir J. 2018 Jul 27;52(1): PMID: 24337046.
-
Chung KF. Tralokinumab unsuccessful for management of severe, uncontrolled asthma. Lancet Respir Med. 2018 Jul;6(7):480-481. doi: 10.1016/S2213-2600(18)30194-2. Epub 2018 May 21. PMID: 29793858.
-
Corren J, Garcia Gil E, Griffiths JM, Parnes JR, van der Merwe R, Sałapa K, O'Quinn S. Tezepelumab improves patient-reported outcomes in patients with severe, uncontrolled asthma in PATHWAY. Ann Allergy Asthma Immunol. 2021 Feb;126(2):187-193. doi: 10.1016/j.anai.2020.10.008. Epub 2020 Oct 23. PMID: 33169672.
-
Domingo Ribas C, Carrillo Díaz T, Blanco Aparicio M, Martínez Moragón E, Banas Conejero D, Sánchez Herrero MG; REDES Study Group. REal worlD Effectiveness and Safety of Mepolizumab in a Multicentric Spanish Cohort of Asthma Patients Stratified by Eosinophils: The REDES Study. Drugs. 2021 Oct;81(15):1763-1774. doi: 10.1007/s40265-021-01597-9. Epub 2021 Sep 29. Erratum in: Drugs. 2021 Oct 21;: PMID: 34586602; PMCID: PMC8550660.
-
Elliott EI, Sutterwala FS. Initiation and perpetuation of NLRP3 inflammasome activation and assembly. Immunol Rev. 2015 May;265(1):35-52. doi: 10.1111/imr.12286. PMID: 25879282; PMCID: PMC4400874.
-
Fahy JV, Fleming HE, Wong HH, Liu JT, Su JQ, Reimann J, Fick RB Jr, Boushey HA. The effect of an anti-IgE monoclonal antibody on the early- and late-phase responses to allergen inhalation in asthmatic subjects. Am J Respir Crit Care Med. 1997 Jun;155(6):1828-34. doi: 10.1164/ajrccm.155.6.9196082. PMID: 9196082.
-
Fildan AP, Rajnoveanu RM, Cirjaliu R, Pohrib I, Tudorache E, Ilie AC, Oancea C, Tofolean D. Biological therapies targeting the type 2 inflammatory pathway in severe asthma (Review). Exp Ther Med. 2021 Nov;22(5):1263. doi: 10.3892/etm.2021.10698. Epub 2021 Sep 6. PMID: 34603531; PMCID: PMC8453334.
-
Flood-Page PT, Menzies-Gow AN, Kay AB, Robinson DS. Eosinophil's role remains uncertain as anti-interleukin-5 only partially depletes numbers in asthmatic airway. Am J Respir Crit Care Med. 2003 Jan 15;167(2):199-204. doi: 10.1164/rccm.200208-789OC. Epub 2002 Oct 17. PMID: 12406833.
-
Gauvreau GM, O'Byrne PM, Boulet LP, Wang Y, Cockcroft D, Bigler J, FitzGerald JM, Boedigheimer M, Davis BE, Dias C, Gorski KS, Smith L, Bautista E, Comeau MR, Leigh R, Parnes JR. Effects of an anti-TSLP antibody on allergen-induced asthmatic responses. N Engl J Med. 2014 May 29;370(22):2102-10. doi: 10.1056/NEJMoa1402895. Epub 2014 May 20. PMID: 24846652.
-
Gour N, Wills-Karp M. IL-4 and IL-13 signaling in allergic airway disease. Cytokine. 2015 Sep;75(1):68-78. doi: 10.1016/j.cyto.2015.05.014. Epub 2015 Jun 9. PMID: 26070934; PMCID: PMC4532591.
-
Haldar P, Brightling CE, Hargadon B, Gupta S, Monteiro W, Sousa A, Marshall RP, Bradding P, Green RH, Wardlaw AJ, Pavord ID. Mepolizumab and exacerbations of refractory eosinophilic asthma. N Engl J Med. 2009 Mar 5;360(10):973-84. doi: 10.1056/NEJMoa0808991. Erratum in: N Engl J Med. 2011 Feb 10;364(6):588. PMID: 19264686; PMCID: PMC3992367.
-
Hammad H, Lambrecht BN. The basic immunology of asthma. Cell. 2021 Mar 18;184(6):1469-1485. doi: 10.1016/j.cell.2021.02.016. Epub 2021 Mar 11. Erratum in: Cell. 2021 Apr 29;184(9):2521-2522. PMID: 33711259.
-
Hanania NA, Alpan O, Hamilos DL, Condemi JJ, Reyes-Rivera I, Zhu J, Rosen KE, Eisner MD, Wong DA, Busse W. Omalizumab in severe allergic asthma inadequately controlled with standard therapy: a randomized trial. Ann Intern Med. 2011 May 3;154(9):573-82. doi: 10.7326/0003-4819-154-9-201105030-00002. Erratum in: Ann Intern Med. 2019 Oct 1;171(7):528. PMID: 21536936.
-
Hanania NA, Korenblat P, Chapman KR, Bateman ED, Kopecky P, Paggiaro P, Yokoyama A, Olsson J, Gray S, Holweg CT, Eisner M, Asare C, Fischer SK, Peng K, Putnam WS, Matthews JG. Efficacy and safety of lebrikizumab in patients with uncontrolled asthma (LAVOLTA I and LAVOLTA II): replicate, phase 3, randomised, double-blind, placebo-controlled trials. Lancet Respir Med. 2016 Oct;4(10):781-796. doi: 10.1016/S2213-2600(16)30265-X. Epub 2016 Sep 5. PMID: 27616196.
-
Hanania NA, Wenzel S, Rosén K, Hsieh HJ, Mosesova S, Choy DF, Lal P, Arron JR, Harris JM, Busse W. Exploring the effects of omalizumab in allergic asthma: an analysis of biomarkers in the EXTRA study. Am J Respir Crit Care Med. 2013 Apr 15;187(8):804-11. doi: 10.1164/rccm.201208-1414OC. PMID: 23471469.
-
Hart TK, Blackburn MN, Brigham-Burke M, Dede K, Al-Mahdi N, Zia-Amirhosseini P, Cook RM. Preclinical efficacy and safety of pascolizumab (SB 240683): a humanized anti-interleukin-4 antibody with therapeutic potential in asthma. Clin Exp Immunol. 2002 Oct;130(1):93-100. doi: 10.1046/j.1365-2249.2002.01973.x. PMID: 12296858; PMCID: PMC1906490.
-
Heffler E, Blasi F, Latorre M, Menzella F, Paggiaro P, Pelaia G, Senna G, Canonica GW; SANI Network. The Severe Asthma Network in Italy: Findings and Perspectives. J Allergy Clin Immunol Pract. 2019 May-Jun;7(5):1462-1468. doi: 10.1016/j.jaip.2018.10.016. Epub 2018 Oct 25. PMID: 30368004.
-
Hogan SP, Rosenberg HF, Moqbel R, Phipps S, Foster PS, Lacy P, Kay AB, Rothenberg ME. Eosinophils: biological properties and role in health and disease. Clin Exp Allergy. 2008 May;38(5):709-50. doi: 10.1111/j.1365-2222.2008.02958.x. Epub 2008 Apr 1. PMID: 18384431.
-
https://healthy-pregnancy-rohu.eu/. Accesat în 28.02.2022.
-
Humbert M, Taillé C, Mala L, Le Gros V, Just J, Molimard M; STELLAIR investigators. Omalizumab effectiveness in patients with severe allergic asthma according to blood eosinophil count: the STELLAIR study. Eur Respir J. 2018 May 10;51(5):1702523. doi: 10.1183/13993003.02523-2017. PMID: 29545284; PMCID: PMC6383600.
-
Kaur R, Chupp G. Phenotypes and endotypes of adult asthma: Moving toward precision medicine. J Allergy Clin Immunol. 2019 Jul;144(1):1-12. doi: 10.1016/j.jaci.2019.05.031. PMID: 31277742.
-
Kim RY, Pinkerton JW, Essilfie AT, Robertson AAB, Baines KJ, Brown AC, Mayall JR, Ali MK, Starkey MR, Hansbro NG, Hirota JA, Wood LG, Simpson JL, Knight DA, Wark PA, Gibson PG, O'Neill LAJ, Cooper MA, Horvat JC, Hansbro PM. Role for NLRP3 Inflammasome-mediated, IL-1β-Dependent Responses in Severe, Steroid-Resistant Asthma. Am J Respir Crit Care Med. 2017 Aug 1;196(3):283-297. doi: 10.1164/rccm.201609-1830OC. PMID: 28252317.
-
Koistinen V, Kauppi P, Idänpään-Heikkilä J, Veijalainen L, Iso-Mustajärvi I, Ylisaukko-Oja T, Mehtälä J, Viinanen A, Kilpeläinen M. Effectiveness of mepolizumab in patients with severe eosinophilic asthma: results from real-world clinical practice in Finland. J Asthma. 2022 Jan 30:1-11. doi: 10.1080/02770903.2021.2020813. Epub ahead of print. PMID: 35094632.
-
Kuruvilla ME, Lee FE, Lee GB. Understanding Asthma Phenotypes, Endotypes, and Mechanisms of Disease. Clin Rev Allergy Immunol. 2019 Apr;56(2):219-233. doi: 10.1007/s12016-018-8712-1. PMID: 30206782; PMCID: PMC6411459.
-
Lambrecht BN, Hammad H. The immunology of asthma. Nat Immunol. 2015 Jan;16(1):45-56. doi: 10.1038/ni.3049. PMID: 25521684.
-
Leckie MJ, ten Brinke A, Khan J, Diamant Z, O'Connor BJ, Walls CM, Mathur AK, Cowley HC, Chung KF, Djukanovic R, Hansel TT, Holgate ST, Sterk PJ, Barnes PJ. Effects of an interleukin-5 blocking monoclonal antibody on eosinophils, airway hyper-responsiveness, and the late asthmatic response. Lancet. 2000 Dec 23-30;356(9248):2144-8. doi: 10.1016/s0140-6736(00)03496-6. PMID: 11191542.
-
Ledford D, Busse W, Trzaskoma B, Omachi TA, Rosén K, Chipps BE, Luskin AT, Solari PG. A randomized multicenter study evaluating Xolair persistence of response after long-term therapy. J Allergy Clin Immunol. 2017 Jul;140(1):162-169.e2. doi: 10.1016/j.jaci.2016.08.054. Epub 2016 Nov 5. PMID: 27826098.
-
Levi-Schaffer F, Mankuta D. Omalizumab safety in pregnancy. J Allergy Clin Immunol. 2020 Feb;145(2):481-483. doi: 10.1016/j.jaci.2019.11.018. Epub 2019 Nov 26. PMID: 31778706.
-
Liu Y, Zhang S, Chen R, Wei J, Guan G, Zhou M, Dong N, Cao Y. Meta-analysis of randomized controlled trials for the efficacy and safety of anti-interleukin-13 therapy with lebrikizumab in patients with uncontrolled asthma. Allergy Asthma Proc. 2018 Sep 1;39(5):332-337. doi: 10.2500/aap.2018.39.4149. PMID: 30153886.
-
Marone G, Spadaro G, Braile M, Poto R, Criscuolo G, Pahima H, Loffredo S, Levi-Schaffer F, Varricchi G. Tezepelumab: a novel biological therapy for the treatment of severe uncontrolled asthma. Expert Opin Investig Drugs. 2019 Nov;28(11):931-940. doi: 10.1080/13543784.2019.1672657. Epub 2019 Oct 10. PMID: 31549891.
-
McGregor MC, Krings JG, Nair P, Castro M. Role of Biologics in Asthma. Am J Respir Crit Care Med. 2019 Feb 15;199(4):433-445. doi: 10.1164/rccm.201810-1944CI. PMID: 30525902; PMCID: PMC6835092.
-
Menzella F, Bertolini F, Biava M, Galeone C, Scelfo C, Caminati M. Severe refractory asthma: current treatment options and ongoing research. Drugs Context. 2018 Dec 5;7:212561. doi: 10.7573/dic.212561. PMID: 30534175; PMCID: PMC6284776.
-
Menzella F, Galeone C, Formisano D, Castagnetti C, Ruggiero P, Simonazzi A, Zucchi L. Real-life Efficacy of Omalizumab After 9 Years of Follow-up. Allergy Asthma Immunol Res. 2017 Jul;9(4):368-372. doi: 10.4168/aair.2017.9.4.368. PMID: 28497924; PMCID: PMC5446952.
-
Miralles López JC, Andújar-Espinosa R, Bravo-Gutiérrez FJ, Castilla-Martínez M, Flores-Martín I, Alemany-Francés ML, Pajarón-Fernández MJ, Mora González A, Valverde-Molina J, Pérez-Fernández V; RE-ASGRAMUR GROUP. Effectiveness of benralizumab in severe eosinophilic asthma under routine clinical practice. J Investig Allergol Clin Immunol. 2022 Feb 11:0. doi: 10.18176/jiaci.0793. Epub ahead of print. PMID: 35166673.
-
Mukherjee M, Aleman Paramo F, Kjarsgaard M, Salter B, Nair G, LaVigne N, Radford K, Sehmi R, Nair P. Weight-adjusted Intravenous Reslizumab in Severe Asthma with Inadequate Response to Fixed-Dose Subcutaneous Mepolizumab. Am J Respir Crit Care Med. 2018 Jan 1;197(1):38-46. doi: 10.1164/rccm.201707-1323OC. PMID: 28915080.
-
Mukherjee M, Lacy P, Ueki S. Eosinophil Extracellular Traps and Inflammatory Pathologies-Untangling the Web! Front Immunol. 2018 Nov 26;9:2763. doi: 10.3389/fimmu.2018.02763. PMID: 30534130; PMCID: PMC6275237.
-
Murphy K, Jacobs J, Bjermer L, Fahrenholz JM, Shalit Y, Garin M, Zangrilli J, Castro M. Long-term Safety and Efficacy of Reslizumab in Patients with Eosinophilic Asthma. J Allergy Clin Immunol Pract. 2017 Nov-Dec;5(6):1572-1581.e3. doi: 10.1016/j.jaip.2017.08.024. Erratum in: J Allergy Clin Immunol Pract. 2018 May - Jun;6(3):1095. PMID: 29122156.
-
Newcomb DC, Peebles RS Jr. Th17-mediated inflammation in asthma. Curr Opin Immunol. 2013 Dec;25(6):755-60. doi: 10.1016/j.coi.2013.08.002. Epub 2013 Sep 11. PMID: 24035139; PMCID: PMC3855890.
-
Normansell R, Walker S, Milan SJ, Walters EH, Nair P. Omalizumab for asthma in adults and children. Cochrane Database Syst Rev. 2014 Jan 13;(1):CD003559. doi: 10.1002/14651858.CD003559.pub4. PMID: 24414989.
-
Ortega H, Hahn B, Bogart M, Bell CF, Bancroft T, Chastek B, Llanos JP. Impact of mepolizumab on exacerbations in severe asthma: Results from a U.S. insurance claims data base. Allergy Asthma Proc. 2020 Sep 1;41(5):341-347. doi: 10.2500/aap.2020.41.200043. PMID: 32867888.
-
Ortega HG, Yancey SW, Mayer B, Gunsoy NB, Keene ON, Bleecker ER, Brightling CE, Pavord ID. Severe eosinophilic asthma treated with mepolizumab stratified by baseline eosinophil thresholds: a secondary analysis of the DREAM and MENSA studies. Lancet Respir Med. 2016 Jul;4(7):549-556. doi: 10.1016/S2213-2600(16)30031-5. Epub 2016 May 10. PMID: 27177493.
-
Pavord ID, Korn S, Howarth P, Bleecker ER, Buhl R, Keene ON, Ortega H, Chanez P. Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial. Lancet. 2012 Aug 18;380(9842):651-9. doi: 10.1016/S0140-6736(12)60988-X. PMID: 22901886.
-
Pelaia C, Calabrese C, Terracciano R, de Blasio F, Vatrella A, Pelaia G. Omalizumab, the first available antibody for biological treatment of severe asthma: more than a decade of real-life effectiveness. Ther Adv Respir Dis. 2018 Jan-Dec;12:1753466618810192. doi: 10.1177/1753466618810192. PMID: 30400762; PMCID: PMC6236630.
-
Perez-de-Llano L, Tran T, Al-Ahmad M, Alacqua M, Bulathsinhala L, Busby J, Canonica G, Carter V, Chaudhry I, Christoff G, Cosio BG. Characterization of eosinophilic and non-eosinophilic severe asthma phenotypes and proportion of patients with these phenotypes in the International Severe Asthma Registry (ISAR). Am J Respir Crit Care Med. 2020 Jan 1;201:A4525.
-
Pfaller B, José Yepes-Nuñez J, Agache I, Akdis CA, Alsalamah M, Bavbek S, Bossios A, Boyman O, Chaker A, Chan S, Chatzipetrou A, du Toit G, Jutel M, Kauppi P, Kolios A, Li C, Matucci A, Marson A, Bendien S, Palomares O, Rogala B, Szepfalusi Z, Untersmayr E, Vultaggio A, Eiwegger T. Biologicals in atopic disease in pregnancy: An EAACI position paper. Allergy. 2021 Jan;76(1):71-89. doi: 10.1111/all.14282. PMID: 32189356.
-
Reddel HK, Bacharier LB, Bateman ED, Brightling CE, Brusselle GG, Buhl R, Cruz AA, Duijts L, Drazen JM, FitzGerald JM, Fleming LJ, Inoue H, Ko FW, Krishnan JA, Levy ML, Lin J, Mortimer K, Pitrez PM, Sheikh A, Yorgancioglu AA, Boulet LP. Global Initiative for Asthma Strategy 2021: Executive Summary and Rationale for Key Changes. J Allergy Clin Immunol Pract. 2022 Jan;10(1S):S1-S18. doi: 10.1016/j.jaip.2021.10.001. Epub 2021 Oct 28. PMID: 34718211.
-
Reddel HK, Taylor DR, Bateman ED, Boulet LP, Boushey HA, Busse WW, Casale TB, Chanez P, Enright PL, Gibson PG, de Jongste JC, Kerstjens HA, Lazarus SC, Levy ML, O'Byrne PM, Partridge MR, Pavord ID, Sears MR, Sterk PJ, Stoloff SW, Sullivan SD, Szefler SJ, Thomas MD, Wenzel SE; American Thoracic Society/European Respiratory Society Task Force on Asthma Control and Exacerbations. An official American Thoracic Society/European Respiratory Society statement: asthma control and exacerbations: standardizing endpoints for clinical asthma trials and clinical practice. Am J Respir Crit Care Med. 2009 Jul 1;180(1):59-99. doi: 10.1164/rccm.200801-060ST. PMID: 19535666.
-
Ricciardolo FLM, Sorbello V, Folino A, Gallo F, Massaglia GM, Favatà G, Conticello S, Vallese D, Gani F, Malerba M, Folkerts G, Rolla G, Profita M, Mauad T, Di Stefano A, Ciprandi G. Identification of IL-17F/frequent exacerbator endotype in asthma. J Allergy Clin Immunol. 2017 Aug;140(2):395-406. doi: 10.1016/j.jaci.2016.10.034. Epub 2016 Dec 5. PMID: 27931975.
-
Rodrigo GJ, Neffen H, Castro-Rodriguez JA. Efficacy and safety of subcutaneous omalizumab vs placebo as add-on therapy to corticosteroids for children and adults with asthma: a systematic review. Chest. 2011 Jan;139(1):28-35. doi: 10.1378/chest.10-1194. Epub 2010 Aug 5. PMID: 20688929.
-
Rossjohn J, McKinstry WJ, Woodcock JM, McClure BJ, Hercus TR, Parker MW, Lopez AF, Bagley CJ. Structure of the activation domain of the GM-CSF/IL-3/IL-5 receptor common beta-chain bound to an antagonist. Blood. 2000 Apr 15;95(8):2491-8. PMID: 10753826.
-
Salter BM, Oliveria JP, Nusca G, Smith SG, Watson RM, Comeau M, Sehmi R, Gauvreau GM. Thymic stromal lymphopoietin activation of basophils in patients with allergic asthma is IL-3 dependent. J Allergy Clin Immunol. 2015 Dec;136(6):1636-1644. doi: 10.1016/j.jaci.2015.03.039. Epub 2015 May 9. PMID: 25962901.
-
Sehmi R, Lim HF, Mukherjee M, Huang C, Radford K, Newbold P, Boulet LP, Dorscheid D, Martin JG, Nair P. Benralizumab attenuates airway eosinophilia in prednisone-dependent asthma. J Allergy Clin Immunol. 2018 Apr;141(4):1529-1532.e8. doi: 10.1016/j.jaci.2018.01.008. Epub 2018 Jan 31. PMID: 29382593.
-
Seif F, Khoshmirsafa M, Aazami H, Mohsenzadegan M, Sedighi G, Bahar M. The role of JAK-STAT signaling pathway and its regulators in the fate of T helper cells. Cell Commun Signal. 2017 Jun 21;15(1):23. doi: 10.1186/s12964-017-0177-y. PMID: 28637459; PMCID: PMC5480189.
-
Teach SJ, Gill MA, Togias A, Sorkness CA, Arbes SJ Jr, Calatroni A, Wildfire JJ, Gergen PJ, Cohen RT, Pongracic JA, Kercsmar CM, Khurana Hershey GK, Gruchalla RS, Liu AH, Zoratti EM, Kattan M, Grindle KA, Gern JE, Busse WW, Szefler SJ. Preseasonal treatment with either omalizumab or an inhaled corticosteroid boost to prevent fall asthma exacerbations. J Allergy Clin Immunol. 2015 Dec;136(6):1476-1485. doi: 10.1016/j.jaci.2015.09.008. Epub 2015 Oct 27. PMID: 26518090; PMCID: PMC4679705.
-
Trischler J, Bottoli I, Janocha R, Heusser C, Jaumont X, Lowe P, Gautier A, Pethe A, Woessner R, Zerwes HG, Zielen S. Ligelizumab treatment for severe asthma: learnings from the clinical development programme. Clin Transl Immunology. 2021 Mar 15;10(3):e1255. doi: 10.1002/cti2.1255. PMID: 33747510; PMCID: PMC7958305.
-
Upham JW, Le Lievre C, Jackson DJ, Masoli M, Wechsler ME, Price DB; Delphi Panel. Defining a Severe Asthma Super-Responder: Findings from a Delphi Process. J Allergy Clin Immunol Pract. 2021 Nov;9(11):3997-4004. doi: 10.1016/j.jaip.2021.06.041. Epub 2021 Jul 13. PMID: 34271216.
-
Varricchi G, Bagnasco D, Borriello F, Heffler E, Canonica GW. Interleukin-5 pathway inhibition in the treatment of eosinophilic respiratory disorders: evidence and unmet needs. Curr Opin Allergy Clin Immunol. 2016 Apr;16(2):186-200. doi: 10.1097/ACI.0000000000000251. PMID: 26859368; PMCID: PMC4768650.
-
Wechsler ME, Hickey L, Garin M, Chauhan A. Efficacy of Reslizumab Treatment in Exacerbation-Prone Patients with Severe Eosinophilic Asthma. J Allergy Clin Immunol Pract. 2020 Nov-Dec;8(10):3434-3442.e4. doi: 10.1016/j.jaip.2020.06.009. Epub 2020 Jun 18. PMID: 32562877.
-
Wechsler ME, Ruddy MK, Pavord ID, Israel E, Rabe KF, Ford LB, Maspero JF, Abdulai RM, Hu CC, Martincova R, Jessel A, Nivens MC, Amin N, Weinreich DM, Yancopoulos GD, Goulaouic H. Efficacy and Safety of Itepekimab in Patients with Moderate-to-Severe Asthma. N Engl J Med. 2021 Oct 28;385(18):1656-1668. doi: 10.1056/NEJMoa2024257. PMID: 34706171.
-
Wenzel S, Ford L, Pearlman D, Spector S, Sher L, Skobieranda F, Wang L, Kirkesseli S, Rocklin R, Bock B, Hamilton J, Ming JE, Radin A, Stahl N, Yancopoulos GD, Graham N, Pirozzi G. Dupilumab in persistent asthma with elevated eosinophil levels. N Engl J Med. 2013 Jun 27;368(26):2455-66. doi: 10.1056/NEJMoa1304048. Epub 2013 May 21. PMID: 23688323.
-
Wright TK, Gibson PG, Simpson JL, McDonald VM, Wood LG, Baines KJ (2016). Neutrophil Extracellular Traps Are Associated with Inflammation in Chronic Airway Disease. Respirology. 2016;21:467–475. doi:10.1111/resp.12730.
-
Zhang Y, Cheng J, Li Y, He R, Pan P, Su X, Hu C. The Safety and Efficacy of Anti-IL-13 Treatment with Tralokinumab (CAT-354) in Moderate to Severe Asthma: A Systematic Review and Meta-Analysis. J Allergy Clin Immunol Pract. 2019 Nov-Dec;7(8):2661-2671.e3. doi: 10.1016/j.jaip.2019.05.030. Epub 2019 May 29. PMID: 31152798.
Articole din ediţiile anterioare
Impactul clinic şi managementul comorbidităţilor în astmul sever
Pacienţii cu astm sever reprezintă o minoritate din populaţia totală cu astm (3-10% dintre aceştia), afecţiunea fiind responsabilă pentru 60% din c...
Rolul diagnosticului molecular în anafilaxie
Anafilaxia reprezintă o reacţie alergică severă, cu potenţial letal, caracterizată prin debutul acut al simptomelor şi care necesită intervenţie me...