The diversity of physiological effects and pharmacological actions of glucocorticoids determines their use in the treatment of diseases and pathological conditions in rheumatology, nephrology, allergology, hematology, transplantology, hepatology, neurology, intensive care etc. Experimental and clinical research in recent decades has revealed new aspects of pharmacological and pleiotropic effects based on elucidation of the genomic and non-genomic mechanism; influence on different ways of transmitting and regulating the intracellular signal; variability of cellular and tissue responses depending on physiological or pathological condition; the diversity of pharmacological or adverse effects depending on the dose and dosing regimen, purpose of treatment; pharmacokinetic characteristics depending on the structure and physicochemical properties. The pharmacodynamic and pharmacokinetic aspects of glucocorticoids allow the practitioner to rationally select the glucocorticoid in order to perform an effective and harmless therapy.
Aspecte de farmacologie clinică a glucocorticoizilor
Aspects of clinical pharmacology of glucocorticoids
First published: 27 mai 2022
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Farm.206.3.2022.6521
Abstract
Rezumat
Diversitatea acţiunilor fiziologice şi a efectelor farmacologice ale glucocorticoizilor determină utilizarea acestora în tratamentul maladiilor şi stărilor patologice în reumatologie, nefrologie, alergologie, hematologie, transplantologie, hepatologie, neurologie, terapie intensivă etc. Cercetările experimentale şi clinice din ultimele decenii au relevat aspecte noi ale efectelor farmacologice şi pleiotrope bazate pe elucidarea: mecanismului genomic şi nongenomic; influenţei asupra diferitelor căi de transmitere şi reglare a semnalului intracelular; variabilităţii răspunsurilor celulare şi tisulare în funcţie de starea fiziologică sau patologică; diversităţii efectelor farmacologice sau adverse în funcţie de doze şi de regimul de dozare, scopul tratamentului; particularităţilor farmacocinetice în funcţie de structură şi de proprietăţile fizico-chimice. Aspectele farmacodinamice şi farmacocinetice ale glucocorticoizilor permit medicului practician să selecteze raţional glucocorticoidul pentru a efectua o terapie eficientă şi inofensivă.
Efectele terapeutice ale glucocorticoizilor (GC) sunt cunoscute şi utilizate de mai bine de 70 de ani, dar descifrarea complexităţii răspunsului organismului la GC rămâne o provocare. Rezultatul final este o combinaţie dintre răspunsurile diferite şi uneori opuse determinate de tipuri de celule, care depind de programele transcripţionale specifice rezultate din integrarea semnalului complex, care fac foarte dificilă prezicerea efectelor terapeutice ale GC într-o anumită maladie şi/sau stare patologică. Studii recente experimentale aprofundate au contribuit la elucidarea acestei complexităţi şi au arătat că răspunsul molecular la GC a fost specific tipului de celule şi de ţesuturi şi era reglementat de micromediul celular, care ar putea modela receptorul glucocorticoid. Aceste constatări vor diversifica practica clinică de administrare a GC la pacienţii cu diverse maladii şi stări patologice. Astfel, mai ales în ultimele două decenii, s-au extins datele referitoare la mecanismul de acţiune, realizarea efectelor farmacologice, căile de administrare, principiile de dozare, durata terapiei, tactica administrării, asocierea cu alte medicamente, reacţiile adverse şi mecanismele care stau la baza lor(8,12,15).
Bolile inflamatorii constituie una dintre problemele majore de sănătate în societatea modernă. Ele sunt cauzate de un sistem imunitar aberant patologic, care fie îşi atacă propriile celule (autoimunitate), fie reacţionează la antigeni străini inofensivi (alergie). În alte cazuri, cum ar fi leziunea pulmonară acută (ALI) şi COVID-19, răspunsul imun este inadecvat de puternic. Indiferent de antigen, inflamaţia patologică are ca rezultat leziuni tisulare, care pot influenţa calitatea vieţii şi pot culmina cu insuficienţă poliorganică letală. Bolile autoimune (scleroza multiplă, maladiile inflamatorii intestinale, artrita reumatoidă etc.) şi cele alergice (astmul bronşic, dermatita de contact etc.) sunt în creştere, iar pentru tratamentul lor sunt propuse o multitudine de terapii, inclusiv anticorpi monoclonali, care pot fi utilizate pentru a încetini progresia proceselor inflamatorii, dar niciun alt tratament nu are succes la fel ca GC(14).
Glucocorticoizii sunt cea mai prescrisă clasă de medicamente la nivel mondial, iar eficacitatea lor în tratamentul inflamaţiei acute sau cronice, a maladiilor alergice, a stărilor patologice acute (şoc anafilactic, edem pulmonar, COVID-19 etc.) este incontestabilă. Dezvoltarea GC sintetici cu potenţă şi specificitate superioare a optimizat managementul acestor maladii şi stări patologice, încât în zilele noastre este dificil să ne imaginăm medicina fără ele. Cu toate acestea, GC nu sunt perfecţi, deoarece tratamentul poate fi însoţit de o multitudine de efecte secundare mai mult sau mai puţin severe (osteoporoză, atrofie musculară, hipertensiune arterială, hiperglicemie, rezistenţă la insulină, diabet zaharat de tip 2 etc.). Prin urmare, există încă o necesitate stringentă de a optimiza terapia cu GC(14).
Glucocorticoizii sunt medicamente extrem de eficiente în tratamentul diferitelor maladii şi stări patologice, prin suprimarea inflamaţiei şi modularea sistemul imunitar. Mecanismele de acţiune şi efectele pleiotrope se consideră a fi datorate reglării aproximativ a 20% din întregul genom prin transactivarea sau transrepresia unor gene implicate în sinteza citokinelor, chemokinelor, moleculelor de adeziune, receptorilor, enzimelor, mediatorilor şi altor proteine, responsabile de efectele genomice şi nongenomice. Cu toate acestea, înţelegerea imunoreglării mediate de GC are încă lacune substanţiale, mai ales în ceea ce priveşte efectele GC asupra anumitor tipuri de celule şi ţintele lor celulare cheie, în anumite stări de boală şi acţiunile pe care aceşti hormoni le induc în linii mari în celule şi ţesuturi, faţă de cele care sunt unice pentru sistemul imunitar(6).
Steroizii reprezintă un număr mare de substanţe cu structură steroidă care include colesterolul, hormonii sexuali şi corticosteroizii. Corticosteroizii (corticoizi) sunt substanţele sintetizate de corticosuprarenale care se subdivizează în corticosteroizi propriu-zişi (conţin 21 de atomi de carbon) şi androgeni (conţin 19 atomi de carbon). Corticosteroizii se subdivizează în glucocorticoizi (după influenţa asupra metabolismului glucidic) şi mineralocorticoizi (influenţa asupra metabolismului electroliţilor). Glucocorticoizii reprezintă corticosteroizi sintetici cu acţiune antiinflamatoare şi influenţă asupra metabolismului glucidic (capacitatea de a creşte nivelul glucozei în sânge şi depunerea glicogenului în ficat) şi a celui proteic, dar cu efect slab sau absent asupra metabolismului electroliţilor(15).
După provenienţă, glucocorticoizii se subdivizează în naturali (cortizol, hidrocortizon) şi sintetici: nefluoraţi (prednison, prednisolon, metilprednisolon) şi fluoraţi (triamcinolonă, dexametazonă, betametazonă, parametazonă, fluprednisolon). Glucocorticoizii sintetici sunt mai activi decât cei naturali şi eficienţi în doze mai mici şi au un raport diferit de acţiune glucocorticoidă/mineralocorticoidă. Acest raport este mai benefic la GC fluoraţi, dar concomitent aceştia au şi o absorbţie redusă la utilizarea topică, cu efecte sistemice mai mici. Glucocorticoizii fluoraţi, concomitent cu activitatea antiinflamatoare mai mare, au şi reacţii adverse (RA) mai semnificative. Printre RA ale triamcinolonei se numără: atrofia musculară, sindromul Cushing şi dereglări psihice, dar stimulează mai puţin apetitul. Preparatele fluorate prezintă o tolerabilitate mai redusă, din aceste considerente fiind indicate pentru cure scurte şi intense, deoarece exercită efect inhibitor puternic asupra ţesutului limfoid şi destabilizarea hipofizei, cu risc crescut de miopatie, care limitează utilizarea de durată a acestora(8,15).
Glucocorticoizii reglează inflamaţia prin mecanisme pleiotrope, iar efectele lor asupra răspunsurilor imune depind de tipul celulei, de maladie, de doză şi de momentul administrării, dacă precedă sau urmează expunerii la agentul inflamator. Glucocorticoizii în macrofage inhibă expresia citokinelor proinflamatorii (IL-1β, IL-6, IL-12, IL-17, TNF-alfa), factorului de stimulare a coloniilor granulocite-macrofage (GMCSF), nitric oxid sintazei inductibile (iNOS) şi inhibă ciclooxigenaza, atenuând astfel eliberarea prostaglandinelor. În celulele endoteliale, GC inhibă expresia moleculelor de adeziune precum E-selectina, molecula de adeziune intercelulară 1 (ICAM1) şi molecula de adeziune a celulelor vasculare 1 (VCAM1). În celulele imune, inhibă expresia integrinelor, precum antigenul 1 asociat funcţiei limfocitare (LFA1) şi antigenul tardiv 4, atenuând astfel recrutarea leucocitelor. Glucocorticoizii polarizează macrofagele către fenotipul antiinflamator, care secretă mai mult IL-10 şi factorul inductor al creşterii şi transformării celulare-β (TGFβ) şi promovează eferocitoza şi eliminarea reziduurilor celulare datorită expresiei crescute a moleculelor de captare, favorizând astfel rezolvarea inflamaţiei. Reacţia la antigeni este reglată de GC prin influenţarea prezentării antigenului, precum şi prin modularea activităţii celulelor T. Glucocorticoizii inhibă maturarea, promovează apoptoza şi atenuează prezentarea antigenului în celulele dendritice, reglează timopoieza prin inducerea apoptozei limfocitelor şi atenuează semnalizarea receptorilor celulelor T. Astfel, GC în concentraţii terapeutice exercită efecte antiinflamatoare puternice atât asupra sistemului imun înnăscut, cât şi adaptiv. Datorită acestor efecte antiinflamatorii, GC reprezintă un pilon al terapiilor imunosupresive. Glucocorticoizii sintetici (dexametazonă, metilprednisolon, prednisolon) prezintă o potenţă mai mare în comparaţie cu cortizolul datorită timpului de înjumătăţire mai mare în plasmă, absorbţiei mai bune şi reducerii legării cu globulinele specifice(2,7).
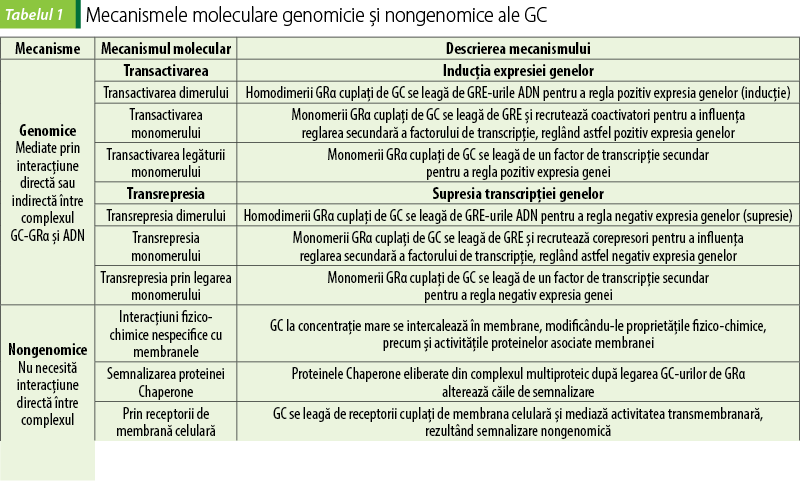
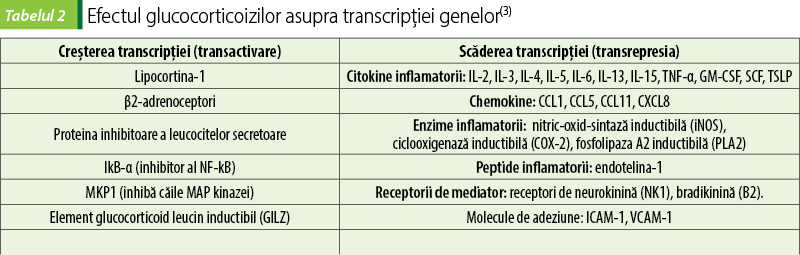
Pentru GC sunt descrise două mecanisme de acţiune: genomic şi nongenomic (figura 1). Mecanismele genomice sunt activate după ce GC, ca molecule lipofile, traversează membranele celulare şi se leagă de complexul multiproteic de chaperone (Hsp40, Hsp56, Hsp70 şi Hsp90), imunofiline care acţionează ca co-chaperone (p23, FKBP51, FKBP52) şi receptorul glucocorticoid citoplasmatic intracelular (cGR). După legarea şi disocierea ulterioară de aceste proteine, complexul GC-cGR se translocă în nucleu şi se leagă de situsurile ADN-ului, cunoscute sub numele de elemente de răspuns la glucocorticoizi. Rezultatul final este o transrepresie a genelor care codifică citokine inflamatorii (interleukina-6, interleukina-8, TNF‑alfa) şi o transactivare a genelor antiinflamatorii (interleukina-10, IκB, anexina A1 sau lipocortina 1), precum şi influenţează procese metabolice importante în celulă. Glucocorticoizii stimulează producerea de lipocortină, care blochează fosfolipaza A2 cu inhibarea cascadei acidului arachidonic şi sintezei prostaglandinelor şi leucotrienelor. Blocada factorului nuclear de transcripţie (NF-kB) determină inhibarea sintezei IL-1, IL-6, TNF-alfa, metaloproteinazelor, blocarea NOS inductibile şi declanşarea stresului oxidativ şi a reacţiilor inflamatorii sistemice. Glucocorticoizii, prin modularea complexă a citokinelor, interleukinelor şi moleculelor de adeziune, precum şi prin implicarea în procesele de proliferare şi sinteză a proteinelor, blochează hiperactivarea verigilor celulare ale răspunsului imunoinflamator, inclusiv macrofage, monocite, celule endoteliale, bazofile, fibroblaşti şi limfocite. Mecanismele genomice sunt în general evidente la 30 de minute după administrarea GC(1,2,4,8,10,14,16,19,20).
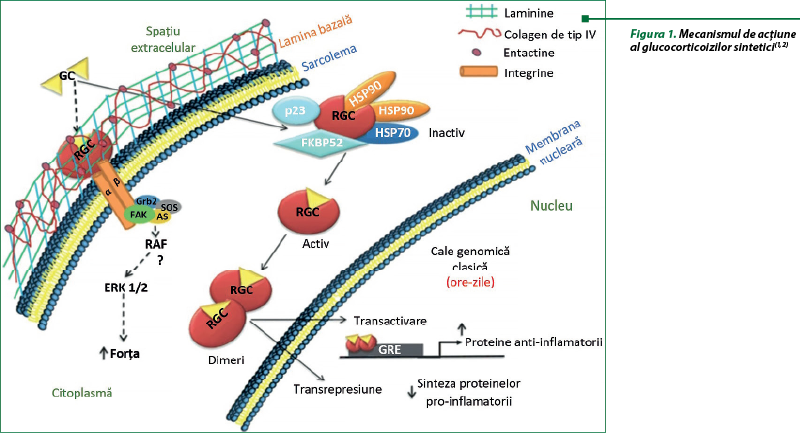
Mecanismele nongenomice produc efecte în câteva secunde sau minute după administrare. Aceste efecte nongenomice sunt mediate prin modificări ale membranelor celulare, inactivarea enzimei fosfolipazei A2 şi interacţiunea cu receptorii glucocorticoizi membranari (mGR) (figura 1). Se evidenţiază următoarele grupe de efecte nongenomice: a) stabilizarea membranelor celulare şi a organelor, diminuarea permeabilităţii endoteliului capilarelor, protecţia celulelor de acţiunea citotoxică; b) inhibarea activităţii fagocitare a mononuclearelor; c) diminuarea migrării leucocitelor în focarul inflamator; d) reducerea activităţii funcţionale a endoteliocitelor, monocitelor, macrofagelor, granulocitelor neutrofile şi fibroblaştilor. Efectul final este reprezentat de scăderea activităţii şi proliferarea limfocitelor(2,10,11).
Mecanismul nongenomic cel mai bine descris implică activarea nitric‑oxid‑sintetazei endoteliale (eNOS). Glucocorticoizii stimulează activitatea fosfatidilinozitol-3-hidroxikinazei (PI3K) cu fosforilarea Akt, care fosforilează şi activează eNOS cu producerea de oxid nitric. În condiţii experimentale, GC, prin activarea căii PI3K-Akt-eNOS, protejează împotriva leziunilor induse de ischemie sau de reperfuzie. Un alt mecanism de inhibare a inflamaţiei induse de GC implică scăderea stabilităţii ARNm pentru genele proteinelor inflamatorii, precum factorul de creştere a endoteliului vascular şi ciclooxigenaza 2 (figura 2). Glucocorticoizii acţionează în mod evident asupra ţintelor prin diverse mecanisme de control al inflamaţiei(13,16).
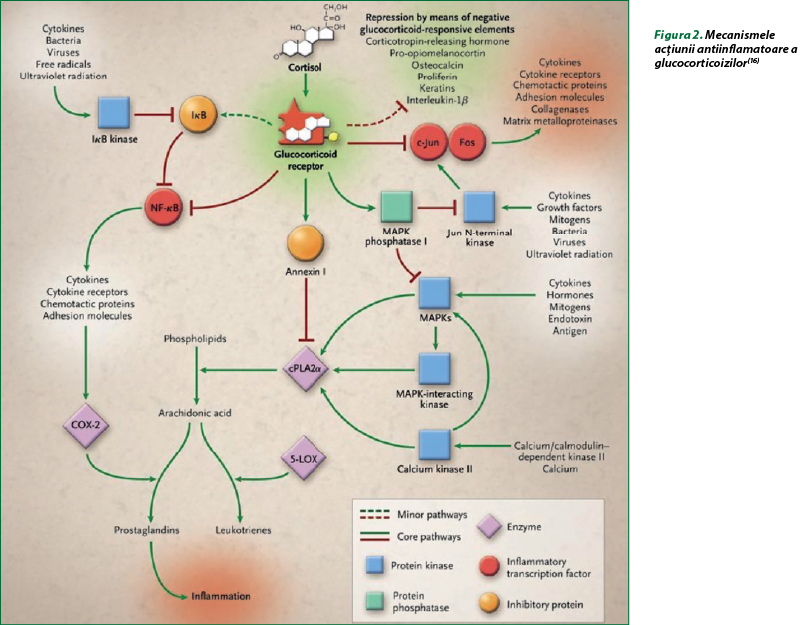
Mecanismele genomice şi nongenomice se caracterizează prin transactivarea sau transrepresia mai multor gene implicate în procesele inflamatorii (tabelele 1 şi 2).
Identificarea mecanismelor genomice şi nongenomice este importantă din punct de vedere clinic datorită profilului de efecte adverse diferenţiale şi activării diferenţiale exercitate de dozele şi preparatele de GC utilizate în prezent. Efectele genomice sunt activate la doze mici (<7,5 mg echivalent prednison/zi) până la moderate ale GC (7,5–30 mg echivalent prednison/zi), iar receptorii GR sunt saturaţi progresiv la doze de peste 30 până la 50 mg/zi. Potrivit acestui concept farmacologic, dozele de prednison de peste 50 mg/zi se apropie de plafonul saturaţiei cGR, cu beneficii antiinflamatorii suplimentare limitate, crescând totuşi riscul de efecte adverse. Unele efecte adverse, precum necroza osoasă avasculară, depind de doza maximă de GC şi de durata expunerii la doze mari (viteza de diminuare) (figura 3)(19).
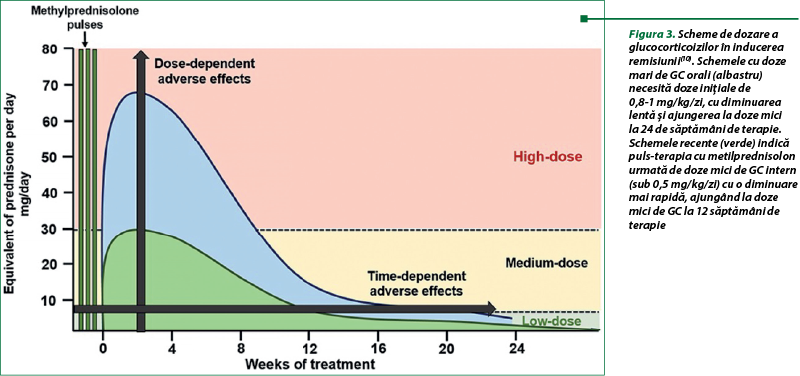
Mecanismele nongenomice sunt activate cu doze foarte mari de GC, precum pulsterapia cu metilprednisolon. Această activare începe la doze de prednison de 100 mg şi atinge maximul în jurul valorii de 250 până la 500 mg. Spre deosebire de efectele mediate de mecanismele genomice, mecanismele nongenomice sunt considerate a fi asociate cu mai puţine efecte adverse, cel puţin în parte datorită duratei scurte de administrare. Activarea relativă a efectelor genomice şi nongenomice diferă între diverse preparate de GC. De exemplu, dexametazona şi metilprednisolonul activează calea nongenomică cu o rată de 3-5 ori mai mare decât prednisolonul. GC diferă după potenţă (exprimată în raport cu hidrocortizonul), efectele mineralocorticoide şi durata suprimării axei hipotalamus-hipofiză-corticosuprarenale (HHC). Timpul de administrare (suprimare mai mică atunci când sunt administrate dimineaţa) şi cronofarmacologia contribuie la gradul de suprimare de GC a axei şi, în consecinţă, la severitatea efectelor adverse. Înţelegerea acestor mecanisme este importantă pentru a dezvolta strategii de limitare a toxicităţii GC. Strategiile de administrare a GC utilizate în studiile clinice recente au inclus pulsterapia intravenoasă cu metilprednisolon, care activează căi nongenomice, urmată de doze orale mai mici de GC şi o diminuare mai rapidă a GC. Această strategie îşi propune să menţină eficacitatea tratamentului, limitând în acelaşi timp efectele adverse cauzate de GC(10).
Glucocorticoizii sintetici sunt utilizaţi pe scară largă pentru tratamentul a numeroase afecţiuni acute sau cronice, cu dezvoltarea efectului antiinflamator şi/sau imunodepresiv. Expunerea acută este asociată cu o reducere a inflamaţiei, în timp ce expunerea cronică are acţiune imunodepresivă. După administrare se observă o scădere aproape imediată a limfocitelor şi a bazofilelor din sânge, precum şi o creştere a neutrofilelor, în timp ce inducţia de interleukine antiinflamatoare şi mediatori imunodepresivi (inhibitorul factorului de transcripţie NFκB) se observă după câteva ore. Concomitent, reacţiile adverse ale GC sintetici sunt fundamental aceleaşi cu cele asociate cu nivelurile atipice de cortizol endogen, datorate exceselor sau deficienţelor locale în ţesuturile periferice, care rezultă din secreţia atipică de cortizol şi/sau transducţia anormală a semnalului. Astfel, nivelurile scăzute de GC sunt asociate cu răspunsuri inflamatorii mai severe din cauza creşterii mediatorilor proinflamatori, în timp ce nivelurile crescute de GC, în special în absenţa inflamaţiei, prezintă un risc crescut de infecţii şi probleme imune ca urmare a proprietăţilor imunodepresive(17).
Structurile chimice ale glucocorticoizilor sunt similare cu ale compuşilor endogeni, dar cu modificări pentru a îmbunătăţi proprietăţile terapeutice şi a reduce în acelaşi timp efectele adverse. Prin prisma acţiunii primare a GC asupra receptorilor, se întreprind cercetări pentru dezvoltarea agoniştilor selectivi ai receptorilor glucocorticoizi şi cu activitate minimă asupra receptorilor mineralocorticoizi. Se estimează că activitatea mineralocorticoidă este asociată cu multe dintre proprietăţile de transactivare care duc la efecte adverse, în timp ce activitatea glucocorticoidă este asociată cu multe dintre proprietăţile de transrepresie care suprimă genele proinflamatorii. Efectele terapeutice mediate de receptorii glucocorticoizi sunt însoţite de supresia axei HHC. Hidrocortizonul manifestă activitate atât glucocorticoidă, cât şi mineralocorticoidă, prednisolonul şi metilprednisolonul au o acţiune mineralocorticoidă mai mică, iar triamcinolona, dexametazona şi betametazona practic nu manifestă activitate mineralocorticoidă. Efectele clinice ale GC sintetici depind de solubilitatea medicamentului, de rata de absorbţie, de afinitatea pentru receptori, de rata metabolică şi de doză, care variază în funcţie de medicament(17).
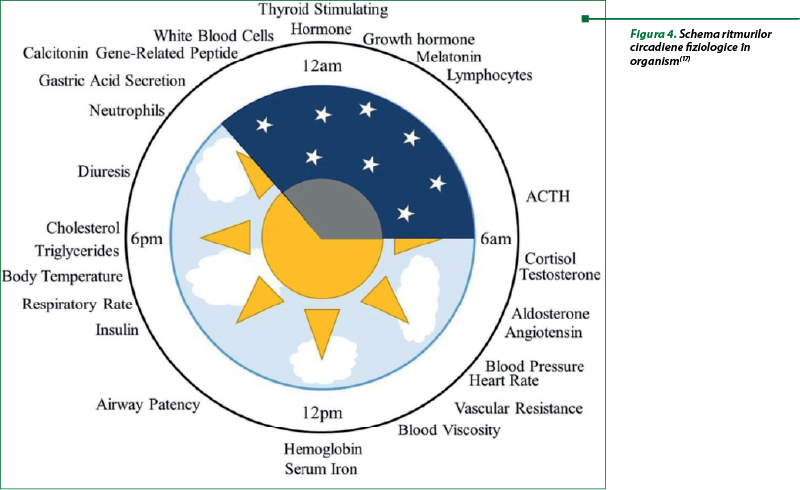
Aspectele cronofarmacologice ale efectelor pleiotrope ale GC necesită cunoştinţe despre căile implicate atât în efectele terapeutice, cât şi în efectele adverse, care vor promova dezvoltarea unor tratamente eficiente şi sigure. Timpul de concentraţie maximă pentru diferite funcţii fiziologice în raport cu ciclul de repaus-activitate la om necesită a fi luat în considerare pentru aprecierea beneficiilor schemelor selectate de tratament (figura 4). Beneficiile dozării cronofarmacologice pentru a minimiza perturbarea axei HHC sunt în general acceptate, dar legătura dintre cronofarmacologie şi alte efecte adverse necesită încă studii. Un exemplu de progres în acest scop este influenţa tratamentului cu GC asupra nivelului de glucoză şi a secreţiei de insulină. În condiţii normale, GC endogeni sunt responsabili pentru menţinerea homeostaziei glucozei. Niveluri crescute de glucoză sunt observate atât în urma dozelor de dimineaţă, cât şi a celor de seară de hidrocortizon, dar s-au observat efecte hiperglicemice reduse când este administrat dimineaţa. Aceste observaţii oferă dovezi că riscul de diabet indus de tratament poate fi minimizat prin momentul adecvat al administrării medicamentului. Un efect advers comun al tratamentului cronic cu GC implică perturbarea tensiunii arteriale (TA), posibil, prin influenţele asupra sistemului cardiovascular prin semnalizarea receptorului angiotensinei II. Excesul de GC determină osteoporoză prin transreprimarea genelor implicate în formarea osului. Impactul glucocorticoizilor asupra metabolismului osos şi mineral este atât dependent de doză, cât şi de timp, iar dozarea cronofarmacologică reprezintă o abordare potenţială pentru prevenirea efectelor adverse asupra sistemului osos prin sincronizarea dozării cu variaţia circadiană a diferenţierii şi turnoverului osteoblastelor şi osteoclastelor(17).
Nomenclatura dozelor glucocorticoizilor
Dozele de GC (după echivalentul presnisolonului administrat intern) se clasifică pe baza gradului de ocupare a receptorilor GC, a realizării efectelor genomice şi nongenomice, a frecvenţei dezvoltării şi gradului de manifestare a RA:
-
mici – până la 7,5 mg/zi (0,1-0,25 mg/kg/zi) – doze care ocupă sub 50% din receptorii de GC (RGC) şi sunt utilizate pentru terapia de întreţinere în maladiile reumatice; provoacă un număr minim de RA;
-
medii – 7,5-30 mg/zi (0,5 mg/kg/zi în mediu) – ocupă de la 50% până la 100% din RGC, sunt eficiente în maladiile reumatice primar-cronice; la utilizarea de durată, determină RA severe (osteoporoză etc.);
-
mari – 31-≤100 mg/zi (1-3 mg/kg/zi) – ocupă 100% din RGC şi determină manifestarea deplină a efectelor genomice; se recomandă în tratamentul maladiilor reumatice subacute (evoluţia subacută a lupusului eritematos), acutizări, nedeterminate de pericol vital; nu pot fi utilizate timp îndelungat din cauza RA grave;
-
foarte mari – peste 100 mg/zi (15-30 mg/kg/zi) – ocupă 100% din RGC, iar majorarea dozelor pot deregla farmacodinamia (pot leza receptorul însuşi), dar pot fi obţinute efecte terapeutice suplimentare, cauzate de influenţa asupra receptorilor membranari sau interacţiuni fizico-chimice cu membranele celulare; doze foarte mari sunt utilizate în evoluţia acută a lupusului eritematos sau în acutizări periculoase pentru viaţă; utilizarea de durată este contraindicată din cauza dezvoltării RA dramatice;
-
pulsterapia – peste 250 mg/zi – megadoze pe un timp foarte scurt, o dată/zi, timp de 1-5 zile; se bazează pe efectele nongenomice; eficiente în lupusul eritematos foarte activ şi determină regresul formelor grave, cu o frecvenţă relativ mică a RA(5,9,15,19).
-
fazele terapiei sistemice cu GC (prednisolon, metilprednisolon):
-
de inducţie – 1 mg/kg/zi repartizată în 2-3 prize la interval de 6-8 ore;
-
de consolidare – trecerea la administrarea GC o dată în orele dimineţei;
-
de micşorare a dozelor – depinde de doză, e posibil a trece la terapia alternativă la doze mici (administrarea dozei la orele 8.00 peste o zi);
-
de susţinere (întreţinere) – administrarea dozei minime eficiente(15).
-
La administrarea internă este necesar de reţinut că fiecare comprimat (tabletă) a preparatelor este de regulă echivalentă – prednisolon 5 mg cu 4 mg triamcinolonă şi metilpredisolon, cu 0,5-0,75 mg dexametazonă şi betametazonă, ceea ce face ca în cazul de substituţie a unui preparat cu altul să se schimbe comprimat pe comprimat. În majoritatea cazurilor în literatură calculul se face referitor la prednisolon şi prednison. Această regulă e valabilă la doze de prednisolon sub 100 mg, deoarece peste 100 mg sunt importante efectele nongenomice(8,15).
Pentru terapia de inducere a remisiunii şi pentru controlul proceselor patologice se recurge frecvent la doze mari de GC – 31-100 mg prednisolon, care se subdivizează în două prize – 2/3 dimineaţa şi 1/3 în prima jumătate a zilei (orele 15.00) în conformitate cu ritmurile circade de secreţie a corticosteroizilor endogeni. În unele situaţii, de exemplu, în procesul inflamator intens, administrarea în două prize poate fi insuficientă şi atunci se recomandă ca doza pentru 24 de ore să fie subdivizată în trei prize (2/3 dimineaţa, 1/6 ziua şi 1/6 seara). Acest regim al terapiei de inducere a remisiunii, de regulă, se foloseşte până la lichidarea simptomaticii de bază (în medie, 2-3 săptămâni) cu iniţierea etapei de micşorare a dozelor şi în primul rând a celor de seară sau la masă cu trecerea la administrarea într-o priză dimineaţa(5).
Terapia de durată cu GC se poate efectua prin administrarea GC după metoda: permanentă (neîntreruptă), alternantă sau intermitentă. Metoda alternantă se reduce la administrarea unei doze pentru 48 de ore (dublă, de regulă) în dimineaţa celei de-a doua zi, care se asociază cu o incidenţă mai mică a RA şi cu o inhibarea mai mică a funcţiei corticosuprarenalelor. În practică, deseori, această metodă nu este eficientă şi mai frecvent se recomandă după dispariţia manifestărilor patologice la etapa de suspendare a GC sau trecerea la terapia de întreţinere. Terapia intermitentă se reduce la administrarea dozei sumare pentru o săptămână în 3-4 zile cu o întrerupere pentru celelalte zile ale săptămânii cu aceleaşi beneficii ca şi la terapia alternantă(5).
Pentru utilizarea de durată a GC se recomandă metilprednisolonul datorită unei tolerabilităţi mai bune: mai rar, produce atrofia muşchilor şi a pielii; se recomandă la pacienţii cu surplus ponderal, hipertensiune arterială şi dereglări psihice. Prezenţa grupei metil (CH3) asigură inofensivitate faţă de evenimentele gastrointestinale. Triamcinolona şi dexametazona pot fi utilizate doar în cure scurte în cazul acutizărilor sau în caz de intoleranţă la prednisolon sau metilprednisolon. Introducerea atomului de flor a crescut acţiunea antiinflamatoare, dar şi incidenţa RA precum: inhibarea axei HHC, creşterea ponderală, dezvoltarea osteoporozei, a hipertensiunii arteriale, ulcerelor peptice, leziuni cutanate(5).
Pulsterapia
Această metodă se utilizează de mai bine de 50 de ani, când pentru prima dată s-a constatat că administrarea intravenoasă prin perfuzie a dozelor extrem de mari la pacienţii cu glomerulonefrită lupică cu înrăutăţirea rapidă a funcţiilor organismului s-a soldat cu o ameliorare a stării. Actualmente se disting câteva metode de pulsterapie: clasică (1000 mg metilprednisolon i.v. timp de 3 zile); midi pulsterapia (500 mg metilprednisolon i.v. timp de 3 zile), mini pulsterapia (250 mg metilprednisolon i.v. timp de 3 zile). Pulsterapia clasică implică perfuzia intravenoasă a dozelor extrem de mari (nu mai puţin de 1000 mg metilprednisolon) timp de trei zile consecutive cu un interval de 6 săptămâni. Infuzia se efectuează în 250 ml soluţie fiziologică sau 5% glucoză timp de 30-60 de minute cu o viteză de 60 de picături/minut. Această durată scurtă de administrare nu determină inhibarea funcţiei corticosuprarenale, deoarece, de regulă, peste 1-2 săptămâni funcţia sistemului hipofiză-corticosuprarenale se restabileşte, iar efectul clinic se menţine 4-12 săptămâni sau mai mult. Metoda mini puls-terapie prevede administrarea unor doze mai mici, de 250 mg metilprednisolon, trei zile. O variantă a pulsterapiei intravenoase este cea internă cu administrarea a 1 000 mg metilprednisolon, trei zile consecutive. După eficacitatea clinică şi frecvenţa RA, nu există diferenţe între cea intravenoasă şi cea perorală, doar cu o prevalenţă a RA gastrointestinale la utilizarea internă, faţă de cele vegeto-vasculare la cea intravenoasă. Pulsterapia cu metilprednisolon se poate manifesta prin RA: tahicardie, hiperemia feţei şi excitaţie emoţională nesemnificativă. Mai rar se pot constata bradicardia, hiper- sau hipotensiunea arterială şi artrita temporară a articulaţiilor mari. Pentru ameliorarea fenomenelor cardiovasculare, se recomandă a asocia puls-terapia cu administrarea diureticelor de ansă. În unele cazuri, metilprednisolonul poate fi înlocuit cu betametazonă fosfat (celeston), prin administrarea intravenoasă a 120-132 mg (egală cu 1000 mg metilprednisolon) zilnic, timp de 2-3 zile sau chiar două zile, deoarece betametazona are o perioadă de înjumătăţire de 36-72 de ore, fără ca să se reducă eficacitatea pulsterapiei(5,8,19).
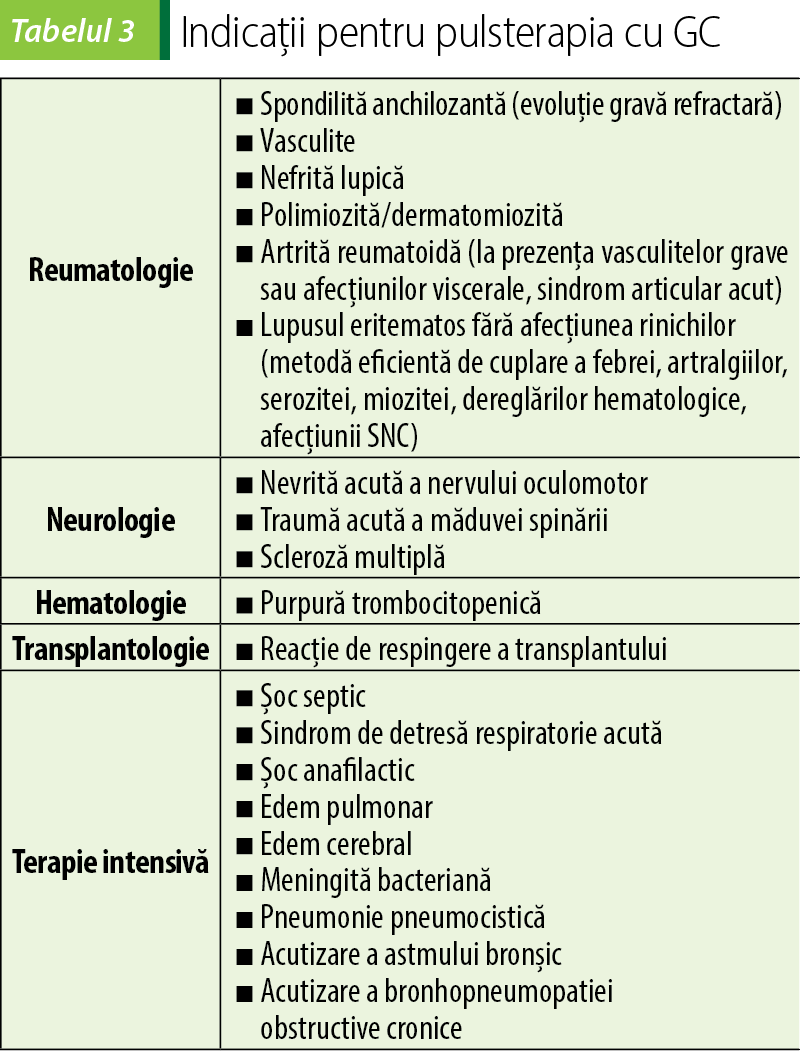
Pulsterapia este indicată în reumatologie, neurologie, hematologie, transplantologie şi terapie intensivă, într-o diversitate de maladii grave şi stări patologice(8,18).
Pulsterapia este contraindicată în: maladii infecţioase, ulcer gastric, glaucom, hipertensiune arterială necontrolată, diabet zaharat decompensat. Acestea sunt contraindicaţii relative în situaţia când este necesară intervenţia de ordin vital(8).
Diferenţele de farmacodinamică din această clasă de medicamente trebuie să fie însoţite de o înţelegere a farmacocineticii pentru a optimiza relaţia doză-expunere-răspuns. Glucocorticoizii pot fi administraţi intravenos sau oral, în funcţie de indicaţia şi de severitatea afecţiunii. Proprietăţile imunodepresive şi antiinflamatorii similare pot fi menţinute folosind echivalenţa dozei cu interschimbabilitatea preparatelor la necesitate. Durata şi gradul efectelor supresive asupra axei HHC depind de timpul în care concentraţiile sistemice rămân peste concentraţiile medii, care este în mod inerent o funcţie a dozei, clearance-ului şi potenţei medicamentului administrat. Astfel, o suprimare mai mare a axei HHC este de obicei observată la doze mai mari din cauza semnalelor de feedback negativ crescute, iar alegerea GC sintetic va fi determinată de natura şi severitatea afecţiunii tratate şi de frecvenţa dozării. Hidrocortizonul este considerat un GC cu acţiune scurtă, prednisolonul şi metilprednisolonul au acţiune intermediară, iar dexametazona are efecte supresoare extinse asupra axei HHC chiar şi după administrarea unei doze unice mici(17).
Hidrocortizonul este cel mai frecvent utilizat pentru substituirea hormonală în insuficienţa corticosuprarenală datorită activităţii sale duale glucocorticoide şi mineralocorticoide. Prednisolonul şi metilprednisolonul sunt utilizate în mod obişnuit pentru a trata o varietate de afecţiuni inflamatorii şi imune, iar pentru substituţie hormonală trebuie administrate împreună cu un mineralocorticoid pentru a compensa activitatea redusă mineralocorticoidă. Prednisolonul este preferat pentru tratamentul cronic datorită timpului său scurt de înjumătăţire, iar pentru administrarea internă se poate folosi sub forma promedicamentului prednisone. Dexametazona este utilizată pe termen scurt în condiţii severe, acute, pentru tratamentul inflamaţiei, al afecţiunilor alergice şi autoimune, leucemiei, vomei, precum şi pentru a testa funcţionalitatea axei HHC pentru identificarea sindromului Cushing, a depresiei sau pentru a suprima axa HHC, pentru a imita stările de boală şi pentru analiza altor glucocorticoizi sintetici. Preparatul este rar utilizat pentru substituţia hormonală, dată fiind absenţa acţiunii mineralocorticoide(17).
Glucocorticoizii sintetici sunt medicamente lipofile cu o absorbţie rapidă şi biodisponibilitate orală de 60-100%. Concentraţia maximă se determină în 1-3 ore după administrarea formelor cu eliberare imediată. Hidrocortizonul, la doze mai mari, poate prezenta viteză redusă de dizolvare. Prednisolonul are permeabilitate şi solubilitate mari, iar metilprednisolonul şi dexametazona sunt asociate cu permeabilitate mare sau mică în funcţie de studiu. Dexametazona poate fi expusă circulaţiei enterohepatice, care poate contribui la variabilitatea expunerii sistemice.
Hidrocortizonul şi prednisolonul au o farmacocinetică neliniară, dependentă de doză, în parte datorită legării de proteinele plasmatice, în timp ce metilprednisolonul şi dexametazona au o farmacocinetică liniară la doze farmacologice. Hidrocortizonul şi prednisolonul se transportă atât de globulina specifică de legare a corticosteroizilor, cât şi de albumină, în timp ce metilprednisolonul şi dexametazona se leagă doar de albumină. Hidrocortizonul şi prednisolonul vor concura cu cortizolul endogen pentru locurile de legare ale globulinei specifice a corticosteroizilor, afectând concentraţiile circulante ale glucocorticoizilor endogeni şi sintetici necuplaţi. În intervalul terapeutic al dozelor de prednisolon, globulina specifică poate deveni saturată, determinând scăderea neliniară a fracţiunii legate de cortizol endogen de la 95% la 60-70%. Glucocorticoizii sintetici sunt, de asemenea, substraturi pentru 11β-hidroxisteroid dehidrogenaza (11β-HSD) tipurile 1 şi 2, care vor influenţa cantităţile relative de forme active şi inactive de GC. Similar cu interconversia dintre cortizol şi cortizon, prednison şi prednisolon vor suferi interconversii de către sistemul enzimatic 11β-HSD. Prin urmare, compuşi precum prednisonul sunt consideraţi atât promedicamente, cât şi metaboliţi. Posibila activitate a 11β-HSD2 în colon poate influenţa absorbţia formulărilor cu eliberare lentă în tractul gastrointestinal(17).
Toţi GC sunt eliminaţi prin metabolizare hepatică şi excreţie renală a metaboliţilor inactivi şi a formelor nemetabolizate. Hidrocortizonul şi prednisolonul au timp de înjumătăţire scurt (sub 3,5 ore), fără cumularea de medicament între doze, chiar şi atunci când pacienţilor li se administrează mai multe doze zilnice, ceea ce face ca aceşti compuşi să fie preferaţi pentru tratamentul cronic cu intervale scurte de dozare. Clearance-ul prednisolonului este dependent de doză datorită legării cu proteinele plasmatice şi de volumul aparent de distribuţie la doze mai mari, având în vedere o fracţie mai mare de medicament liber. Timpul de înjumătăţire al metilprednisolonului este de până la 2,5 ore, iar cel al dexametazonei de 36-72 de ore, fiind, de obicei, administrată la doze mai mici ca urmare a activităţii sale puternice asupra RGC şi a duratei mai lungi de acţiune(17).
Concluzii
Glucocorticoizii constituie o grupă importantă de medicamente utilizate larg în practica medicală în tratamentul maladiilor cronice şi suprimarea stărilor de urgenţă datorită particularităţilor farmacodinamice şi farmacocinetice: mecanismele genomice şi/sau nongenomice care asigură o gamă variată de efecte de bază şi pleiotrope; varietatea largă a dozelor şi regimurilor de dozare; capacitatea de modulare a efectelor în funcţie de ritmurile circadiene; diversitatea formelor medicamentoase şi a modurilor de administrare în funcţie de situaţia clinică; posibilităţile de monitorizare a terapiei pe baza particularităţilor de absorbţie, distribuţie, metabolizare şi eliminare. În aceste condiţii, medicii practicieni pot asigura o farmacoterapie argumentată, raţională şi inofensivă.
Bibliografie
-
Ahmed MH, Hassan A. Dexamethasone for the Treatment of Coronavirus Disease (COVID-19): a Review. SN Compr Clin Med. 2020 Oct 31:1-10. doi: 10.1007/s42399-020-00610-8. Epub ahead of print. PMID: 33163859; PMCID: PMC7599121.
-
Bacinschi N, Ţurcan L, Podgurschi L, Guţu I, Covalschi T, Mihalachi-Anghel M, Chianu M, Caracaş A, Vasilache E. Utilizarea glucocorticoizilor în infecţia cu SARS CoV-2: pro şi contra. Sănătate Publică, Economie şi Management în medicină. 2021; 1(88):4-20.
-
Barnes PJ. Glucocorticosteroids: current and future directions. Br J Pharmacol. 2011 May;163(1):29-43. doi: 10.1111/j.1476-5381.2010.01199.x.
-
Becker DE. Basic and clinical pharmacology of glucocorticosteroids. Anesth Prog. 2013 Spring;60(1):25-31; quiz 32. doi: 10.2344/0003-3006-60.1.25.
-
Bychenko OV, Lytvynenko AV. Systemic glucocorticosteroid therapy. Ukr Pulmonol. J. 2017; 4:63–67.
-
Buttgereit F. Glucocorticoids: surprising new findings on their mechanisms of actions. Ann Rheum Dis. 2021 Feb;80(2):137-139. doi: 10.1136/annrheumdis-2020-218798.
-
Ismini AV, Holger H. The Role of Glucocorticoids in the Management of COVID-19 Playlist. Hormone and Metabolic Research. 2020. DOI: 10.1055/a-1300-2550.
-
Kovalenko VN, Iaremenko OB, Şuba NM, et al. Prinţipî primenenia glucocorticoidov d lecenii revmaticeschih boleznei s ucetom ih ăffectivnosti i bezopasnosti. Revmatologhia nauka – practichi. 2018; 24-26.
-
Litvinenko А V. Major principles of glucocorticosteroid therapy. Ukr. Pulmonol. J. 2014; 1: 60–64.
-
Mejía-Vilet JM, Ayoub I. The Use of Glucocorticoids in Lupus Nephritis: New Pathways for an Old Drug. Front Med (Lausanne). 2021 Feb 16;8:622225. doi: 10.3389/fmed.2021.622225.
-
Panettieri RA, Schaafsma D, Amrani Y, Koziol-White C, Ostrom R, Tliba O. Non-genomic Effects of Glucocorticoids: An Updated View. Trends Pharmacol Sci. 2019 Jan;40(1):38-49. doi: 10.1016/j.tips.2018.11.002.
-
Quatrini L, Ugolini S. New insights into the cell- and tissue-specificity of glucocorticoid actions. Cell Mol Immunol. 2021 Feb;18(2):269-278. doi: 10.1038/s41423-020-00526-2.
-
Quattrocelli M, Zelikovich AS, Salamone IM, Fischer JA, McNally EM. Mechanisms and Clinical Applications of Glucocorticoid Steroids in Muscular Dystrophy. J Neuromuscul Dis. 2021;8(1):39-52. doi: 10.3233/JND-200556.
-
Reichardt SD, Amouret A, Muzzi C, Vettorazzi S, Tuckermann JP, Lühder F, Reichardt HM. The Role of Glucocorticoids in Inflammatory Diseases. Cells. 2021 Oct 28;10(11):2921. doi: 10.3390/cells10112921.
-
Reshetnyak TM, Seredavkina NV, Dydykina IS, Nasonov EL. Glucocorticoids in the therapy of systemic lupus erythematosus. Kliniţist. 2013, 3-4, 14-25.
-
Rhen T, Cidlowski JA. Antiinflammatory action of glucocorticoids--new mechanisms for old drugs. N Engl J Med. 2005 Oct 20;353(16):1711-23. doi: 10.1056/NEJMra050541.
-
Scherholz ML, Schlesinger N, Androulakis IP. Chronopharmacology of glucocorticoids. Adv Drug Deliv Rev. 2019 Nov-Dec;151-152:245-261. doi: 10.1016/j.addr.2019.02.004.
-
Straciunskii LS, Kozlov SN. Gliucocorticoidnîe preparatî. Metodiceskoie posobie. Smolensk, 2012, 30p.
-
van der Goes MC, Jacobs JW, Bijlsma JW. The value of glucocorticoid co-therapy in different rheumatic diseases – positive and adverse effects. Arthritis Res Ther. 2014 Nov 13;16 Suppl 2(Suppl 2):S2. doi: 10.1186/ar4686.
-
Williams DM. Clinical Pharmacology of Corticosteroids. Respir Care. 2018 Jun;63(6):655-670. doi: 10.4187/respcare.06314.