Boala renală cronică şi utilizarea medicamentelor
Chronic kidney disease and the use of drugs
Abstract
Chronic kidney disease occurs insidiously and is usually diagnosed in advanced stages when its evolution is more difficult to control. Frequently, it is favored by inadequately controlled hypertension and/or insufficiently controlled diabetes mellitus, exacerbating their consequences. The complications of chronic kidney disease are manifested by edema, electrolyte and acid-base disorders, cardiovascular damages, anemia, and bone disorder. The most severe form of the condition is end-stage renal disease, when life cannot be sustained without renal replacement therapy – i.e., dialysis or kidney transplantation. Diet and the pharmacological control of high blood pressure and diabetes can slow the progression rate of chronic kidney disease. Disease-specific complications can also be addressed. Renal impairment affects the elimination of many medicines from the body, so the patient with chronic kidney disease should not be given contraindicated drugs for kidney failure and the doses for may drugs should be properly adjusted.Keywords
chronic kidney diseasedose adjustment in renal failureRezumat
Boala renală cronică se instalează insidios şi de obicei este diagnosticată în stadii avansate, când evoluţia ei este mai dificil de controlat. Frecvent, este favorizată de hipertensiunea arterială inadecvat controlată şi/sau de diabetul zaharat insuficient controlat şi le agravează acestora consecinţele. Complicaţiile bolii renale cronice se manifestă cu edeme, tulburări electrolitice şi acido-bazice, afectare cardiovasculară, anemie şi afectare osoasă. Forma cea mai severă a afecţiunii este boala renală în stadiu terminal, când viaţa nu poate fi menţinută fără terapie de substituţie renală, adică dializă sau transplant renal. Dieta şi controlul farmacologic al hipertensiunii arteriale şi al diabetului zaharat pot încetini rata de progresie a bolii renale cronice. Complicaţiile specifice bolii pot fi şi ele gestionate medicamentos. Afectarea renală modifică eliminarea multor medicamente din organism, de aceea pacientului cu boală renală cronică trebuie să i se ajusteze corespunzător dozele primite şi să nu i se administreze medicamente contraindicate în insuficienţa renală.Cuvinte Cheie
boală renală cronicăajustare a dozelor în insuficienţa renalăBoala cronică renală (BCR) este o leziune renală progresivă, ireversibilă, caracterizată prin scăderea ratei estimate de filtrare glomerulară (RFGe) sau prin dovezi de afectare renală timp de cel puţin 3 luni(1).
BCR se datorează unei pierderi globale a funcţiei renale, care apare în grade diferite. Organismul îşi poate menţine homeostazia chiar cu funcţia renală redusă la aproximativ jumătate din cea normală, în special dacă declinul renal este lent(2).
Stadializarea BCR se realizează pe baza nivelului de afectare a funcţiei renale.
Cel mai avansat stadiu al BCR, cunoscut sub numele de boală renală în stadiu terminal (BRST), necesită dializă sau transplant renal pentru a susţine viaţa(1).
BCR cronică, spre deosebire de insuficienţa renală acută, are un debut insidios şi este de obicei cauzată de deteriorarea directă a ţesutului renal. Rezerva renală naturală mare şi progresia lentă a BRC înseamnă că de obicei au avut loc leziuni ireversibile considerabile în momentul în care pacientul raportează simptome. Există apoi un declin inexorabil spre boala renală în stadiu terminal, care este fatală fără terapia de substituţie renală (dializă sau transplant). Rata declinului funcţiei renale variază în funcţie de cauza de bază şi poate fi încetinită de tratament(2).
Prevalenţa estimată la nivel global a BCR este de 13,4% (11,7-15,1%), iar numărul pacienţilor cu boală renală în stadiu terminal care au nevoie de terapie de substituţie renală este estimat a fi între 4,9 şi 7 milioane(3).
Definiţia bolii renale cronice
Boala renală cronică constă în reducerea funcţionării rinichilor, pusă în evidenţă prin valori ale ratei de filtrare glomerulară < 60 ml/min/1,73 m2 timp de mai mult de 3 luni (cu sau fără leziuni renale) ŞI/SAU distrucţie renală, care poate consta în prezenţa pentru mai mult de 3 luni, indiferent dacă sunt sau nu însoţite de scăderea RFG, fie a anomaliilor patologice, fie a markerilor de distrucţie renală, precum albuminuria, reprezentată de rata albumină urinară:creatinină mai mare de 30 mg/g(4).
Estimarea funcţiei renale. Diagnosticarea şi stadializarea BCR
Clearance-ul creatininei şi rata de filtrare glomerulară
Rata de filtrare glomerulară (RFG) este indicatorul cel mai precis al funcţiei renale, dar nu poate fi măsurată direct. RFG oferă o estimare a cantităţii de plasmă filtrată de rinichi în fiecare minut. RFG se calculează prin măsurarea clearance-ului unei substanţe care este excretată exclusiv prin filtrare, precum inulina sau iohexolul. Clinic, utilizarea acestora este impracticabilă, de aceea pentru estimarea RFG se foloseşte frecvent valoarea concentraţiei serice a creatininei (Crser), pe baza căreia se calculează clearance-ul creatininei (ClCr)(5).
Epurarea creatininei nu este o modalitate perfectă pentru a estima RFG, deoarece nu este afectată până când funcţia renală nu este redusă semnificativ, reflectă şi secreţia tubulară activă pe care o suferă creatinina şi este influenţată şi de alţi factori decât filtrarea glomerulară, precum:
- masa musculară (care e mai mică la vârstnici, femei, pacienţi subnutriţi, pacienţi amputaţi)
- dieta (carnea gătită poate creşte tranzitoriu Crser; vegetarienii au Crser mai mică)
- medicamente (de exemplu, trimetoprimul şi cimetidina reduc secreţia tubulară a creatininei; cefoxitina şi cefotetanul pot creşte în mod fals Crser, de aceea determinarea Crser se face la cel puţin două ore după administrarea cefoxitinei etc.)
- supraîncărcare de volum (în hipervolemie, Crser scade)(5).
ClCr poate fi calculat pornind de la concentraţia creatininei aflate în volumul de urină eliminată într-un anumit interval de timp, de exemplu, 24 de ore, dar acest lucru este greoi, incomod şi poate fi inexact din cauza colectării incomplete a urinei. Cu toate acestea, există situaţii în care colectarea temporizată este de dorit, de exemplu la pacienţi cu masa musculară modificată (tetraplegici, pacienţi care au suferit amputarea membrelor) sau când este necesară o estimare precisă (de exemplu, în chimioterapie).
Au fost dezvoltate mai multe formule de calcul pentru estimarea RFG.
Ecuaţia Cockcroft-Gault este frecvent utilizată pentru a calcula ClCr (ml/min); mediul online oferă instrumente uşor de folosit care aplică această formulă, de exemplu la adresa https://mediately.co/ro/tools/CreatinineClearance. Această formulă a fost propusă în anul 1973, folosind date provenite de la bărbaţi cu clearance-ul creatininei având valori între 30 ml/min şi 130 ml/min. Această ecuaţie ţine seama de factori precum vârstă (exprimată în ani), sex şi greutate (exprimată în kilograme), dar nu este ajustată în funcţie de suprafaţa corporală.
ClCr = ((140 – vârstă) × greutate × (0,85 pentru femei)):
(72 × Crser [mg/dl])(5)
Se utilizează greutatea corporală reală, dacă aceasta este mai mică decât greutatea ideală a pacientului. Dacă greutatea pacientului este cu 20-30% mai mare decât cea ideală, se utilizează greutatea corporală ajustată, calculată după formula:
greutatea ajustată = greutatea ideală + 0,4 x (greutatea reală – greutatea ideală).
Recomandările bazate pe clearance-ul creatininei au fost metodele standard de ajustare a dozelor pentru folosirea diferitelor medicamente la pacienţi cu afectare renală încă din anii 1970. Alte două modele folosite mult în prezent sunt ecuaţia MDRD şi ecuaţia CKD-EPI; acestea pot fi accesate online la https://mediately.co/ro/tools/GfrCdkMdrd.
RFGe calculată folosind ecuaţiile MDRD sau CKD-EPI este raportată la suprafaţa corporală normală (1,73 m2) şi este exprimată în ml/min/1,73 m2. Pentru pacienţii cu suprafeţe corporale diferite de 1,73 m2, RFGe trebuie ajustată corespunzător raportului dintre suprafaţa lor corporală (calculată, de exemplu, online: https://mediately.co/ro/tools/BSA) şi cea standard.
Ecuaţia MDRD a fost dezvoltată şi validată de Grupul de studiu pentru modificarea dietei în cazul bolilor renale (Modification of Diet in Renal Disease Study Group) şi este mai precisă decât estimarea realizată prin colectarea de urină pe 24 de ore sau cea furnizată de ecuaţia Cockcroft-Gault. Estimează RFG ajustată la suprafaţa corporală, ţinând cont de concentraţia serică a creatininei, sex şi rasă. În prezent este larg folosită în laboratoare, fiind potrivită pentru pacienţii de înălţime şi greutate medie şi cu GFR < 60 ml/min/1,73m2 (cu boală renală cronică în stadiul III).
Ecuaţia CKD-EPI este mai precisă decât ecuaţia MDRD, dacă valorile RFG sunt peste 60 ml/min/1,73 m2. Nu ţine seama de rasă şi este în prezent larg folosită.
Atât calcularea ClCr cât şi a RFGe se bazează pe creatinina serică, dar sunt estimate folosind ecuaţii diferite. Acest aspect este extrem de important când se ajustează dozele de medicament. Folosirea RFGe când ar trebui să fie utilizat ClCr poate să nu indice nevoia de ajustare a dozei în aproape jumătate din cazurile când acest lucru ar fi indicat, mai ales la vârstnici sau la pacienţii cu insuficienţă renală moderată până la severă.
Stadializarea BCR
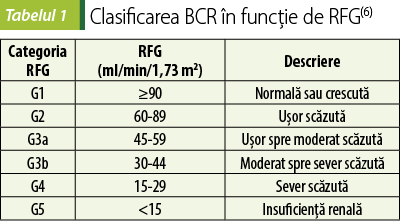
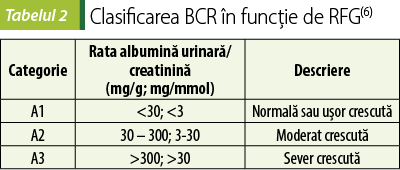
În funcţie de rata filtrării glomerulare şi de stadiile albuminuriei, clasificarea BCR se poate face folosind gradele şi termenii prezentaţi în tabelele 1 şi 2. În absenţa deteriorării rinichilor, categoriile G1 şi G2 nu constituie BCR. Când rata albumină urinară:creatinină depăşeşte 2200 mg/g, se vorbeşte despre sindrom nefrotic(6).
Anatomia şi fiziologia rinichilor, pe scurt
Rinichii, împreună cu ureterele, vezica urinară şi uretra, alcătuiesc aparatul excretor renal. Unitatea morfofuncţională a rinichiului este nefronul. Fiecare rinichi are aproximativ 1 milion de nefroni; persoanele sănătoase au o rezervă fiziologică mare de nefroni. Pierderea lentă, progresivă, a nefronilor funcţionali este în general asimptomatică; de obicei, nu există simptome până când nu se pierd mai mult de trei sferturi din funcţia renală.
Funcţiile rinichilor sunt multiple:
-
menţinerea homeostaziei hidroelectrolitice şi acido-bazice şi eliminarea substanţelor nenecesare organismului. La nivelul glomerulilor renali, plasma este ultrafiltrată, iar la nivelul tubilor renali au loc procesele de reabsorbţie şi de secreţie;
-
funcţii endocrine – rinichii produc renina, implicată în controlul tensiunii arteriale; produc eritropoietina care stimulează formarea hematiilor; activează 25-(OH) vitamina D (calcifediol) la 1,25-(OH)2 vitamină D (calcitriol, forma cea mai activă a vitaminei D3);
-
funcţii metabolice – rinichii participă la gluconeogeneză şi metabolizează medicamente şi substanţele endogene (de exemplu, insulina).
Etiologia şi fiziopatologia bolii cronice de rinichi
Boala cronică de rinichi, sau insuficienţa renală cronică, este o afecţiune cu etiologie multifactorială. Pierderea progresivă a funcţionalităţii nefronilor sau deteriorarea lor poate fi rezultatul unor boli primare ale rinichiului (boală renală polichistică, malformaţii congenitale ale rinichilor, nefrolitiază, nefrită interstiţială, stenoză de arteră renală, carcinom renal, nefropatie asociată cu virusul imunodeficienţei umane), al unei complicaţii secundare anumitor boli sistemice (diabet zaharat sau hipertensiune arterială) sau al unei leziuni acute a rinichiului care duce la leziuni renale ireversibile. Există variaţii geografice, etnice şi rasiale. De exemplu, nefropatia ulterioară hipertensiunii arteriale este mai frecventă în rândul populaţiei de culoare, iar nefropatia diabetică este mai frecventă în rândul populaţiei cu origini asiatice. În ţările în curs de dezvoltare, de obicei cauzele infecţioase sunt mult mai frecvente(2).
Printre factorii de risc care fac ca un individ să fie susceptibil de a dezvolta BCR se numără: vârsta înaintată, dimensiunea redusă a rinichilor, greutate scăzută la naştere, istoric familial, apartenenţa la minorităţi rasiale sau etnice, statut socioeconomic scăzut, inflamaţia sistemică şi dislipidemia. Debutul afecţiunii este favorizat de diabet zaharat, hipertensiune arterială, glomerulonefrită, utilizarea unor medicamente (AINS, litiu), fumat sau obezitate. Factorii de risc pentru progresia accelerată a BCR sunt hiperglicemia, hipertensiunea, proteinuria, fumatul şi obezitatea(1).
Consecinţele pierderii funcţionalităţii nefronilor în BCR sunt:
-
modificarea compoziţiei urinei; volumul urinei eliminate poate să nu se modifice;
-
reducerea excreţiei deşeurilor; uremia poate să nu fie evidentă până când BCR nu este suficient de avansată;
-
modificările hormonale pot genera anemia (ca urmare a scăderii secreţiei de eritropoietină) şi tulburări minerale şi osoase (cu osteoporoză şi hiperparatiroidism, consecinţe ale împiedicării activării vitaminei D);
-
reducerea catabolismului unor medicamente sau al insulinei şi glucagonului(1).
Aspecte clinice
Pe măsură ce funcţia renală se degradează, reducerea clearance-ului renal duce la acumularea de substanţe provenite din metabolism cu grad avansat de glicare, de citokine proinflamatorii, de specii reactive de oxigen şi de alte componente cu caracter acid.
Chiar şi la persoanele fără diabet, se poate instala rezistenţa la insulină, care duce la scăderea captării glucozei de către muşchii scheletici şi la instalarea unei stări inflamatorii(1).
Afectarea cardiovasculară
Principalele cauze de BCR sunt diabetul zaharat, hipertensiunea arterială şi glomerulonefrita. Controlul optim al glicemiei şi atingerea ţintelor de tensiune arterială prin tratamentul antihipertensiv sunt esenţiale pentru a încetini progresia BCR şi pentru a reduce morbiditatea şi mortalitatea(1).
Cardioprotecţia este necesară în toate stadiile BCR, deoarece bolile cardiovasculare sunt principala cauză de deces în BCR(1). Administrarea de IECA sau BRA reduce riscul de dezvoltare a microalbuminuriei sau progresia de la microalbuminurie la macroalbuminurie şi nefropatie evidentă(6).
Dezechilibre hidroelectrolitice şi acido‑bazice
Acumularea de lichide şi anomaliile electrolitice secundare BCR complică adesea tratamentul hipertensiunii arteriale şi pot avea efecte cardiotoxice(1).
În stadiile târzii ale BCR se instalează frecvent acidoza metabolică, datorată excreţiei reduse a ionilor de hidrogen şi formării reduse de bicarbonat. Acidoza metabolică poate agrava bolile osoase şi alte procese metabolice(1).
Perturbări metabolice
Există mai multe modificări interconectate în metabolismul lipidelor şi carbohidraţilor. Rinichii catabolizează în mod normal mai mulţi hormoni, inclusiv aproximativ o treime din insulina naturală, iar acest mecanism este diminuat în BCR. În schimb, toleranţa la glucoză este redusă, astfel încât efectele sunt imprevizibile, în special la diabetici. Dislipidemia duce la un risc ridicat de aterogeneză(2).
Proteinuria (albuminuria)
În mod normal, proteinele nu sunt filtrate glomerular din cauza dimensiunii lor moleculare relativ mari, fiind prezente în urină doar urme la pacienţii fără boli renale. Instalarea leziunilor glomerulare duce la proteinurie şi poate preceda creşteri ale CrSer. Nivelul de proteine (albumină, apoproteine, proteine cu greutate moleculară mică) prezente în urină este un bun predictor al progresiei bolii renale.
Microalbuminuria, definită drept rata albumină urinară:creatinină între 2 şi 20 mg/mol, este primul semn al nefropatiei diabetice şi este asociată cu afectarea cardiovasculară. Se consideră că pacientul are albuminurie dacă două din trei măsurători ale ratei albumină urinară:creatinină într-o perioadă de 3-6 luni sunt anormale. Macroalbuminuria este un factor de risc pentru evenimente cardiovasculare şi progresia către BRST.
Suplimentar, în diabetul zaharat, glicemia ridicată provoacă hiperfiltrare glomerulară şi declanşează inflamaţia, deteriorarea oxidativă, fibroza şi activarea sistemului renină-angiotensină-aldosteron (SRAA). Împreună, aceste efecte dăunează rinichilor.
Administrarea de IECA sau BRA reduce riscul de dezvoltare a microalbuminuriei sau progresia de la microalbuminurie la macroalbuminurie şi nefropatie evidentă(6).
Anemia
Sinteza de eritropoietină este deficitară în BCR, cu instalarea anemiei. Tratarea anemiei care apare în BCR este esenţială pentru reducerea complicaţiilor bolilor cardiovasculare. Managementul anemiei include administrarea de compuşi ai fierului şi agenţi de stimulare a eritropoiezei(1).
Boala renală osoasă
Tulburările minerale şi osoase caracterizate prin anomalii biochimice, osteodistrofie renală şi calcifiere vasculară devin mai frecvente pe măsură ce BCR progresează, ducând la creşterea riscului de mortalitate cardiovasculară. Hiperfosfatemia, hipocalcemia, hiperparatiroidismul, scăderea sintezei de vitamină D activă şi rezistenţa la vitamină D duc la complicaţiile secundare ale BCR (dureri osoase, fracturi, miopatie)(1).
Afectarea sistemului imunitar
Când funcţia renală este compromisă, homeostazia componentelor sistemului imunitar şi a microbiotei intestinale este perturbată. Imunodeficienţa şi inflamaţia sistemică care însoţesc BCR contribuie la creşterea morbidităţii şi mortalităţii(8).
Gestionarea BCR
Scopurile intervenţiilor terapeutice în BCR sunt(1):
-
diagnosticarea timpurie a afecţiunii;
-
identificarea şi controlarea cauzei, cu rezolvarea ei, dacă e posibil;
-
întârzierea deteriorării funcţiei renale;
-
identificarea şi gestionarea complicaţiilor;
-
pregătirea pacientului pentru terapia de substituţie renală.
Gestionarea HTA, a albuminuriei, a complicaţiilor aterosclerotice şi a diabetului
Ghidul ESH/ESC pentru gestionarea HTA din 2018 consideră pacienţii cu BCR la risc mare sau foarte mare (peste 10%) de a avea un eveniment cardiovascular fatal în următorii 10 ani(9). De aceea, gestionarea adecvată a HTA este foarte importantă. Un control adecvat al hipertensiunii arteriale încetineşte progresia BCR. Valori‑ţintă mai mici de 140/90 mmHg sunt potrivite pentru majoritatea pacienţilor cu BCR, unele surse recomandând pentru pacienţii cu insuficienţă renală care prezintă şi albuminurie ţinte mai mici de 130/80 mm Hg(10). IECA sau BRA sunt cele mai potrivite antihipertensive pentru un pacient hipertensiv, cu BCR şi albuminurie, după cum arată studii clinice de amploare.
Studiul ONTARGET (Ongoing Telmisartan Alone and in Combination with Ramipril Global End Point Trial) a înrolat pacienţi cu ateroscleroză sau diabet şi leziuni ale organelor-ţintă. În ONTARGET, atingerea unei tensiuni arteriale sub 130/80 mmHg a fost asociată cu un risc mai mic de microalbuminurie sau macroalbuminurie şi chiar cu conversia la normoalbuminurie, comparativ cu atingerea unei ţinte de tensiune arterială mai mică de 140/90 mmHg(7).
Studiul ACCOMPLISH (Avoiding Cardiovascular Events Through Combination Therapy in Patients Living with Systolic Hypertension) a inclus aproape 7000 de pacienţi cu diabet zaharat. Pacienţii au fost randomizaţi la benazepril plus amlodipină sau benazepril plus hidroclorotiazidă. Numai asocierea benazepril/hidroclorotiazidă a condus la reducerea microalbuminuriei(11).
Studiul ADVANCE (Action in Diabetes and Vascular disease: PreterAx and DiamicroN-MR Controlled Evaluation) a inclus pacienţi cu diabet zaharat de tip 2 care au fost randomizaţi la perindopril/indapamidă sau placebo. Asocierea a fost eficientă pentru prevenirea apariţiei microalbuminuriei, prevenirea progresiei microalbuminuriei la macroalbuminurie şi chiar regresia albuminuriei(12).
IECA şi BRA sunt medicamente extrem de utilizate la pacienţii cu afecţiuni cardiovasculare, diabet şi BCR; titrarea şi monitorizarea lor se fac ţinând seama de următoarele precauţii:
-
tratamentul se iniţiază după determinarea CrSer şi a potasemiei (<5,5 mEq/l). La pacienţii cu BCR, dozele iniţiale sunt mai mici;
-
creşterea dozei se face treptat, cu monitorizarea CrSer şi a potasemiei:
-
creşteri importante şi persistente ale CrSer şi ale potasemiei (peste 5,5 mEq/l) fac necesară reducerea dozei sau întreruperea tratamentului;
-
reacţiile adverse sunt favorizate de anumiţi factori de risc – utilizarea de AINS, ciclosporină, tacrolimus, diuretice (mai ales cele care produc hiperpotasemie), suplimente cu potasiu; diabet, stenoza arterei renale (mai frecventă la vârstnici, femei, fumători, colesterol ridicat); RFG < 60 ml/min/1,73m2; boli cronice de rinichi; insuficienţă cardiacă; hiponatriemie; albumină scăzută; ateroscleroză; deshidratare; hipo- sau hipertensiune arterială(1).
Hipercolesterolemia se gestionează cu statine. AAS în doze mici se foloseşte pentru efectul antiagregant plachetar la pacienţii cărora nu le este contraindicat.
Tratamentul antidiabetic se conduce individualizat, obiectivele HbA1C stabilindu-se ţinând cont de speranţa de viaţă, istoricul bolilor cardiovasculare, riscul de hipoglicemie şi de comorbidităţi. Pentru majoritatea pacienţilor diabetici, este rezonabilă o valoare a HbA1C mai mică decât 7%. Valori ale HbA1C sub 8% pot fi adecvate pentru unii pacienţi cu complicaţii avansate legate de diabet, speranţa de viaţă mai mică de 5 ani sau cu antecedente recente de hipoglicemie severă.
Unele antidiabetice pot aduce beneficii suplimentare scăderii glicemiei în BCR. De exemplu, inhibitorii SGLT2 pot reduce presiunea intraglomerulară, iar agoniştii GLP‑1 (liraglutid) pot avea un efect antiinflamator. Ambele grupe de hipoglicemiante reduc riscul cardiovascular(13).
Următoarele studii au arătat beneficiile suplimentare ale unor inhibitori SGLT2 la pacienţii cu diabet, boală cardiovasculară şi afectare renală.
-
Studiul EMPA-REG OUTCOME a investigat adăugarea empagliflozinului la îngrijirea standard (de exemplu, IECA sau BRA, statină, metformină) la pacienţii cu diabet zaharat de tip 2 şi boală cardiovasculară. La momentul iniţial, majoritatea pacienţilor au avut normo- sau microalbuminurie şi/sau RFGe mai mare de 60 mL/min/1,73 m2. Empagliflozin a prevenit nefropatia nou instalată sau agravarea acesteia la aproximativ 1 din 16 pacienţi. Dublarea CrSer a avut loc la 1,5% dintre pacienţii cu empagliflozină, faţă de 2,6% dintre pacienţii cu placebo. Progresia la macroalbuminurie a avut loc la 11,2% dintre pacienţii cu empagliflozină faţă de 16,2% dintre pacienţii cu placebo. Empagliflozin a întârziat nevoia de dializă la 1 din 333 de pacienţi(14).
-
În studiul DAPA-CKD, dapagliflozin a fost adăugat la medicamente blocante ale SRAA la pacienţii cu sau fără diabet zaharat de tip 2, cu RFGe 25‑75 ml/min/1,73 m2 şi cu albuminurie. După o urmărire de 2,4 ani, dapagliflozin a fost asociat cu un declin mai redus al FRGe, cu întârzierea progresiei către BRST şi cu scăderea mortalităţii de cauză renală sau cardiovasculară(15).
Dapagliflozin (Forxiga®, compr. film. 10 mg) este primul medicament din clasa inhibitorilor SGLT2 autorizat de EMA pentru tratamentul pacienţilor adulţi cu boală cronică de rinichi. Dapagliflozin reduce reabsorbţia glucozei din filtratul glomerular la nivelul tubilor contorţi proximali, cu reducerea concomitentă a reabsorbţiei de sodiu, ducând la excreţia urinară a glucozei şi diureză osmotică. Dapagliflozin creşte astfel transportul de sodiu la nivelul tubilor distali, cu creşterea feedbackului tubuloglomerular şi reducerea presiunii intraglomerulare. Efectul natriuretic, alături de diureza osmotică duc la reducerea supraîncărcării volemice, scăderea tensiunii arteriale şi la scăderea presarcinii şi postsarcinii, ceea ce poate avea efecte benefice asupra remodelării cardiace (medicamentul este indicat şi în insuficienţa cardiacă), şi la păstrarea funcţiei renale. Dapagliflozin creşte hematocritului şi promovează scăderea greutăţii corporale. Beneficiile dapagliflozinului la nivel cardiovascular şi renal nu depind doar de efectul hipoglicemiant şi nu se limitează la pacienţii cu diabet zaharat, aşa cum s-a demonstrat în studiile DAPA-HF şi DAPA-CKD(16).
Canagliflozinul s-a dovevit că reduce progresia bolii renale, fără a scădea nevoia de dializă sau transplant, şi poate reduce riscul de infarct miocardic, accident vascular cerebral, de spitalizare ca urmare a insuficienţei cardiace şi de deces de cauză cardiovasculară(1).
Farmacistul care consiliază şi monitorizează pacientului cu BCR care îşi administrează flozine trebuie să aibă în vedere următoarele aspecte. Debutul tratamentului cu canagliflozin sau dapagliflozin poate fi asociat cu leziuni renale acute. Empagliflozin şi ertugliflozin pot determina creşterea CrSer şi scăderea RFGe. Factorii de risc care favorizează apariţia acestor reacţii adverse sunt scăderea volemiei, BCR, insuficienţă cardiacă sau utilizarea de diuretice, IECA, BRA ori AINS. De aceea, se recomandă reducerea dozei diuretice înainte de a începe administrarea inhibitorilor SGLT2. Poate fi necesară întreruperea temporară a flozinelor în situaţii în care aportul oral de lichide este redus (boală acută sau postoperatoriu) sau cu pierderi crescute de lichide (boli gastrointestinale sau expunere excesivă la căldură). Pacienţii trebuie sfătuiţi să raporteze dacă observă scăderi ale volumului urinar sau edeme ale picioarelor. Funcţia renală se evaluează la începutul tratamentului şi apoi periodic. O scădere tranzitorie a RFGe cu aproximativ 5 ml/min/1,73 m2 poate apărea în primele câteva săptămâni, stabilizându-se ulterior(1).
Gestionarea complicaţiilor secundare BRC
Anemia renală
Corectarea anemiei feriprive se face prin administrarea parenterală a compuşilor cu fier la pacienţii cu anemii cronice severe pentru care fierul oral nu este suficient, cum e cazul pacienţilor cu boală renală cronică avansată care necesită hemodializă şi tratament cu factori de stimulare a eritropoiezei(17).
Sinteza de eritropoietină fiind deficitară în BCR, se instalează un tip particular de anemie care se tratează cu agenţi de stimulare e eritropoiezei obţinuţi prin tehnologia ADN‑ului recombinant. Eritropoietina şi analogii săi stimulează proliferarea şi diferenţierea precursorilor eritroidici la nivelul măduvei spinării(1).
Pentru tratamentul anemiei simptomatice asociate cu insuficienţa renală cronică, la pacienţi dializaţi sau care încă nu efectuează dializă, se folosesc epoetină alfa (Binocrit®, sol. inj. 1000 UI/0,5 ml, 2000 UI/1 ml, 3000 UI/0,3 ml, 4000 UI/0,4 ml, 5000 UI/0,5 ml, 30000 UI/0,75 ml, 40000 UI/1 ml, Eprex®, sol. inj. 40000 UI/ml), epoetină beta (Neorecormon®, sol. inj. 2000 UI, 4000 UI, 5000 UI, 10000 UI, 30000 UI) sau epoetină zeta (Retacrit®, sol. inj. 2000 UI, 4000 UI, 6000 UI, 8000 UI, 10000 UI, 30000 UI, 40000 UI), administrate subcutanat sau intravenos. Darbepoetina alfa (Aranesp®, sol. inj. 10 mcg/0,4 ml, 15 mcg/0,375 ml, 20 mcg/0,5 ml, 25 mcg/1 ml, 30 mcg/0,3 ml, 40 mcg/0,4 ml, 50 mcg/0,5 ml, 60 mcg/0,3 ml, 60 mcg/1 ml, 80 mcg/0,4 ml, 130 mcg/0,65 ml, 150 mcg/0,3 ml, 300 mcg/0,6 ml) este o formă glicozilată cu durată lungă de acţiune, cu administrare o dată pe săptămână. Metoxi-polietilenglicol epoetină beta (Mircera®, sol. inj. 50 mcg/0,3 ml, 80 mcg/0,4 ml, 100 mcg/0,3 ml, 150 mcg/0,3 ml) este un derivat PEG-ilat cu durată lungă de acţiune, care se poate administra la 2-4 săptămâni(18).
Reacţiile adverse ale medicamentelor stimulatoare ale eritropoiezei sunt hipertensiunea arterială şi favorizarea trombozelor. Tratamentul trebuie condus astfel încât concentraţiile hemoglobinei să nu depăşească 12 g/dl, pentru gestionarea corespunzătoare a riscului cardiovascular(18).
Boala osoasă renală
Formele active de vitamină D (calcitriol, paricalcitol) sau un medicament calcimimetic (cinacalcet) pot fi necesare pentru a obţine un echilibru biochimic adecvat şi metabolismul osos(1).
Calcitriolul şi alţi analogi ai vitaminei D, precum paricalcitol (Zemplar®, caps. moi 1 microgram, 2 micrograme, sol. inj. 5 micrograme/ml) suprimă activitatea glandei paratiroide în stadii avansate ale BCR. Totuşi, utilizarea lor este asociată cu un risc crescut de hipercalcemie, neavând beneficii semnificative pentru funcţia cardiacă la pacienţii în predializă. Orientările actuale recomandă evitarea utilizării de rutină a acestora înainte de BRST(19).
Calcimimeticul cinacalcet (Mimpara®, compr. film. 30 mg, 60 mg, 90 mg) creşte sensibilitatea receptorilor de detectare a calciului la ionii de calciu extracelulari şi inhibă eliberarea PTH, scăzând nivelurile PTH în câteva ore după administrare(18).
Acidoza metabolică
Rinichiul este responsabil pentru reabsorbţia bicarbonatului şi excreţia protonilor. Reducerea reabsorbţiei bicarbonatului şi anomalii ale sintezei de amoniac de către rinichi sunt factorii majori responsabili pentru dezvoltarea acidozei metabolice în BCR avansată. Pe măsură ce funcţia nefronilor scade, sinteza de amoniac este crescută pentru a compensa scăderea secreţiei de ioni de hidrogen. Odată ce capacitatea maximă de producţie de amoniac este atinsă, se dezvoltă acidoza. Acidoza metabolică poate contribui la boala osoasă prin stimularea resorbţiei osoase şi poate influenţa, de asemenea, starea nutriţională prin scăderea sintezei de albumină şi promovarea unui balanţe negative azotate(1).
Hiperfosfatemia şi pruritul
Pruritul se datorează acumulării de fosfat. Hiperfosfatemia este gestionată cu restricţie dietetică de fosfor şi cu administrare de agenţi de legare a fosfatului(1).
Lantanum (Fosrenol®) este un agent de fixare a fosfatului utilizat pentru controlul hiperfosfatemiei la pacienţii cu insuficienţă renală cronică supuşi hemodializei sau dializei peritoneale continue ambulatorii(20).
Sevelamer (Renagel®, compr. film. 800 mg clorhidrat de sevelamer; Renvela®, compr. film. 800 mg, 1600 mg sau 2400 mg carbonat de sevelamer) are aceleaşi indicaţii. Este un polimer care conţine multiple amine care se protonează la nivelul stomacului, legând apoi la nivelul intestinului ioni negativi, cum este fosfatul alimentar. Sevelamer nu conţine metale şi calciu şi, probabil, din acest motiv scade incidenţa episoadelor de hipercalcemie, comparativ cu pacienţii care folosesc doar chelatori de fosfat pe bază de calciu. Sevelamer leagă acizii biliari, ducând la scăderi ale valorilor colesterolului total şi a LDL-colesterolului, dar poate interfera cu absorbţia vitaminelor liposolubile, cum sunt vitaminele A, D, E şi K. Pentru a controla evoluţia formei osoase a bolii renale, sevelamer trebuie administrat în cursul unui tratament multiplu, incluzând suplimente de calciu, 1,25‑dihidroxi vitamina D3 sau un analog al acesteia. Reacţiile adverse frecvente asociate cu utilizarea de sevelamer includ: greaţă şi vărsături, constipaţie, diaree, hiperaciditate gastrică, flatulenţă(18).
Terapia de substituţie renală
Când GFR scade sub aproximativ 10 ml/min, metaboliţii azotaţi toxici, potasiul, acidul şi apa încep să se acumuleze într-un grad care pune viaţa în pericol. Creatinina serică în acest stadiu poate depăşi 1000 micromol/l (11,3 mg/dl), iar ureea sangvină poate ajunge mai mare de 30 mmol/l.
Când afectarea renală avansează la boală renală în stadiu terminal, posibilităţile terapeutice de menţinere a vieţii sunt dializa şi transplantul de rinichi. Tipul de dializă se selectează pe baza preferinţelor pacientului şi a opţiunilor de acces vascular, în cazul hemodializei, sau acces peritoneal, în cazul dializei peritoneale. Planificarea timpurie pentru terapia de dializă şi iniţierea în timp util pot reduce morbiditatea şi mortalitatea pacienţilor. Realizarea şi succesul transplantului renal depind de disponibilitatea organelor de transplantat şi de acceptarea grefelor, asigurată prin terapie imunosupresivă de lungă durată(21).
Nutriţia şi boala cronică de rinichi
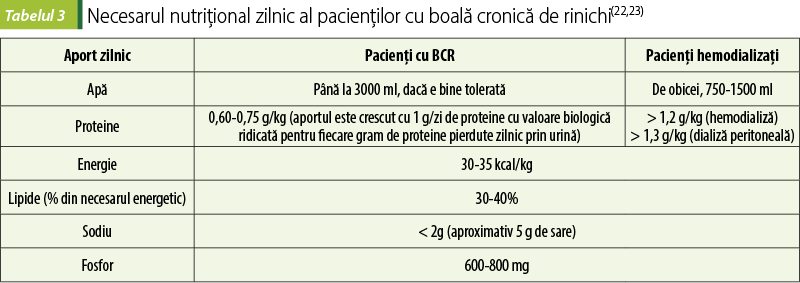
În prezent, se consideră că cea mai bună abordare nutriţională a BCR este oferită în terapia nutriţională medicală, care reprezintă o abordare înalt individualizată, prescrisă de un medic sau un nutriţionist, în scopul gestionării afecţiunii. Are la bază evaluarea iniţială a nutriţiei şi a stilului de viaţă ale pacientului, furnizează un plan nutriţional şi asigură consiliere nutriţională, oferind informaţii privind gestionarea dietei. Pentru creşterea aderenţei pacientului la dietă, periodic se organizează sesiuni individuale sau de grup pentru monitorizarea progresului(22).
Principalele recomandări vizează restricţia de fluide şi sodiu, limitarea aportului proteic şi limitarea aportului de potasiu.
Proteinuria este un predictor semnificativ al BRST la pacienţii cu BCR. Restricţia proteică poate încetini progresia BCR, dar nu se cunosc încă nivelul aportului proteic optim şi tipul cel mai indicat de proteine. Beneficiul reprezentat de evitarea acumulării excesive de toxine uremice este de pus în balanţă, cu pierderea masei musculare şi riscul de malnutriţie asociate restricţiilor proteice(1).
Utilizarea adecvată a medicamentelor în BCR
La pacienţii a căror excreţie renală a medicamentelor este perturbată, pot să apară următoarele probleme:
-
excreţia renală redusă a unui medicament sau a metaboliţilor săi poate provoca supradozare, cu creşterea toxicităţii;
-
sensibilitatea la unele medicamente este crescută. De exemplu, uremia crescută poate modifica volumul de distribuţie a medicamentelor legate de proteinele plasmatice şi tisulare, cu afectarea semnificativă a efectelor terapeutice şi a profilului de siguranţă pentru medicamentele cu indice terapeutic îngust, precum digoxin(1);
-
multe efecte secundare sunt tolerate slab de către pacienţii cu insuficienţă renală;
-
unele medicamente nu sunt eficiente când funcţia renală este redusă.
Multe dintre aceste probleme pot fi evitate prin reducerea dozei sau prin utilizarea de medicamente alternative.
Monografiile oficiale ale medicamentelor conţin referiri la ajustarea folosirii acestora conform gradului de insuficienţă renală. E nevoie să se acorde atenţie deosebită medicamentelor care se elimină majoritar renal, celor nefrotoxice sau celor care se acumulează la nivelul aparatului renal. Recomandările de dozare în insuficienţa renală se bazează adesea pe ecuaţia Cockcroft-Gault. Pentru medicamentele noi, RFGe este utilizată din ce în ce mai mult pentru ajustarea dozelor. Se utilizează metoda recomandată în monografia produsului. Dacă metoda de estimare a funcţie renale nu este explicită, se utilizează formula Cockcroft-Gault dacă recomandările sunt exprimate folosind ca unităţi de măsură ml/min, respectiv una dintre formulele MDRD sau CKD-EPI dacă recomandările folosesc ml/min/1,73 m2. Folosirea inadecvată a formulelor MDRD sau CKD-EPI când ar trebui folosită formula Cockcroft-Gault poate duce la supraestimarea dozei, mai ales la vârstnici şi la pacienţi cu boală renală în stadiul III(1).
Particularităţi ale antibioterapiei în BCR
Pentru antibioticele eliminate în mod semnificativ prin hemodializă (peniciline, cefalosporine, ciprofloxacină), dacă este posibil, medicamentul se administrează în mod normal după sesiunea de dializă, dacă se administrează în doză unică zilnică. Pentru medicamentele administrate de mai multe ori pe zi, se recomandă administrarea unei doze suplimentare postdializă. Dializa peritoneală, în general, nu elimină în mod semnificativ medicamentele. Pentru antibioticele cu efect antibacterian dependent de concentraţie (de exemplu, chinolone) este importantă administrarea unei doze de încărcare(24).
Multe antibiotice necesită reducerea dozei sau prelungirea intervalului dintre doze în BRC, corespunzător clearance-ului creatininei:
-
peniciline – amoxicilină, asocierea amoxicilină/clavulanat, ampicilină;
-
cefalosporine: cefaclor, cefiximă, cefpodoximă, cefuroxim axetil, cefalexină;
-
fluorochinolone – ciprofloxacină, levofloxacină;
-
macrolide: claritromicină;
-
tetraciclină;
-
co‑trimoxazol;
-
nitrofurantoină(18).
În insuficienţa renală severă sunt contraindicate tetraciclina, nitrofurantoina şi co-trimoxazolul(18).
Anticoagulante
Toate anticoagulantele orale directe sunt excretate de rinichi într-o oarecare măsură (dabigatran în procentaj de 80-85%, edoxaban 35%, rivaroxaban 35%, iar apixaban 25%), ridicând ideea că este necesară ajustarea dozelor la persoanele cu boli cronice de rinichi. Totuşi, folosirea anticoagulantelor orale directe la persoanele cu boli cronice de rinichi pare a fi sigură şi eficientă, în special în cazul BCR uşoară până la moderată(25).
Apixaban, rivaroxaban şi edoxaban nu sunt recomandate când clearance-ul creatininei este sub 15 ml/min sau la pacienţii supuşi dializei. Dabigatran nu se foloseşte la un CrCl mai mic de 30 ml/min(18).
Anticoagularea la pacienţii cu BCR se face în general după cum urmează:
-
la pacienţii spitalizaţi, se utilizează în general heparina;
-
pentru pacienţii în ambulatoriu cu BCR uşoară până la moderată (CrCl 30 până la 50 ml/minut sau mai mare), anticoagulantele orale directe (apixaban, rivaroxaban, edoxaban, dabigatran) sunt la fel de eficiente ca warfarina şi cel puţin la fel de sigure. Ajustări ale dozei pot fi necesare, conform monografiilor medicamentelor;
-
pentru pacienţii nespitalizaţi cu insuficienţă renală severă (CrCl < 30 ml/minut) există deocamdată dovezi limitate pentru a prezice modul în care anticoagulantele orale directe se pot compara cu warfarina. Warfarina sau heparina cu greutate moleculară mică sunt în general preferate la cei cu un ClCr mai mic de 30 ml/minut care necesită anticoagulare pe termen lung.(25)
Alte medicamente
Subcitratul de bismut este contraindicat în insuficienţa renală severă. În insuficienţa renală severă se recomandă reducerea dozelor de antisecretoare gastrice anti-H2 la jumătate faţă de cele uzuale. Ca urmare a riscului de hipermagneziemie şi de intoxicaţie cu aluminiu, antiacidele nu se folosesc în insuficienţă renală severă(18).
AINS se folosesc cu prudenţă sau sunt contraindicate în insuficienţa renală severă.
Analgezicul opioid petidină nu trebuie administrat pacienţilor cu insuficienţă renală, deoarece metabolitul său normeperidină, a cărui eliminare depinde de rinichi, poate cauza convulsii(26).
Folosirea agenţilor de contrast iodaţi necesită prudenţă în BCR, din cauza nefrotoxicităţii lor. Pacienţii cu insuficienţă renală trebuie să fie supuşi hidratării profilactice înainte de a li se administra medii de contrast radiologic care conţin iod(26).
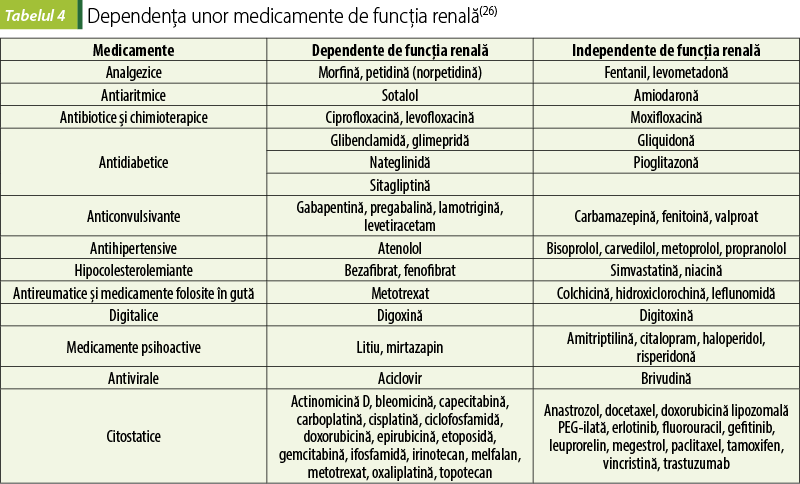
Alte medicamente a căror eliminare depinde de funcţia renală, precum şi variante ale lor considerate sigure în BCR sunt prezentate în tabelul 4.
Prin numărul pacienţilor afectaţi şi prin implicaţiile pe care le are asupra morbidităţii şi mortalităţii asociate altor boli cronice, boala renală cronică este o adevărată problemă de sănătate publică. Identificarea precoce, nutriţia adecvată şi buna gestionare a hipertensiunii arteriale sau a diabetului cu medicamente care au dovedit efecte renoprotectoare sunt modalităţi bune de a întârzia progresia acestei afecţiuni. Deoarece rinichii excretă multe medicamente, ajustarea dozelor acestora în BC este necesară pentru a limita apariţia supradozării.
Bibliografie
-
Mason DL. Chronic kidney disease. In: Zeind CS, Carvalho MG, editors. Applied Therapeutics. The Clinical Use of Drugs. 11th ed. Wolters Kluwer Health; 2017. p. 597–629.
-
Greene RJ, Harris ND. Renal System. In: Pathology and Therapeutics for Pharmacists. 3rd ed. Pharmaceutical Press; 2008. p. 869–492.
-
Lv J-C, Zhang L-X. Prevalence and Disease Burden of Chronic Kidney Disease. Adv Exp Med Biol. 2019;1165:3–15.
-
KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease: Definition and classification of CKD. Kidney Int Suppl. 2013;3(1):19–62.
-
National Kidney Foundation. Frequently asked questions about GFR estimates. https://www.kidney.org/sites/default/files/docs/12-10-4004_abe_faqs_aboutgfrrev1b_singleb.pdf, accesat 01 februarie 2022.
-
KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease: Summary of Recommendation Statements. Kidney Int Suppl. 2013;3(1):5–14.
-
Mancia G, Schumacher H, Redon J, Verdecchia P, Schmieder R, Jennings G, et al. Blood pressure targets recommended by guidelines and incidence of cardiovascular and renal events in the Ongoing Telmisartan Alone and in Combination With Ramipril Global Endpoint Trial (ONTARGET). Circulation. 2011;124(16):1727–36.
-
Kurts C, Panzer U, Anders H-J, Rees AJ. The immune system and kidney disease: basic concepts and clinical implications. Nat Rev Immunol. 2013;13(10):738–53.
-
Williams B, Mancia G, Spiering W, Agabiti Rosei E, Azizi M, Burnier M, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 2018;39(33):3021–104.
-
Chang AR, Lóser M, Malhotra R, Appel LJ. Blood Pressure Goals in Patients with CKD: A Review of Evidence and Guidelines. Clin J Am Soc Nephrol. 2019;14(1):161–9.
-
Weber MA, Bakris GL, Jamerson K, Weir M, Kjeldsen SE, Devereux RB, et al. Cardiovascular events during differing hypertension therapies in patients with diabetes. J Am Coll Cardiol. 2010;56(1):77–85.
-
de Galan BE, Perkovic V, Ninomiya T, Pillai A, Patel A, Cass A, et al. Lowering blood pressure reduces renal events in type 2 diabetes. J Am Soc Nephrol. 2009;20(4):883–92.
-
Muskiet MHA, Tonneijck L, Smits MM, van Baar MJB, Kramer MHH, Hoorn EJ, et al. GLP-1 and the kidney: from physiology to pharmacology and outcomes in diabetes. Nat Rev Nephrol. 2017;13(10):605–28.
-
Wanner C, Inzucchi SE, Lachin JM, Fitchett D, von Eynatten M, Mattheus M, et al. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med. 2016;375(4):323–34.
-
Heerspink HJL, Stefánsson B V., Correa-Rotter R, Chertow GM, Greene T, Hou F-F, et al. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. 2020;383(15):1436–46.
-
EMA/CHMP. Forxiga. Rezumatul caracteristicilor produsului. Ultima actualizare ianuarie 2022.
-
Sylvester R. Anemia. In: Chisholm-Burns MA, Schwinghammer TL, Wells BT, Malone PM, Kolesar JM, DiPiro JT, editors. Pharmacotherapy Principles and Practice. McGraw-Hill; 2016.
-
Chiriţă C, Marineci CD. Agenda medicală. Bucureşti: Editura Medicală; 2021.
-
Whittaker CF, Miklich MA, Patel RS, Fink JC. Medication Safety Principles and Practice in CKD. Clin J Am Soc Nephrol. 2018;13(11):1738–46.
-
Dobrescu D, Negreş S, Dobrescu L, McKinnon R. Memomed 2021. Bucureşti: Editura Universitară; 2021.
-
Morell P, Barrett C V, Mason JL, Toews AD, Hostettler JD, Knapp GW, et al. Gene expression in brain during cuprizone-induced demyelination and remyelination. Mol Cell Neurosci. 1998;12(4–5):220–7.
-
Ikizler TA. Nutrition and Kidney Disease. In: Gilbert S, Weiner DE, editors. Primer on Kidney Diseases. 7th ed. Elsevier; 2017. p. 484–93.
-
Kim SM, Jung JY. Nutritional management in patients with chronic kidney disease. Korean J Intern Med. 2020;35(6):1279–90.
-
Vilay AM. Antibiotic Dosing in Chronic Kidney Disease and End-Stage Renal Disease: A Focus on Contemporary Challenges. Adv Chronic Kidney Dis. 2019;26(1):61–71.
-
Leung LL. Direct oral anticoagulants (DOACs) and parenteral direct-acting anticoagulants: Dosing and adverse effects - UpToDate [Internet]. [accesat 02/2022]. www.uptodate.com
-
Hartmann B, Czock D, Keller F. Drug therapy in patients with chronic renal failure. Dtsch Arztebl Int. 2010;107(37):647–55; quiz 655–6.





