Noutăţi în tratamentul insuficienţei cardiace
What’s new in heart failure treatment?
Abstract
Heart failure is one of the leading causes of morbidity globally, with an increasing incidence. Heart failure is a progressive, multi-causal syndrome with three phenotypic manifestations: heart failure with reduced ejection fraction, heart failure with mildly reduced ejection fraction, and heart failure with preserved ejection fraction. The aims of therapeutic interventions are to alleviate symptoms, limit disease progression, increase quality of life, decrease hospitalisations and prolong survival. Evidence-based treatment guidelines propose optimised individual strategies based on high-quality data collected from clinical trials. New therapeutic classes have emerged in recent years for different forms of heart failure.Keywords
heart failureejection fractionneurohormonal antagonistsevidence-based therapyRezumat
Insuficienţa cardiacă este una dintre principalele cauze de morbiditate la nivel global, cu o incidenţă în creştere. Insuficienţa cardiacă este o afecţiune progresivă, un sindrom având cauze multiple şi care are ca manifestări fenotipice insuficienţa cardiacă cu fracţie de ejecţie redusă, insuficienţa cardiacă cu fracţie de ejecţie uşor redusă şi insuficienţa cardiacă cu fracţie de ejecţie păstrată. Scopurile intervenţiilor terapeutice sunt atenuarea simptomelor, limitarea progresiei afecţiunii, sporirea calităţii vieţii, reducerea spitalizărilor şi prelungirea supravieţuirii. Ghidurile de tratament bazate pe dovezi propun strategii individuale optimizate, pe baza datelor de înaltă calitate colectate din studii clinice. Noi clase terapeutice au apărut în ultimii ani, cu indicaţie în diferite forme de insuficienţă cardiacă.Cuvinte Cheie
insuficienţă cardiacăfracţie de ejecţieantagonişti neurohormonaliterapie bazată pe doveziInsuficienţa cardiacă (IC) este un sindrom clinic complex cauzat de tulburările cardiace structurale sau funcţionale care afectează capacitatea ventriculului de a se umple ori de a pompa sânge.
Principalele simptome ale IC sunt dispneea, oboseala, edemele şi intoleranţa la efort. IC este o afecţiune progresivă, care scade calitatea vieţii şi este una dintre principalele cauze de morbiditate şi mortalitate la nivel mondial.
Numărul pacienţilor cu insuficienţă cardiacă la nivel mondial aproape s-a dublat, de la 33,5 milioane în 1990 la 64,3 milioane în 2017(1). Este de aşteptat ca şi mai multe persoane să sufere în viitor de această afecţiune, deoarece prevalenţa ei creşte cu vârsta, iar speranţa de viaţă şi numărul seniorilor cresc.
Nu există tratament curativ pentru IC. Obiectivele terapeutice generale ale IC cronice includ prevenirea apariţiei simptomelor clinice sau reducerea acestora, prevenirea sau reducerea spitalizărilor, încetinirea progresiei bolii, îmbunătăţirea calităţii vieţii şi prelungirea supravieţuirii(2).
Deoarece terminologia, tehnicile de diagnostic şi intervenţiile terapeutice în IC au suferit schimbări importante în ultimii ani, în prezent ghidurile de tratament ale principalelor asociaţii profesionale din domeniu (Heart Failure Society of America, American College of Cardiology – ACC, American Heart Association – AHA, European Society of Cardiology – ESC) reprezintă o standardizare a managementul IC, prin înglobarea recomandărilor bazate pe dovezi furnizate de studii clinice de mari dimensiuni, relevante(2,3).
Fiziopatologia IC
Insuficienţa cardiacă poate avea cauze ischemice, nonischemice sau idiopatice.
Insuficienţa cardiacă este un sindrom care poate avea mai multe cauze. Ocazional, IC apare brusc, cum ar fi după un infarct miocardic acut sau după o regurgitare mitrală acută. Mai frecvent, debutul este treptat şi apare prin pierderea progresivă a funcţiei miocardice sau ca urmare a unor schimbări degenerative lente ale funcţiei valvelor cardiace(4).
Problema de bază în insuficienţa cardiacă este reducerea debitului cardiac şi, prin urmare, scăderea tensiunii arteriale, însă sindromul de IC apare în mare parte ca urmare a răspunsurilor neurohormonale induse de scăderea tensiunii arteriale şi de perfuzia renală redusă. Apar activări la nivelul sistemului nervos simpatic şi sistemului renină-angiotensină-aldosteron. Consecinţele acestor mecanisme compensatorii sunt vasoconstricţia arterelor şi venelor şi retenţia excesivă de sare şi apă de către rinichi. Aceste răspunsuri fiziologice normale au însă beneficii limitate în IC(4).
În ventriculul care devine insuficient, volumul de sânge expulzat la o contracţie scade; debitul‑bătaie devine mai puţin responsiv la modificări ale presarcinii (întoarcerea venoasă). Ca urmare a activării mecanismelor compensatorii, retenţia hidrosalină creşte volemia, iar venoconstricţia creşte întoarcerea venoasă către inimă. Aceşti factori cresc presiunea de umplere a ventriculului stâng, în încercarea de a restabili debitul cardiac de repaus. Ritmul cardiac creşte, de asemenea, cu creşterea debitul cardiac, în ciuda unui volum mai mic al debitului‑bătaie. Cu toate acestea, un nivel persistent crescut al tonusului sistemului nervos simpatic duce la down‑reglarea receptorilor β1 cardiaci, astfel încât menţinerea debitului cardiac datorată creşterii frecvenţei nu mai este la fel de eficientă. În cazul în care aceste răspunsuri sunt de succes în restabilirea unui debit cardiac de repaus normal, se spune despre IC că este compensată. Cu toate acestea, debitul cardiac nu poate creşte în continuare pentru a satisface nevoile organismului în timpul efortului. Decompensarea IC apare când combinaţia dintre creşterile presarcinii şi ale frecvenţei cardiace nu reuşesc să restabilească un debit cardiac de repaus normal(4).
Ca răspuns la creşterea presiunilor de umplere atrială şi ventriculară, apare eliberarea de peptidă natriuretică de tip A (ANP) şi de peptidă natriuretică de tip B (BNP). Aceste peptide favorizează natriureza şi vasodilataţia, dar sunt relativ ineficiente în prezenţa activării neurohomonale. Peptidele natriuretice sunt degradate de neprilizină, o endopeptidază neutră, care are şi alte substraturi, inclusiv angiotensină II, bradikinină, endotelină şi vasopresină(4).
În cele mai multe cazuri de IC, deficitul funcţional afectează iniţial ventriculul stâng. Pe măsură ce volemia continuă să crească în încercarea de a creşte debitul‑bătaie, presiunea hidrostatică din venele pulmonare creşte. Când această presiune hidrostatică depăşeşte presiunea coloid-osmotică plasmatică, are loc extravazarea plasmei; fluidul se deplasează în interstiţiul alveolelor şi apoi în spaţiile alveolare, producând edem pulmonar. În cele din urmă, presiunea vasculară pulmonară crescută compromite funcţionarea ventriculului drept şi duce la insuficienţă cardiacă dreaptă. Se instalează insuficienţa biventriculară sau insuficienţa cardiacă congestivă, iar edemul se dezvoltă în ţesuturile periferice şi splanhnice(4).
Rezistenţa arterială periferică (postsarcina) creşte, de asemenea, ca urmare a mecanismelor compensatorii. Ventriculul insuficient nu poate să îşi mărească adecvat forţa de contracţie pentru a contracara vasoconstricţia periferică; de aceea, debitul cardiac scade şi mai mult(4).
În urma pierderii miocitelor, cum ar fi după un infarct miocardic sau în cardiomiopatii, au loc modificări adaptive în miocitele supravieţuitoare şi în matricea extracelulară; apare procesul de remodelare ventriculară. Remodelarea ventriculară are loc sub influenţa mai multor factori: catecolamine, angiotensină II, aldosteron şi citokine proinflamatorii. Ventriculul stâng hipertrofiat devine disfuncţional; acest tip de IC se caracterizează printr-o fracţie de ejecţie redusă(4).
IC poate apărea, de asemenea, din cauza relaxării diastolice afectate, ducând la umplere ventriculară redusă Volumul‑bătaie este redus, dar fracţia de ejecţie este normală. Această formă de IC este cunoscută sub numele de insuficienţă cardiacă cu fracţie de ejecţie păstrată (IC-FEP), sau insuficienţă cardiacă diastolică. Aceasta apare de obicei la persoanele în vârstă, în asociere cu hipertrofia ventriculară stângă, dar şi în IC care însoţeşte disfuncţia ventriculară ischemică stângă sau stenoza aortică(4).
Anumite medicamente care pot precipita sau agrava IC
Întocmirea sau consultarea listei complete şi actuale a medicamentelor şi suplimentelor alimentare pe care le utilizează pacientul poate pune în evidenţă medicamente care pot favoriza sau agrava IC. Efecte detrimentale asupra inimii insuficiente pot apărea prin mai multe mecanisme(5):
-
efect inotrop negativ – antiaritmice (disopiramidă, dronedaronă, flecainidă, propafenonă, sotalol); beta-blocante (propranolol, metoprolol, carvedilol); blocante non-dihidropiridinice ale canalelor de calciu (verapamil, diltiazem); itraconazol;
-
cardiotoxicitate – antineoplazice (antracicline: doxorubicină, daunorubicină, epirubicină, idarubicină, daunomicină; citostatice clasice: ciclofosfamidă, ifosfamidă, mitoxantronă; anticorpi monoclonali: pertuzumab, trastuzumab, bevacizumab; inhibitori de tirozin-kinază: lapatinib, sunitinib, sorafenib, imatinib); carbamazepină; alcool etilic şi alte substanţe abuzate în scop recreaţional (cocaină, metamfetamină);
-
retenţie hidrosalină – AINS inhibitoare neselective ale COX sau selective COX-2; antidiabetice agonişti PPAR-gamma (pioglitazonă; rosiglitazonă – retrasă); glucocorticoizi; hormoni androgeni şi estrogeni; doze mari de salicilaţi; medicamente utilizate ca săruri de sodiu (penicilina sodică, piperacilină sodică etc.) sau preparatele efervescente;
-
mecanisme necunoscute – antagonişti ai TNF-α (adalimumab, infliximab, etanercept); antidiabetice inhibitoare ale dipeptidil-peptidazei 4 (saxagliptină).
Tipuri de IC şi stadializare
Parametrul definitoriu pentru clasificarea IC şi pentru instituirea tratamentului este fracţia de ejecţie a ventriculului stâng, evaluată ecocardiografic. În funcţie de afectarea nivelului fracţiei de ejecţie, vorbim despre trei fenotipuri.
Insuficienţa cardiacă cu fracţie de ejecţie redusă (IC-FER)
În IC-FER, scăderea debitului cardiac conduce la activarea unor răspunsuri compensatorii care încearcă să menţină debitul cardiac adecvat. Aceste răspunsuri includ activarea sistemului nervos simpatic şi a sistemului renină-angiotensină-aldosteron (RAAS). Aceste mecanisme compensatorii sunt responsabile pentru simptomele IC-FER şi contribuie la progresia bolii.
În IC-FER, fracţia de ejecţie a ventriculului stâng este sub 40%. De cele mai multe ori, IC-FER este însoţită de simptome caracteristice; cu tratament adecvat, simptomele pot să se diminueze.
Două treimi din cazurile de IC-FER se dezvoltă ca urmare a bolii coronariene; restul au cauză nonischemică: HTA, afecţiuni tiroidiene, obezitate, stres, substanţe cardiotoxice, miocardite, tahicardie, sarcină sau idiopatice(2).
Insuficienţa cardiacă cu fracţie de ejecţie uşor redusă (IC-FEUR)
Fracţia de ejecţie a ventriculului stâng este între 41% şi 49%(2).
Insuficienţa cardiacă cu fracţie de ejecţie păstrată (IC-FEP)
În această situaţie, fracţia de ejecţie este mai mare de 50%. IC-FEP afectează aproape jumătate din pacienţii cu IC, fiind în majoritatea cazurilor urmare a HTA. Relaxarea şi umplerea ventriculară sunt afectate, dar mişcările pereţilor ventriculari sunt normale(2).
Severitatea simptomatică a IC
Prezentarea clinică a pacienţilor cu IC variază de la asimptomatici până la şoc cardiogen.
În stadiile incipiente ale IC, mai ales ale celei cu fracţie de ejecţie păstrată, precum şi la pacienţii trataţi optim, semnele pot să nu fie prezente(5).
Simptomele IC sunt: dispnee (în special la efort), ortopnee, scurtarea respiraţiei, dispnee paroxistică nocturnă, intoleranţă la efort, tahipnee, tuse, oboseală, nicturie şi/sau poliurie, hemoptizie, dureri abdominale, anorexie, greaţă, balonare, ascită, modificări ale stării mentale (confuzie, halucinaţii), stări de slăbiciune şi letargie, insomnie(5).
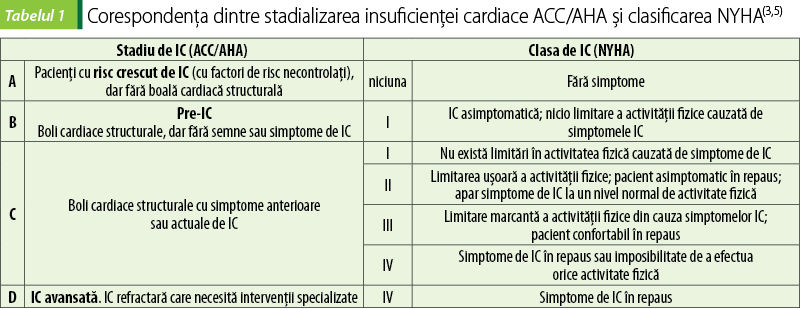
Clasificarea funcţională a IC furnizată de The New York Heart Association se bazează pe toleranţa pacientului la activitate fizică. Plasarea pacientului într-o clasă NYHA de IC reflectă evaluarea subiectivă a simptomelor pacientului de către cardiolog şi poate suferi schimbări frecvente, ascendente sau descendente. Stadializarea ACC/AHA oferă o imagine a dezvoltării şi progresiei ireversibile a IC. Această stadializare propune strategii de gestionare a fiecărui stadiu, inclusiv de modificare a factorilor de risc, pentru a împiedica sau întârzia progresia IC(3).
Antecedentele de infarct de miocard, remodelarea ventriculului stâng, scăderea fracţiei de ejecţie a ventriculului stâng sau afecţiunile valvelor cardiace reprezintă afecţiuni cardiace structurale care echivalează cu preinsuficienţa cardiacă (stadiul B de IC). Se consideră dovezi de boli cardiace structurale care favorizează instalarea IC dimensiunile crescute ale atriului stâng, hipertrofia VS sau disfuncţia diastolică a VS(2).
Gestionarea insuficienţei cardiace cu fracţie de ejecţie redusă(2)
Gestionarea IC cronice se face cu medicamente modificatoare de boală, care ţintesc mecanismele neurohormonale şi alte mecanisme compensatoare, şi cu medicamente simptomatice precum diureticele, folosite pentru combaterea supraîncărcării de volum.
Medicamentele modificatoare de boală de primă alegere (terapii de bază) sunt considerate IECA, ARNI, BB, ARM şi inhibitorii SGLT2. La anumiţi pacienţi se pot utiliza şi alte medicamente modificatoare de boală, de a doua alegere (BRA, inhibitoare ale nodului sinusal, vericiguat, digoxin sau asocierea hidralazină/isosorbid dinitrat)(2).
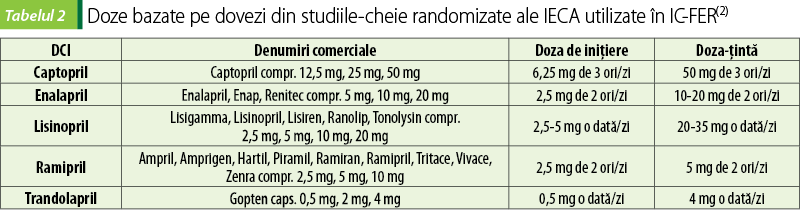
IECA
IECA ar trebui administrate tuturor pacienţilor cu IC-FER, cu excepţia celor la care sunt contraindicate. IECA scad nivelul de angiotensină II şi aldosteron, atenuând remodelarea ventriculară, fibrozarea miocardului, apoptoza miocitelor şi hipertrofia cardiacă. Scad, de asemenea, eliberarea de catecolamine şi împiedică vasoconstricţia şi retenţia hidrosalină.
Beneficiile IECA în IC sunt ameliorarea simptomatologiei, creşterea toleranţei la efort şi îmbunătăţirea statusului clinic general. Reduc progresia IC, incidenţa spitalizărilor, îmbunătăţesc calitatea vieţii şi prelungesc supravieţuirea(6,7).
IECA au următoarele reacţii adverse: rash, tuse seacă, angioedem, hiperpotasemie (mai ales la pacienţi cu insuficienţă renală (IR) sau care iau antiinflamatoare nesteroidiene, diuretice antialdosteronice sau suplimente cu potasiu), disgeuzie, afectare renală acută la pacienţi cu stenoză renală, proteinurie, neutropenie, hipotensiune la iniţierea tratamentului, mai ales la pacienţii cu activitate crescută a reninei plasmatice sau la cei hipovolemici(4).
Pentru a preveni riscul de hipotensiune arterială şi afectarea renală acută, tratamentul cu IECA se începe cu doze mici, care se cresc treptat(7).
IECA sunt contraindicate în sarcină, în edem angioneurotic, în hiperpotasemie şi la pacienţi cu stenoză bilaterală de arteră renală. Se evită sarcina pe perioada utilizării: femeile trebuie consiliate să utilizeze o contracepţie eficace(7).
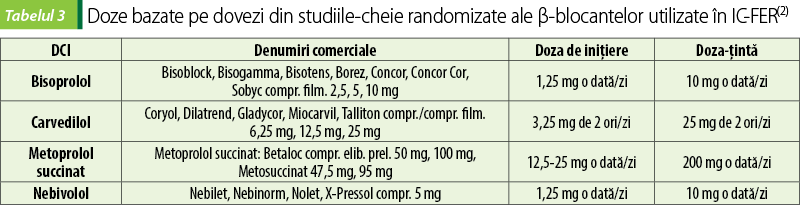
Beta-blocante
Beta-blocantele încetinesc progresia IC, reduc spitalizările şi reduc mortalitatea la pacienţii cu IC sistolică(7).
Beta-blocantele sunt indicate la toţi pacienţii stabili, cu IC şi FEVS redusă în absenţa contraindicaţiilor sau a unui istoric de intoleranţă la β-blocante; pacienţii ar trebui să primească un β-blocant chiar dacă simptomele sunt moderate sau bine controlate de tratamentul cu IECA şi diuretice(7).
Beta-blocantele le sunt recomandate şi pacienţilor asimptomatici cu FEVS redusă (stadiul B) pentru a scădea riscul de progresie către IC(7).
Se recomandă iniţierea beta-blocantelor la pacienţi stabili, fără retenţie hidrică sau cu încărcare minimă de lichide(7).
Se face titrarea ascendentă lentă a dozei (deoarece au efect inotrop negativ, se începe cu doze foarte scăzute de β-blocant, pentru evitarea înrăutăţirii simptomatologiei sau a decompensării acute). Dacă este posibil, se cresc progresiv dozele până la doza-ţintă pentru a obţine beneficii maximale în privinţa supravieţuirii(6,7). Dozele ar trebui dublate la interval de minimum două săptămâni, în funcţie de tolerabilitate, până la atingerea dozei-ţintă sau a celei maxime tolerate (pacienţii trebuie informaţi asupra titrării lente a dozelor şi atingerii dozei-ţintă)(6,7).
Răspunsul la tratament poate apărea cu întârziere şi simptomatologia IC se poate înrăutăţi pe parcursul perioadei de iniţiere(6,7).
Beta-blocantele pot avea următoarele reacţii adverse: bronhospasm, fatigablitate, insomnie, disfuncţii sexuale, exacerbarea insuficienţei cardiace, mascarea semnelor hipoglicemiei, trigliceridemie, creşterea colesterolului total şi a LDL-colesterolului.
Contraindicaţii absolute ale beta-blocantelor sunt: astm bronşic, bloc atrioventricular de grad 2 sau 3. Contraindicaţii relative ale beta-blocantelor sunt: sindrom metabolic, intoleranţă la glucoză, boală pulmonară obstructivă cronică. Beta-blocantele pe lista substanţelor interzise a fi folosite de unele categorii de sportivi.


Antagoniştii receptorilor pentru mineralocorticoizi (antagonişti ai receptorilor aldosteronului)
ARM blochează receptorii mineralocorticoizi; astfel, sunt antagonizate efectele aldosteronului. Reabsorbţia sodiului şi excreţia potasiului sunt inhibate, dar la dozele utilizate în IC efectul diuretic este minim. Beneficiile terapeutice în IC sunt datorate altor acţiuni: inhibarea depozitării matrixului extracelular şi a colagenului, cu atenuarea fibrozării cardiace şi a remodelării ventriculare. ARM diminuează, de asemenea, statusul sistemic proinflamator, stresul oxidativ şi aterogeneza mediate de aldosteron(6,7).
Pentru a scădea riscul de hiperkaliemie, tratamentul se începe cu doze mici, care sunt crescute treptat(2).
Reacţiile adverse ale antagoniştilor receptorilor pentru mineralocorticoizi sunt hiperpotasemie (mai ales la pacienţii cu insuficienţă renală sau la cei trataţi cu IECA, BRA sau AINS), greaţă şi disconfort gastrointestinal. Deoarece spironolactona are şi efecte antiandrogenice, poate produce impotenţă, iar ca urmare a activităţii progesteronice, poate cauza ginecomastie şi menstre neregulate(7).
ARM sunt contraindicaţi în insuficienţa renală acută sau severă şi în hiperpotasemie (potasemie mai mare de 5 mEq/L) sau în caz de hiperpotasemie severă(7).
ARNI (inhibitor al receptorilor angiotensinei II şi inhibitor de neprilizină)
Asocierea valasartan/sacubitril este aprobată pentru tratarea IC-FER şi conţine un inhibitor al receptorilor angiotensinei (valsartan) şi un inhibitor al neprilizinei (sacubitril). Neprilizina este o enzimă care degradează peptidele natriuretice endogene(6,7).
Sacubitril este un prodrog care se scindează în formă activă după administrare. Combinaţia cu valsartan anulează efectele nivelurilor crescute de angiotensină II care ar rezulta în urma utilizării doar a neprilizinei(6,7).
Combinaţia este indicată în reducerea riscului de deces cardiovascular şi a spitalizărilor la pacienţi cu IC clasa II-IV NYHA şi FEVS redusă(7).
Administrarea se face prin titrare până la doza-ţintă: 200 mg (97 mg sacubitril/103 mg valsartan) de 2/zi.
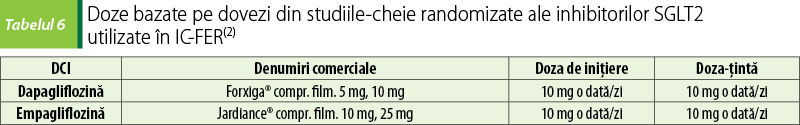
Inhibitorii cotransportorului 2 sodiu-glucoză SGLT2
Dapagliflozina, empagliflozina şi sotagliflozina le sunt recomandate pacienţilor cu IC-FER pentru a reduce riscul de spitalizare şi de deces(2).
O metaanaliză publicată în 2021, cea mai mare de până acum, arată că utilizarea inhibitorilor SGLT2 este asociată cu reducerea riscului de spitalizare datorată IC, de deces de cauză cardiovasculară şi de mortalitate de toate cauzele la pacienţii cu IC, indiferent de starea iniţială a diabetului zaharat. Cele mai bune rezultate în reducerea riscului sunt la pacienţii cu IC-FER(8).
Unele dintre beneficiile inhibitorilor SGLT2 în IC ar putea fi explicate prin natriureza şi diureza osmotică realizate. Inhibitorii SGLT2 nu reduc volumul intravascular la fel de mult ca diureticele clasice, ci vizează destul de selectiv lichidul interstiţial, cu o reducere mai mare a fluidului extracelular şi fără impact major asupra perfuziei organelor. În plus, spre deosebire de diureticele de ansă, inhibitorii SGLT2 promovează uricozuria şi pot inversa hiperuricemia indusă de diuretic, un alt factor care contribuie la efectele lor de protecţie cardiovasculară. Scad tensiunea arterială fără a creşte frecvenţa cardiacă şi, prin urmare, îmbunătăţesc travaliul cardiac(8).
Mecanismele intime de acţiune ale inhibitorilor SGLT2 nu sunt pe deplin cunoscute încă. Se pare că realizează o stare care mimează înfometarea; ca urmare, apar activări ale căilor de semnalizare care implică enzime importante, precum sirtuina 1 (SIRT1) şi kinaza proteinei activate de adenozin monofosfat (AMPK), ambele atenuând stresul oxidativ şi inflamaţia şi promovând oxidarea acizilor graşi. În plus, activarea SIRT1 duce la stimularea sintezei de eritropoietină şi a eritrocitozei, care s-a dovedit a fi unul dintre factorii ce contribuie la beneficiile cardiovasculare semnificative ale inhibitorilor SGLT2. Au efect antifibrotic: empagliflozin atenuează direct activitatea miofibroblastelor cardiace şi remodelarea colagenului, iar dapagliflozin diminuează procesul de fibroză miocardică după infarctul miocardic. Efecte benefice apar şi din acţiunile acestora la nivelul metabolismului glucidic, unde îmbunătăţesc sensibilitatea la insulină şi controlul glicemic(8).
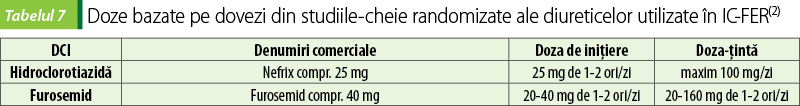

Alte medicamente: diuretice, BRA, ivabradină, digoxin, combinaţia hidralazină/isosorbid dinitrat
Diuretice
Diureticele sunt indicate la pacienţii cu dovezi de retenţie de lichide.
Inhibă reabsorbţia sodiului în segmentul ascendent al ansei Henle (diureticele de ansă: furosemid) sau în tubulul distal (tiazide: hidroclorotiazidă, precum şi tiazid-like: indapamid). Diureticele de ansă sunt preferate datorită eficacităţii lor diuretice mai mari; diureticele de ansă îşi păstrează, de asemenea, eficacitatea cu scăderea funcţiei renale (sunt necesare doze mai mari odată cu scăderea filtrării glomerulare)(4).
Beneficiile pe termen scurt ale administrării de diuretice saluretice constau în scăderea distensiei venelor jugulare, scăderea congestiei pulmonare şi scăderea edemului periferic. După câteva săptămâni sau luni de tratament, se diminuează simptomele IC şi creşte toleranţa la efort. Pe termen lung, nu au însă beneficiu asupra mortalităţii(4).
Tratamentul se începe cu o doză iniţială mică şi apoi se titrează în funcţie de pacient. La cei cu suprasarcină de volum, terapia se conduce astfel încât să se obţină o pierdere în greutate zilnică de 0,5-1 kg pentru pacienţii în ambulatoriu; tratamentul poate fi mai agresiv la pacienţii spitalizaţi(7).
Monitorizarea tratamentului, mai ales pentru diureticele de ansă, constă în dozarea concentraţiilor plasmatice de potasiu şi de magneziu; în boli cardiovasculare, pentru a minimiza riscul de aritmii, potasemia este de dorit să fie peste 4 mEq/l, iar magneziemia peste 2 mEq/l (dacă este necesar, aceşti electroliţi trebuie suplimentaţi). Pentru a evita leziunile renale acute ca urmare a diurezei crescute, se monitorizează creatininemia şi porţiunea azotată a ureei (BUN). De asemenea, se monitorizează apariţia alcalozei metabolice(4).
Reacţiile adverse ale diureticelor de ansă sunt: hipopotasemie, hiponatremie, hipomagneziemie, deshidratare, hipotensiune posturală, tinitus, afectarea auzului(4).
Reacţiile adverse ale diureticelor tiazidice şi tiazid-like sunt: hipopotasemie, hiperuricemie, intoleranţă la glucoză, hipercolesterolemie, hipertrigliceridemie, hipercalcemie, disfuncţii sexuale la bărbaţi, slăbiciune, rash(4).
Hidroclorotiazida este contraindicată în gută şi trebuie utilizată cu prudenţă în caz de sindrom metabolic sau intoleranţă la glucoză şi în situaţii de hipercalcemie sau de hipopotasemie.
Blocantele receptorilor angiotensinei (BRA)
BRA blochează subtipul AT1 al receptorilor angiotensinei II şi previn astfel efectele nocive ale acesteia. Deoarece nu inhibă enzima de conversie a angiotensinei, nu interferează în metabolismul bradikininei; de aceea, nu sunt implicate în apariţia tusei seci sau a angioedemului, efecte adverse caracteristice IECA(6,7).
Ghidurile recomandă BRA la pacienţii care dezvoltă tuse sau angioedem după IECA, BRA fiind în prezent considerate medicamente de alternativă(2).
Blocarea la mai multe niveluri a sistemului renină‑angiotensină‑aldosteron nu este indicată, deoarece apare risc crescut de afectare renală şi hiperkalemie. Se evită astfel administrarea combinată de IECA, BRA şi ARM(6,7).
Inhibitorii nodului sinusal
Ivrabadina încetineşte frecvenţa cardiacă prin inhibarea canalului If la nivelul nodului sinusal.
Ivabradina (Bixebra®, Ivabradină®, Raenom®, Apredonav®, Felocord®, Corlentor®, cpr. film. 5 mg, 7,5 mg) este autorizată în UE la pacienţii cu IC-FER cu FEVS ≤35%, aflaţi în ritm sinusal, cu o frecvenţă cardiacă de repaus ≥75 bpm(2).
Având în vedere beneficiile asupra mortalităţii bine dovedite ale terapiei cu beta-blocant, pacienţii trebuie să primească beta-blocante la doze maxim tolerate sau ladoze‑ţintă ori să aibă o contraindicaţie pentru administrarea beta-blocantelor înainte de a monitoriza pulsul pentru a decide asupra oportunităţii introducerii în schema terapeutică a ivabradinei(7).
Dozare iniţială: 5 mg de două ori pe zi; se poate creşte până la 7,5 mg de două ori pe zi.
Ivabradina este contraindicată în IC acută decompensată, hipotensiune arterială (<90/50 mm Hg), bradicardie (puls <60 bătăi/min), bloc sinoatrial sau la utilizarea concomitentă cu inhibitori puternici ai CYP3A4(7).
Digoxina
Acest glicozid cardiotonic a fost mult timp una dintre intervenţiile terapeutice larg utilizate în IC pentru efectul său inotrop pozitiv şi cronotrop şi dromotrop negativ.
Deşi nu îmbunătăţeşte supravieţuirea şi nu are efect asupra mortalităţii, îmbunătăţeşte simptomele şi toleranţa la efort şi scade numărul spitalizărilor(2).
Mecanismul de acţiune în IC constă în inhibarea Na-K adenozin trifosfatazei miocardice şi scăderea reabsorbţiei renale a Na, cu minimă creştere a contractilităţii(7).
Isosorbid dinitrat/hidralazină
Combinaţia fixă dintre un nitrat (de exemplu, Isosorbid dinitrat®) şi hidralazină nu este disponibilă comercial în România, dar ghidul ESC pentru gestionarea IC o recomandă, pentru că medicamentele au acţiuni hemodinamice complementare, nitraţii având în primul rând efect venodilatator, cu reducerea presarcinii, pe când hidralazina este un vasodilatator arterial direct care reduce rezistenţa vasculară sistemică şi creşte valoarea debitului-bătaie şi a debitului cardiac(6,7).
Şi alte explicaţii privind efectele benefice ale asocierii au fost propuse: normalizarea stresului oxidativ şi reducerea semnalizării pe calea oxidului nitric, aceasta favorizând progresia IC(6,7).
Ghidurile recomandă adăugarea combinaţiei fixe hidralazină/isosorbid dinitrat la afro-americanii cu IC-FER şi simptome de clasă II-IV NYHA, când tratamentul cu IECA şi β-blocante nu este suficient(6,7). Combinaţia poate fi folositoare pacienţilor care nu pot tolera IECA sau BRA din cauza insuficienţei renale, hiperkalemiei sau a hipotensiunii.
Ca urmare a vasodilataţiei importante, cefaleea şi ameţelile apar cu o frecvenţă relativ crescută, limitând utilizarea(7).
Intervenţii medicale pentru managementul ritmului cardiac
Un cardioverter-defibrilator implantabil reduce riscul de moarte subită cardiacă la pacienţii cu funcţie ventriculară stângă redusă. La acesta se poate asocia terapia de resincronizare cardiacă pentru a îmbunătăţi simptomele şi calitatea vieţii la pacienţii cu simptome severe de IC.
Gestionarea insuficienţei cardiace cu fracţia de ejecţie uşor redusă
Ghidul ESC din 2021 recomandă luarea în considerare a utilizării medicamentelor modificatoare de boală în IC-FEUR pentru a reduce riscul de spitalizare din cauza IC şi de deces. Se pot folosi IECA, BRA, beta-blocante, ARM sau ARNI(2).
Insuficienţa cardiacă cu fracţie de ejecţie păstrată(2)
Dovezile clinice în privinţa eficacităţii medicamentelor în IC-FEP nu au fost, în general, la fel de concludente ca în situaţia IC-FER. Până în prezent, niciun tratament nu a arătat reducerea mortalităţii şi a morbidităţii la pacienţii cu IC-FEP. Sunt recomandate medicamente pentru gestionarea simptomelor, comorbidităţilor şi adresarea factorilor de risc care pot agrava boala cardiovasculară(7).
Tensiunea arterială trebuie să fie bine controlată. HTA afectează relaxarea miocardică şi promovează hipertrofia cardiacă. Ţinta pentru valoarea tensiunii arteriale sistolice ar trebui să fie mai mică de 130 mm Hg. HTA se poate controla cu beta-blocante, IECA şi BRA(7).
Diureticele trebuie utilizate pentru ameliorarea simptomelor în supraîncărcarea volumului(7).
Revascularizarea coronariană este rezonabil de realizat la pacienţii cu angină pectorală sau ischemie miocardică demonstrabilă, simptomatice în ciuda terapiei optime. Pentru a controla simptomele IC, este necesară gestionarea fibrilaţiei atriale(7).
Utilizarea ARM ar putea fi luată în considerare pentru a reduce spitalizările la pacienţii cu IC-FEP aflaţi deja sub tratament cu IECA/BRA şi beta-blocante(7).
Tahicardia scade timpul în care atriile şi ventriculele se pot umple cu sânge, de aceea reducerea ei poate ameliora simptomele IC. Tahicardia se combate cu beta-blocante sau blocante de canale de calciu non-dihidropiridinice; acestea se folosesc cu precauţie, pentru a nu deprima contractilitatea cardiacă(7).
Simptomele dispneei pot fi ameliorate folosind nitraţi în plus faţă de diuretice. Se evită utilizarea nitraţilor în IC-FEP fără boală coronariană simptomatică asociată(7).
Insuficienţa cardiacă avansată
Conform ghidului ESC de gestionare a IC din 2021, suportul circulator mecanic şi transplantul cardiac sunt soluţii terapeutice pentru IC avansată(2). Transplantul cardiac este recomandat pacienţilor cu IC avansată, refractară la farmacoterapie sau pentru care diferitele dispozitive folosite în IC nu sunt adecvate ori sunt insuficiente şi care nu prezintă contraindicaţii absolute(2).
Administrarea continuă a medicaţiei inotrope pozitive şi/sau vasopresoare la pacienţii cu debit cardiac scăzut şi cu dovezi de hipoperfuzie de organ poate fi luată în considerare până la realizarea suportului circulator mecanic sau a transplantului cardiac(2).
Insuficienţa cardiacă acută
Există patru prezentări clinice majore ale IC acute:
IC acută decompensată, edemul pulmonar acut, insuficienţa de ventricul drept şi şocul cardiogen(2).
IC acută decompensată
Recunoaşterea promptă a simptomelor şi tratamentul adecvat sunt esenţiale în gestionarea IC acute decompensate. Principalul pilon al terapiei la pacienţii cu suprasarcină de volum este reprezentat de un diuretic de ansă administrat intravenos.
Medicamentele inotrope pozitive (digoxin) nu au reuşit să prezinte beneficii pe termen lung în reducerea mortalităţii(2).
În IC acută se folosesc:
-
diuretice de ansă administrate intravenos, eventual asociindu-se cu diuretice tiazidice:
-
vasodilatatoare (nitroglicerină, isosorbid dinitrat, nitroprusiat), care combat congestia;
-
medicamente inotrop pozitive (dobutamină, dopamină, epinefrină; milrinonă enoximonă; levosimendan; digoxin) – îmbunătăţesc perfuzia periferică şi menţin funcţia organelor;
-
vasopresoare (adrenalină, noradrenalină) – se utilizează pentru a creşte perfuzia organelor vitale;
-
profilaxia tromboembolismului se face uzual cu heparine cu masă moleculară mică(2).
Edemul pulmonar acut (EPA)
EPA este asociat congestiei pulmonare. Se prezintă cu dispnee, ortopnee, insuficienţă respiratorie cu hipoxemie şi hipercapnie, tahipnee (peste 25 respiraţii/minut) şi travaliu respirator crescut(2).
Gestionarea EPA se face cu oxigenoterapie şi asistarea respiraţiei, precum şi cu medicamente. Se administrează i.v. diuretice şi vasodilatatoare(2).
Şocul cardiogen
Şocul cardiogen se diagnostichează când hipoperfuzia tisulară este severă, putând duce la disfuncţie multiplă de organ şi la deces. Şocul cardiogen se prezintă cu extremităţi reci, transpirate, oligurie, confuzie mentală, ameţeli şi presiune a pulsului scăzută. Este o situaţie de urgenţă, când este necesară administrarea rapidă de diuretice de ansă şi vasopresoase şi/sau inotrop pozitive(2).
Comorbidităţi
Gestionarea IC asociate cu fibrilaţie atrială
Pentru prevenţia AVC se poate folosi tratament pe termen lung cu un anticoagulant oral. Anticoagulantele orale directe (apixaban, rivaroxaba, edoxaban; dabigatran) sunt preferate anticoagulantelor orale cumarinice antivitamină-K la pacienţii cu IC, exceptându-i pe cei cu stenoză mitrală moderat-severă sau cu proteză valvulară mecanică(2).
Pentru controlul frecvenţei, se folosesc beta-blocantele. Dacă acestea sunt contraindicate, nu sunt tolerate sau sunt insuficiente, se foloseşte digoxin(2).
Gestionarea IC asociate cu sindroame coronariene cronice
Beta-blocantele sunt prima alegere terapeutică. Alternativa este reprezentată de ivabradină, care se utilizează dacă beta-blocantele sunt contraindicate sau se asociază beta-blocantelor la pacienţi cu ritm sinusal şi cu frecvenţă cardiacă de peste 70 bătăi/minut(2).
Pot avea beneficii în gestionarea simptomelor coronariene şi alte antianginoase: amlodipina, felodipina, nicorandilul, ranolazina, nitraţii administraţi oral sau transdermic şi trimetazidina(2).
Gestionarea IC asociate cu HTA
Tratamentul HTA este recomandat pentru prevenţia sau întârzierea apariţiei IC şi pentru prevenţia spitalizărilor pentru IC. Cele mai multe medicamente utilizate în IC scad şi tensiunea arterială(2).
Tratamentul cu statine este recomandat la pacienţii cu risc crescut de boală cardiovasculară sau cu boală cardiovasculară pentru prevenirea sau întârzierea apariţiei IC şi pentru prevenţia spitalizărilor pentru IC(2).
Gestionarea IC asociate cu diabet
Inhibitorii SGLT2 (dapagliflozină, empagliflozină şi sotagliflozină) sunt recomandaţi la pacienţii cu DZ de tip 2 şi IC-FER, pentru a reduce spitalizările pentru IC şi decesul de cauză cardiovasculară(2).
Gestionarea IC asociate cu obezitate
Obezitatea poate fi o cauză majoră a IC-FEP. Restricţia calorică şi exerciţiile fizice au efecte benefice adiţionale asupra capacităţii de efort şi asupra calităţii vieţii(2).
Gestionarea IC asociate cu fragilitate, caşexie şi sarcopenie
IC creşte prevalenţa fragilităţii, după cum şi fragilitatea (vulnerabilitatea crescută la factori de stres) creşte riscurile de apariţie a IC(2).
Fragilitatea din IC se gestionează cel mai bine prin reabilitarea fizică cu exerciţii şi prin suplimentare nutriţională(2). De asemenea, antrenamentul fizic poate avea efecte benefice asupra sarcopeniei (masă musculară redusă asociată cu funcţie, forţă sau performanţă musculară scăzute) din IC(2).
Gestionarea IC asociate cu anemie
Terapia orală cu fier nu este eficientă în deficitul de fier din IC şi nu îmbunătăţeşte capacitatea de efort la pacienţii cu IC-FEP şi deficit de fier. Se recomandă administrarea intravenoasă de carboximaltoză ferică dacă feritina serică este <100 ng/mL sau dacă feritină serică este 100-299 ng/mL, iar saturaţia transferinei este sub 20%(2).
Gestionarea IC asociate cu disfuncţie renală
Iniţierea tratamentului cu IECA sau BRA, ARNI sau cu inhibitori de SGLT2 (mai ales dacă nu se începe cu doze mici) duce la scăderea iniţială a presiunii de filtrare glomerulară, cu scăderea RFG şi creşterea creatininei serice; aceste evenimente sunt în general trecătoare(2).
Beta-blocantele reduc mortalitatea la pacienţii cu IC-FER cu disfuncţie renală moderată până la severă. Inhibitorii de SGLT2 realizează protecţia funcţiei renale, atât la pacienţii cu IC-FER, cât şi la pacienţii cu BRC(2).
Educaţia pacientului cu IC. Stil de viaţă, activitate fizică şi dietă
Pacienţii ar trebui educaţi şi încurajaţi să se implice în propria îngrijire, inclusiv în automonitorizare. Statusul volemic trebuie monitorizat zilnic prin evaluarea greutăţii, a edemului periferic şi a toleranţei la efort. Măsurarea greutăţii ar trebui realizată zilnic, dimineaţa la trezire şi înainte de mese, iar valorile înregistrate într-un jurnal şi aduse la fiecare programare la medic sau la specialistul din domeniul sănătăţii implicat în managementul IC. Modificările în greutate pot indica retenţia de lichide înainte de apariţia simptomelor congestive periferice sau pulmonare. Persoanele care iau în greutate mai mult de 1,4 kg într-o singură zi sau 2,3 kg pe parcursul unei săptămâni ar trebui să-şi alerteze medicul(5).
Aderenţa la terapia medicamentoasă este de maximă importanţă în gestionarea IC.
Tratamentul nonfarmacologic implică modificări de dietă, renunţarea la fumat şi activitate fizică.
Pentru a preveni progresia IC, se recomandă întreruperea fumatului, reducerea greutăţii corporale la obezi, controlul HTA (valori tensionale sub 130/80 mm Hg sunt recomandate de ghidurile de terapie americane), controlul diabetului zaharat, limitarea consumului de alcool la cel mult două băuturi pe zi pentru bărbaţi şi maximum una pentru femei (în cardiomiopatia indusă de alcool, consumul de alcool trebuie oprit) şi tratarea apneei de somn(2,5).
Deoarece retenţia de sodiu şi de apă este un mecanism compensator care contribuie la supraîncărcarea de volum compensatorie care apare în IC, restricţia de sare şi, eventual, de fluide este adesea necesară pentru a ajuta la reducerea congestiei. Majoritatea pacienţilor cu stadiul C sau D de IC trebuie să limiteze aportul de sare la maximum 3 g/zi. Pacienţii ar trebui să reducă la minimum gătitul cu sare şi să limiteze aportul de alimente cu conţinut ridicat de sare, cum ar fi alimentele prăjite sau procesate (brânzeturi, gustări sărate şi conserve). Restricţia de sodiu poate fi o provocare, iar schimbările drastice ale dietei pot duce la neaderenţă la recomandările medicale. Restricţia de sodiu poate fi mai eficientă dacă este implementată lent în timp. Înlocuitorii de sare trebuie utilizaţi în mod judicios, deoarece mulţi conţin cantităţi semnificative de potasiu, care pot creşte riscul de hiperkaliemie. Este posibil ca restricţia de lichide să nu fie necesară la mulţi pacienţi. Dacă este cazul (mai ales în stadiul D de IC), aportul de lichide este limitat la un volum din toate sursele de mai puţin de 2 litri pe zi, nivel rezonabil dacă natriemia este scăzută(5).
Activitatea fizică realizată în limitele condiţiei fizice este benefică. Se recomandă activităţi fizice regulate supravegheate, vorbindu-se în prezent de programe de reabilitare cardiacă.
Pacienţii cu IC ar trebui să se vaccineze antigripal anual şi să fie imunizaţi prin vaccinare împotriva pneumoniei pneumococice (ghidul ESC de gestionare a IC din 2021 recomandă luarea în considerare a acestor imunizări pentru a preveni spitalizările pentru IC)(2). Se monitorizează funcţia tiroidiană, deoarece hipotiroidismul poate fi mascat de simptomele IC, iar hipertiroidismul poate agrava disfuncţia sistolică. Deoarece IC este asociată cu un risc mare de instalare a depresiei, sunt necesare depistarea şi tratarea acesteia(7).
Gestionarea IC este o provocare atât pentru pacient, cât şi pentru echipa multidisciplinară care îl îngrijeşte. Farmacistul îşi are locul său în această echipă multidisciplinară.
Bibliografie
-
Bragazzi NL, Zhong W, Shu J, Abu Much A, Lotan D, Grupper A, et al. Burden of heart failure and underlying causes in 195 countries and territories from 1990 to 2017. Eur J Prev Cardiol. 2021;28(15):1682–90.
-
McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A. 2021 Ghidul ESC pentru diagnosticul şi tratamentul insuficienţei cardiace acute şi cronice. Romanian Journal of Cardiology. 2022;32(1).
-
Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2022;145(18).
-
Waller DG, Sampson AP. Heart failure. In: Medical Pharmacology and Therapeutics. Elsevier Limited; 2018. p. 131–43.
-
Ng TMH, Yeung SL. Hearth Failure. In: Chisholm-Burns M, Schwinghammer T, Wells B, Malone P, DiPiro J, Kolesar JM, editors. Pharmacotherapy Principles and Practice. McGraw-Hill; 2022. p. 107–133.
-
Tromp J, Ouwerkerk W, van Veldhuisen DJ, Hillege HL, Richards AM, van der Meer P, et al. A Systematic Review and Network Meta-Analysis of Pharmacological Treatment of Heart Failure with Reduced Ejection Fraction. JACC Heart Fail. 2022;10(2):73–84.
-
Parker RB, Nappi JM, Cavallari LH. Chronic Heart Failure. In: DiPiro JT, Yee GC, Posey LM, editors. Pharmacotherapy: A Pathophysiologic Approach. 11th ed. McGraw-Hill Education; 2020.
-
Tsampasian V, Baral R, Chattopadhyay R, Debski M, Joshi SS, Reinhold J, et al. The Role of SGLT2 Inhibitors in Heart Failure: A Systematic Review and Meta-Analysis. Cardiol Res Pract. 2021;2021:9927533.





