Objective. The purpose of this article is to assess the most recent data in literature regarding factors predicting the risk of residual disease in women treated by cervical conization for adenocarcinoma in situ of the uterine cervix. Adenocarcinoma in situ (AIS) of the cervix is a relatively rare histologic diagnosis; yet, in the last 40 years both incidence and mortality from adenocarcinoma have increased substantially in Europe and The United States.
The management of AIS still represents a challenge to the health care provider and a subject of controversy in literature. Although histerectomy continues to be the treatment of choice for AIS in women who have completed child-bearing, AIS often occurs in women who wish to maintain their fertility (the average age at diagnosis being 35.8 years ), hence the need for a conservative therapy requiring careful follow-up to minimize the risk of residual disease. Recent studies have tried to describe a predictive model of residual disease in women treated conservatively for AIS including conization margin status and endocervical curettage , with encouraging results. One of the major concerns regarding the conservative therapy for cervical AIS is the adequacy and accuracy of follow-up protocols; considering the potential for persistence and recurrence of glandular disease, the ASCCP and ACOG recommend to use a combination of cervical citology, HPV DNA testing, colposcopy with endocervical sampling every 6 months.
Conclusion. patients treated conservatively for cervical AIS need to be counselled regarding the potential risks of residual or recurrent disease despite negative screening results and also the importance of compliance with long-term follow-up ;
combining the conization margin status with endocervical curettage gives the most statistically significant predictive model of residual disease.
Factori predictivi ai bolii reziduale la pacientele cu conizaţie pentru adenocarcinom cervical in situ
Factors predicting the risk of residual disease in women conservatively treated for adenocarcinoma in situ of the cervix
First published: 15 aprilie 2014
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Gine.3.2.2014.4952
Abstract
Rezumat
Obiective. Scopul lucrării este de a realiza o imagine integrată privind datele recente din literatura de specialitate asupra factorilor de predicţie a bolii reziduale în rândul pacientelor tratate conservator pentru adenocarcinom cervical in situ. Adenocarcinomul in situ (AIS) de col uterin reprezintă un diagnostic histologic relativ rar; în ultimii 40 de ani însă, atât rata de incidenţă, cât şi cea de mortalitate prin adenocarcinom cervical au cunoscut creşteri substanţiale în Europa şi în Statele Unite. Managementul AIS constituie în continuare un subiect de controversă în literatura de specialitate. Deşi histerectomia totală este de primă intenţie ca tratament definitiv pentru AIS, o mare parte dintre pacientele diagnosticate cu această patologie sunt tinere (vârsta medie la momentul diagnosticului fiind de 35,8 ani) şi doresc menţinerea funcţiei reproductive, motiv pentru care terapia conservatoare rămâne o alternativă acceptabilă, cu menţiunea că riscul de boală reziduală şi necesitatea unei urmăriri post-terapie atente nu pot fi neglijate. Studiile recente au încercat să descrie un model predictiv al bolii reziduale după tratamentul conservator pentru AIS care să includă, pe lângă statusul marginilor post-rezecţie, şi curetajul endocervical (ECC) efectuat la momentul conizaţiei, rezultatele obţinute fiind încurajatoare. O preocupare majoră a clinicienilor în cazul optării pentru un management conservator al AIS în scopul menţinerii fertilităţii pacientelor este protocolul de follow-up post-terapie, care trebuie să includă citologia cervicală, testarea ADN-HPV, colposcopia cu curetaj endocervical, efectuate la fiecare 6 luni, conform recomandărilor ASCCP şi ACOG. Concluzie. Pacientele care beneficiază de terapie conservatoare pentru AIS trebuie consiliate asupra importanţei deosebite atât a complianţei, cât şi a potenţialelor riscuri de boală cervicală glandulară persistentă sau recurentă, în ciuda rezultatelor negative ale screeningului post-terapie; statusului marginilor post-rezecţie li se poate adăuga ca factor de predicţie pentru boala reziduală curetajul endocervical.
Introducere
Adenocarcinomul cervical in situ, considerat leziune precursoare a carcinomului cervical glandular, reprezintă un diagnostic histologic relativ rar, având o incidenţă de 1,25/100.000 femei; în ultimii 40 de ani însă, atât rata de incidenţă, cât şi cea de mortalitate prin adenocarcinom cervical au cunoscut creşteri substanţiale în Europa şi în Statele Unite(1). Raportul de frecvenţă AIS: CIN3 variază între 1:29 şi 1:239, cu o medie de aproximativ 50 de cazuri de CIN3 pentru fiecare caz de AIS(2). Fie că este o leziune in situ sau invazivă, în 46-72% din cazuri neoplazia glandulară cervicală coexistă cu leziuni displazice scuamoase, în particular cu displazia de grad înalt - CIN3(3,4).
Dacă metodele de screening, detecţie şi tratament al leziunilor preinvazive au avut un impact major asupra incidenţei carcinomului scuamocelular cervical (CSC) pe care au scăzut-o cu cel puţin 75%, acelaşi lucru nu a fost observat şi în cazul carcinomului glandular(3), în principal din cauza sensibilităţii reduse de depistare prin intermediul citologiei cervicale, a aspectelor colposcopice echivoce, a dimensiunii şi localizării leziunilor la nivelul canalului endocervical, a prezenţei leziunilor „skip” (multifocale), a leziunilor mixte.
Valoarea prognostică a citologiei cervicale s-a dovedit a fi mai redusă în cazul adenocarcinomului decât al carcinomului scuamos, pentru că frotiurile PAP pot să nu conţină suficiente celule sugestive pentru afectarea glandulară; sistemul de raportare Bethesda 2001 a înlocuit categoria celulelor „de semnificaţie nedeterminată” (AGUS) cu AGC (atypical glandular cells), iar AIS are propria sa categorie(5). Rezultatele PAP conţin raportări AGC în aproximativ 41-70% din cazuri(6,7); examenul citologic depistează mult mai frecvent anomaliile scuamoase, întrucât acestea sunt mai frecvent exocervicale, deci mai accesibile examinării. În plus, este important ca pe frotiurile PAP AIS să fie diferenţiat de o serie de alte entităţi care pot da aspecte citologice asemănătoare: modificări reactive/reparatorii, modificări Arias-Stella, polip cervical, vestigii de duct mezonefrotic, metaplazie tubară/seroasă, endometrioză cervicală, hiperplazie microglandulară, modificări endocervicale asociate DIU, adenocarcinom invaziv sau adenocarcinom endometrial invaziv(13).
Majoritatea studiilor arată că leziunile glandulare sunt situate la nivelul zonei de transformare (ZT) cervicale; mai mult, în studiul lui Muntz et al. observăm că ele implică exclusiv ZT exocervicală în 53% din cazuri, iar canalul endocervical exclusiv, în doar 5% din cazuri(8). Leziunile glandulare de tip „skip” (AIS multifocal) - leziunile discontinue definite histologic ca o secţiune radială complet normală, care separă două sau mai multe zone de AIS - apar în 6,5%-15% din cazurile de AIS; deşi nu foarte frecvente, ele reprezintă o cauză a valorii predictive negative scăzute pentru boala reziduală pe care o au marginile negative de rezecţie pe piesele de conizaţie(9).
Circumstanţele clinice ale depistării AIS raportate în studiul lui Young et al. din 2007 includ: rezultate anormale ale examenului PAP (dintre care 37% AIS şi 18% AGC), 8,1% cu ocazia curetajului endocervical efectuat la momentul colposcopiei iniţiale, 40% pe piesele de conizaţie efectuate pentru leziuni scuamoase depistate prin PAP sau biopsie cervicală(10). Similar, în studiul lui Soutter et al., din 85 de paciente, 82 s-au prezentat la consult pentru un rezultat anormal la examenul PAP: 53,6% fiind anomalii scuamoase, 28,6% anomalii glandulare şi 15,5% leziuni mixte; restul de două paciente fiind diagnosticate prin conizaţie (o pacientă ca urmare a colposcopiei nesatisfăcătoare şi biopsiei, iar cealaltă pacientă prezentând metroragii disfuncţionale şi CIN în curetajul endocervical)(11). Aspecte similare sunt redate şi în lucrarea lui Tierney et al. din 2014(12).
Stabilirea diagnosticului histologic definitiv concomitent cu excluderea bolii invazive este realizată cu ajutorul unei tehnici excizionale (ERAD, conizaţie chirurgicală, conizaţie laser CO2), care să permită obţinerea unui fragment tisular de dimensiuni şi configuraţie (rază, înălţime) optime(9). Practic, dezideratul este ca piesa obţinută să fie suficient de adâncă pentru a cuprinde întreaga afectare glandulară şi suficient de întinsă pentru a cuprinde leziunea în totalitate; de obicei, lungimea liniară a leziunii AIS (distanţa pe suprafaţa tisulară între marginile caudale şi cefalice ale leziunii) nu depăşeşte 15 mm, iar adâncimea de invazie a criptelor glandulare are o medie de 2,5 mm (maximum 4 mm)(13).
Literatura americană de specialitate încurajează utilizarea conizaţiei cu laser CO2 de înaltă frecvenţă pentru obţinerea unui fragment excelent atât ca eficienţă, dar şi pentru interpretarea anatomopatologică(13); totuşi, din cauza disponibilităţii reduse pe care această tehnică o are în ţara noastră, atât conizaţia chirurgicală, cât şi electrorezecţia cu ansă diatermică (ERAD) - tehnica „top hat” (cu excizia secundară a regiunii din canalul endocervical) reprezintă două alternative larg accesibile practicienilor. În cazul ERAD însă, rata artefactelor termice care fac interpretarea anatomopatologică mult mai dificilă este mai ridicată şi, totodată, studiile au arătat în unanimitate că pentru conizaţia chirurgicală procentul de obţinere a fragmentelor cu margini negative este mai mare faţă de ERAD: 69% vs 50%(10), 58,1% vs 45%(14).
Atât diagnosticul histologic, cât şi managementul AIS constituie în continuare un subiect de controversă în literatura de specialitate. Deşi histerectomia totală este de primă intenţie ca tratament definitiv pentru AIS(9,15), o mare parte dintre pacientele diagnosticate cu această patologie sunt tinere (vârsta variind între 29 şi 46 de ani, cu o medie de 35,8 ani)(13) şi doresc menţinerea funcţiei reproductive, motiv pentru care terapia conservatoare este o alternativă acceptabilă, cu menţiunea că riscul de boală reziduală şi necesitatea unei urmăriri post-terapie atente nu pot fi neglijate. De aceea, nu putem discuta momentan despre o variantă ideală de terapie în rândul pacientelor cu AIS.
Cea mai mare parte a studiilor clinice evaluează ca principal factor predictiv pentru boala reziduală după tratamentul conservator al AIS statusul marginilor piesei de rezecţie; definim anatomopatologic marginile pozitive post-rezecţie ca prezenţa AIS <1 mm faţă de marginea chirurgicală(10). O analiză a lucrărilor publicate în intervalul 1984-2000 pe acest subiect arată că rata de recurenţă în cazul pacientelor care au beneficiat de conizaţie pentru AIS a fost de 8% (tabelul 1)(11).
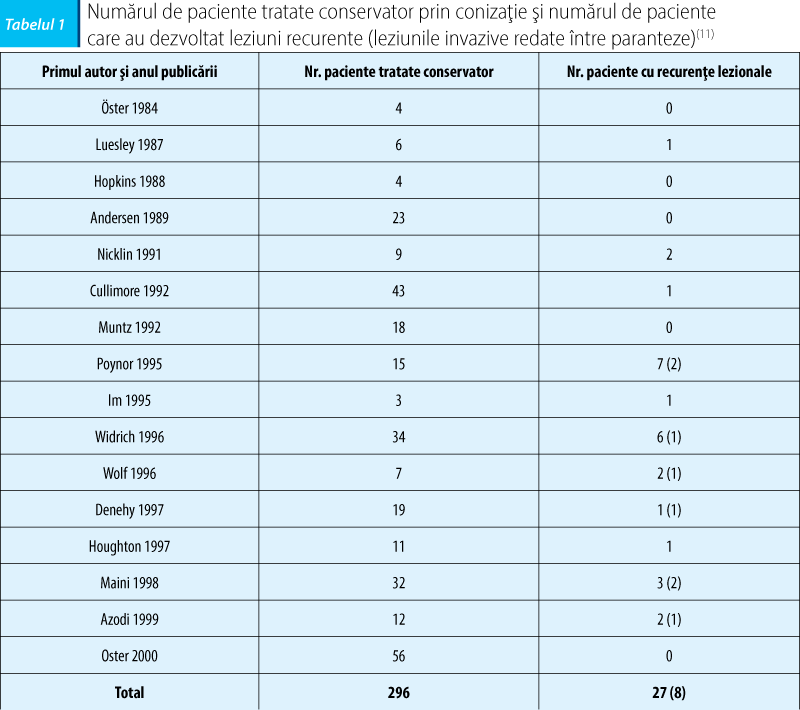
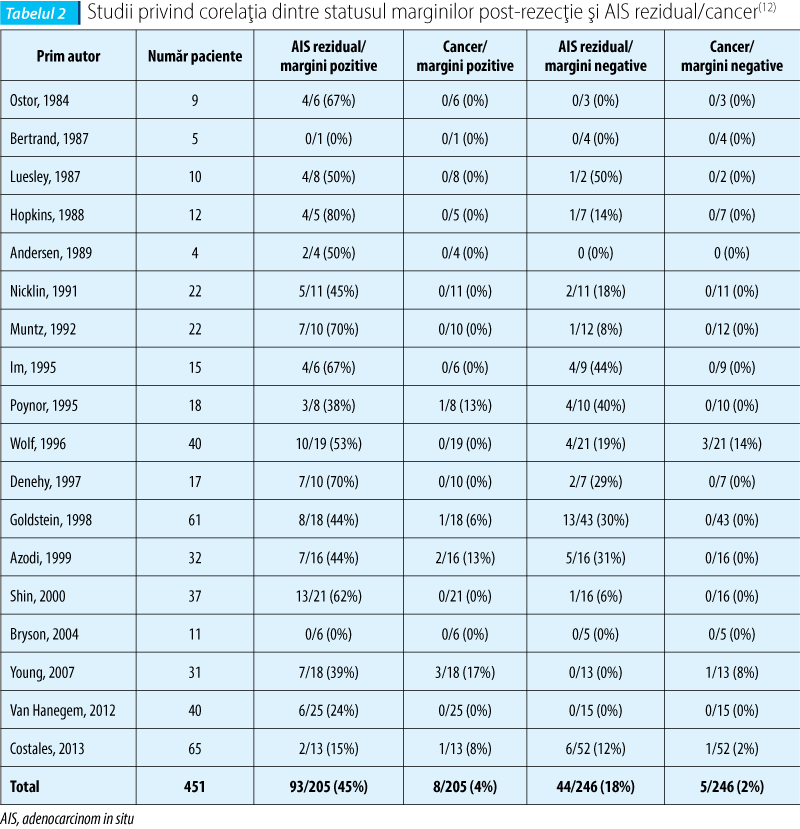
Statusul marginilor de rezecţie se corelează semnificativ statistic cu riscul de boală reziduală; astfel, pacientele la care marginile post-rezecţie au fost pozitive au înregistrat o rată de recurenţă a AIS pe piesele de conizaţie/histerectomie ulterioare de 55-70%(8,10,16,17). Pe de altă parte, marginile negative pentru AIS nu reprezintă o garanţie a vindecării lezionale(10): între 0% şi 13% din cazuri se asociază cu recurenţa AIS; Young et al. raportează în studiul lor că din 46 de paciente cu margini negative post-rezecţie, 6 (13%) paciente au fost diagnosticate cu AIS rezidual, iar două paciente cu adenocarcinom pe parcursul perioadei de follow-up(10); Salani et al. au obţinut un procent mai redus de recurenţă (2,6%) şi de adenocarcinom invaziv (0,1%)(17). Studiul recent efectuat de Tierney et al. arată că valoarea predictivă negativă doar a statusului marginilor de rezecţie nu este la fel de ridicată ca valoarea predictivă pozitivă, întrucât 20% din pacientele cu margini negative au dezvoltat boală reziduală şi 2% cancer invaziv pe perioada urmăririi(12); datele raportate de aceştia sunt în concordanţă cu 18 studii care au analizat corelaţia dintre statusul marginilor post-rezecţie şi AIS rezidual (tabelul 2).
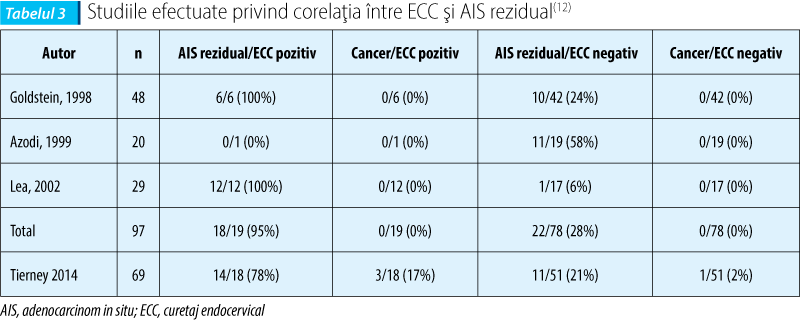
Studiile recente au încercat să descrie un model predictiv al bolii reziduale după tratamentul conservator pentru AIS care să includă, pe lângă statusul marginilor post-rezecţie, şi curetajul endocervical (ECC) efectuat la momentul conizaţiei. Rezultatele obţinute sunt încurajatoare (tabelul 3): Lea et al. au arătat că ECC are atât o valoare predictiv pozitivă superioară (100% vs 47%, p <0,01) şi valoare predictivă negativă (94% vs 57%, p <0,01) comparativ cu statusul marginilor post-rezecţie(18); studiul efectuat de Tierney et al. raportează rezultate similare: riscul de neoplazie glandulară a fost redus (14% risc de AIS, nici un caz de cancer invaziv) dacă nici marginile post-rezecţie şi nici ECC nu au fost pozitive, dar foarte înalt (94%) când ECC este pozitiv şi respectiv 77% când ambele variabile sunt pozitive şi 15% diagnosticate cu cancer invaziv în follow-up(12).
Una dintre limitările pe care le prezintă studiile din literatura de specialitate pe această temă este caracterul retrospectiv al acestora, întrucât un model prospectiv este destul de dificil de realizat, dată fiind relativa raritate a acestei patologii. Un studiu prospectiv arată că din 35 de paciente tratate conservator pentru AIS, nici o pacientă nu a prezentat recurenţă, dar perioada de follow-up a fost de doar 12 luni(19); pe de altă parte, Andersen şi Nielsen au arătat în lucrarea lor că din cele 58 de paciente urmărite pe parcursul a 49 de luni, 4 paciente (6,9%) au fost depistate cu leziuni AIS recurente(20), rată similară celei obţinute în cadrul studiilor retrospective.
Toate datele raportate până în prezent susţin în mod clar că, indiferent de metoda de conizaţie utilizată, atât marginile post-rezecţie, cât şi ECC efectuat la momentul exciziei cervicale sunt utile în predicţia bolii reziduale post-terapie. Cu toate acestea, dat fiind faptul că nici unul dintre cei doi parametri nu poate să excludă cu certitudine o posibilă recurenţă lezională (mai ales că aceasta poate să apară şi tardiv(21), o preocupare majoră a clinicienilor în cazul optării pentru un management conservator al AIS este protocolul de follow-up post-terapie. Utilizarea citologiei cervicale ca metodă de detecţie a leziunilor glandulare post-terapie conservatoare pentru AIS nu este atât de eficientă ca în cazul leziunilor scuamoase, de aceea ea nu poate fi utilizată ca unică modalitate de screening. Costa et al. au arătat că singurul factor independent predictiv atât pentru recurenţa lezională, cât şi pentru riscul de progresie spre cancer invaziv pe parcursul perioadei de follow-up este detectarea HPV de risc înalt(14); astfel, utilizarea cotestării va creşte siguranţa screeningului pentru recurenţa lezională la pacientele tratate conservator.
Ghidurile ASCCP din 2006 recomandă ca urmărirea pacientelor tratate conservator pentru AIS să fie făcută pe termen lung, cu ajutorul citologiei cervicale, testării HPV, colposcopiei cu curetaj endocervical; luând în calcul că riscul de cancer invaziv rămâne de cinci ori mai ridicat în cazul pacientelor care au beneficiat de terapie conservatoare faţă de populaţia generală(11,21) şi că 12% dintre paciente au risc de recurenţă lezională şi chiar de progresie spre boală invazivă la 36 de luni de la prima conizaţie(14), urmărirea pacientelor ar trebui să se facă pe o perioadă de minimum 10 ani. La obţinerea a patru rezultate complet negative (utilizând toate cele patru modalităţi de screening) efectuate la interval de 6 luni, spaţierea examinărilor se poate face la un an, similar recomandărilor pentru urmărirea leziunilor CIN 2,3(9). Nu există momentan recomandări cu privire la optarea pentru histerectomie totală la pacientele care nu îşi doresc menţinerea funcţiei fertile, care sunt compliante şi la care nu se poate demonstra persistenţa AIS.
Concluzie
Pacientele care beneficiază de terapie conservatoare pentru AIS trebuie consiliate asupra importanţei deosebite atât a complianţei, a potenţialelor riscuri de boală cervicală glandulară persistentă sau recurentă, în ciuda rezultatelor negative ale screeningului post-terapie, dar şi a prognosticului obstetrical după conizaţii repetate. Statusului marginilor post-rezecţie li se poate adăuga ca factor de predicţie pentru boala reziduală curetajul endocervical efectuat la momentul conizaţiei, în scopul de a stabili o conduită terapeutică ulterioară adecvată, care să minimizeze riscul de dezvoltare a cancerului invaziv. Dacă fie marginile post-rezecţie, fie ECC sunt pozitive, este recomandată repetarea conizaţiei pentru a determina extensia afectării, indiferent dacă pacienta doreşte sau nu păstrarea funcţiei fertile; dacă ambele variabile sunt negative, este recomandată histerectomia totală şi, respectiv, protocolul de follow-up la fiecare 6 luni pentru pacientele care optează pentru tratament conservator.
Bibliografie
Wright VC. Cervical squamous and glandular intraepithelial neoplasia: identification and current management approaches. Salud Publica Mex 2003;45(suppl 3):S417-29.
Chan PG, Sung HY, Sawaya GF. Changes in cervical cancer incidence after three decades of screening US women less than 30 years old. Obstet Gynecol 2003;102:765-73.
Colgan TJ, Lickrish GM. The topography and invasive potential of cervical adenocarcinoma in situ, with or without associated dysplasia. Gynecol Oncol 1990;36:246-9.
Solomon D, Davey D,Kurman R, et al. The 2001 Bethesda System:terminology for reporting results of cervical cytology.JAMA 2002;287:2114-9.
Ruba S, Schoolland M, Allpress S, Sterrett G. Adenocarcinoma in situ of the uterine cervix:screening and diagnostic errors in Papanicolau smears. Cancer 2004;102:280-7.
Schoolland M, Segal A, Allpress S, Miranda A, Frost FA, Sterrett GF. Adenocarcinoma in situ of the cervix. Sensitivity of detection by cervical smear. Cancer (Cancer Cytopathol) 2003;96:330-7.
Muntz HG, Bell DA, Lage JM, et al. Adenocarcinoma in situ of the uterine cervix. Obstet Gynecol 1992;80:935-9.
Wright TC, Massad LS, Dunton CJ, Spitzer M, Wilkinson EJ, Solomon D; For the American Society for Colposcopy and Cervical Pathology.2006 Consensus Guidelines for the mangement of women with cervical intraepithelial neoplasia or adenocarcinoma in situ. Am J Obstet Gynecol 2007;197(4):340-5.
Young JL, Jazaeri AA, Lachance JA, et al. Cervical adenocarcinoma in situ: the predictive value of conization margin status. Am J Obstet Gynecol 2007;197:195.e1-195.e8.
Soutter WP, Haidopoulos D, Gornall RJ, et al. Is conservative treatment for adenocarcinoma in situ of the cervix safe? BJOG 2001;108:1184-9.
Tierney KE, Lin PS, Amezcua C, et al. Cervical conization of adenocarcinoma in situ: a predicting model of residual disease. Am J Obstet Gynecol 2014;210:366.e1-5.
Wright VC, Dubue-Lissoir J, Ehlen T, et al. Guidelines on adenocarcinoma in situ of the cervix: clinical features and review of mangement. J Soc Obstet Gynaecol Can 1999;21:699-706.
Costa S, Venturoli S, Negri G, et al. Factors predicting the outcome of conservatively treated adenocarcinoma in situ of the uterine cervix: an analysis of 166 cases. Gynecol Oncol 2012;124:490-5.
American College of Obstetricians and Gynecologists. ACOG Practice Bulletin number 99. Management of abnormal cervical cytology and histology. Obstet Gynecol 2008;112:1419-44.
Wolf J, Levenback C, Malpica A, et al. Adenocarcinoma in situ of the cervix: significance of cone biopsy margins. Obstet Gynecol 1996;88:82-6.
Salani R, Puri I, Bristow RE. Adenocarcinoma in situ of the uterine cervix: a metaanalysis of 1278 patients evaluating the predictive value of conization margin status. Am J Obstet Gynecol 2009;200(2):182.e1-5.
Lea JS, Shin CH, Sheets EE,et al. Endocervical curettage at conization to predict residual cervical adenocarcinoma in situ. Gynecol Oncol 2002;87:129-32.
Cullimore JE, Luesley DM, Rollason TP, et al. A prospective study of conization of the cervix in the management of cervical intraepithelial glandular neoplasia (CIGN):a preliminary report. BJOG 1992;99:314-8.
Andersen ES, Nielsen K. Adenocarcinoma in situ of the cervix:a prospective study of conization as definitive treatment. Gynecol Oncol 2002;86:365-9.
Hwang DM, Lickrish GM, Chapman W, Colgan TJ. Long-term surveillance is required for all women treated for cervical adenocarcinoma in situ. J Low Genit Tract Dis 2004;8(2):125-31.
Articole din ediţiile anterioare
Corelaţia dintre factorii demografici şi rata de persistenţă/recurenţă a leziunilor CIN după conizaţie
Cu toate că înţelegerea epidemiologiei leziunilor cervicale intraepiteliale de grad înalt (CIN 2/3) s-a îmbunătăţit semnificativ, cofactorii...