Cervical cancer is the third most common cancer worldwide, with more than 500.000 new cases diagnosed every year. The determined factor of this disease is the infection of the cervical cells by the oncogenic types of HPV. Although all the physiopathologic stages of the disease - starting with the first cervical cell infected by HPV and all the modifications induced by it until de invasive stadium, in Romania, the mortality caused by cervical cancer has still a high rate. The most common screening test for cervical cancer is cervico-vaginal smears - either conventional Papanicolau test (Pap smear) or liquid based Pap test; this method has a sensibility of 53%. Another screening test is detecting the high risk types of HPV; this method has a sensibility of 83-90%. The ideal method of primary screening for cervical cancer is co-testing both liquid based Pap test and detecting the high risk types of HPV. Even though, at present in Romania the most common primary screening test for cervical cancer is cervico-vaginal smears, given the fact that an increasing number of European countries is assessing the detection of high risk types of HPV as a primary screening test for cervical cancer, probably Romania will follow the same direction.
Screeningul primar în cancerul de col uterin - citologia cervico-vaginală vs detecţia tulpinilor HPV-HR
Primary screening of cervical cancer - cervicovaginal cytology vs. detection of HPV-HR strains
First published: 15 aprilie 2014
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Gine.3.2.2014.4881
Abstract
Rezumat
Cancerul cervical ocupă al treilea loc din totalul cancerelor la femei în întreaga lume, cu peste 500.000 de cazuri noi diagnosticate pe an, factorul determinant al acestei boli fiind infecţia cu tulpinile oncogenice de HPV. Cu toate că au fost descrise toate etapele fiziopatologice - începând cu prima celulă infectată de HPV şi modificările suferite de aceasta, până la stadiul invaziv, în România, mortalitatea prin cancer de col a rămas ridicată. Cea mai larg utilizată metodă de screening pentru cancerul colului uterin este citologia cervico-vaginală - fie testele convenţionale Papanicolau, fie citologia în mediu lichid, aceasta având o sensibilitate de 53%. O altă metodă de screening este detectarea tulpinilor cu risc oncogen înalt ale HPV, aceasta având o sensibilitate de 83-90%. Metoda ideală de screening primar în cancerul de col uterin este reprezentată de efectuarea în paralel atât a citologiei cervicovaginale în mediu lichid, precum şi detectarea tulpinilor HR ale HPV. Chiar dacă actualmente, în România, metoda de screening primar în cancerul de col uterin este citologia cervico-vaginală, având în vedere că din ce în ce mai multe ţări din Europa încearcă să impună detectarea tulpinilor HR ale HPV ca metodă de screening primar în cancerul de col uterin, probabil că şi în România se va merge în aceeaşi direcţie.
Introducere
Cancerul cervical ocupă al treilea loc din totalul cancerelor la femei în întreaga lume, cu peste 500.000 de cazuri noi diagnosticate pe an(1), factorul determinant al acestei boli fiind infecţia cu tulpinile oncogenice de HPV(2,3). În funcţie de relaţia cu cancerul cervical, aceste tulpini se împart în următoarele categorii(3):
-
tulpini HPV cu risc oncogen scăzut (HPV-LR) - 6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81;
-
tulpini cu risc oncogen probabil înalt - 26, 53;
-
tulpini cu risc oncogen înalt (HPV-HR) - 16, 18, 31, 33, 35, 39, 45,51, 52, 56, 58, 59, 66, 68, 73, 82;
-
tulpini HPV cu risc oncogen necunoscut (HPV-X) - 34, 57, 83.
ADN-HPV a fost identificat în 99,7% din totalul cazurilor de cancer cervical - infecţia persistentă cu HPV-HR(4,5).
Deşi infecţiile HPV sunt de obicei asimptomatice şi autolimitate (70-75% se vindecă în decurs de un an şi 85-90% în decurs de 2 ani(6,7,8)), infecţia cervicală poate cauza modificări histologice clasificate ca neoplazii intraepiteliale cervicale (CIN) de grad 1, 2 sau 3 (în ordinea gradului de modificări la nivelul epiteliului cervical) sau adenocarcinom in situ (AIS). Vindecarea spontană sau progresia în lipsa tratamentului variază pentru CIN 1, 2 şi 3. CIN 1, de obicei, se vindecă spontan (în 60% din cazuri) şi foarte rar progresează spre cancer cervical (1%); în schimb, doar 30-40% din CIN 2 şi CIN 3 se vindecă spontan şi un procent mult mai mare (>12%) evoluează spre cancer în lipsa tratamentului(9,10).
Cu toate că au fost descrise toate etapele fiziopatologice - începând cu prima celulă infectată de HPV şi modificările suferite de aceasta, până la stadiul invaziv(11), în România, mortalitatea prin cancer de col a rămas ridicată(2,12). Peste 80% din decesele prin cancer de col uterin apar în ţările în curs de dezvoltare, parţial din cauza lipsei programelor eficiente de screening care pot depista anomaliile incipiente ale celulelor cervicale, permiţând instituirea rapidă a tratamentului(1,11).
Metodele de screening în cancerul de col uterin
Cea mai larg utilizată metodă de screening pentru cancerul colului uterin este citologia cervico-vaginală - fie testele convenţionale Papanicolau (PAP), fie citologia în mediu lichid CML)(13). Rezultatele posibile ale acestei metode sunt: negativ pentru o leziune malignă intraepitelială (NILM), celule anormale cu semnificaţie necunoscută (ASC-US), leziune intraepitelială cu grad redus (LSIL) sau leziune intraepitelială cu grad înalt (HSIL). Sensibilitatea examenului PAP clasic variază între 30% şi 85%, iar specificitatea, între 85% şi 100%(13,14). În cazul CML, sensibilitatea este mai mare, variind între 60% şi 90%, în schimb, specificitatea variază între 75% şi 85%(13,14). Astfel s-a demonstrat că screeningul, folosind doar citologia cervico-vaginală, are o sensibilitate de 53%, adică detectează doar una din două paciente cu leziuni cervicale clasificate CIN 2 sau CIN 3(15).
O altă metodă de screening, considerată până de curând adjuvantă a citologiei cervicovaginale, este detectarea ADN-HR-HPV(16,17,18). Deoarece aproximativ 70% din cazurile de cancer de col sunt determinate de tulpinile 16 şi 18, sunt preferate testele care detectează individual prezenţa acestor tulpini, dar şi concomitent a celorlalte tulpini HPV-HR(18,19,20,21). Sensibilitatea acestei metode variază între 83 şi 90%(20,22,23).
Strategia de screening în cancerul
de col uterin
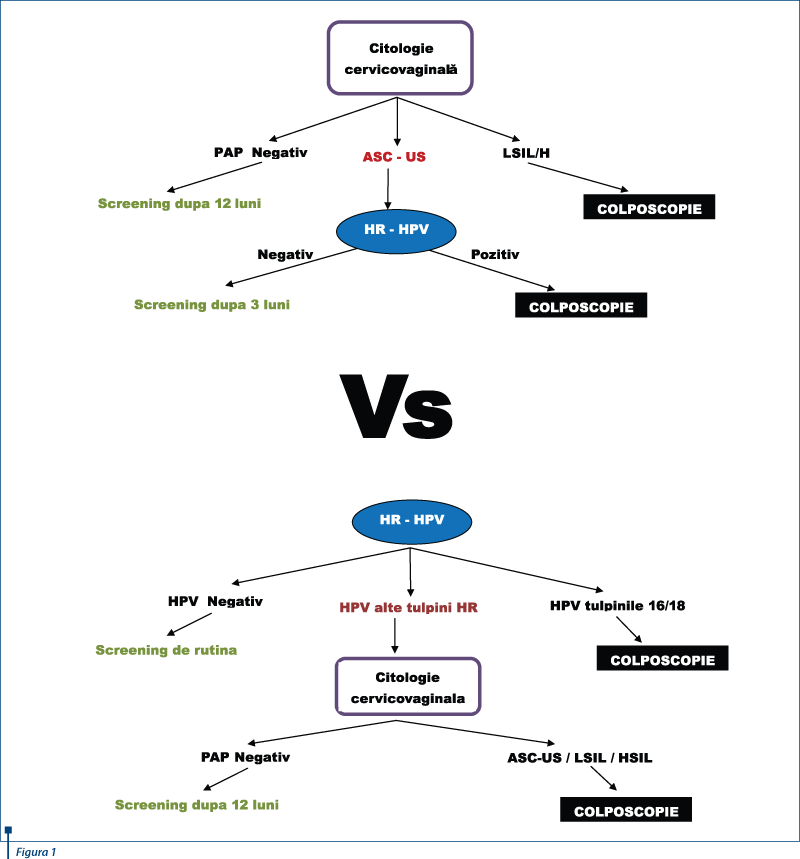
Actualmente, în România, metoda de screening primar în cancerul de col uterin este citologia cervico-vaginală (PAP). Dacă rezultatul la PAP este LSIL/HSIL, se indică examen colposcopic. Dacă însă rezultatul este ASC-US, se indică genotiparea HPV-HR şi dacă acesta este pozitiv, se indică examen colposcopic.
Totuşi foarte multe ţări din Europa încep să opteze pentru detectarea tulpinilor HR ale HPV ca metodă de screening primar în cancerul de col. Dacă se detectează tulpinile HR 16 sau 18, se indică examen colposcopic. Dacă însă testul este pozitiv pentru celelalte tulpini HR ale HPV, se prelevează şi citologie cervico-vaginală (de cele mai multe ori în mediu lichid) şi dacă rezultatul este ASC–US/LSIL/HSIL, se indică examen colposcopic(19,20,21,22).
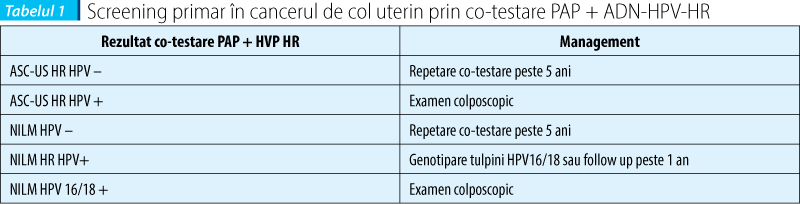
O altă strategie de screening primar în cancerul de col uterin recomandată de majoritatea ghidurilor de profil din America de Nord (American Society for Clinical Pathology - ASCP, American Society for Colposcopy and Cervical Pathology - ASCCP, American Cancer Society ACS) este efectuarea atât a citologiei cervicovaginale în mediu lichid, precum şi detectarea tulpinilor HR ale HPV la toate femeile de peste 30 de ani, o dată la 5 ani. Astfel, atât sensibilitatea, cât şi specificitatea sunt augmentate, însă apare dezavantajul creşterii costurilor (tabelul 1)(19,20,21,22).
Concluzii
Cancerul de col uterin reprezintă în continuare o problemă majoră de sănătate publică în România, astfel strategia de screening a acestei patologii, care este stadială şi astfel poate fi prevenită, trebuie reevaluată.
Metoda ideală de screening primar în cancerul de col uterin este reprezentată de efectuarea în paralel atât a citologiei cervicovaginale în mediu lichid, precum şi detectarea tulpinilor HR ale HPV. Întrucât este mult mai costisitoare, această metodă se va impune greu în România, mai ales în sistemul de stat. Totuşi, având în vedere că din ce în ce mai multe ţări din Europa încearcă să impună detectarea tulpinilor HR ale HPV ca metodă de screening primar în cancerul de col uterin, probabil că şi în România se va merge în aceeaşi direcţie.
Bibliografie
Ferlay J., Bray F., Pisani P., Parkin D.M. Globocan 2002: - Cancer incidence, mortality and prevalence worldwide. IARC Cancerbase No. 5. Version 2.0, IARC Press, Lyon, 2004.
Munoz N., Bosch F.X., de Sanjose S., Herrero R., Castellsague X., Shah K.V., et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med 2003;348(6):518-27.
Peto J., Gilham C., Deacon J., et al. Cervical HPV infection and neoplasia in a large population-based prospective study: the Manchester cohort. Br J Cancer 2004;91:942–53.
Weinstock H., Berman S., Cates W. Jr - Sexually transmitted diseases among American youth: incidence and prevalence estimates, 2000. Perspect Sex Reprod Health 2004;36:6–10.
Ho G.Y., Bierman R., Beardsley L., Chang C.J., Burk R.D. Natural history of cervicovaginal papillomavirus infection in young women. N Engl J Med 1998;338:423–8.
Molano M., Van den B.A., Plummer M., et al. Determinants of clearance of human papillomavirus infections in Colombian women with normal cytology: a population-based, 5-year follow-up study. Am J Epidemiol 2003;158:486–94.
Moscicki A.B., Ellenberg J.H., Farhat S., Xu J. Persistence of human papillomavirus infection in HIV-infected and -uninfected adolescent girls: risk factors and differences, by phylogenetic type. J Infect Dis 2004;190:37– 45.
Yang B.H., Bray F.I., Parkin D.M. et al. Cervical cancer as a priority for prevention in different world regions: An evaluation using years of life lost. Int J Cancer 2004 109: 418–24.
Baseman J.G., Koutsky L.A. - The epidemiology of human papillomavirus infections. J Clin Virol. 2005;32(suppl 1):S16–S24.
Ostor A.G. Natural history of cervical intraepithelial neoplasia: a critical review. Int J Gynecol Pathol 1993;12:186–92.
A. Anttila, G. Ronco, G. Clifford, F. Bray, M. Hakama, M. Arbyn, E. Weiderpass Br J Cancer 2004; 91:935–941.
Belinson J., Qiao Y.L., Pretorius Rea, Shanxi province cervical cancer screening study: a cross-sectional comparative trial of multiple techniques to detect cervical neoplasia. Gynecol-Oncol 2001;83:439-444.
ACOG Practice Bulletin. Clinical management guidelines for obstetrician-gynecologists: cervical cytology screening. Obstet Gynecol 2003;102:417–27.
Cuzick, J., Clavel, C., Petry, K.-U., Meijer, C.J.L.M., Hoyer, H., Ratnam, S., Szarewski, A., Birembaut, P., Kulasingam, S., Sasieni, P. and Iftner, T. (2006), Overview of the European and North American studies on HPV testing in primary cervical cancer screening. Int. J. Cancer, 119: 1095–1101. doi: 10.1002/ijc.21955.
Kulasingam S.L., Hughes J.P., Kiviat K.B. et al- Evaluation of HPV testing in primary screening for cervical abnormalities :comparison of sensitivity, specificity and frequency of referral. JAMA. 2002;288(14)1749-1757.
Wright T.C., Schiffman M., Solomon D. et al – Interim guidance for the use of HPV-DNA testing as an adjunct to cervical cytology for screening. Obstetr-Gynecol. 2004;103:304-309.
Saslow D., Runowicz C.D., Solomon D., et al. American Cancer Society guideline for the early detection of cervical neoplasia and cancer. CA Cancer J Clin 2002;52:342–62.
Munoz, N., et al. 2004. Against which human papillomavirus types shall we vaccinate and screen? The international perspective. Int. J. Cancer. 111:278-285.
Heideman D.A., Hesselink A.T., Berkhof J., van Kemenade F., Melchers W.J., Daalmeijer N.F., Verkuijten M., Meijer C.J., Snijders P.J. 2011. Clinical validation of the Cobas 4800 HPV test for cervical screening purposes. J. Clin. Microbiol. 49:3983–3985.
ACOG Practice Bulletin. Clinical management guidelines for obstetrician-gynecologists: human papillomavirus. Obstet Gynecol 2005;105:905–18.
Kotaniemi-Talonen I., Nieminen P., Anttila A., Hakama M. Routine cervical with primary HPV testing and cytology triage protocol in a randomised setting. Brit J Cancer 2005; 93: 862–7.
Arbyn, M., Ronco, G., Anttila, A., Meijer, C.J., Poljak, M., Ogilvie, G., ... & Peto, J. (2012). Evidence regarding human papillomavirus testing in secondary prevention of cervical cancer. Vaccine, 30, F88-F99.
Articole din ediţiile anterioare
Pulsoximetria pentru screeningul nou-născuţilor cu boli congenitale cardiace
Bolile congenitale cardiace sunt cele mai frecvente malformaţii neonatale, iar cele critice, care necesită intervenţie chirurgicală sau cateter...
HTLV: a new issue in prenatal screening?
Human T-cell leukemia virus-1 (HTLV-1) is the first infectious agent proven to cause cancer, and research suggests that HTLV-1 may be considered am...
Testarea prenatală – studiu despre cunoaşterea şi atitudinea pacientelor
Într-o eră a tehnologiei în plină dezvoltare, informarea a devenit foarte uşor accesibilă. Totuşi, pacientele gravide prezintă lacune important...
Analiza rezultatelor programelor naţionale de screening pentru depistarea activă precoce a cancerului de col uterin şi propunere de strategie
În cazul tuturor tipurilor de cancer, este universal valabil faptul că detectarea precoce îmbunătăţeşte semnificativ rata de supravieţuire.