Cervical cancer is one of the most common causes of cancer-associated mortality in women worldwide. Although neoplastic epithelial transformation and the association with HPV infection have been widely studied, there is less research on the effect of other factors, such as oxidative stress (ROS). To study the antioxidant status of the different steps in cervical cancer development, we analyzed 32 cervical samples. The histological spectrum of alterations varied from low grade intraepithelial lesions to invasive carcinoma. Formalin-fixed, paraffin-embedded 4-cm tissue sections were stained with various immunohistochemical antigens targeting both neoplastic epithelial cells and stromal component. The stromal response was heterogeneous and showed different patterns which were correlated with the epithelial alterations. Carcinogenesis integrates various landmarks into a pathological network of events and cellular responses under the influence of many types of stress – oxidative and inflammatory, which support tumorigenesis and tumor progression, but are also effective antitumoral therapeutic tools. Recent data showed that the chemo- and radiotherapy efficacy requires a tumor-activated oxidative status, suggesting that the pharmacological inhibition of the endogenous antioxidant system may represent an adjunctive therapeutic approach in solid tumors to control resistance to conventional anti-tumoral therapy.
Implicaţiile terapeutice ale stresului oxidativ în leziunile scuamoase neoplazice cervicale
Therapeutic implications of oxidative stress in squamous cervical neoplasia
First published: 20 mai 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Gine.20.2.2018.1716
Abstract
Rezumat
Cancerul de col uterin este una dintre cele mai frecvente cauze ale mortalităţii asociate cancerului la femei din întreaga lume. Deşi transformarea epiteliilor neoplazice şi asocierea cu infecţia cu HPV au fost studiate pe scară largă, există mai puţine cercetări privind efectul altor factori, cum ar fi stresul oxidativ (ROS). Pentru a studia statutul antioxidant al diferitelor etape de dezvoltare a cancerului de col uterin, am analizat 32 de cazuri de neoplazii intraepiteliale cervicale. Spectrul histologic al modificărilor a variat de la leziuni intraepiteliale de grad scăzut până la carcinom invaziv. Fragmentele tisulare au fost fixate în formol şi incluse în parafină, realizându-se ulterior secţiuni histologice marcate cu diferiţi markeri imunohistochimici ce vizează atât celule epiteliale neoplazice, cât şi componenta stromală. Răspunsul stromal a fost heterogen şi a arătat diferite modele, care au fost corelate cu modificările epiteliale. Carcinogeneza integrează diferite etape într-o reţea patologică de evenimente şi răspunsuri celulare, sub influenţa multor tipuri de stres – oxidativ şi inflamator, care susţin tumorigeneza şi progresia tumorii, dar sunt, de asemenea, instrumente terapeutice antitumorale eficiente. Datele recente au arătat că eficacitatea chimio- şi radioterapiei necesită un statut oxidativ activat de tumori, sugerând că inhibarea farmacologică a sistemului endogen antioxidant poate reprezenta o abordare terapeutică adjuvantă în tumorile solide pentru a controla rezistenţa la terapia convenţională antitumorală.
Cancerul reprezintă una dintre principalele cauze de deces la nivel mondial(1), cu impact economic şi social considerabil, în ciuda cercetării extensive pentru descifrarea mecanismelor sale moleculare, precum şi pentru dezvoltarea de strategii terapeutice orientate – conceptul de medicină personalizată. Cancerul de col uterin este o afecţiune ce se dezvoltă progresiv, cu diferite stagii de modificări celulare, de la epiteliu normal la carcinom invaziv. Stresul oxidativ poate activa o serie de factori de transcripţie, cum ar fi NF-kB, AP-1, p53, HIF-1a, PPAR-g, b-catenina/Wnt şi Nrf2, ce poate duce la activarea a peste 500 de gene diferite, inclusiv cele pentru factori de creştere, citokine inflamatorii, chemokine, molecule reglatoare ale ciclului celular şi antiinflamatorii(2).
Stresul oxidativ intrinsec şi de la nivelul micromediului are un rol critic în dezvoltarea şi răspândirea cancerului. Speciile reactive de oxigen (ROS) pot acţiona nu doar ca susţinători ai celulelor tumorale, ci pot căpăta comportament antitumoral, care ar putea fi extrem de eficace în tratamentul cancerului. Celulele canceroase prezintă modificări prooxidative(3) generate de: 1) activarea cronică a diferitelor surse metabolice ale ROS, legate de oxidazele NADPH (NOXs 1-5 şi DUOX1/2)(4), modificări ale ADN-ului mitocondrial, ale fosforilării oxidative şi ale metabolismului energetic, însoţite de creşterea glicolizei aerobe(5); 2) un răspuns antioxidant disfuncţional care nu este în măsură să contracareze producţia susţinută de ROS în timpul genezei tumorale(6). Aceste modificări oxidative intracelulare sunt completate de expunerea constantă a celulelor canceroase la ROS exogene derivate din ciclurile anoxie-reoxigenare(7) şi din activitatea oxidativă a monocitelor şi neutrofilelor ce infiltrează tumorile(8).
Cancerul nu reprezintă un proces de „totul sau nimic”, ci integrează diverse repere într-o reţea patologică de evenimente şi răspunsuri celulare sub influenţa mai multor tipuri de stres – oxidativ şi inflamator. ROS susţin tumorigeneza şi progresia tumorală, dar sunt, de asemenea, instrumente terapeutice eficiente antitumorale.
Prin creşterea ROS la nivel tumoral se poate contracara acţiunea ROS metabolice de promovare a creşterii celulelor canceroase.
Literatura de specialitate descrie influenţa stresului oxidativ în procesele fiziologice de la nivelul sistemului reproductiv feminin, inclusiv menopauza(9), dar în prezent datele din literatură sunt limitate în ceea priveşte statusul redox al tumorilor genitale feminine, de aceea considerăm că o mai bună înţelegere a acestui fenomen poate duce la îmbunătăţirea protocoalelor clinice curente, atât în screening, cât şi în terapie.
Heterogenitatea tumorală derivă, de asemenea, din distribuţia spaţială neuniformă a stresului la nivelul micromediului, cum ar fi hipoxia, acidoza, stresul oxidativ şi pierderea nutrienţilor(10). Deoarece terapiile pe bază de stres oxidativ sunt dependente în special de furnizarea locală de oxigen molecular, celulele canceroase localizate în regiuni hipoxice ar putea să nu răspundă la astfel de terapii.
Studiul de faţă a vizat identificarea markerilor moleculari ce caracterizează stresul oxidativ, dar şi statusul antioxidant al tumorilor genitale. Prin termenul marker am înţeles orice entitate biologică sau fiziologică utilizată pentru identificarea unui subtip de neoplazie, ghidarea terapiei sau monitorizarea pentru a evita recidiva.
Lotul de studiu a fost caracterizat iniţial histologic, utilizând sistemele de clasificare internaţionale şi, ulterior, s-a efectuat profilul fenotipic prin utilizarea următorilor markeri de stres oxidativ exprimaţi la nivelul ţesutului tumoral sau peritumoral, relativ la peroxidarea lipidică (malon dialdehida; MDA), oxidarea ADN (8-oxoguanine; 8-OHdG) şi nitrozilarea proteinelor (nitrotirozina; 3-NT).
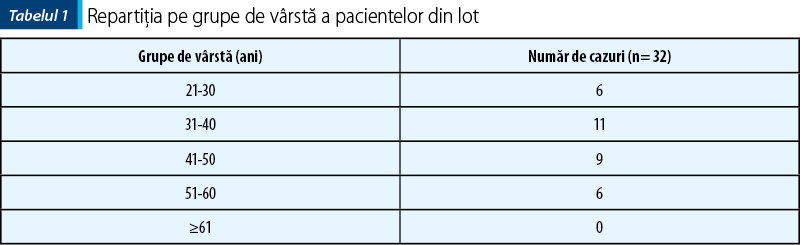
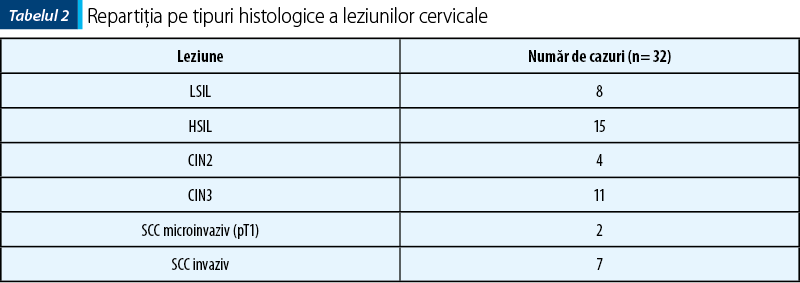
Lotul studiat a inclus 32 de cazuri pozitive pentru leziuni epiteliale cervicale, cu variaţii ale vârstei de prezentare, iar spectrul leziunilor a variat de la leziuni intraepiteliale de grad scăzut până la carcinom scuamos cervical invaziv.
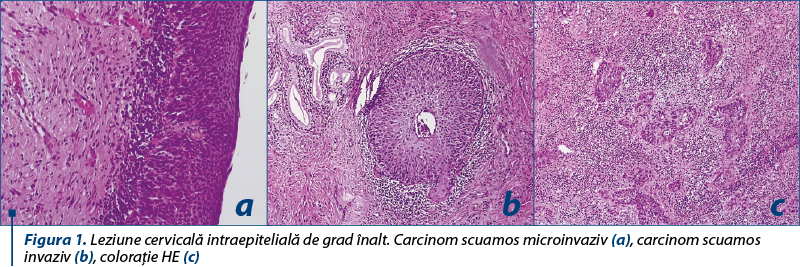
Examinarea histopatologică a secţiunilor tisulare rămâne metoda cea mai utilizată în diagnosticul leziunilor preneoplazice şi neoplazice ale colului uterin. Confirmarea histopatologică a diagnosticului de invazie este necesară pentru instituirea unor metode terapeutice adecvate. Pe lângă descrierea morfologică şi încadrarea într-o clasă de leziuni, examinarea microscopică poate oferi şi în leziunile de col uterin, cum deja este cazul în alte leziuni, informaţii valoroase, având încă un potenţial incomplet exploatat.
În cursul metabolismului celular normal se consumă oxigen şi se produc specii reactive de oxigen (ROS). Dacă nu sunt disipate în mod eficient, ROS se pot acumula şi distrug proteinele reziduale, lipidele şi ADN-ul. Enzimele implicate în reglarea redoxului şi reparaţia ADN-ului disipă ROS şi repară daunele rezultate pentru a păstra un mediu celular funcţional(11), deoarece acumularea de ROS crescute şi/sau deteriorarea necorespunzătoare a ADN-ului pot duce la iniţierea şi progresia cancerului. Am încercat identificarea unui număr de proteine de stres oxidativ şi reparare ADN-ului care influenţează capacitatea de reacţie estrogenică a celulelor neoplazice scuamoase şi expresia lor diferită în ţesutul normal, leziunile displazice de diferite grade (CIN) şi carcinomul invaziv. Cancerul prezintă o modificare prooxidativă în starea de reducţie oxidativă. Nicotinamida-adenin-dinucleotid-fosfat-oxidaza (NADPH oxidaza) este una dintre cele mai importante surse endogene de ROS din organism. Acest sistem enzimatic se integrează cu diferite proteine distribuite între citoplasmă şi membrană. Stresul oxidativ şi nitrozativ perpetuează procesul inflamator prin diferite mecanisme. ROS şi NRS au efecte chemotactice care favorizează recrutarea neutrofilelor(12).
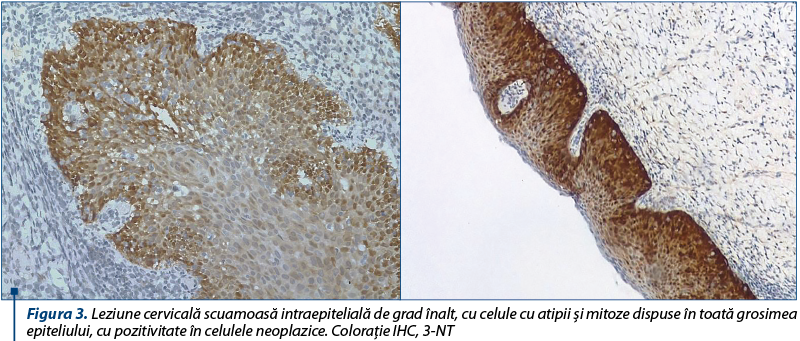
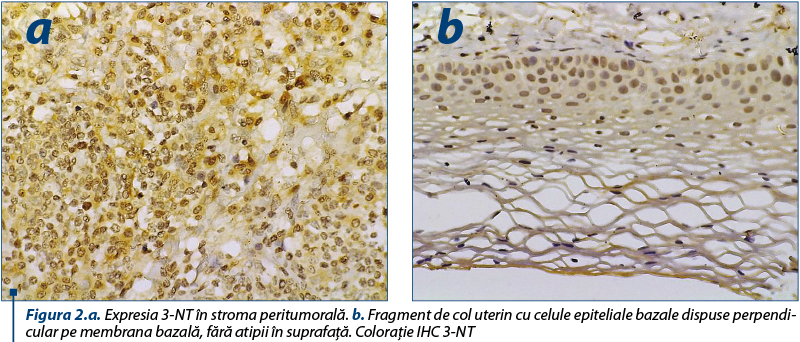
NO este un gaz uşor solubil şi se poate răspândi destul de uşor în mediul biologic. El poate, de asemenea, să reacţioneze cu superoxidul radical pentru a produce ONOO-, care, la rândul său, poate nitra tirozina, formând 3-nitrotirozina (3NT). ONOO‒ determină oxidarea lipoproteinelor şi nitrarea reziduurilor proteice de tirozină. Peroxinitritul este dificil de investigat şi indirect evidenţiat prin proteinele nitrate(13).
Rezultatele obţinute indică o relaţie semnificativă între stresul oxidativ şi leziunea neoplazică. Creşterea procentuală a expresiei markerilor a fost direct proporţională cu gradul leziunii epiteliale. Expresia markerilor IHC este mai intensă în celulele epiteliale versus stromale. Existenţa unui gradient de expresie stromală este importantă.
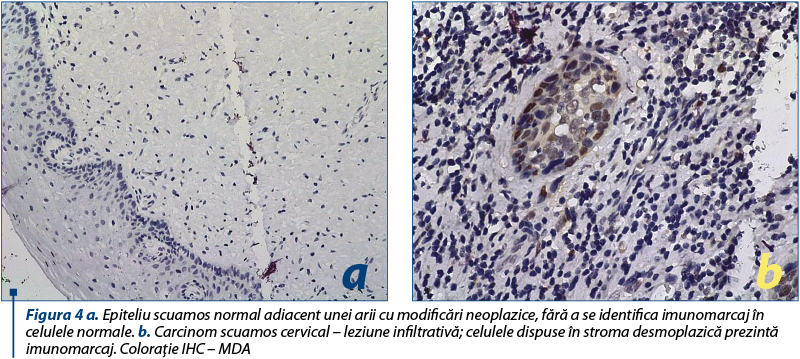
Deteriorarea proteinelor (nitratarea proteinelor) a fost determinată şi analizată în secţiunile histologice cu leziuni neoplazice ale colului uterin, utilizând un anticorp monoclonal împotriva 3-NT pentru a cuantifica 3-NT (imunohistochimie).
MDA (malondialdehida) este o aldehidă cu greutate moleculară joasă, apărută ca urmare a combinaţiei dintre radicali liberi şi acizi graşi polinesaturaţi (PUFA) din procesul de degradare al fosfolipidelor membranare. Alterarea structurii şi funcţiei membranare ar putea induce progresia leziunilor neoplazice. MDA este utilizat în evaluarea procesului de peroxidare lipidică.
Malondialdehida (MDA) este un produs endogen, rezultat ca urmare a peroxidării lipidelor şi a biosintezei prostaglandinelor şi participă la o varietate de reacţii chimice şi biologice, inclusiv legarea covalentă la proteine, ARN şi AND. MDA este utilizat pe scară largă pentru evaluarea procesului de peroxidare a lipidelor. ROS generate cauzează peroxidarea acizilor graşi polinesaturaţi (PUFA) ai membranei, fenomenul purtând denumirea de peroxidare lipidică(15). Acest lucru întrerupe integritatea membranei, care poate fi unul dintre motivele posibile ale progresiei leziunilor neoplazice maligne. Nivelurile crescute ale MDA indică peroxidarea lipidică crescută, care este o consecinţă a generării de radicali liberi crescuţi. Aceasta provoacă alterarea profundă a funcţiei membranei celulare şi, de asemenea, organizarea structurală a ADN-ului, care conduce la mutaţii(15). Pentru măsurarea deteriorării ADN-ului oxidant la secţiunile histologice, am folosit anticorpul monoclonal împotriva MDA-ADN. Această metodă ar trebui să fie utilă pentru detectarea sensibilă a deteriorării ADN-ului într-un număr mic de celule şi secţiuni de ţesuturi.
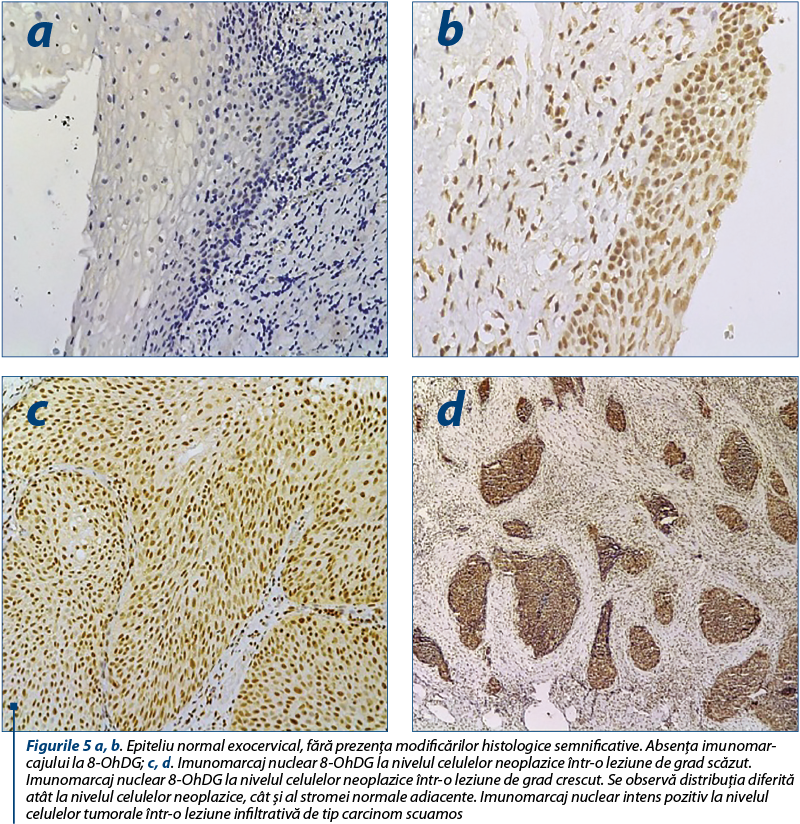
MDA este cea mai abundentă aldehidă individuală ce rezultă din peroxidarea lipidelor. Deteriorarea oxidantă, aşa cum este demonstrată de nivelul MDA, este semnificativ crescută la pacientele cu leziuni neoplazice cervicale, atât intraepiteliale, cât şi infiltrative. O corelaţie de interes este legătura între infecţia cu papilomavirusul uman (HPV) şi modificările de stres oxidativ. Infecţia genitală cu risc crescut de HPV (HR-HPV), deşi este recunoscută ca principalul factor etiopatogenetic al cancerului de col uterin, nu este în sine suficientă pentru a induce dezvoltarea tumorii. ADN-ul viral integrat poate genera o stare de infecţie latentă în care nu apare nici replicare virală şi nici transformarea celulară. Stresul oxidativ în timpul infecţiei virale poate fi un rezultat al răspunsului imun la proteinele virale sau o consecinţă a expresiei genei virale. Stresul oxidativ provoacă leziuni ADN oxidative, care pot facilita integrarea ADN-ului HPV(16).
Pe lângă radicalii liberi care au indus peroxidarea lipidelor şi denaturarea proteică, şi lezarea ADN-ului a fost implicată în multe boli, incluzând cancerul. Apărarea antioxidantă celulară joacă un rol important în boala neoplazică pentru a contracara daunele oxidative. Un dezechilibru între sistemele pro- şi antioxidante generează stresul oxidativ, iar cea mai reactivă specie de oxigen este radicalul hidroxil OH-, care atacă bazele nucleice ale catenelor ADN, cum ar fi guanina, ducând la 8-hidroxi-2-deoxiguanozină (8-OhDG)(17). Producţia de markeri de stres oxidativ şi radicali liberi poate fi corelată cu existenţa unei cantităţi mari de fier. În patologia ginecologică putem întâlni aceaste modificări în cazul existenţei unei hemoragii, cum ar fi menstruaţia retrogradă sau leziunile de tip endometrioid(18). Am constatat faptul că leziunea ADN-ului este mai mare la nivelul celulelor tumorale comparativ cu cele neoplazice. De asemenea, cu cât gradul leziunii este mai mare, cu atât se identifică un procent mai mare de celule pozitive. Am observat o creştere semnificativă progresivă a nivelurilor de 8-OHdG şi a procentului celulelor pozitive medii de la leziunile cervicale intraepiteliale de grad scăzut şi până la cele de grad înalt. Valoarea cea mai mare de pozitivitate celulară a fost identificată la nivelul secţiunilor cu carcinom scuamos invaziv.
Mai multe strategii terapeutice, cum ar fi radioterapia şi terapia fotodinamică, au fost proiectate special pentru a creşte nivelul de ROS în celulele tumorale şi a determina moartea lor prin stres oxidativ brusc şi intens. Prin generarea unei supraîncărcari ROS induse terapeutic, în celulele canceroase, pragul oxidativ ce separă supravieţuirea de moarte ar putea fi depăşit. Din cauza activităţii oxidative intrinseci crescute a celulelor canceroase şi a programării lor defectuoase, sunt necesare mai puţine ROS suplimentare, comparativ cu celulele normale, pentru declanşarea morţii celulare. Nivelurile de ROS care sunt citotoxice pentru celulele canceroase induc efecte mai puţin drastice în celulele normale, care au un status oxidativ inferior şi sunt mai eficiente în repararea leziunilor ROS induse în anumite limite. Cu toate acestea, direcţionarea ţintită a terapiei pe bază de stres oxidativ către ţesutul bolnav reprezintă o prioritate, cu scopul de a proteja ţesuturile normale împotriva acţiunii nocive a ROS „terapeutice”. Celulele tumorale prezintă diferite susceptibilităţi intrinseci la stresul oxidativ. Un dezavantaj major al terapiilor bazate pe stres oxidativ îl reprezintă rezistenţa remarcabilă a celulelor stem tumorale (CSCS). Aceste celule au capacitatea de a se autoreînnoi, de a se diferenţia în mai multe linii şi să iniţieze tumori, fiind astfel responsabile de creşterea necontrolată a tumorilor, întreţinerea bolii reziduale minime şi de reapariţia tumorii după tratament(19). Rezistenţa CSCS se bazează pe mecanismele de reparare, controlul ciclului celular, supraexpresia enzimelor antioxidante şi eliminarea eficientă a radicalilor liberi(20).
Diferite reţele moleculare reglementează CSCS şi răspunsurile lor adaptative la hipoxie şi stres oxidativ în tumoră. De exemplu, PI3K/PTEN/AKT/mTOR controlează nivelul ROS în CSCS prin reglarea localizării nucleare a FOXO şi astfel a supraexpresiei enzimelor antioxidante(21). Dereglarea căilor de semnalizare redox conferă celulelor tumorale un avantaj de supravieţuire(22). Activarea activităţii factorului de transcripţie Nrf2, care controlează sistemul antioxidant endogen, şi scăderea subsecventă a stresului oxidativ în tumorile incipiente ar putea încetini evoluţia procesului tumoral. În acelaşi timp, date recente arată că eficacitatea chimio- şi radioterapiei necesită un status oxidativ activat la nivel tumoral, ceea ce sugerează că inhibarea farmacologică a sistemului antioxidant endogen prin inhibarea activităţii Nrf2 poate reprezenta o abordare terapeutică adjuvantă în tumorile solide pentru a controla rezistenţa la terapia antitumorală convenţională(23).
În concluzie, caracterizarea moleculară a statusului redox în tumorile genitale poate aduce noi informaţii privind identificarea de noi ţinte terapeutice şi pentru estimarea răspunsului la terapiile antitumorale convenţionale (chimio- şi radioterapie).
Acknowledgment: Această lucrare a fost realizată prin programul-nucleu derulat cu sprijinul ANCSI, proiect nr. 16.22.04.04.
Conflict of interests: The authors declare no conflict of interests.
Bibliografie
- http://www-dep.iarc.fr/WHOdb/WHOdb.htm
- Reuter S, Gupta SC, Chaturvedi MM, Aggarwal BB. Oxidative stress, inflammation, and cancer: How are they linked? Free Radic Biol Med. 2010;49(11):1603-16.
- Manda G, Nechifor MT, Neagu TM. Reactive oxygen species, cancer and anti-cancer therapies. Currt Chem Biol. 2009;3:342-66.
- Roy K, Wu Y, Meitzler JL, Juhasz A, Liu H, Jiang H, Lu J, Antony S, Doroshow JH. NADPH oxidases and cancer. Clin Sci. 2015;128:863-75.
- Zheng J. Energy metabolism of cancer: glycolysis versus oxidative phosphorylation (Review). Oncol Lett. 2012;4:1151-7.
- Frohlich DA, McCabe MT, Arnold RS, Day ML. The role of Nrf2 in increased reactive oxygen species and DNA damage in prostate tumorigenesis. Oncogene. 2008;27:4335-62.
- Du H, Yang W, Chen L, Shen B, Peng C, Li H, Ann DK, Yen Y, Qiu W. Emerging role of autophagy during ischemia-hypoxia and reperfusion in hepatocellular carcinoma. Int J Oncol. 2012;40:2049-57.
- Lu T, Gabrilovich DI. Molecular pathways: tumor-infiltrating myeloid cells and reactive oxygen species in regulation of tumor microenvironment. Clin Cancer Res. 2012;15:4877-82.
- Agarwal A, Gupta S, Sharma RK. Role of oxidative stress in female reproduction. Reprod Biol Endocrin. 2005;3:28.
- Mitsuishi Y, Motohashi H, Yamamoto M. The Keap1-Nrf2 system in cancers: stress response and anabolic metabolism. Front Oncol. 2012;2:200.
- Nita M, Grzybowski A. The role of the reactive oxygen species and oxidative stress in the pathomechanism of the age-related ocular diseases and other pathologies of the anterior and posterior eye segments in adults. Oxid Med Cell Longev. 2016;3164734.
- Liou GY, Storz P. Reactive oxygen species in cancer. Free Radic Res. 2010;44(5):479-96.
- Storz P. Reactive oxygen species in tumor progression. Front Biosci. 2005;10:1881-96.
- Ayala A, Muñoz MF, Argüelles S. Lipid peroxidation: production, metabolism, and signaling mechanisms of malondialdehyde and 4-hydroxy-2-nonenal. Oxid Med Cell Longev. 2014;360438.
- Wagner G, Lubin, Ye Chin. Oxidative damage to red cells in cellular antioxidant defence mechanism. CRC Press. Bacon Raton. 1998; 333-5.
- De Marco F. Oxidative Stress and HPV Carcinogenesis. Viruses. 2013;5(2):708-31.
- Valavanidis A, Vlachogianni T, Fiotakis C. 8-hydroxy-2’-deoxyguanosine (8-OHdG): A critical biomarker of oxidative stress and carcinogenesis. J Environ Sci Health C Environ Carcinog Ecotoxicol Rev. 2009;27(2):120-39.
- Yamaguchi K, Mandai M, Toyokuni S, Hamanishi J, Higuchi T, Takakura K, Fujii S. Contents of endometriotic cysts, especially the high concentration of free iron, are a possible cause of carcinogenesis in the cysts through the iron-induced persistent oxidative stress. Clin Cancer Res. 2008;14(1):32-40.
- Stoyanova R, Huang K, Sandler K, Cho H, Carlin S, Zanzonico PB, Koutcher JA, Ackerstaff E. Mapping tumor hypoxia in vivo using pattern recognition of dynamic contrast-enhanced MRI data. Transl Oncol. 2012;5(6):437-47.
- Sahlberg SH, Spiegelberg D, Glimelius B, Stenerlöw B, Nestor M. Evaluation of cancer stem cell markers CD133, CD44, CD24: association with AKT isoforms and radiation resistance in colon cancer cells. PloS ONE. 2014;9(4):e94621.
- Ding S, Li C, Cheng N, Cui X, Xu X, Zhou G. Redox regulation in cancer stem cells. Oxidative Medicine and Cellular Longevity. 2015;(3):750-98.
- Manda G, Isvoranu G, Comănescu MV, Manea A, Debelec Butuner B, Korkmaz KK. The redox biology network in cancer pathophysiology and therapeutics. Redox Biol. 2015;5:347-57.
- Zhou S, Ye W, Shao Q, Zhang M, Liang J. Nrf2 is a potential therapeutic target in radioresistance in human cancer. Crit Rev Oncol Hematol. 2013;88(3):706-15.
Articole din ediţiile anterioare
Lobar holoprosencephaly associated with maternal diabetes mellitus – case report
The term holoprosencephaly (HPE) describes a spectrum of cerebral and facial malformations that result from an absent or incomplete division of emb...
Recurenţa polipilor endometriali – factori de risc şi tratament
Polipii endometriali (PE) sunt frecvent întâlniţi în practica ginecologică, motivele prezentării la medic fiind cel mai adesea infertilitat...
Calitatea vieţii la pacientele cu endometrioză şi rezecţie colorectală laparoscopică
Obiectiv. Scopul acestei lucrări este de a evalua eficacitatea rezecţiei colorectale laparoscopice în cazurile de endometrioză profundă, precum şi ...
Sacrocolpopexia – avantaje şi dezavantaje între abordul abdominal şi cel laparoscopic. Sinteză sistematică şi metaanaliză
Prolapsul genital a devenit o afecţiune frecventă în rândul populaţiei de sex feminin. În urma creşterii incidenţei, au fost dezvoltate diferite te...