Receptors for human chorionic gonadotropin (hCG) are found in the gonads expressed by the theca cells, interstitial cells, differentiated granulosa and lutheal cells, in the endometrial epithelium, myometrium and tubal mucosa, in the breast tissue, in the endothelium and smooth muscle of the uterine artery, in the cervix, thyroid, retina and skin tissue, on lymphocytes, macrophages, neuroendocrine cells, Leydig cells, seminal vesicles and prostate cells, and are present in a series of fetal vital organs. In pregnancy, human chorionic gonadotropin, a glycoprotein which has almost the same structure as the pituitary luteinizing hormone (LH), is one of the earliest products of the cells forming the embryo and can be considered one of the first signals elaborated by the embryo; it is involved in maintaining the corpus luteum, in implantation process, in immunomodulation, placental morphogenesis and function, as well as fetal growth and differentiation. Initially, immature trophoblast cells secrete β-hCG units, than in later pregnancy, complete αβ hCG is secreted by the trophoblast cells of vSTB fenotype, hCG secretion having a predictible pattern during a successful pregnancy. The hormone is an ideal marker in the diagnosis and monitoring of early intrauterine pregnancy and ectopic pregnancy, gestational trophoblastic disease, fetal aneuploidy, and placental dysfunction.
Receptorul şi rolurile gonadotropinei corionice umane în sarcină
Human chorionic gonadotropine receptor and its roles in pregnancy
First published: 15 martie 2016
Editorial Group: MEDICHUB MEDIA
Abstract
Rezumat
Receptorii pentru gonadotropina corionică umană (hCG) se găsesc la nivelul gonadelor exprimaţi pe celulele tecale, interstiţiale, granuloase diferenţiate şi luteale, la nivelul epiteliului endometrial, miometrului, mucoasei tubare, ţesutului mamar, în endoteliul şi tunica musculară netedă a arterelor uterine, la nivelul cervixului, tiroidei, retinei, ţesutului cutanat, limfocitelor, macrofagelor, celulelor neuroendocrine, celulelor Leydig, veziculelor seminale, prostatei, precum şi într-o serie de organe vitale fetale. În sarcină, gonadotropina corionică umană, glicoproteină cu structură foarte asemănătoare cu cea a hormonului luteinizant hipofizar (LH), este unul dintre cei mai timpurii produşi de secreţie ai celulelor embrionare şi poate fi considerat unul dintre primele semnale elaborate de embrionul în formare; hCG are rol în menţinerea corpului luteal, în implantare, imunomodulare, morfogeneză şi funcţia placentară, precum şi în creşterea şi diferenţierea fetală. Iniţial, celulele trofoblastice imature elaborează şi secretă subunităţi β ale hCG, iar mai târziu în sarcină, forma completă αβ hCG este produsă de celulele trofoblastice mature cu fenotip vSTB, secreţia având o evoluţie predictibilă în sarcina care se dezvoltă normal. Hormonul reprezintă un marker ideal în diagnosticul şi monitorizarea sarcinii incipiente intrauterine şi a sarcinii ectopice, a bolii trofoblastice gestaţionale, a aneuploidiilor fetale şi a disfuncţiei placentare.
Reproducerea, în ansamblul fenomenelor ei, nu poate avea loc în afara interacţiunii adecvate gonadotropină corionică - receptor, fapt ce condiţionează în esenţă supravieţuirea speciei.
Susţinerea acestei afirmaţii se bazează pe revizuirea studiilor privind structura biochimică a gonadotropinei corionice, etapele de biosinteză şi reglare a secreţiei hormonale, dinamica ei în sarcină, modul său de acţiune la nivel de receptor, funcţiile încă incomplet elucidate şi aspectele recente legate de utilizarea diagnostică şi terapeutică a hormonului.
Structura biochimică, biosinteza şi reglarea secreţiei hCG-ului
Gonadotropina corionică umană (hCG) este un hormon glicoproteic heterodimeric a cărui subunitate a este comună hormonilor foliculostimulant (FSH), luteinizant (LH) şi tireotrop (TSH), având 18kd, conţinând 92 aminoacizi şi fiind codificată de o genă de pe cromozomul 6q21.1-23; subunitatea b, având 30kd şi 145 aminoacizi, este codificată de 8 gene aflate pe cromozomul 19 (locusul 19q13.3), fiind specifică hCG-ului. Legarea noncovalentă a subunităţilor se realizează anterior eliberării în circulaţie a moleculei (figura 1).
Conţinutul glucidic nu are rol esenţial, intervenind în cuplarea hormonului la sistemul efector intracelular al celulei-ţintă şi în prelungirea duratei de acţiune (24 de ore pentru hCG vs. 2 ore pentru LH) datorită acidului sialic conţinut. Un conţinut crescut de carbohidraţi ataşat aceleiaşi secvenţe peptidice caracterizează molecula de „hCG hiperglicozilat” secretat abundent în perioada implantării, în trisomia 21 în care deficienţa în acid sialic a acestei molecule pare a fi patognomonică şi în afecţiuni maligne(1). Sinteza celor două subunităţi, a şi b, se face separat, formarea moleculei complete aflându-se sub controlul limitării ratei de sinteză a subunităţii b; raportul a/b este 1/1 la 9-10 săptămâni de gestaţie şi 10/1 în apropierea termenului. Sinciţiotrofoblastul imatur produce subunităţi b, precedând cu câteva zile sinteza lanţurilor a de către citotrofoblast. Forma hiperglicozilată a hormonului este produsă după un pattern secretor specific, în momentul implantării, exclusiv de către citotrofoblastul invaziv, nediferenţiat. La nivelul trofoblastului matur cu fenotip vSTB, molecula hCG este sintetizată în primul rând de către sinciţiotrofoblast şi doar ocazional de către citotrofoblastul extravilozitar. Limfocitele femeilor gravide secretă în cultură hCG, fenomen ce se poate transmite prin ser la limfocitele femeilor negravide. De asemenea, niveluri hormonale serice reduse au fost depistate sporadic la femei în afara sarcinii şi în anumite tumori benigne sau maligne la sexul masculin.
În serul matern există 5 tipuri de molecule derivate hCG, molecula integră hCG reprezentând hormonul activ, fragmente ale moleculei heterodimerice de hCG, subunităţi libere a, b şi fragmente ale free b hCG; subunităţile free b hCG pot proveni din 3 surse: producţia directă a celulelor trofoblastice, disocierea moleculei de hCG şi fragmentarea enzimatică a acestei molecule de către macrofage sau neutrofile. Concentraţia serică maternă a free b hCG reprezintă doar 0,3-4% din concentraţia totală a b hCG(2).
În sarcină, sinteza şi secreţia hCG-ului sunt reglate prin interacţiuni complexe ce au loc între steroizii sexuali, citokine, GnRH şi factorii de creştere; GnRh este printre primii reglatori ai secreţiei de hCG pe care o stimulează pe tot parcursul sarcinii. Experimentele in vitro au demonstrat că există o autoreglare directă a hCG-ului prin intermediul AMPc între transcripţia genetică a hormonului şi regiunea relatorie a genomului. Hormonii de stres stimulează în cultura trofoblastică secreţia de hCG prin mărirea amplitudinii pulsaţiilor de 2-10 ori. Activina, proteină placentară cu două subunităţi b, creşte eliberarea de hCG şi progesteron, efect antagonizat de folistatină. Epidermal growth factor (EGF) are ca efect inducerea diferenţierii morfologice a trofoblastului, cu creşterea formării sinciţiotrofoblastului şi secundar stimularea secreţiei de hCG(3), dar EGF stimulează de asemenea secreţia de inhibină a celulelor placentare cu efecte supresoare pe stimularea indusă de GnRH a secreţiei de hCG, mecanism sugestiv pentru complexitatea reglării funcţiilor placentare (figura 2a).
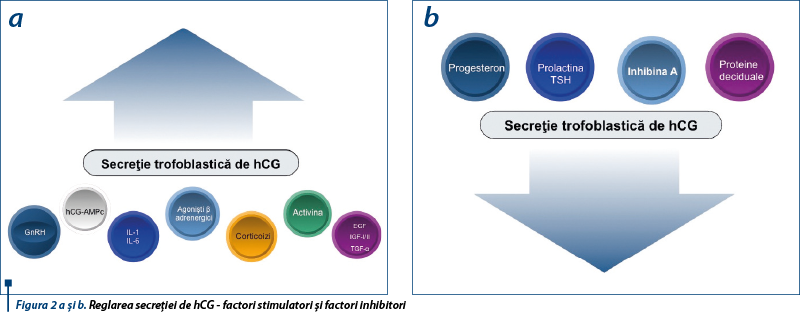
La nivelul vilozităţilor crampon s-a identificat recent o fibronectină specifică - trophouteronectina - implicată în reglarea secreţiei de hCG sub influenţa b TGF (Transforming Growth Factor) şi a LIF (Leukemia Inhibitor Factor). Prolactina frânează pulsatilitatea secreţiei hCG. Inhibina A este o glicoproteină aparţinând familiei TGF-b, care inhibă exclusiv în gestaţie eliberarea de hCG, fără efecte în primul trimestru. Similar acţiunii opiaceelor la nivel hipotalamic, endorfinele exercită o influenţă majoră inhibitorie a secreţiei de hCG. Proteinele deciduale - Progesterone Associated Endometrial Protein, IGFBP-1, IL1, Colony-stimulating Factor 1 - contribuie, de asemenea, la scăderea secreţiei trofoblastice de hCG în trimestrul al III-lea (figura 2b).
Dinamica hCG-ului în sarcină
Gonadotropina corionică este considerată în prezent unul dintre primele semnale embrionare, emise chiar anterior implantării, în ciclurile IVF detectându-se prezenţa ARN mesager pentru b hCG încă din stadiul de 8 celule.
După implantare, hCG creşte exponenţial, atingând un maxim de 100 000 UI/l în săptămânile 9-10 de gestaţie (zilele 60-90), urmează o perioadă de platou în săptămânile 11-12, apoi are loc scăderea nivelurilor până la naştere (figura 3a).
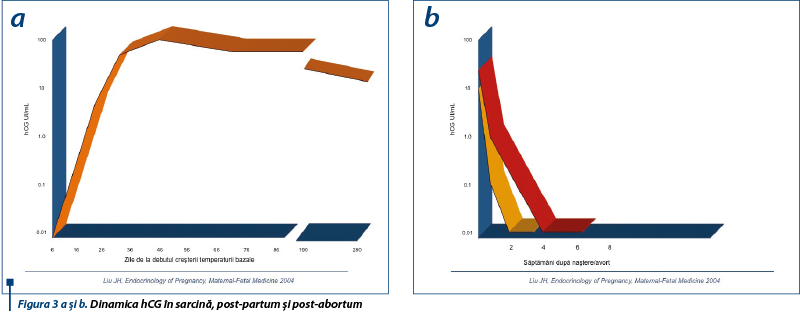
Blastocistul uman secretă hCG în mediu de cultură la 5-8 zile după fertilizare. b hCG este detectabil în sângele matern periferic la o săptămână după concepţie şi nivelurile lui se dublează la 1,4-1,6 zile până în ziua 35 de sarcină, apoi se dublează la 2-2,7 zile între zilele 35-42. hCG este detectat a opta zi în 5% dintre ciclurile ovulatorii fertilizate, a noua zi în 16%, a zecea zi în 53%, iar a 11-a zi după pick-ul de LH preovulator în 100% din cazuri(4). Astfel, dublarea nivelurilor hCG la 48 de ore semnifică în primul trimestru prezenţa unei sarcini viabile, normale, intrauterine.
Aproximativ 20% din gonadotropina corionică serică se elimină urinar; concentraţia de hCG în urină urmează o curbă aproximativ paralelă cu cea plasmatică, valorile de 1 UI/ml la 6 săptămâni crescând la 100 UI/ml între 60 şi 80 de zile de sarcină. Curba concentraţiei în sângele fetal este similară cu cea maternă, valorile absolute reprezentând 3% din cele materne.
La două săptămâni după naştere şi la 4 săptămâni după avort, nivelurile hCG devin nedozabile (figura 3b).
Receptorul pentru hCG şi mecanismul său de acţiune
Receptorul comun hCG/LHR este o glicoproteină cu masă moleculară de aproximativ 85-95 kDa, apare prin maturarea şi transportul unei forme precursoare diferite conformaţional, localizată la nivelul reticulului endoplasmic; rata maturării şi turn-overul nu au fost încă studiate în detaliu la specia umană.
Clonat de peste 20 de ani, receptorul hCG/LHR aparţine superfamiliei receptorilor care cuplează proteina G la 7 helixuri transmembranare, structura şi topologia justificând afilierea la subfamilia receptorilor rodopsin/b2 adrenergici(5). Cele 340 de reziduuri extramembranare N terminale reprezintă principalul domeniu de legare a hormonilor specifici. Helixurile transmembranare sunt legate prin câte 3 punţi hidrofile extra- şi intracelulare şi prezintă un potenţial şi controversat situs de legare secundar cu afinitate redusă. Capătul carboxi-terminal al celei de-a treia bucle intracitoplasmatice în contextul rearanjamentelor spaţiale ale domeniului serpentină este principalul responsabil de activarea sistemului transductor al semnalului extern. Zone ale domeniului intracelular sunt implicate în cuplarea proteinei G şi în desensibilizare prin fosforilare(6) (figura 4).
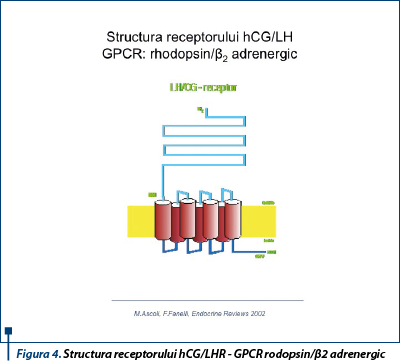
Receptorul este codificat de o singură genă, formată din 10 introni şi 11 exoni, localizată pe braţul scurt al cromozomului 2 (2p21)(7). Dacă mutaţiile afectând restrictiv regiunea serpentină intramembranară au ca efect amplificarea funcţiilor receptoare sau activarea receptorului în absenţa stimulării de către agonist, mutaţii naturale inactivatoare cu localizare heterogenă pot fi urmate de pierderea afinităţii pentru hCG, absenţa transmiterii semnalului sau scăderea expresiei receptorilor prin alterarea proceselor de maturare şi transport al precursorilor. Polimorfismul exonilor 1 şi 10 pare să nu modifice proprietăţile funcţionale ale receptorului (figura 5).
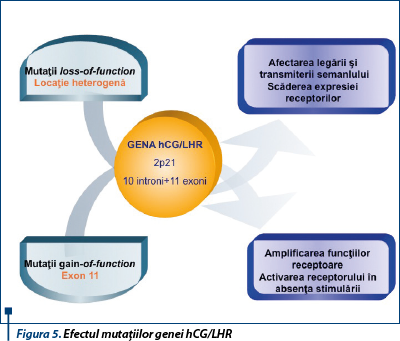
Fenotipic, mutaţiile inactivatoare ale receptorului hCG/LHR determină infertilitate a ambelor sexe. Femeile prezintă insuficienţă ovariană prematură manifestată prin amenoree primară sau secundară, niveluri crescute ale LH şi scăzute ale estrogenilor în faza luteală, foliculogeneza neatingând stadiul antral(8,9). La sexul masculin, datorită imposibilităţii celulelor Leydig de a răspunde stimulului gonadotrop corionic necesar diferenţierii organelor sexuale masculine externe, afectarea în grade variate prin mutaţii a receptorului se manifestă prin infertilitate, însoţită de micropenis, cu sau fără hipospadias, până la pseudohermafroditism(10,11,12).
Ectodomeniul receptorului prezintă situsurile de legare pentru hormonii specifici, fiind responsabil de recunoaşterea şi înalta afinitate a receptorului pentru aceşti liganzi(13). Probabil cea mai cunoscută caracteristică a domeniului extramembranar o reprezintă LRR (leucine rich repeat), secvenţă repetitivă de aminoacizi bogată în leucină, măsurând aproximativ 25 de reziduuri, situată între cele două capete N şi C termiale bogate în cisteină. Rolul funcţional al glicozilării celor 6 situsuri potenţial prezente la nivel extramembranar nu este încă elucidat, dar acest proces nu pare să altereze afinitatea şi specificitatea legării sau transmiterea semnalului prin membrană; legarea carbohidraţilor poate însă facilita legarea calnexinei de molecula imatură, în vederea conversiei. Regiunea N terminală, bogată în cisteină în principal, dar şi secvenţele repetitive 1-7, codificate de exonii 1-7, sunt esenţiale pentru afinitatea legării hCG. În schimb, deleţia exonului 10 face imposibilă legarea LH, fără a afecta afinitatea receptorului pentru hCG.
Cercetările desfăşurate până în prezent în ceea ce priveşte activarea receptorului hCG/LHR de către hormon au condus la elaborarea a 3 modele(6):
-
primul model presupune legarea hormonului de domeniul extracelular, urmată de interacţiunea şi activarea regiunii serpentină de către hormon;
-
al doilea model sugerează activarea regiunii serpentină transmembranară de către domeniul extracelular care a recunoscut şi a legat anterior hormonul;
-
cel de-al treilea model susţine rolul domeniului extracelular de menţinere inactivă a regiunii serpentină, interacţiune relaxată de ataşarea hormonului la domeniul extramembranar.
Ambele subunităţi ale hCG interacţionează cu ectodomeniul receptor prin intermediul a 4 domenii peptidice diferite, ceea ce asigură o înaltă afinitate a legării, superioară LH-ului. Narayan a demonstrat în anul 2002 faptul că formele monomerice nu pot fi agonişti funcţionali ai receptorului(14).
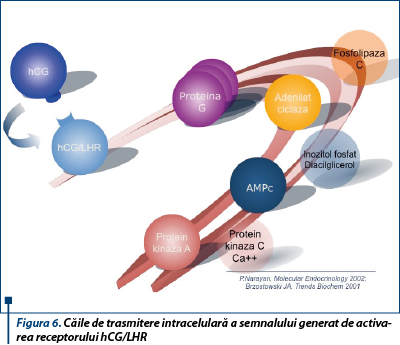
hCG este recunoscut şi activează, de asemenea, receptorii TSHR şi FSHR, fără a împiedica legarea hormonilor specifici de aceştia. Efectul hCG-ului asupra TSHR este argumentat de hipertiroidismul gestaţional, mutaţia Lis în poziţia 183 cu Arg la nivelul acestui receptor crescându-i afinitatea pentru hCG. Funcţia de cuplare o deţine proteina G, activatoare a adenilat ciclazei, care va genera ca răspuns la semnalul extern AMPc, mesager secund intracelular cu rol de activare a proteinkinazei A.
Deşi este clar faptul că efectele mediate de LHR asupra celulelor Leydig şi granuloase sunt transmise aproape exclusiv pe această cale, se consideră în prezent că există şi alte căi de transmitere a semnalului, implicate în proliferarea şi diferenţierea celulelor ce exprimă receptori hCG/LHR. Astfel, la concentraţii mari ale hCG-ului şi ale receptorului său, formarea de complexe pare să activeze mai multe subfamilii de proteine G heterotrimerice care pot transmite semnalul şi pe calea fosfolipazei C (b2), cu acumulare consecutivă intracelulară de inozitol fosfat şi/sau diacilglicerol şi calciu. Această cale pare a fi accesată în principal în sarcină şi în pick-ul preovulator al LH. De asemenea, studii recente indică utilizarea căii inozitol fosfatului în cazul mutaţiilor ce determină câştigare de funcţii receptoare. Bazele moleculare şi consecinţele activării acestei căi nu au fost încă explorate(14,15) (figura 6).
În reglarea transcripţiei receptorului, rolul esenţial îl joacă regiunea promotor a genei, care prezintă 3 situsuri Sp1 a căror activare concomitentă are un rol critic asupra nivelului bazal al transcripţiei genei LHR via AMPc. SAS situat în vecinătatea Sp1c creşte, de asemenea, transcriptul ARNm pe aceeaşi cale. În plus, o serie de receptori nucleari au fost recent implicaţi în reglarea transcripţiei bazale a receptorului.
Pick-ul preovulator al LH are efect de downregulation a LHR, însoţind scăderea ARNm prin creşterea degradării acestuia; LH receptor binding protein 1 reglează stabilitatea transcriptului ARN. În timpul creşterii şi diferenţierii celulelor granuloase ale foliculilor în dezvoltare, creşte activitatea de legare a LHR dependentă de estrogeni şi FSH, creşterea ARNm fiind mediată via AMPc. Interesant este faptul că, deşi concentraţiile crescute de hCG au acelaşi efect de downregulation, scăderea ARN-ului mesager transcript al genei mediată AMPc este nesemnificativă. Astfel, se explică răspunsul prezent al corpului luteal în condiţiile scăderii numărului de receptori, determinată de creşterea bruscă a nivelurilor hCG în sarcina incipientă.
Desensibilizarea este o componentă importantă a reglării acţiunii hormonale, realizată în principal prin 4 mecanisme: scăderea activităţii sau a nivelurilor de 17a-hidroxilază/17,20-liază, scăderea colesterolului disponibil steroidogenezei, scăderea interacţiunii şi activării LHR-proteine G şi downregulation posttranscripţional. Afectarea cuplării receptorului cu sistemul efector intracelular şi down-reglarea posttranscripţională sunt urmarea fosforilării receptorului (catalizată de o familie de serin/treonin kinaze - GRKs) care creşte afinitatea acestuia pentru b arestinele 1 şi 2 cu care formează un complex; mai mult decât fosforilarea, formării complexului îi este necesară activarea receptorului. Astfel, lipsa cuplării proteinei G sau internalizarea receptorului conduce la desensibilizare. Complexele internalizate sunt parţial degradate în lizozomi, parţial reciclate(6).
Funcţiile hCG-ului în sarcină
Studiul receptorilor a dovedit în ultimii ani că efectul endocrin de reglare a steroidogenezei ovariene şi testiculare este completat de efecte paracrine prin care hCG influenţează comportamentul unui număr important de ţesuturi ce exprimă receptori hCG/LHR. Densitatea exprimării receptorilor de către diferitele ţesuturi constituie principalul mecanism de modulare a acţiunii hCG. Studii bazate pe detectarea ARNm transcript al LHR, utilizarea de anticorpi sau de hCG marcat au relevat prezenţa gonadală a receptorilor la nivelul celulelor tecale, interstiţiale, granuloase diferenţiate şi luteale; Rao şi colaboratorii(16) susţin prin numeroase cercetări existenţa receptorilor extragonadali la nivelul epiteliului endometrial, miometrului, mucoasei tubare, ţesutului mamar în perioada de alăptare şi în cadrul unor leziuni benigne sau maligne.
Reshef et al. constatau în 1990 efectul paracrin reglator pe care hCG-ul secretat de către epiteliul glandular endometrial îl are asupra ciclului endometrial normal(17); opt ani mai târziu, Wolkersdorfer demonstrează imunohistochimic, prin hibridizare in situ, culturi celulare şi analize enzimatice, precum şi prin electroforeză şi imunoblotting, abilitatea celulelor epiteliale, dar şi stromale de sinteză a bCG pe parcursul fazei secretorii, cu rol esenţial în ataşarea, creşterea şi stabilirea toleranţei imunologice în cadrul complexelor relaţii ale unităţii feto-placentare, rămânând încă neclarificate modalitatea de reglare şi funcţia pe care bCG o are în fiziologia şi fiziopatologia endometrială(18).
Receptorii pentru hCG prezenţi în endoteliul şi tunica musculară netedă a arterelor uterine devin mult mai abundenţi la nivelul arterelor mici intramiometriale, având un rol esenţial în reglarea rezistenţei vasculare uteroplacentare.
La nivel cervical, epiteliul scuamos stratificat exocervical, epiteliul columnar, glandele, vasele şi fibrele musculare netede ale endocervixului conţin receptori pentru hCG care ar putea regla funcţionalitatea cervicală în sarcină(19).
Tiroida, retina şi ţesutul cutanat sunt organe receptoare pentru hCG/LH. hCG pare, de asemenea, să intervină în reglarea funcţiilor macrofagice(20) la nivel de deciduă, corp luteal şi endometru în faza luteală tardivă. Receptori specifici există şi la nivelul limfocitelor Vg1, o serie de celule neuroendocrine exprimând acest tip de receptori.
Sugestive pentru localizarea extragonadală a receptorilor sunt studiile privind femeile în post-menopauză cu hiperplazie adrenală macronodulară ACTH independentă sau sindrom Cushing, care au dezvoltat acest sindrom în fiecare din sarcinile duse la termen(21); expresia acestor receptori în cortexul adrenal, devenită manifestă sub nivelurile crescute ale hCG în sarcină şi respectiv LH în menopauză, constituie o dovadă indirectă a localizării ectopice a acestor receptori. Mai mult decât atât, administrarea de hCG determină creşterea secreţiei de testosteron, estradiol, dar şi de cortizol.
Efectul protector faţă de dezvoltarea cancerului mamar pe care îl conferă o sarcină obţinută la vârstă tânără şi menţinută până la termen pare a fi datorat, de asemenea, hCG-ului, care manifestă un efect antiproliferativ, dar mai ales antiinvaziv asupra celulelor MCF-7, prin inhibarea activării NF-kB şi AP-1, pe calea protein-kinazei A AMPc dependentă(22).
Desigur, toate aceste localizări ridică numeroase întrebări legate de rolul fiziologic al gonadotropinelor şi receptorilor hCG/LHR; faptul că mutaţiile receptorilor nu implică anomalii decelabile clinic ale acestor sisteme sugerează un rol subtil, încă neelucidat, al acestor receptori în funcţionarea lor.
La sexul masculin, receptorii au fost decelaţi în membrana celulelor Leydig, spermă, vezicule seminale, prostată, tumori benigne şi maligne ale acestei glande sau ale altor ţesuturi.
hCG este, de asemenea, prezent în circulaţia fetală, nivelurile reduse fiind derivate din rinichiul fetal, ficatul şi hipofiza anterioară, în plus, fătul fiind expus hCG-ului prezent în lichidul amniotic şi exocelomic. Stimularea steroidogenezei mediată de receptorii gonadali şi adrenali este cunoscută, dar foarte recent teste de imunocitochimie, Western blott, hibridizare in situ şi analize genetice moleculare au demonstrat prezenţa receptorilor hCG/LHR în rinichiul, ficatul, pancreasul, plămânul şi intestinul fetal, ceea ce constituie un argument pentru rolul hCG-ului în creşterea şi diferenţierea ţesuturilor fetale(23).
Procesul de adaptare al organismului matern în sarcină se numără printre cele mai remarcabile fenomene naturale. Modificările hormonilor secretaţi de unitatea feto-materno-placentară sunt esenţiale evoluţiei şi finalităţii sarcinii (figura 7).
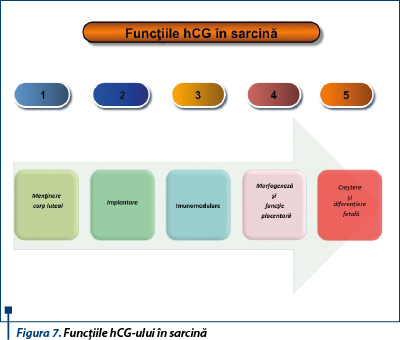
Descoperirea recentă a receptorilor pentru hCG la nivelul uterului şi a fenomenului de up-regulation al acestor receptori în fereastra de receptivitate endometrială a condus la explorarea rolului hCG-ului în procesul de implantare. Tot mai evidentă devine în ultimul timp implicarea esenţială a hCG-ului în toate etapele dezvoltării placentei, precum şi în creşterea şi diferenţierea fetală. Teoria cel mai larg acceptată privind rolul hCG în sarcină este menţinerea în primele 6-8 săptămâni de sarcină a corpului luteal, cu scopul asigurării secreţiei ovariene continue de progesteron şi, posibil, relaxină (hormon peptidic a cărui dinamică este paralelă cu a hCG-ului, având ca efect principal creşterea secreţiei de prostaciclină miometrială, cu scăderea contractilităţii), până în momentul preluării acestei funcţii de către sinciţiotrofoblastul în dezvoltare. O serie de argumente susţin acest concept: administrarea de hCG la femeile negravide prelungeşte cu două săptămâni activitatea corpului galben, în timp ce imunoneutralizarea hCG-ului determină întreruperea precoce a evoluţiei sarcinii. Culturile placentare au relevat pulsatilitatea secreţiei de hCG la 18-23 de minute, buna funcţionare a corpului galben părând să aibă nevoie de această secreţie episodică. hCG, alături de PG şi EGF, stimulează producţia placentară de inhibină A, care la rândul ei menţine, aşa cum au dovedit studiile experimentale, sinteza luteală de progesteron şi intervine în semnalizarea celulară, stimulând probabil invazia trofoblastică. Steroidogeneza luteală este stimulată de către hCG prin stimularea enzimelor de clivaj ale colesterolului şi prin creşterea fixării, internalizării şi degradării intracelulare a LDL.
În cadrul etapei de implantare, prin intermediul receptorilor hCG/LHR funcţionali identificaţi la nivelul trofoblastului intermediar, hCG promovează diferenţierea citotrofoblastului în sinciţiotrofoblast(24,25) şi modulează sinteza, activarea şi inhibiţia metaloproteinazelor MMP, enzime proteolitice cu un atom de zinc, secretate de trofoblast, dar şi de endometru în procesul de invazie; MMP-9 este exprimată de citotrofoblast, cu rol în degradarea matricei proteice extracelulare; concentraţia sa crescută în mediul de cultură embrionar se corelează direct cu succesul transferului în cadrul reproducerii asistate. Vascular Endothelial Growth Factor (VEGF) este esenţial angiogenezei în endometrul periimplantaţional. LIF (Leukemia Inhibitor Factor) este o glicoproteină a familiei IL-6, care pe lângă efectul endometrial stimulează diferenţierea celulelor trofoblastice în fenotipuri invazive şi creşte producţia de fibronectină a acestor celule, facilitând ancorarea. Insulin-like Growth Factor binding protein se opune invaziei trofoblastice prin legarea IGF-I şi II cu blocarea consecutivă a stimulării citotrofoblastului şi a creşterii, diferenţierii şi reglării metabolismului celular local. Glicodelina este o proteină majoră a endometrului secretor, asociată cu imunosupresia şi diferenţierea epitelială. Antigenul trofoblastului invaziv (ITA) „hCG hiperglicozilat” are un rol independent de cel al hCG-ului, promovând invazia celulară şi dovedindu-se a fi un component absolut necesar implantării normale a blastocistului.
Funcţia imună în ansamblul ei nu este alterată de sarcină; unele studii afirmă scăderea funcţiei celulelor T şi NK, dar răspunsul matern la administrarea de vaccinuri şi reacţia de hipersensibilitate întârziată rămân intacte; hCG-ul are acţiune directă de inhibare a proliferării limfocitare, la care se adaugă efectul imonosupresor mediat de progesteron. Macrofagele placentare care exprimă receptori hCG/LHR intervin în prezentarea antigenelor celulelor T, în fagocitoza bacteriană, stimulează creşterea şi diferenţierea citotrofoblastului, crescând producţia de hCG prin producerea de IL-1.
În ceea ce priveşte morfogeneza şi funcţia placentară, hCG este un reglator autocrin şi paracrin necesar diferenţierii sinciţiului trofoblastic din citotrofoblastul mononuclear, mediată prin activarea receptorilor hCG/LHR şi prin intermediul EGF, TGFa şi LIF care cresc producţia de hCG; diferenţierea consecutivă a citotrofoblastului va induce o creştere suplimentară a concentraţiei hormonului(3). O alternativă a acestui mecanism o constituie activarea directă a proteinkinazei A care şuntează calea hCG, probabil prin activarea genelor responsabile de diferenţiere. Formarea deficientă a sinciţiotrofoblastului pare a fi implicată în apariţia preeclampsiei şi a restricţiei de creştere intrauterină. Cel de-al doilea val de invazie trofoblastică a porţiunii intramiometriale a arterelor spiralate, necesar creşterii fluxului uteroplacentar în trimestrul al II-lea de sarcină, necesită transformarea trofoblastului din fenotip epitelial în fenotip endotelial. Această pseudovasculogeneză este mediată de hCG prin intermediul VEGF, PIGF şi al angiopoietinelor; de asemenea, hCG interferează cu metabolismul eicosanozilor la nivelul peretelui vascular(26).
hCG este considerat primul stimul primit de celulele Leydig fetale în vederea producerii nivelurilor crescute de testosteron necesare diferenţierii şi dezvoltării organelor genitale masculine; fără a fi cunoscute motivele, receptorii gonadali nu sunt supuşi down-reglării, nefiind supuşi desensibilizării. Hormonul prin intermediul receptorului său intervine în dezvoltarea şi funcţia pulmonară, hepatică, renală şi pancreatică a fătului.
Rolul diagnostic şi terapeutic al hCG-ului
hCG reprezintă un marker ideal pentru diagnosticul şi urmărirea evoluţiei sub tratament a bolii trofoblastice gestaţionale; nivelul lui seric este crescut proporţional cu masa de ţesut patologic, depăşind frecvent 100.000 mUI/ml. Valori înalte ale hCG-ului mergând spre 500.000 mUI/ml pot determina rezultate fals negative ale determinării serice de laborator, fenomen cunoscut drept „hook efect” (27). Diagnosticul bolii persistente după evacuarea molei (molă invazivă sau coriocracinom) se bazează pe stagnarea în platou sau creşterea progresivă a concentraţiei hormonale. Creşterea titrului consecutivă unei sarcini nonmolare este diagnostică pentru coriocarcinom, în care hCG apare în forma hiperglicozilată în procent crescut de la 4,9%, cât reprezintă în mola hidatiformă completă, la 61-100% din hCG-ul total(28). Tumora trofoblastică a situsului placentar, cu origine în citotrofoblastul intermediar, se asociază cu niveluri relativ reduse ale hCG comparativ cu masa tumorală, preponderenţa fiind forma liberă a subunităţii b.
Nivelurile scăzute persistente ale hCG-ului sunt definite de niveluri ce nu variază cu mai mult decât dublarea valorii într-un interval de 3 luni, situându-se întotdeauna sub pragul de 1000 mUI/mL, în absenţa unei formaţiuni tumorale evidenţiabilă imagistic. Cauzele cele mai frecvente sunt sarcina incipientă, boala trofoblastică gestaţională şi secreţia hipofizară în perimenopauză(29,30), mai rare fiind neoplasmele nontrofoblastice(31), rezultatele fals pozitive (hCG-fantomă)(32) sau administrarea de hCG. Boala trofoblastică latentă, cu valori hCG sub 212 mUI/mL persistente peste 3 luni în absenţa unei tumori primare sau metastatice trebuie monitorizată lunar, prin determinare de hCG, în 22% dintre cazuri producându-se reactivarea(33).
Sensibilitatea metodelor actuale face ca dozarea hCG-ului să fie principala metodă de diagnosticare precoce a sarcinii ectopice. Concentraţiile hCG seriate la intervale de 48 de ore sunt inferioare şi lipsite de pattern-ul creşterii progresive, caracteristic sarcinii normale, iar chiuretajul uterin e urmat de scăderea concentraţiei serice cu mai puţin de 15% în 12 ore. Specificitatea free hCG este superioară celorlalte izoforme. De asemenea, nivelul hCG-ului constituie atât un criteriu de selecţie a abordării terapeutice conservatoare medicamentoase, cât şi o metodă de monitorizare dinamică a resorbţiei spontane sau evoluţiei sub tratament. Creşterea sub 66% a nivelurilor de hCG în 48 de ore sau menţinerea în platou a concentraţiilor hCG este sugestivă pentru oprirea precoce în evoluţie a sarcinii(34).
Concentraţia hCG-ului sub percentila 10 în trimestrul I de sarcină denotă o disfuncţie trofoblastică cu insuficienţă placentară ulterioară; în trimestrele II şi III, niveluri crescute (2,5MoM) semnifică o creştere de 2-3 ori a riscului. În preeclampsie, creşterea hCG-ului în trimestrul al III-lea poate fi consecinţa invaziei anormale, imaturităţii placentare sau răspunsului la hipoxie a trofoblastului; creşterea din trimestrul al II-lea are o acurateţe discutabilă, la un cut-off de 2MoM valoarea predictivă fiind de 30%, similară velocimetriei pe arterele uterine, creşterea fiind mai frecventă la multipare şi având semnificaţia unei forme severe. Nivelul de hCG crescut în trimestrul al II-lea constituie, de asemenea, un factor de prognostic pentru creşterea mortalităţii perinatale şi a riscului de naştere prematură. b hCG peste 50 mUI/ml prezent în secreţia cervicovaginală între săptămânile 24 şi 28 are semnificaţia unei creşteri de două ori a riscului de naştere prematură sub 34 de săptămâni.
Hiperemesis gravidarum se asociază frecvent cu niveluri crescute ale hCG-ului în primul trimestru de sarcină(35).
Aneuploidiile se caracterizează prin alterarea secreţiei steroizilor şi proteinelor placentare şi fetale. Plecându-se de la constatarea lui Merkatz şi colab., comunicată în 1987, privind asocierea sarcinilor aneuploide cu niveluri serice scăzute ale a-fetoproteinei, numeroşi markeri serici şi ecografici, printre care şi hCG-ul, au fost utilizaţi alături de vârsta maternă în scopul detecţiei sarcinilor cu trisomie 21, 18 sau 13. Concentraţiile trofoblastice crescute de hCG (prin mecanism post-transcripţional, expresia ARNm fiind nemodificată) şi ale receptorilor reflectă imaturitatea ţesutului trofoblastic ce caracterizează trisomia 21, în timp ce nivelurile scăzute ale hCG (prin blocarea transcripţiei) asociate supraexpresiei receptorilor în trisomia 18 sunt probabil secundare slabei diferenţieri a citotrofoblastului. Asocierea optimă de markeri biochimici şi ecografici adăugaţi riscului bazal determinat de vârsta maternă a fost evaluată în cadrul a două mari trialuri: SURUSS, desfăşurat pe 47.000 de paciente din 25 de maternităţi ale Marii Britanii(36), şi FASTER, care a analizat 38.000 de screening-uri efectuate în 15 centre ale Statelor Unite(37). b hCG-ul a fost coroborat cu proteina plasmatică asociată sarcinii-A (PAPP-A) şi măsurarea translucenţei nucale în cadrul testului combinat de trimestrul I, cu a-fetoproteina şi estriolul seric neconjugat în cadrul triplului test de trimestrul II, cu adăugarea inhibinei A la markerii de trimestrul II în cadrul cvadruplului test, sau în contextul analizei cumulative a NT, PAPP-A, b hCG, a-fetoproteinei, estriolului, inhibinei A şi vârstei materne în cadrul testului integrat. Rezultatele trialurilor au fost similare, relevând o rată de detecţie de 85% la o rată minimă de fals pozitiv de 0,8% pentru testul integrat; pentru femeile cu vârsta ≥35 de ani, screeningul combinat de trimestrul I a avut o rată de detecţie de 95% cu 22% fals pozitiv, în timp ce testul integrat a detectat 91% dintre cazuri la o rată de 2% a rezultatelor fals pozitive. Nivelurile serice crescute ale b hCG-ului la feţii afectaţi de sindromul Down sunt aproximativ duble comparativ cu sarcinile euploide. Fără a se putea susţine cu certitudine superioritatea performanţei utilizării free b hCG-ului comparativ cu a b hCG-ului total în cadrul testului combinat, ambele tipuri de molecule îşi cresc capacitatea de detecţie cu avansarea vârstei gestaţionale în intervalul 110-13+6 şi respectiv 90-13+6 pentru free b hCG(38,39,40). Antigenul trofoblastului invaziv (ITA) este crescut în trisomia 21, iar absenţa acidului sialic expune molecula receptorilor hepatici pentru galactoză, explicând eficacitatea scăzută a dozării serice comparativ cu cea urinară a ITA. hCG şi b hCG au concentraţii scăzute în trisomia 18, a doua aneuploidie ca frecvenţă diagnostică prin teste biochimice de screening, b hCG utilizat în trimestrul I, alături de PAPP-A depistând 60% din trisomiile 18 la o rată de fals pozitiv de 0,1%, rată la care testul integrat depistează 90% dintre sarcinile efectuate(41).
hCG afectează metabolismul miometrial al prostaciclinei şi sinteza de eicosanoizi a ţesuturilor în timpul gestaţiei, contribuind de asemenea la starea de linişte a miometrului.
hCG este un semnal transductor important în semnalizarea embrio-maternă şi joacă un rol important în implantare, fiind, de asemenea, utilizat de mult timp în declanşarea ovulaţiei, forma recombinantă având eficacitate similară celei urinare(42).
Prin acţiunea sa la nivelul arterelor uterine, intramiometriale şi endometriale superficiale, scade rezistenţa şi se ameliorează fluxul în circulaţia uteroplacentară; creşterea sintezei eicosanoizilor vasodilatatori şi stimularea steroizilor sexuali pot explica deopotrivă acest efect. Administrarea de hCG s-a dovedit a scădea incidenţa restricţiei de creştere intrauterină şi a naşterii premature, favorizarea angiogenezei ca efect pe termen lung putând explica aceste rezultate.
Carp şi colab., într-un review al revistei „Lupus” din 2004, afirmă că progesteronul şi b hCG-ul îşi justifică utilizarea în scopul îmbunătăţirii ratei naşterilor la femeile cu avorturi recurente, acţionând prin modularea balanţei între diferite citokine(43).
În concluzie, deşi ultimii ani au aprofundat considerabil cunoştinţele privind receptorul, funcţia şi reglarea biosintezei moleculei de hCG, multe aspecte rămân în prezent controversate şi tot atât de necunoscute.
Bibliografie
2. Reis FM, D`Antona D, Petraglia F. Predictive value of hormone measurements in maternal and fetal complications of pregnancy. Endocrine Reviwes 2002; 23(2):230-257.
3. Yang M, Lei ZM, Rao ChV. The central role of human chorionic gonadotropin in the formation of human placental syncytium. Endocrinology 2003; 144(3): 1108-1120.
4. Daya S. Human chorionic gonadotropin increase in normal early pregnancy. Am J Obstet Gynecol. 1987;156(2):286.
5. Moyle WR, Campbell RK, Rao SNV et al. Model of human chorionic gonadotropin and lutropin receptor interaction that explains signal transduction of the glycoprotein hormones. J Biol Chem 1999; 270:20020-20031.
6. Ascoli M, Fanelli F, Segaloff DL, The Lutropin/Choriogonadotropin Receptor, A 2002 Perspective. Endocrine Reviews 2002; 23(2):141-174.
7. Rousseau-Merck MF, Misrahi M, Atger M et al. Localization of the human luteinizing hormone/choriogonadotropin receptor gene (LHCGR) to chromosome 2p21. Cytogenet Cell Genet 1990; 54:77-79.
8. Meehan TP,Harmon BG, Yu KK et al. Gonadal defects and hormonal alterationsin trasgenic mice expressing a single chain human gonadotropin-lutropin receptor complex. Journal of Molecular Endocrinology (2005) 34: 489-503.
9. Toledo S, Brunner H, Kraaij R. et al. An inactivating mutation of the luteinizing hormone receptor causes amenorrhea in a 46,XX female. J Clin Endocrinol Metab 1996; 81: 3850-3854.
10. Gromoll J, Eiholzer U, Nieschlag E. et al. Male hypogonadism caused by homozygous deletion of exon 10 of the luteinizing hormone (LH) receptor: differential action of human chorionic gonadotropin and LH. J Clin Endocrinol Metab. 2000; 85:2281-2286.
11. Martens JWM, Verhoef-Post M, Abelin N et al. A homozygous mutation in the luteinizing hormone receptor causes partial Leydig cell hypoplasia: correlation between receptor activity and phenotype. Mol Endocrinol 1998; 12:775-784.
12. Misrahi M, Meduri G, Pissard S etal. Comparison of immunocytochemical and molecular features with the phenotype in a case of incomplete male pseudohermaphroditism associated with a mutation of the luteinizing hormone receptor. J Clin Endocrinol Metab 1997; 82: 2159-2165.
13. Galet C, Ascoli M. The differential Binding Affinities of the Luteinizing Hormone (LH)/Choriogonadropin Receptor for LH and Choriogonadotropin Are Dictated by Different Extracelular Domain Residues. Molecular Endocrinology. 2005. 19(5): 1263-1276.
14. Narayan P, Gray J, Puett D. Yoked complexes of human coriogonadotropin and the lutropin receptor: evidence that monomeric individual subunits are inactive. Mol Endocrinol. 2002;16(12): 2733-2745.
15. Brzostowski JA, Kimmel AR, Signaling at zero G: G-protein-independent fuctions for 7-TM receptors. Trends Biochem Sci 2001; 26: 291-297.
16. Rao CV. A paradigm shift on the targets of luteinizing hormone/human chorionic gonadotropin actions in the body. J Bellevue Obstet Gynecol Soc 1999; 15:26-32.
17. Reshef E, Lei ZM, Rao CV et al. The presence of gonadotropin receptors in nonpregnant human uterus, human placenta, fetal membranes, and decidua. J. Clin. Endocrinol. Metab. 1990 (70):421-430.
18. Wolkersdorfer GW, Bornstein SR, Hilbers U. The presence of chorionic gonadotrohin β subunit in nornal cyclic human endometrium. Molecular Human Reproduction 1998 (4)2: 179-184.
19. Lin PC, Li X, Lei ZM, Rao Ch V. Human cervix contains functional luteinizing hormone/human chorionic gonadotropin receptors. J Clin Endocrinol Metab. 2003 Jul; 88(7):3409-14.
20. Zhang YM, Rao ChV, Lei ZM. Macrophages in human reproductive tissues contain luteinizing hormone/chorionic gonadotropin receptors. Am J Reprod Immunol. 2003 Feb; 49(2):93-100.
21. Lacroix A, Hamet P, Boutin JM. Leuprolide acetate therapy in luteinizing hormone-dependent Cushing`s syndrome. N Engl J Med 1999; 341:1577-1581.
22. Rao CV, Li X, Manna SK et al. Human Chorionic Gonadotropin Decreases Proliferation and Invasion of Breast Cancer MCF-7 Cells by Inhibiting NF-kB and AP-1 Activation. J Biol Chem 2004 (279)24:25503-25510.
23. Abdallah MA, Lei ZM, Li X. et al. Human fetal nongonadal tissues contain human chorionic gonadotropin/luteinizing hormone receptors. J Clin Endocrinol Metab. 2004 Feb;89(2):952-6.
24. Shi QJ, Lei ZM, Rao CV, Lin J. Novel role of human chorionic gonadotropin in differentiation of human cytotrophoblasts.Endocrinology 1993 Mar; 132(3):1387-95.
25. Tao YX, Lei ZM, Hofmann GE et al, Human intermediate trophoblasts express Chorionic Gonadotropin/Luteinizing Hormone Receptor Gene. Biology of Reproduction 1995(53): 899-904.
26. Zygmunt M, Herr F, Keller-Schoenwetter S, Kunzi-Rapp K, Münstedt K, Rao CV. Characterization of human chorionic gonadotropin as a novel angiogenic factor. J Clin Endocrinol Metab. 2002;87(11):5290.
27. Cole LA. Immunoassay of human chorionic gonadotropin, its free subunits, and metabolites. Clin Chem. 1997;43(12):2233.
28. Cole LA, Dai D, Butler SA, Leslie KK, Kohorn EI. Gestational trophoblastic diseases: 1. Pathophysiology of hyperglycosylated hCG. Gynecol Oncol. 2006;102(2):145.
29. Snyder JA, Haymond S, Parvin CA. Diagnostic considerations in the measurement of human chorionic gonadotropin in aging women. Clin Chem. 2005 Oct; 51(10):1830-5. Epub 2005 Aug 11.
30. Cole LA, Khanlian SA, Muller CY. Detection of perimenopause or postmenopause human chorionic gonadotropin: an unnecessary source of alarm. Am J Obstet Gynecol. 2008;198(3):275.e1.
31. Marcillac I, Troalen F, Bidart JM. Free human chorionic gonadotropin beta subunit in gonadal and nongonadal neoplasms. Cancer Res. 1992 Jul; 52(14):3901-7.
32. Knight AK, Bingemann T, Cole L, Cunningham-Rundles C. Frequent false positive beta human chorionic gonadotropin tests in immunoglobulin A deficiency. Clin Exp Immunol. 2005; 141(2):333.
33. Khanlian SA, Cole LA. Management of gestational trophoblastic disease and other cases with low serum levels of human chorionic gonadotropin. J Reprod Med. 2006;51(10):812.
34. Doubilet PM, Benson CB, Bourne T, Blaivas M, Society of Radiologists in Ultrasound Multispecialty Panel on Early First Trimester Diagnosis of Miscarriage and Exclusion of a Viable Intrauterine Pregnancy, Barnhart KT, Benacerraf BR, Brown DL, Filly RA, Fox JC, Goldstein SR, Kendall JL, Lyons EA, Porter MB, Pretorius DH, Timor-Tritsch IE. Diagnostic criteria for nonviable pregnancy early in the first trimester. N Engl J Med. 2013 Oct; 369(15):1443-51.
35. Goodwin TM, Montoro M, Mestman JH The role of chorionic gonadotropin in transient hyperthyroidism of hyperemesis gravidarum. J Clin Endocrinol Metab. 1992; 75(5):1333.
36. Wald NJ, Rodeck C, Hackshaw AK, Walters J, Chitty L, Mackinson AM, SURUSS Research Group. First and second trimester antenatal screening for Down’s syndrome: the results of the Serum, Urine and Ultrasound Screening Study (SURUSS). Health Technol Assess. 2003;7(11):1.
37. Malone FD, Canick JA, Ball RH, Nyberg DA, Comstock CH, Bukowski R, Berkowitz RL, Gross SJ, Dugoff L, Craigo SD, Timor-Tritsch IE, Carr SR, Wolfe HM, Dukes K, Bianchi DW, Rudnicka AR, Hackshaw AK, Lambert-Messerlian G, Wald NJ, D’Alton ME, First- and Second-Trimester Evaluation of Risk (FASTER) Research Consortium First-trimester or second-trimester screening, or both, for Down’s syndrome. N Engl J Med. 2005;353(19):2001.
38. Canick JA, Lambert-Messerlian GM, Palomaki GE et al. Comparison of serum markers in first-trimester down syndrome screening. First and Second Trimester Evaluation of Risk (FASTER) Trial Research Consortium. Obstet Gynecol. 2006;108(5):1192.
39. Palomaki GE, Lambert-Messerlian GM, Canick JA. A summary analysis of Down syndrome markers in the late first trimester. Adv Clin Chem. 2007;43:177.
40. Evans MI, Krantz DA, Hallahan TW, Galen RS. Meta-analysis of first trimester Down syndrome screening studies: free beta-human chorionic gonadotropin significantly outperforms intact human chorionic gonadotropin in a multimarker protocol. Am J Obstet Gynecol. 2007;196(3):198.
41. Palomaki GE, Neveux LM, Knight GJ, Haddow JE. Maternal serum-integrated screening for trisomy 18 using both first- and second-trimester markers. Prenat Diagn. 2003;23(3):243.
42. Al-Inany HG, Aboulghar M, Mansour R, Proctor M. Recombinant versus urinary human chorionic gonadotrophin for ovulation induction in assisted conception. Cochrane Database Syst Rev. 2005.
43. Carp H.Cytokines in recurrent miscarriage. Lupus. 2004;13(9):630-4.
Articole din ediţiile anterioare
Un caz rar de sarcină abdominală secundară – prezentare de caz şi review al literaturii
Sarcina abdominală este o formă foarte rară de sarcină extrauterină şi este asociată cu o rată ridicată a mortalităţii. Principala complicaţ...
Relaţia dintre cicatricea uterină determinată de intervenţii histeroscopice şi abdomenul acut chirurgical în sarcină - prezentare de cazuri -
Abdomenul acut chirurgical în cursul sarcinii reprezintă o entitate patologică, plurietiologică, cu evoluţie rapidă şi risc vital atât pentru partu...
Sarcină ectopică în corn rudimentar: diagnostic precoce şi management
Sarcina în corn rudimentar este o entitate clinică rară, cu o incidenţă ce variază între 1:76.000 şi 1:140.000 de sarcini. Simptomatologia care îns...
Diagnosticul precoce al sarcinii ovariene – prezentare de caz
Sarcina ovariană este o varietate foarte rară de sarcină ectopică şi reprezintă o provocare medicală în ceea ce priveşte managementul acesteia...