Intrauterine growth restriction is defined as the fetal failure of achieving the endorsed growth potential and the diagnosis is made on the basis of ultrasound estimated fetal weight below the 10th centile in the absence of a gold standard for defining this condition. Fetuses with growth restriction are at risk for perinatal morbidity and mortality and for poor long-term health outcomes. In the last 10 years many algorithms have been developed aiming to prevent these consequences. This year new consensus-based definitions for early and late fetal growth restriction, including cut-off values for parameters, have been agreed. An update in diagnosis and management of intrauterine growth restriction, through a review of the latest publications in the field, presents the arguments for decisions necessary to produce national guidelines and recommendations of clinical practice in order to reduce the perinatal morbidity and mortality due to this condition, whose prevalence is estimated at 6-7% of total births in Romania.
Restricţia de creştere intrauterină - o nouă abordare
A new aproach of intrauterine growth restriction
First published: 20 martie 2017
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Gine.15.1.2017.491
Abstract
Rezumat
Restricţia de creştere intrauterină este definită de imposibilitatea fătului de a-şi atinge potenţialul de creştere programat; în absenţa unui gold standard capabil să definească această condiţie, diagnosticul se pune pe baza greutăţii fetale estimate ultrasonografic, situate sub percentila 10. Feţii cu restricţie de creştere prezintă un risc crescut de morbiditate şi mortalitate perinatală, precum şi un prognostic nefavorabil pe termen lung. De-a lungul ultimilor 10 ani au fost dezvoltate numeroase protocoale de monitorizare, în scopul prevenirii acestor consecinţe. Anul acesta au fost elaborate prin consens definiţia şi valorile-prag ale parametrilor definitorii pentru restricţia de creştere intrauterină cu debut precoce şi tardiv. Actualizarea diagnosticului şi a managementului restricţiei de creştere intrauterină printr-o recenzie a celor mai noi publicaţii în domeniu îşi propune argumentarea decizională necesară elaborării ghidurilor naţionale şi recomandărilor clinice de practică medicală, în scopul reducerii morbidităţii şi mortalităţii perinatale datorate acestei patologii, a cărei prevalenţă este apreciată la 6-7% din numărul total de naşteri în România.
Introducere
Diagnosticul şi managementul cazurilor de restricţie de creştere fetală rămân o provocare a obstetricii actuale. Criteriile de diagnostic variabile, metodele de monitorizare încă nestandardizate, relativitatea predictibilităţii, absenţa soluţiilor terapeutice cu eficienţă dovedită şi impactul diferit pe care îl au diverşi factori de risc la fiecare vârstă gestaţională susţin această afirmaţie, provocarea obstetricianului fiind reprezentată de alegerea momentului naşterii cu cel mai bun prognostic neonatal previzibil. Prematuritatea iatrogenă creşte semnificativ mortalitatea şi morbiditatea asociate acestor cazuri, vârsta gestaţională la naştere fiind un foarte important predictor al prognosticului neonatal; jumătate dintre decesele fetale perinatale inexplicabile la termen au drept cauză restricţia de creştere intrauterină nediagnosticată(1,2). În contextul restricţiei de creştere, mortalitatea fetală in utero creşte de 20 de ori. Mortalitatea perinatală a copiilor sub 1500 g este de 70 de ori mai mare. Restricţia de creştere se asociază, de asemenea, cu un prognostic nefavorabil pe termen lung, din punctul de vedere al dezvoltării neurologice şi cognitive(3), cardiovasculare şi metabolice(4), expunerea cronică la mediul intrauterin ostil alterând programarea dezvoltării fetale. Descrisă în 1963 de Lubchenco, restricţia de creştere intrauterină a fost corelată încă de atunci cu riscul crescut de a dezvolta evenimente neprevăzute pe parcursul vieţii(5).
Ultrasonografia prenatală este metoda imagistică de elecţie în diagnosticul, monitorizarea şi managementul cazurilor cu restricţie fetală de creştere. Studiile Doppler ale ultimilor 10 ani stau la baza progreselor realizate în profilaxia, clasificarea şi standardizarea monitorizării expectativei şi în îmbunătăţirea prognosticului perinatal şi pe termen lung.
În mod clasic, restricţia de creştere intrauterină este definită de diferenţa semnificativă între unii sau între toţi parametrii biometrici fetali şi valorile lor corespunzătoare vârstei gestaţionale. Aprecierea corectă a vârstei gestaţionale grevează major diagnosticul şi poate fi element de confuzie în cazul pacientelor cu sângerare uterină anormală sau al sarcinilor nedispensarizate; variabilitatea aprecierii predictive a vârstei gestaţionale pe baza măsurătorilor ultrasonografice este de 20%, iar curbele de creştere diferă substanţial în funcţie de populaţia studiată. Având în vedere toate aceste aspecte, definirea şi managementul acestei patologii trebuie să fie ghidate de o evaluare ultrasonografică seriată, în cadrul căreia să fie analizată dinamica coroborată a numeroşi parametri: studii Doppler în teritoriul matern (artere uterine) şi fetal (arteră ombilicală, arteră cerebrală medie, duct venos, istm aortic, venă ombilicală), biometrie şi scor biofizic fetal.
Definiţie şi clasificări
Fără a exista până în prezent un diagnostic gold standard, restricţia de creştere intrauterină (IUGR) este clasic definită de greutatea estimativă la naştere sub percentila 10 a curbei de creştere specifică populaţiei, corespunzătoare vârstei gestaţionale date; utilizând acest cutoff, aproximativ 10% din populaţia obstetricală ar trebui încadrată în această patologie. Severitatea restricţiei este cuantificată prin utilizarea ca repere comparative a percentilelor 5 şi 3 ale valorilor de referinţă specifice populaţiei şi vârstei de gestaţie.
De asemenea, definitorie pentru această condiţie este imposibilitatea fătului de a-şi atinge potenţialul de creştere corespunzător vârstei gestaţionale, din cauza unuia sau mai multor factori determinanţi ai disfuncţiei placentare(6-8).
Europa foloseşte drept criteriu de definire a IUGR scăderea cu peste două deviaţii standard a greutăţii estimate la naştere, ceea ce reprezintă 5% din numărul total de nou-născuţi. În realitate, doar a treia parte dintre copiii cu greutate sub 2500 g la naştere constituie reale restricţii de creştere, cu variaţii largi între ţările dezvoltate (cu prevalenţă de 4-7%) şi cele în curs de dezvoltare, în care IUGR poate atinge până la 30%(9).
Termenul „small for gestational age” descrie populaţia fetală a cărei greutate se află sub percentila 10, fără referire la cauză; astfel, această categorie cuprinde două entităţi dificil de diferenţiat: restricţia de creştere şi greutatea mică constituţională, care reprezintă aproximativ 70% dintre copiii cu greutate mică, ce reflectă particularităţile materne ale etnicităţii, parităţii şi indicelui de masă corporală(10). Printre caracteristicile care susţin o creştere necorespunzătoare de cauză constituţională se numără greutatea aflată între percentilele 5 şi 10, valori normale ale velocitometriei Doppler pe parcursul sarcinii, dezvoltare normală cu creştere proporţională pe tot parcursul sarcinii, valoarea circumferinţei abdominale aflată constant peste valoarea celei mai mici percentile şi dimensiunile fătului concordante cu caracteristicile materne(11).
Utilizând cutoff-ul percentilei 10, studiile au arătat că, alături de includerea excesivă fals-pozitivă în grupul restricţiei de creştere a unui număr mare de feţi mici constituţionali, are loc o subdiagnosticare a restricţiilor reale situate peste percentila 10, a căror creştere în dinamică este restricţionată faţă de potenţialul adecvat, dar care nu au atins încă pragul diagnostic, însă care au un risc crescut din punctul de vedere al prognosticului perinatal(12).
Utilizând criterii diferite, restricţia de creştere intrauterină cunoaşte o serie de clasificări:
- O clasificare a restricţiei de creştere intrauterină are la bază creşterea simetrică sau asimetrică. Astfel, feţii cu IUGR simetrică au dimensiuni proporţionale mici ale capului şi abdomenului, cauza acestei forme de restricţie fiind frecvent reprezentată de factorii intrinseci (infecţii congenitale sau anomalii cromozomiale) şi având de obicei debut în sarcina incipientă(13). IUGR asimetrică reprezintă aproximativ 70-80% dintre cazuri şi se caracterizează prin scăderea disproporţionată a circumferinţei abdominale, această formă având frecvent debutul la sfârşitul trimestrului al doilea sau în trimestrul al treilea, iar cauza dominantă fiind insuficienţa placentară(13). Dat fiind faptul că disfuncţia placentară survenită precoce în sarcină conduce în final la un pattern simetric al deficitului de creştere fetal, această clasificare şi-a pierdut în ultima vreme utilitatea clinică.
- Tot mai acut este discutat, astăzi, conceptul etiopatogenic diferit al restricţiilor de creştere precoce şi tardivă, care au drept cutoff vârsta de 32-34 de săptămâni, caracteristici fenotipice distinctive clare din punctul de vedere al severităţii, asocierii cu preeclampsia şi istoriei naturale a deteriorării fetale. IUGR precoce reprezintă 20-30% din numărul total de cazuri(14), are o prevalenţă de 1-2% şi asociază preeclampsie la peste 50% dintre paciente(14), insuficienţă placentară severă şi hipoxie fetală cronică cu fenomene de adaptare cardiovasculară sistemică evidente, a cărei deteriorare survine rapid, în câteva săptămâni. Caracteristice sunt anomaliile de flux pe arterele uterine(15), hipoxia şi acidoza fetală fiind relevate prin creşterea indicelui de pulsatilitate pe artera ombilicală şi prezenţa anomaliilor de flux pe ductul venos, pe baza căruia decompensarea este optim monitorizată. Rezultatul final este frecvent reprezentat de moartea fetală intrauterină, managementul acestor cazuri fiind deosebit de complex în alegerea momentului optim de extragere a fătului, evaluând riscurile continuării sarcinii în raport cu riscurile complicaţiilor prematurităţii(16). IUGR cu debut tardiv reprezintă 70-80% dintre cazuri(14), afectarea placentară este uşoară, asocierea cu preeclampsia este rară, motiv pentru care Dopplerul pe arterele uterine este normal aproape întotdeauna, dar există o înaltă asociere cu alterarea raportului cerebro-placentar(17). Modificarea fluxului ductului venos nu apare aproape niciodată. Chiar dacă, în comparaţie cu restricţia de creştere intrauterină cu debut precoce, cea cu debut tardiv este considerată a fi benignă, anterior travaliului se poate produce o deteriorare acută, rapidă, care contribuie major la prevalenţa mortalităţii fetale prenatale(18).
- Din punct de vedere neonatologic, clasificarea nou-născuţilor în normoponderali, cu greutate mică/foarte mică/extrem de mică la naştere, având drept cutoff-uri definitorii 2500 g/1500 g/1000 g, rămâne în actualitate. Tendinţa de renunţare la termenul de „dismaturitate” devine tot mai evidentă, restricţia de creştere neonatală diagnosticată la naştere necesitând a fi corelată cu cea intrauterină şi cu un pattern evolutiv specific ulterior.
În septembrie 2016, Gordjin şi colaboratorii au publicat în Ultrasound in Obstetrics and Gynecology consensul experţilor de definire a restricţiei de creştere intrauterină pe baza procedurii Delphi(19). Conform opiniei majoritare, restricţia precoce de creştere intrauterină este cea instalată sub 32 de săptămâni vârstă gestaţională (VG) şi are trei parametri definitorii: măsurarea circumferinţei abdominale (AC), estimarea greutăţii fetale (EFW) şi indicele de pulsatilitate (PI) al arterei ombilicale (UA). Pentru definirea restricţiei tardive de creştere, doi parametri sunt foarte importanţi: estimarea AC şi EFW. Criteriile diagnostice se aplică exclusiv în absenţa malformaţiilor congenitale. Cutoff-ul măsurătorilor biometrice este percentila 3. În plus, au fost introduşi parametri funcţionali cu status unic definitor (flux end-diastolic absent pe artera ombilicală UA-AEDF) sau complementar (indicele de pulsatilitate pe artera ombilicală UA-PI >percentila 95, indicele de pulsatilitate pe artera uterină UtA-PI >percentila 95 sau raport cerebro-placentar CPR <percentila 5). Definiţiile consensuale ale restricţiilor de creştere precoce şi tardive sunt sistematizate în tabelul 1.

Etiopatogenie
Creşterea intrauterină este dirijată de factori materni, placentari, fetali şi externi, combinaţi cu potenţialul de creştere determinat genetic(20). Implantarea cu succes a unui embrion normal din punct de vedere genetic cu o placentaţie normală într-un organism matern sănătos va avea ca rezultat cel mai probabil naşterea unui făt sănătos; afectarea oricăruia dintre aceşti factori influenţează în mod negativ prognosticul unei sarcini. Astfel, patogeneza restricţiei de creştere intrauterină se dovedeşte a fi multifactorială, iar calificarea factorului etiologic şi identificarea unei patologii de substrat reprezintă paşi esenţiali în managementul cazurilor grevate de această condiţie. Principalii factori fetali sunt reprezentaţi de anomaliile cromozomiale sau structurale, de sarcina multiplă şi de infecţii, inclusiv cea cu virusul varicelo-zosterian şi, mai nou, cu virusul ZIKA. Afecţiunile materne frecvente care determină restricţie de creştere intrauterină sunt boala cronică renală, hipertensiunea, bolile vasculare de colagen, trombofilia şi condiţiile de mediu cu efect negativ asupra sarcinii, cum ar fi fumatul, malnutriţia sau consumul de droguri. Multe dintre cauzele fetale sunt decelabile ecografic, totuşi insuficienţa utero-placentară reprezintă factorul etiopatogenic dominant care afectează semnificativ morbiditatea şi mortalitatea feţilor cu restricţie de creştere intrauterină(21).
Creşterea fetală intrauterină este dependentă de pasajul placentar al nutrienţilor din circulaţia maternă, ceea ce necesită un transport transplacentar bidirecţional normal şi o perfuzie ombilicală normală. Furnizarea de nutrienţi şi oxigen către făt este dependentă de perfuzia uterină, zona de schimb fetoplacentară şi de afinitatea crescută a hemoglobinei pentru oxigen(22). Orice schimbare a acestor componente se reflectă în rata de creştere intrauterină; schimbări importante ale morfologiei placentei, cum ar fi greutatea placentară, raportul feto-placentar, tipul de inserţie placentară a cordonului ombilical, particularităţile şi anomaliile de cordon, anomaliile structurale şi de origine inflamatoare ale placentei sau dezlipirea acesteia, constituie factori care au fost asociaţi cu restricţia de creştere intrauterină(23,24). Totuşi, evenimentele enumerate au o frecvenţă de apariţie mică, ceea ce face insuficientă explicarea majorităţii cazurilor de restricţie de creştere intrauterină.
Reflectarea ultrasonografică a adaptării fetale la hipoxie continuă să rămână în actualitate din 2003, când a fost descrisă de Baschat. Disfuncţia placentară este obiectivată ecografic prin velocitometrie Doppler anormală a arterelor uterine sau prin persistenţa notch-ului după 24 de săptămâni, ceea ce indică un flux cu rezistenţă crescută în compartimentul matern al placentei. Disfuncţia compartimentului fetal este reflectată prin creşterea rezistenţei la flux ombilical(25). Fluxul ombilical diastolic absent sau fluxul end-diastolic inversat apare atunci când 60-70% din patul vascular vilos este afectat(26). Rezistenţa crescută în patul placentar se reflectă în creşterea impedanţei la nivelul aortei descendente toracice; particularităţile circulaţiei fetale „în paralel” stau la baza redistribuţiei debitului cardiac către teritoriul cardiac şi cerebral (brain sparing effect), obiectivată prin fluxul diastolic inversat în istmul aortic şi prin scăderea impedanţei la flux pe artera cerebrală medie. Scăderea raportului cerebroplacentar stabilit între circulaţia cerebrală şi aorta descendentă toracică sau artera ombilicală reliefează centralizarea circulaţiei în stadiul în care celelalte modificări Doppler sunt subtile. Perfuzia miocardică preferenţială se însoţeşte de creşterea irigării adrenalelor, splinei şi ficatului, în paralel cu scăderea fluxului către intestin, plămâni şi rinichi. Afectarea perfuziei feto-placentare se reflectă şi în scăderea întoarcerii venoase şi a volumului venos ombilical care precedă instalarea întârzierii de creştere.
Răspunsul biofizic fetal la insuficienţa placentară care determină hipoxemie cronică constă în întârzierea debutului comportamentului organizat şi diminuarea răspunsului la stimuli. Scăderea variabilelor comportamentale are loc în paralel cu întârzierea maturării integrării la nivel central a controlului frecvenţei cardiace, ceea ce determină o frecvenţă bazală crescută şi o scădere a variabilităţii pe termen scurt şi lung. Hipoxemia progresivă are ca urmare scăderea indexului lichidului amniotic, a respiraţiei fetale, a mişcărilor grosiere, a tonusului fetal şi a variabilităţii cordului fetal. În timp ce afectarea dezvoltării fetale poate fi obiectivată prin anomaliile Doppler ale circulaţiilor placentară, arterială şi venoasă fetale, hipoxemia şi acidemia sunt reflectate doar de declinul biofizic care progresează spre deceleraţii tardive şi dispariţia variabilităţii pe termen scurt.
Management
Managementul sarcinilor cu restricţie de creştere intrauterină include evaluare ecografică seriată, implicit velocitometrie Doppler, monitorizarea creşterii fetale şi evaluarea statusului fetal pe baza scorului biofizic. Scopul unui management corect este identificarea feţilor cu risc înalt de deces in utero şi aprecierea riscului de mortalitate şi morbiditate neonatală a celor cu indicaţie de naştere prematură.
Esenţiale sunt analiza Dopplerului pe artera ombilicală, a cărei undă diastolică absentă sau inversată precede cu o săptămână deteriorarea fetală acută(27), şi Dopplerul pe ductul venos care precede alterarea variabilităţii pe termen scurt şi a profilului biofizic cu 48-72 de ore, la care se pot adăuga Dopplerul pe istmul aortic, artera cerebrală medie, oligoamniosul şi, în final, alterarea scorului biofizic fetal(28). Dopplerul pe artera ombilicală este unicul element de diagnostic şi prognostic în managementul restricţiei de creştere intrauterină. Monitorizarea pe baza lui a sarcinilor cu risc înalt s-a dovedit a îmbunătăţi prognosticul perinatal şi a reduce cu 29% mortalitatea perinatală în cazul sarcinilor evaluate sistematic(29).
Studiul prospectiv PORTO(30) confirmă cele menţionate mai sus. Primele semne de insuficienţă placentară sunt observate ecografic când 30% din vascularizaţia viloasă este funcţional alterată; fluxul end-diastolic al arterei ombilicale absent sau inversat este asociat prognosticului nefavorabil prin compromiterea a peste 2/3 din circulaţia placentară, cu sensibilitate şi specificitate de 60%, ceea ce justifică extragerea unui făt cu vârsta gestaţională peste 30 de săptămâni al cărui risc de moarte intrauterină depăşeşte riscurile consecutive prematurităţii(31). Măsurarea velocitometriei Doppler se recomandă a se face la un interval de două săptămâni dacă greutatea fătului este peste percentila 5, fără alţi factori de risc, alterarea indexului de pulsatilitate impunând monitorizare săptămânală.
Prin redistribuţie către organele vitale, indexul de pulsatilitate al arterei cerebrale medii creşte. Dopplerul la acest nivel este considerat o manifestare tardivă cu specificitate acceptabilă, dar sensibilitate redusă, îmbunătăţită de utilizarea sa în cadrul raportului cerebro-placentar, care reflectă concomitenţa creşterii impedanţei placentare cu scăderea rezistenţei cerebrale. Valoarea lui rezidă din identificarea şi predicţia prognosticului nefavorabil în cazurile de restricţie de creştere cu debut tardiv, în care Dopplerul pe artera ombilicală este cel mai adesea normal; modificarea acestui parametru creşte de şase ori riscul cezarienei de urgenţă pentru suferinţă fetală acută(32), iar dezvoltarea neurocomportamentală a acestor copii la vârsta de 2 ani este afectată(33). În continuarea degradării fetale, indexul arterei cerebrale medii se normalizează sau creşte anormal, acesta fiind rezultatul pierderii redistribuţiei adaptative către organele vitale. Este interesant faptul că alterarea raportului este predictivă pentru subdezvoltarea neurocomportamentală la 18 luni postnatal, inclusiv în populaţia generală(34).
Dopplerul ductului venos este cel mai important element de predicţie a riscului iminent de deces fetal în restricţia de creştere cu debut precoce. Absenţa sau inversarea fluxului pe parcursul contracţiei atriale are semnificaţia unui risc de 40-100% de mortalitate perinatală, fapt ce justifică extragerea urgentă a fătului după efectuarea curei corticoide, indiferent de vârsta gestaţională, supravieţuirea la o săptămână fiind puţin probabilă(35). Trialul european TRUFFLE a demonstrat lipsa beneficiului neonatal imediat în caz de amânare a naşterii până la valori anormale ale ductului venos, singurul beneficiu constând în dezvoltarea neuropsihică superioară la vârsta de 2 ani(36).
Anomaliile Dopplerului pe istmul aortei sunt asociate cu creşterea mortalităţii fetale şi a morbidităţii neurologice a cazurilor de restricţie de creştere precoce şi a unora dintre cele cu instalare tardivă; inversarea fluxului are semnificaţia deteriorării avansate, precedând cu o săptămână modificarea velocitometriei ductului venos. Includerea acestui parametru de insuficienţă placentară severă în protocoalele clinice ar putea justifica naşterea electivă după 34 de săptămâni de gestaţie.
Testul de non-stres are o rată de fals-pozitiv de 50%, nu şi-a demonstrat eficacitatea în reducerea mortalităţii perinatale(37) şi semnalizează prin deceleraţii un stadiu mult prea tardiv al suferinţei fetale.
Pierderea variabilităţii pe termen scurt se corelează cu acidoza şi hipoxia severă, poate avea semnificaţia unui marker acut, dar în 50% dintre cazuri este precedată de modificarea ductului venos. Alterarea profilului biofizic se corelează cu acidoza, cu mortalitatea perinatală şi cu riscul paraliziei cerebrale(38), la o rată de fals-pozitiv similară cardiotocografiei. Totuşi, studiile observaţionale au raportat o scădere a ratei mortalităţii fetale în sarcinile urmărite prin test de non-stres şi profil biofizic faţă de cele fără monitorizare fetală sau total neinvestigate.
Pe baza acestor markeri, Gratacos şi colab.(39) au elaborat în 2014 managementul celor patru stadii ale IUGR, în care deteriorarea statusului fetal, care începe din stadiul II, poate impune naşterea înainte de 37 de săptămâni (tabelul 2).
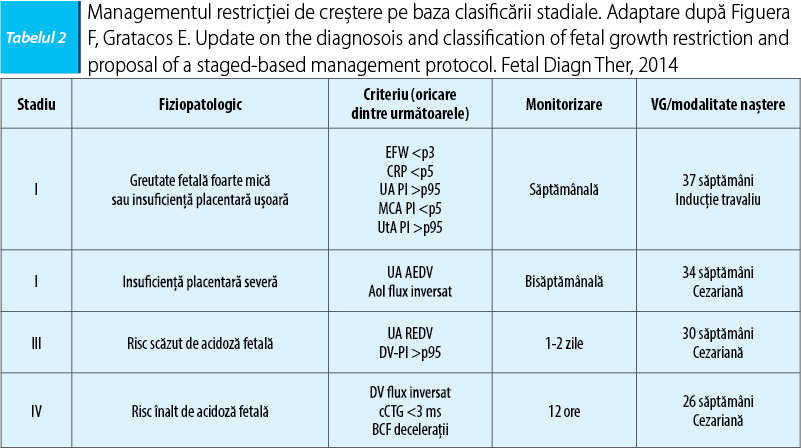
Fluxul diastolic absent pe artera ombilicală (UA AEDV) sau inversat pe istm necesită monitorizare la 2-3 zile, poate dura 2-4 săptămâni şi impune naşterea nu mai târziu de săptămâna a 34-a. Inversarea fluxului diastolic pe artera ombilicală (UA REDV) şi creşterea indexului de pulsatilitate pe duct peste percentila 95 descrie o condiţie severă care caracterizează stadiul III, impune monitorizarea zilnică a celor 10 zile până la deteriorare şi extragere electivă între 28-32 de săptămâni, în medie în jurul săptămânii a 30-a. Dacă naşterea nu survine şi are loc intrarea în stadiul terminal, moartea intrauterină va surveni în 4-7 zile de la inversarea fazei atriale a ductului venos care apare aproape simultan cu dispariţia variabilităţii pe cardiotocografie. Apoi scorul biofizic va scădea sub 6, pentru ca, după 1-2 zile, în decurs de ore, să apară deceleraţiile. O teorie integrativă similară a fost publicată în februarie 2004 de Baaschat A. şi colaboratorii(40).
Este ideal ca modificările Doppler definitorii stadiului să fie reconfirmate la interval de 12 ore. Intervalele recomandate de monitorizare sunt valabile în absenţa preeclampsiei severe, care impune monitorizare fetală permanentă, indiferent de stadiu. Pragul de 26 de săptămâni a fost ales în raport cu datele din literatură care raportează, pentru această vârstă gestaţională, 50% supravieţuire neafectată; decizia trebuie să fie în acord cu dorinţa informată a părinţilor şi cu performanţele terapiei intensive neonatale locale.
În contextul restricţiei diagnosticate de creştere intrauterină se recomandă profilaxia maturării pulmonare cu corticosteroizi între 24 şi 34 de săptămâni de gestaţie, dovedită a fi eficientă. Decizia naşterii va fi luată având în vedere severitatea restricţiei de creştere intrauterină, valorile Doppler, patologiile asociate, statusul fetal şi evoluţia nefavorabilă a acestuia. Chiar dacă, pe parcursul timpului, multiple studii au vizat prevenţia restricţiei de creştere intrauterină prin acţiuni asupra mamei, nu a fost demonstrată până în prezent eficienţa niciunui tratament.
Studiile efectuate asupra restricţiei de creştere intrauterină nu indică monitorizarea obligatorie în spital a acestor sarcini, totuşi Lausman şi colaboratorii(41) consideră spitalizarea a fi necesară pentru cazurile selectate care impun evaluare zilnică maternă şi fetală, în absenţa datelor care să certifice un prognostic mai bun al cazurilor spitalizate. În aceste condiţii, alături de studiul Doppler şi biometrie, este recomandată măsurarea săptămânală a indexului lichidului amniotic care precede deteriorarea acută fetală cu o săptămână în 20-30% dintre cazuri.
Prognosticul perinatal include decesul intrauterin sau neonatal, morbiditate neonatală şi dezvoltare neuropsihică alterată. Prognosticul matern include un posibil risc pe termen lung de dezvoltare a bolii cardiace ischemice. Conform unui studiu prospectiv naţional efectuat în Norvegia, rata de recurenţă a restricţiei de creştere intrauterină la o sarcină următoare este de 23%(42).
Bibliografie
2. M. Ross, Beall M., Adult sequelae of intrauterine growth restriction. Semin Perinatol, 2009;32 (3):213–8.
3. Meher S, Hernandez-Andrade E, Basheer SN, Lees C. Impact of cerebral redistribution on neurodevelopmental outcome in small-for-gestational-age or growth-restricted babies: a systematic review. Ultrasound Obstet Gynecol 2015;46:398–404.
4. Jaddoe VW, de Jonge LL, Hofman A, Franco OH, Steegers EA, Gaillard R. First trimester fetal growth restriction and cardiovascular risk factors in school age children: population based cohort study. BMJ, 2014; 348:g14.
5. Lubchenco LO, Hansman C, Dressler M, Boyd E. Intrauterine growth as estimated from live born birth-weight data at 24–42 weeks of gestation.Pediatrics, 1963,32:793.
6. Mifsud W, Sebire NJ. Placental pathology in early-onset and late-onset fetal growth restriction. Fetal Diagn Ther 2014; 36:117–28.
7. Kingdom J, Huppertz B, Seaward G, Kaufmann P. Development of the placental villous tree and its consequences for fetal growth. Eur J Obstet Gynecol Reprod Biol 2000; 92:35–43.
8. Salafia CM, Charles AK, Maas EM. Placental and fetal growth restriction. Clin Obstet Gynecol 2006; 49:236–56.
9. Bianchi DW, Crombleholme TM, D’Alton ME, Malone FD. Intrauterine Growth Restriction. In: Fetology: Diagnosis and Management of the Fetal Patient, Sec ed, McGraw-Hill Professional, NY, 2010:857-65.
10. Lin CC, Santolaya-Forgas J. Current concepts of fetal growth restriction. Part I. Causses, classification, and pathophysiology. Obstet Ginecol, 1998;92:1044-55.
11. Buck Louis GM, Grewal J, Albert PS, et al. Racial/ethnic standards for fetal growth: the NICHD Fetal Growth Studies. Am J Obstet Gynecol 2015; 213:449.e1.
12. Vasak B, Koenen SV, Koster MP, Hukkelhoven CW, Franx A, Hanson MA, Visser GH. Human fetal growth is constrained below optimal for perinatal survival. Ultrasound Obstet Gynecol 2015; 45: 162–7.
13. Anderson MS, Hay WW. Intrauterine growth restriction and the small-for-gestational-age infant. In: Neonatology Pathophysiology and Management of the Newborn, 5th ed, Avery GB, Fletcher MA, MacDonald MG (Eds), Lippincott Williams and Wilkins, Philadelphia 1999:411.
14. Crovetto F, et al. Performance of first-trimester integrated screening for early and late small for gestational age newborns. Ultrasound Obstet Gynecol 2013 (E-pub ahead of print).
15. Turan OM, et al. Progression of Doppler abnormalities in intrauterine growth restriction. Ultrasound Obstet Gynecol, 2008;32:160-7.
16. Baschat AA, et al: Predictors of neonatal outcome in early-onset placental dysfunction. Obstet Gynecol, 2007;109:253-61.
17. Oros D, et al: Longitudinal changes in uterine, umbilical and fetal cerebral Doppler indices in late-onset small-for-gestational age fetuses. Ultrasound Obstet Gynecol 2011;37:191-5.
18. Kady S, Gardosi J. Perinatal mortality and fetal growth restriction. Best Pract Res Clin Obstet Gynaecol, 2004;18:397-410.
19. Gordjin SJ, Beune IM, Thilaganathan B, Papageorghiou A et al. Consensus definition of fetal growth restriction: a Delphi procedure, Ultrasound Obstet Gynecol, 2016;48(3):333-9.
20. Gardosi J., Chang A., Kalyan B., et al. Customised antenatal growth charts. Lancet, 1992;339: 283–7.
21. Bernstein IM, Horbar JD, Badger GJ, et al. Morbidity and mortality among very-low-birth-weight neonates with intrauterine growth restriction. Am J Obstet Gynecol, 2000; 182(1):198-206.
22. Meschia G. Placenta respiratory gas exchange and fetal oxygenation. In: R.K. Creasy, R. Resnik (Eds.), Maternal Fetal medicine: Principles and Practice, 1987, ed 1:274–85.
23. Pardi G, Marconi AM, Cetin I. Placental–fetal interrelationship in IUGR fetuses. A review. Placenta, 2002;23(Suppl A):136–41.
24. Salafia CM., Vintzileos A. Placental pathology of idiopathic intrauterine growth retardation at term. Am J Perinatol, 1992;9(3):179–84.
25. Rigano S, Bozzo M, Ferrazzi E. et al. Early and persistent reduction in umbilical vein blood flow in the growth-restricted fetus: a longitudinal study. Am J Obstet Gynecol, 2001(185):834–8.
26. Morrow RJ, Adamson SL, Bull SB, et al. Effect of placental embolization on the umbilical arterial velocity waveform in fetal sheep. Am J Obstet Gynecol, 1989(161):1055–60.
27. Ferrazzi E, et al. Temporal sequence of abnormal Doppler changes in the peripheral and central circulatory systems of the severely growth-restricted fetus. Ultrasound Obstet Gynecol 2002;19:140–6..
28. Turan OM, Turan S, Gungor S, et al. Progression of Doppler abnormalities in intrauterine growth restriction. Ultrasound Obstet Gynecol, 2008;32:160.
29. Alfirevic Z, Stampalija T, Gyte GM. Fetal and umbilical Doppler ultrasound in high-risk pregnancies. Cochrane Database Syst Rev 2013;CD007529.
30. O’Dwyer V, Burke G, Unterscheider J, et al. Defining the residual risk of adverse perinatal outcome in growth-restricted fetuses with normal umbilical artery blood flow. Am J Obstet Gynecol, 2014;211:420.e1.
31. Vasconcelos RP, Brazil Frota Aragão JR, Costa Carvalho FH, et al. Differences in neonatal outcome in fetuses with absent versus reverse end-diastolic flow in umbilical artery Doppler. Fetal Diagn Ther, 2010;28:160.
32. Cruz-Martinez R, et al. Fetal brain Doppler to predict cesarean delivery for non-reassuring fetal status in term small-for-gestational-age fetuses. Obstet Gynecol, 2011;117:618–26.
33. Oros D, et al. Middle versus anterior cerebral artery Doppler for the prediction of perinatal outcome and neonatal neurobehavior in term small-for-gestational-age fetuses with normal umbilical artery Doppler. Ultrasound Obstet Gynecol, 2010;35:456–61.
34. Roza SJ, et al: What is spared by fetal brain-sparing? Fetal circulatory redistribution and behavioral problems in the general population. Am J Epidemiol, 2008;168:1145–52.
35. Turan OM, Turan S, Berg C, et al. Duration of persistent abnormal ductus venosus flow and its impact on perinatal outcome in fetal growth restriction. Ultrasound Obstet Gynecol, 2011;38:295.
36. Bahado-Singh RO, Kovanci E, Jeffres A, et al. The Doppler cerebroplacental ratio and perinatal outcome in intrauterine growth restriction. Am J Obstet Gynecol, 1999;180:750.
37. Pattison N, McCowan L: Cardiotocography for antepartum fetal assessment. Cochrane Database Syst Rev, 2000:CD001068.
38. Manning FA, et al. Fetal assessment based on fetal biophysical profile scoring. VIII. The incidence of cerebral palsy in tested and untested perinates. Am J Obstet Gynecol, 1998;178: 696–706.
39. Figuera F, Gratacos E. Update on the diagnosois and classification of fetal growth restriction and proposal of a staged-based management protocol. Fetal Diagn Ther, 2014;36:86-98.
40. Baschat A. Hecher K. Fetal growth restriction due to placental disease, Seminars in Perinatology. 2004;28(1):67–80.
41. Lausman A, McCarthy FP, Walker M, Kingdom J. Screening, diagnosis, and management of intrauterine growth restriction. J Obstet Gynaecol Can, 2012;34:17.
42. Voskamp BJ, Kazemier BM, Ravelli AC, et al. Recurrence of small-for-gestational-age pregnancy: analysis of first and subsequent singleton pregnancies in The Netherlands. Am J Obstet Gynecol, 2013; 208:374.e1.
Articole din ediţiile anterioare
Modificări metabolice şi structurale descoperite prin rezonanţă magnetică la feţii cu restricţie de creştere intrauterină
Restricţia de creştere intrauterină (RCIU) afectează 5-10% dintre sarcini şi include tulburări cognitive la copii într-o proporţie substanţială, as...
Diabetul şi hipertensiunea arterială gestaţională - impactul asupra nou-născuţilor
Diabetul gestaţional este o complicaţie frecventă în ultimii ani, asociată cu greutate excesivă sau obezitate. Pe de altă parte, hipertensiunea ge...