Abordarea terapeutică a uretritelor persistente sau recurente
Therapeutic management of persistent or recurrent urethritis
Abstract
Sexually transmitted diseases represent a public health problem with extremely diverse clinical, social and economic implications, which is often underestimated by both doctors and patients. The increasing incidence of persistent or recurrent urethritis might be explained by the emergence of microorganisms resistant to the latest treatments available. In this review we aim to provide a general overview of the therapeutic management of persistent and recurrent urethritis, according to the most recent international recommendations.Keywords
recurrent urethritispersistent urethritisantibiotic resistanceRezumat
Bolile transmisibile sexual reprezintă o problemă de sănătate publică cu implicaţii extrem de variate, clinice, sociale şi economice, a căror amploare este adesea subestimată atât de medici, cât şi de pacienţi. Incidenţa în creştere a uretritelor persistente sau recurente ar putea fi explicată prin emergenţa microorganismelor rezistente la ultimele tratamente disponibile. Această lucrare oferă o perspectivă asupra abordării terapeutice a uretritelor persistente sau recurente, conform celor mai recente recomandări internaţionale.Cuvinte Cheie
uretrită recurentăuretrită persistentărezistenţă la antibioticeIntroducere
Bolile transmisibile sexual reprezintă o problemă de sănătate publică cu implicaţii extrem de variate, clinice, sociale şi economice, a căror amploare este adesea subestimată atât de medici, cât şi de pacienţi. Aceste afecţiuni pot genera complicaţii medicale dificil de gestionat, facilitează transmiterea infecţiei cu virusul imunodeficienţei umane (HIV) şi au un impact psihologic major asupra pacienţilor şi familiilor lor.
Incidenţa infecţiilor transmisibile sexual continuă să rămână ridicată, în ciuda eforturilor de educare a populaţiei şi de îmbunătăţire a programelor de screening, fapt cu atât mai îngrijorător cu cât procentul infecţiilor rezistente la tratamentele standard este în creştere. Ţinând cont de aceste aspecte, ghidurile de diagnostic şi tratament emise de organizaţiile care se ocupă de controlul şi prevenţia bolilor transmisibile sexual sunt actualizate periodic. Recomandările acestora sunt însă menite a orienta practica medicală şi nu trebuie să constituie standarde absolute de prescripţie. Sunt esenţiale evaluarea particularităţilor clinice ale fiecărui pacient, dar şi contextul local de prevalenţă şi sensibilitate la medicamente a infecţiei.
Scopurile tratamentului bolilor transmisibile sexual sunt eradicarea microbiologică, obţinerea remisiunii clinice, prevenirea sechelelor şi prevenirea transmiterii infecţiei(1).
Strategiile de prevenţie a bolilor transmisibile sexual se bazează pe educarea persoanelor la risc asupra modalităţilor de prevenţie a acestor infecţii, vaccinare pentru virusul papiloma uman (HPV) şi virusul hepatitei B (VHB), profilaxie postexpunere, screeningul infecţiilor transmisibile sexual în rândul persoanelor asimptomatice, diagnosticarea şi tratarea persoanelor infectate şi a partenerilor lor, precum şi repetarea testării pacienţilor în vederea confirmării vindecării infecţiei(1). De importanţă majoră este screeningul femeilor însărcinate pentru infecţii transmisibile sexual, care trebuie practicat la prima vizită prenatală, la 28 de săptămâni şi la naştere la pacientele la risc (consumatoare de droguri, pacientele cu antecedente personale de boli transmisibile sexual sau parteneri diagnosticaţi cu astfel de infecţii în prezent sau în antecedente, pacientele cu parteneri sexuali multipli sau care trăiesc în zone cu prevalenţă crescută a infecţiilor transmisibile sexual)(1).
Uretritele sunt afecţiuni caracterizate prin inflamaţia uretrală, care poate avea etiologie infecţioasă sau neinfecţioasă. Uretritele acute se manifestă clinic prin secreţie uretrală seroasă, mucopurulentă sau purulentă, rareori hemoragică în cantitate variată (de la „picătura matinală” până la secreţie abundentă), eritem şi edem perimeatal, însoţite de disurie sau prurit. Pe măsură ce boala evoluează, semnele şi simptomele scad în intensitate. Netratată, infecţia ascensionează şi poate induce o serie largă de complicaţii locale şi regionale. La bărbaţi, complicaţiile locale sunt reprezentate de tysonita, inflamaţia ductelor parauretrale, a glandelor Littre şi Morgagni, a glandelor Cowper, abcese periuretrale, strictură uretrală, fimoză sau parafimoză inflamatorie. Complicaţiile regionale constau în prostatită, veziculită şi epididimită, aceasta din urmă putând duce la infertilitate. Rar, pot apărea complicaţii la distanţă, produse prin diseminare hematogenă (artrită, endocardită, perihepatită, septicemie). Femeile pot dezvolta bartholinită, vulvovaginită, cervicită şi au risc crescut de boală inflamatorie pelviană şi infertilitate.
Din punct de vedere etiologic, uretritele se clasifică în uretrite gonococice, uretrite negonococice (UNG) şi uretrite nespecifice, în care nu pot fi izolaţi germenii implicaţi. Frecvent însă, uretrita este polimicrobiană, infecţia cu Neisseria gonorrhoeae coexistând cu infecţia cu Chlamydia trachomatis, Mycoplasma genitalium sau cu alţi germeni. C. trachomatis este responsabilă de 15-40% din UNG, iar M. genitalium, de 15-25% dintre acestea(1). Alte specii de Mycoplasma şi Ureaplasma pot fi implicate, dar analizele de laborator, inclusiv testele de amplificare a acizilor nucleici (NAAT), nu pot diferenţia portajul asimptomatic de boală, cu stabilirea unei relaţii de cauzalitate între microorganism şi manifestările clinice. Infecţia cu Ureaplasma spp. este întâlnită în general la indivizi asimptomatici, iar relaţia infecţiei U. urealyticum cu UNG nu a putut fi dovedită(2). Mai mult, majoritatea studiilor au utilizat ca metodă de diagnostic cultura, care nu poate diferenţia între infecţia cu U. urealyticum şi cea cu U. parvum. Se estimează că aproximativ 1% din UNG sunt cauzate de Trichomonas vaginalis(1). Bacteriile asociate vaginozei bacteriene şi Candida spp. pot fi rar cauza UNG(3). Virusul herpes simplex (VHS), virusul Epstein-Barr (EBV), citomegalovirusul (CMV) şi adenovirusul pot fi cauze ale UNG dezvoltate în urma contactului sexual oral, în timp ce bacteriile enterice reprezintă o cauză rară de UNG la bărbaţii homosexuali(1).
Importanţa UNG nespecifice nu este clară, deoarece, în general, nu determină complicaţii semnificative sau manifestări clinice la partenerii sexuali(1). Este foarte probabil ca mare parte dintre acestea să nu fie de etiologie infecţioasă(4).
Diagnosticul etiologic al uretritelor se bazează pe o serie de investigaţii. O modalitate diagnostică facilă şi rapidă este reprezentată de examinarea frotiului secreţiei uretrale colorat Gram, cu albastru de metil sau violet de genţiană. Identificarea a minimum două leucocite polimorfonucleare (PMN)/câmp (x1000) şi a diplococilor intracelulari Gram-negativi (GNID)/ având tinctorialitate pentru fucsină are utilitate diagnostică în infecţia gonococică. În situaţia în care la un pacient simptomatic frotiul este negativ sau relevă prezenţa de PMN în absenţa diplococilor intracelulari Gram-negativi (GNID) se recomandă efectuarea de NAAT. La bărbaţi, specimenul preferat este secreţia uretrală, dar pot fi testate şi urina sau probe prelevate de la nivel uretral. În cazul pacientelor este de preferat secreţia de la nivelul colului, dar se poate încerca diagnosticul şi utilizând probe recoltate de la nivel vulvovaginal.
Testul esterazei leucocitare efectuat pe probe din prima urină de dimineaţă relevă în uretrite prezenţa a minimum 10 PMN/câmp(1).
Cultura însoţită de antibiogramă este obligatorie în cazurile refractare la tratament şi este de preferat înainte de administrarea tratamentului.
Tratamentul uretritelor gonococice
Incidenţa infecţiei gonococice este în continuare ridicată, rata de incidenţă raportată în 2016 fiind de 18,8/100 000 locuitori în Europa şi de 145,8/100 000 locuitori în SUA(5,6). Afectează cu precădere adolescenţii şi adulţii tineri, cu vârste <35 ani şi este mai frecventă în rândul bărbaţilor (în 2016, raportul M/F a fost de 3,3:1 în Europa şi 2,13:1 în SUA)(5,6).
În ultimele decade, N. gonorrhoeae a dezvoltat rezistenţă la sulfonamide, peniciline, tetracicline, macrolide, fluorochinolone şi recent la cefalosporine de generaţia a treia.
În 2007, în SUA, a fost raportată rezistenţa N. gonorrhoeae la fluorochinolone, cefalosporinele rămânând astfel singura clasă de antibiotice cu eficienţă în gonoree, după unii autori(7).
În perioada 2006-2011 s-a înregistrat o creştere a concentraţiilor minime de Cefiximă necesare pentru inhibarea creşterii in vitro a N. gonorrhoeae şi au fost raportate cazuri de eşec al tratamentului gonoreei cu Cefiximă şi alte cefalosporine orale în întreaga lume(1,8,9). Prin urmare, din 2012, Cefixima nu mai reprezintă tratamentul de elecţie al infecţiei cu N. gonorrhoeae(9). În aceeaşi perioadă au fost raportate o serie de cazuri de eşec al tratamentului infecţiilor gonococice faringiene cu Ceftriaxonă(1).
Începând cu 2010 ghidurile recomandă terapia duală în gonoree, chiar dacă NAAT pentru C. trachomatis sunt negative, date fiind dovezile conform cărora terapia combinată cu antibiotice cu mecanisme de acţiune diferite poate preveni instalarea rezistenţei. Azitromicina este preferată Doxiciclinei ca al doilea agent pentru tratamentul infecţiei gonococice datorită convenienţei administrării şi prevalenţei mult mai mari a rezistenţei N. gonorrhoeae la tetracicline comparativ cu Azitromicină, mai ales printre izolatele cu concentraţii minime inhibitorii (MIC) ridicate pentru Cefiximă(8,9). Totuşi monoterapia cu Azitromicină nu este recomandată, din cauza abilităţii N. gonorrhoeae de a dezvolta rezistenţă la macrolide(10-12).
În februarie şi martie 2018 au fost raportate trei cazuri de infecţie cu N. gonorrhoeae rezistentă la Ceftriaxonă (MIC = 0,5 mg/L) şi cu rezistenţă înaltă la Azitromicină (MIC > 256 mg/L), precum şi la majoritatea alternativelor terapeutice(13,14). Unul dintre cazuri a fost diagnosticat în Marea Britanie şi alte două cazuri în Australia(13,14). Cazul diagnosticat în Marea Britanie şi unul dintre cele diagnosticate în Australia au prezentat un istoric comun de contaminare în Asia de Sud-Est(13,14).
Din nefericire, este preconizată o scădere continuă a susceptibilităţii N. gonorrhoeae la cefalosporine şi alte antibiotice(1,6). Tabelul 1 prezintă recomandările actuale de tratament al infecţiei gonococice anogenitale necomplicate, conform ghidurilor de tratament al bolilor transmisibile sexual emise de către Centrul pentru Prevenţia şi Controlul Bolilor (CDC) din SUA în 2015 şi de către Uniunea Internaţională împotriva Infecţiilor Transmisibile Sexual (IUSTI) în 2018(1,15).
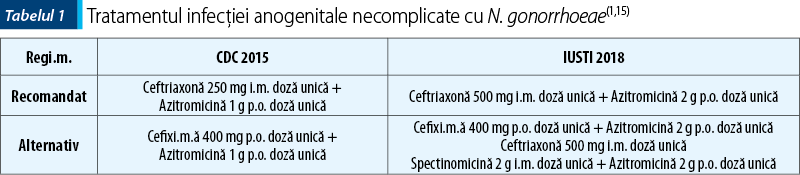
Pacienţii diagnosticaţi cu uretrită gonococică trebuie investigaţi pentru eventuala prezenţă a altor boli transmisibile sexual. Se impune tratarea partenerilor sexuali din ultimele 60 de zile sau a ultimului partener sexual, chiar dacă intervalul de la ultimul contact sexual depăşeşte 60 de zile. De asemenea, se recomandă repetarea testării la 3 luni după încheierea tratamentului, pentru verificarea vindecării infecţiei(1). Abstinenţa este indicată pe tot parcursul tratamentului şi timp de 7 zile după terminarea tratamentului tuturor partenerilor.
Recomandările pentru tratarea infecţiei anogenitale cu N. gonorrhoeae la femeile însărcinate şi la pacienţii alergici la cefalosporine sunt prezentate în tabelul 2 şi în tabelul 3.
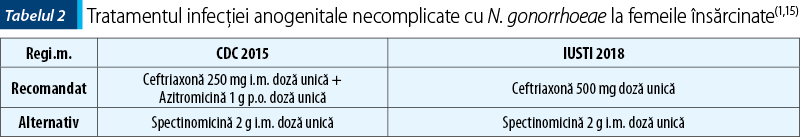
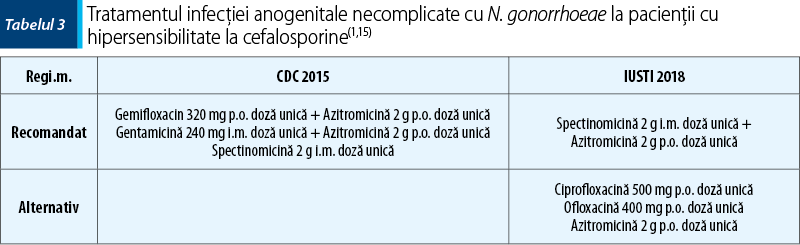
Eşecul tratamentului trebuie suspectat în cazul în care reinfecţia este exclusă şi semnele şi simptomele persistă la 3–5 zile de la iniţierea tratamentului sau testele de control sunt pozitive (cultură pozitivă la 72 de ore sau NAAT pozitiv la 7 zile după administrarea tratamentului), în absenţa unui raport sexual în această perioadă(1). O altă dovadă a ineficienţei tratamentului este obţinerea unei culturi de control pozitive, cu o antibiogramă care atestă susceptibilitate scăzută la cefalosporine(1).
În cazul în care pacientul a fost tratat iniţial cu un regim alternativ, se recomandă administrarea regimului recomandat. Dacă tratamentul iniţial a constat în regimul recomandat, o serie de alternative terapeutice sunt disponibile, cu rate de vindecare înalte. Acestea sunt reprezentate în special de cazurile în care izolatele de N. gonorrhoeae au MIC ridicate pentru cefalosporine, fiind indicată combinaţia Gemifloxacină 320 mg p.o. în doză unică + Azitromicină 2 g p.o. în doză unică sau Gentamicină 240 mg i.m. în doză unică + Azitromicină 2 g p.o. în doză unică(16). Ratele de vindecare raportate se ridică la 99,5% pentru prima combinaţie de antibiotice şi la 100% pentru cea de-a doua(16). Aceste terapii duale pot reprezenta alternative terapeutice la pacienţii alergici la cefalosporine.
Spectinomicina 2 g i.m. şi Azitromicina 2 g p.o. doză unică în monoterapie sau combinate pot fi, de asemenea, eficiente în gonoreea anogenitală necomplicată. Monoterapia cu Azitromicină nu este însă recomandată, din cauza riscului crescut de instalare a rezistenţei bacteriene la macrolide(10-12).
În astfel de cazuri de uretrită gonococică persistentă sau recurentă, se impune verificarea de laborator a eficienţei tratamentului la 7-14 zile după încheierea administrării acestuia, preferabil prin efectuarea simultană a NAAT şi a culturii însoţite de antibiogramă(1).
Tratamentul uretritelor negonococice
Infecţia cu C. trachomatis este cea mai frecventă boală raportată (185 de cazuri/100 000 de locuitori în Europa şi 497,3/100 000 de locuitori în SUA în 2016). Majoritatea cazurilor sunt diagnosticate în rândul adolescenţilor şi adulţilor tineri, cu vârste sub 35 de ani, raportul M/F fiind de 0,7 în Europa şi 0,5 în SUA pentru cazurile raportate în 2016(6,17). Ratele de incidenţă pentru infecţia anogenitală cu C. trachomatis sunt în continuă creştere(6). Incidenţa reală a infecţiei este cel mai probabil mult mai mare decât cea raportată, având în vedere că un procent foarte mare dintre indivizii infectaţi sunt asimptomatici.
Regimurile recomandate şi alternative indicate de ghidurile în vigoare pentru tratarea infecţiei cu C. trachomatis sunt prezentate în tabelul 4.
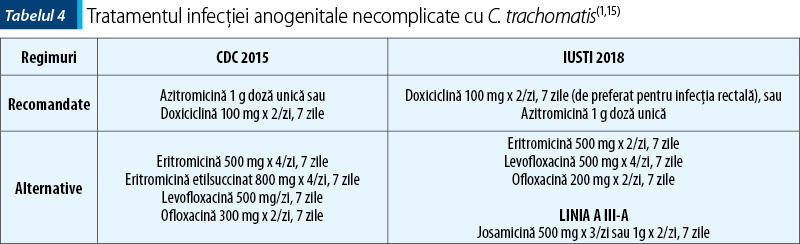
O metaanaliză a 23 de studii clinice randomizate cu privire la eficienţa Azitromicinei şi Doxiciclinei în tratamentul infecţiei urogenitale cu C. trachomatis a arătat o uşoară superioritate a Doxiciclinei (97% faţă de 95%)(18). Deşi eficiente, alternativele terapeutice prezentate în tabelul 4 sunt fie mai costisitoare, fie însoţite de mai multe reacţii adverse. Limeciclina 300 mg x 2/zi, 10 zile, şi Tetraciclina clorhidrat 500 mg x 2/zi, 10 zile, au fost propuse ca alternative de tratament pentru UNG(15), ratele de vindecare pentru infecţia chlamydiană depăşind 95%(19).
La femeile însărcinate, tratamentul de elecţie al infecţiei cu C. trachomatis este reprezentat de Azitromicină (tabelul 5). Studiile pe animale au demonstrat persistenţa infecţiei cu C. trachomatis după tratamentul cu peniciline, prin urmare Amoxicilina nu reprezintă un tratament de primă linie. Riscul de transmitere verticală a infecţiei este foarte ridicat, ceea ce face obligatorie profilaxia oftalmiei nou-născutului cu unguent oftalmic cu eritromicină 0,5%, o singură aplicaţie în fiecare ochi la naştere.
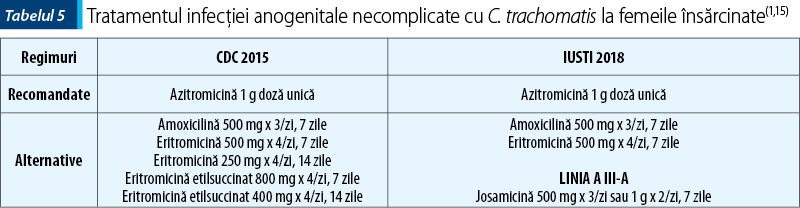
Ca şi în cazul uretritei gonococice, se recomandă screeningul acestor pacienţi pentru alte boli transmisibile sexual şi tratarea partenerilor sexuali din ultimele 60 de zile sau a ultimului partener sexual, chiar dacă intervalul de la ultimul contact sexual depăşeşte 60 de zile. În plus, este recomandată repetarea testării (preferabil prin NAAT) la 3-4 săptămâni şi ulterior la 3 luni după încheierea tratamentului, când sunt utilizate regimuri alternative, în infecţiile complicate, la femeile însărcinate, la pacienţii cu simptome persistente, la pacienţii necomplianţi sau dacă se suspectează o reinfecţie(1).
15-20% din UNG sunt cauzate de infecţia cu M. genitalium(1). Coinfecţia cu C. trachomatis este întâlnită în aproximativ 10% dintre cazuri(20,21). M. genitalium este, de asemenea, cauza a aproximativ 30% din uretritele persistente, refractare la tratamentul standard(22). Totuşi, similar infecţiei cu C. trachomatis, majoritatea infecţiilor cu M. genitalium sunt asimptomatice.
În urma tratamentului cu Doxiciclină 100 mg x 2/zi, timp de 7 zile, se obţine vindecarea infecţiei cu M. genitalium în aproximativ 30% dintre cazuri(23-25). Deşi Azitromicina 1 g p.o. doză unică are eficienţă superioară Doxiciclinei, rezistenţa M. genitalium la Azitromicină este din ce în ce mai frecventă, un studiu recent raportând o rată de vindecare de doar 40% în urma acestui tratament(25). Unii autori subliniază riscul selectării de germeni rezistenţi la Azitromicină consecutiv administrării acesteia în doză unică(26). De aceea, când infecţia cu M. genitalium este suspectată sau dovedită, Ghidul IUSTI 2018 recomandă ca tratament de primă linie Azitromicina 500 mg în prima zi, apoi 250 mg/zi, 4 zile, sau Josamicina 500 mg x 3/zi, 10 zile(15). Cura de 5 zile cu Azitromicină induce mai rar apariţia rezistenţei la macrolide(26). Cu toate acestea, o proporţie ridicată de infecţii, care poate ajunge până la 40% în anumite regiuni (în special în cele în care se recomandă în mod uzual tratament cu Azitromicină 1 g în doză unică), sunt produse de tulpini de M. genitalium rezistente la Azitromicină(27). Prin urmare, pacienţii care nu răspund la tratamentul cu Azitromicină în doză unică nu beneficiază de repetarea tratamentului cu Azitromicină în cură prelungită(28). Josamicina este, de asemenea, ineficientă în infecţiile cu germeni rezistenţi la macrolide.
O alternativă terapeutică în aceste cazuri, cu rate de vindecare de 100% raportate în urma studiilor iniţiale, este reprezentată de Moxifloxacină 400 mg/zi 7-14 zile(29,30). Moxifloxacina trebuie utilizată cu prudenţă şi rezervată cazurilor neresponsive(27). Recent, au fost raportate eşecuri ale acestui tratament administrat timp de 7 zile(31-34). Testarea rezistenţei la Moxifloxacină nu este recomandată de rutină în Europa, unde rata rezistenţei M. genitalium la acest medicament este redusă (<5%), dar trebuie avută în vedere în zona Asia-Pacific sau la pacienţii care au contractat infecţia în această regiune, în care proporţia tulpinilor de M. genitalium rezistente la Moxifloxacină este mult mai mare(35-38). În Asia de Sud-Est au fost identificate izolate de M. genitalium rezistente atât la macrolide, cât şi la fluorochinolone. Frecvenţa lor se ridică la aproximativ 10%(27). Tratamentul cu Doxiciclină 100 mg x 2/zi, timp de 14 zile, duce la eradicarea infecţiei în aproximativ 30% din astfel de cazuri(39). Pristinamicina 1 g x 4/zi, timp de 10 zile, este singurul antibiotic cu eficienţă dovedită în infecţia cu M. genitalium rezistent atât la macrolide, cât şi la fluorochinolone, atingând o rată de vindecare de 75%(40).
Se recomandă repetarea testării la toţi pacienţii diagnosticaţi cu infecţie cu M. genitalium la 3-4 săptămâni de la încheierea tratamentului(41). Pacienţii trebuie sfătuiţi să nu întreţină relaţii sexuale până ce ei şi partenerii lor au încheiat tratamentul, simptomele s-au remis şi testul de control a fost negativ.
În 30-80% dintre cazurile de UNG nu pot fi identificate C. trachomatis sau M. genitalium(27).
Datele cu privire la implicarea U. urealyticum în apariţia UNG sunt contradictorii. Deşi este frecvent izolat de la nivelul tractului urogenital atât la indivizii asimptomatici, cât şi la cei simptomatici, se estimează că reprezintă agentul etiologic în doar 3-11% dintre cazurile de UNG(42). Riscul de dezvoltare a UNG ca urmare a infecţiei cu U. urealyticum este asociat cu o încărcătură bacteriană mare, la femei în general, în contextul vaginozei bacteriene(42). Nu a fost stabilit un regim optim de tratament al uretritelor produse de U. urealyticum. Eradicarea acestei infecţii este dificilă. În plus, tratamentul inadecvat poate induce rezistenţă la antibiotice a altor agenţi etiologici ai bolilor transmisibile sexual.
Nu există dovezi care să susţină implicarea U. parvum sau a M. hominis în apariţia UNG(42).
T. vaginalis trebuie suspectat ca agent etiologic al UNG în regiunile în care trichomoniaza este frecventă (>2% dintre femeile simptomatice)(27). Tratamentul constă în Metronidazol 2 g p.o. în doză unică, Metronidazol 400 mg x 2/zi, 5 zile, sau Tinidazol 2 g p.o. în doză unică(1).
Abordarea terapeutică a pacienţilor cu simptome persistente, în ciuda mai multor cure de antibiotice şi în absenţa reinfecţiei, este neclară. Aceşti pacienţi trebuie evaluaţi de un medic specialist urolog, în vederea excluderii altor afecţiuni, de natură neinfecţioasă, care să explice manifestările clinice.
Concluzii
Pe fondul incidenţei în creştere a bolilor transmisibile sexual şi al emergenţei microorganismelor rezistente la ultimele tratamente disponibile, o serie de măsuri se impun pentru împiedicarea extinderii acestei rezistenţe şi menţinerea eficienţei terapiei. Acestea constau în urmărirea constantă şi adoptarea modificărilor recomandărilor de diagnostic şi tratament emise de organizaţiile de prevenţie şi control al bolilor transmisibile sexual, monitorizarea pacienţilor la risc şi recomandarea testelor de laborator de control pentru verificarea vindecării, precum şi raportarea cazurilor de eşec al tratamentului. De asemenea, este necesară îmbunătăţirea strategiilor naţionale de control al bolilor transmisibile sexual, atât în ceea ce priveşte programele de screening, cât şi asigurarea tratamentului adecvat şi monitorizarea eficienţei acestuia.
Bibliografie
- Workowski KA, Bolan GA. Centers for Disease Control and Prevention. Sexually transmitted diseases treatment guidelines, 2015. MMWR Recomm Rep. 2015;64(RR-03):1-137.
- Zhang N, Wang R, Li X, et al. Are ureaplasma spp. a cause of nongonococcal urethritis? A systematic review and meta-analysis. PLoS One. 2014;9:e113771.
- Manhart LE, Khosropour CM, Liu C, et al. Bacterial vaginosis-associated bacteria in men: association of Leptotrichia/Sneathia spp. with nongonococcal urethritis. Sex Transm Dis. 2013;40:944-9.
- Horner P. The etiology of acute nongonococcal urethritis. The enigma of idiopathic urethritis? Sex Transm Dis 2011;38:187-9.
- European Centre for Disease Prevention and Control. Gonorrhoea. In: ECDC. Annual epidemiological report for 2016. Stockholm: ECDC; 2018.
- Centers for Disease Control and Prevention. Sexually Transmitted Disease Surveillance 2016. Atlanta: U.S. Department of Health and Human Services; 2017.
- Centers for Disease Control and Prevention (CDC). Update to CDC’s sexually transmitted diseases treatment guidelines, 2006: fluoroquinolones no longer recommended for treatment of gonococcal infections. MMWR Morb Mortal Wkly Rep. 2007;56(14):332-6.
- Centers for Disease Control and Prevention. Sexually Transmitted Disease Surveillance 2013. Atlanta: U.S. Department of Health and Human Services; 2014.
- Centers for Disease Control and Prevention. Update to CDC’s Sexually transmitted diseases treatment guidelines, 2010: oral cephalosporins no longer a recommended treatment for gonococcal infections. MMWR Morbid Mortal Wkly Rep. 2012;61(31):590-4.
- Ison CA, Hussey J, Sankar KN, et al. Gonorrhoea treatment failures to cefixime and azithromycin in England, 2010. Euro Surveill. 2011;16(14):19833.
- Soge OO, Harger D, Schafer S, et al. Emergence of increased azithromycin resistance during unsuccessful treatment of Neisseria gonorrhoeae infection with azithromycin (Portland, OR, 2011). Sex Transm Dis. 2012;39:877-9.
- Waters LJ, Boag FC, Betournay R. Efficacy of azithromycin 1 g single dose in the management of uncomplicated gonorrhoea. Int J STD AIDS. 2005;16(1):84.
- Public Health England. UK case of Neisseria gonorrhoeae with high-level resistance to azithromycin and resistance to ceftriaxone acquired abroad. Health Protection Report. 2018;12(11).
- Australian Government. Department of Health. Multi-drug resistant gonorrhoea 2018. Available from: http://www.health.gov.au/internet/main/publishing.nsf/Content/mr-yr18-dept-dept004.htm.
- IUSTI. STI Treatment pocket European guidelines 2018.
- Kirkcaldy RD, Weinstock HS, Moore PC, et al. The efficacy and safety of gentamicin plus azithromycin and gemifloxacin plus azithromycin as treatment of uncomplicated gonorrhea. Clin Infect Dis. 2014;59:1083-91.
- European Centre for Disease Prevention and Control. Chlamydia infection. In: ECDC. Annual epidemiological report for 2016. Stockholm: ECDC; 2018.
- Kong FY, Tabrizi SN, Law M, et al. Azithromycin versus doxycycline for the treatment of genital Chlamydia infection: A meta-analysis of randomized controlled trials. Clin Infect Dis. 2014;59:193-205.
- Lindemalm-Lundstam B, Johannisson G, Lohwhagen GB. Alternative drugs against chlamydia urethritis. Tetracycline offers the most cost-effective cure. Lakartidningen. 1996;93:369-371.
- Wetmore CMP, Manhart LEP, Lowens MSP, et al. Demographic, behavioral, and clinical characteristics of men with nongonococcal urethritis differ by etiology: A case-comparison study. Sex Transm Dis. 2011;38:180-6.
- Gaydos C, Maldeis NE, Hardick A, et al. Mycoplasma genitalium compared to chlamydia, gonorrhoea and trichomonas as an aetiological agent of urethritis in men attending STD clinics. Sex Transm Infect. 2009;85:438-440.
- Taylor-Robinson D, Jensen JS. Mycoplasma genitalium: from chrysalis to multicolored butterfly. Clin Microbiol Rev. 2011;24:498-514.
- Mena LA, Mroczkowski TF, Nsuami M, et al. A randomized comparison of azithromycin and doxycycline for the treatment of Mycoplasma genitalium-positive urethritis in men. Clin Infect Dis. 2009;48:1649-54.
- Schwebke JR, Rompalo A, Taylor S, et al. Re-evaluating the treatment of nongonococcal urethritis: emphasizing emerging pathogens – a randomized clinical trial. Clin Infect Dis. 2011;52:163-70.
- Manhart LE, Gillespie CW, Lowens MS, et al. Standard treatment regimens for nongonococcal urethritis have similar but declining cure rates: a randomized controlled trial. Clin Infect Dis 2013;56:934-42.
- Horner P, Ingle S, Blee K, et al. Treatment of Mycoplasma genitalium with azithromycin 1 g is less efficacious and associated with induction of macrolide resistance compared to a 5 day regimen. Sex Transm Infect. 2015;91(Suppl 1):A10.
- Horner PJ, Blee K, Falk L et al. 2016 European guideline on the management of non-gonococcal urethritis. Int J STD AIDS. 2016;27(11):928-37.
- Totten PA, Jensen NL, Khosropour CM, et al. Azithromycin and doxycycline resistance profiles of recent clinical isolates of Mycoplasma genitalium. STI and AIDS World Congress Joint Meeting of the 20th International Society of Sexually Transmitted Disease Research; July 14-17, 2013; Vienna, Austria.
- Jernberg E, Moghaddam A, Moi H. Azithromycin and moxifloxacin for microbiological cure of Mycoplasma genitalium infection: an open study. Int J STD AIDS. 2008;19:676-9.
- Bradshaw CS, Chen MY, Fairley CK. Persistence of Mycoplasma genitalium following azithromycin therapy. PLoS One. 2008;3(11):e3618.
- Terada M, Izumi K, Ohki E, et al. Antimicrobial efficacies of several antibiotics against uterine cervicitis caused by Mycoplasma genitalium. J Infect Chemother. 2012;18:313-7.
- Manhart LE, Khosropour CM, Gillespie CW, et al. Treatment outcomes for persistent Mycoplasma genitalium-associated NGU: evidence of moxifloxacin treatment failures. STI and AIDS World Congress Joint Meeting of the 20th International Society for Sexually Transmitted Disease Research; July 14-17, 2013; Vienna, Austria.
- Couldwell DL, Tagg KA, Jeoffreys NJ, et al. Failure of moxifloxacin treatment in Mycoplasma genitalium infections due to macrolide and fluoroquinolone resistance. Int J STD AIDS. 2013;24:822-8.
- Tagg KA, Jeoffreys NJ, Couldwell DL, et al. Fluoroquinolone and macrolide resistance-associated mutations in Mycoplasma genitalium. J Clin Microbiol. 2013;51:2245-9.
- Pond MJ, Nori AV, Witney AA et al. High prevalence of antibiotic-resistant Mycoplasma genitalium in nongonococcal urethritis: the need for routine testing and the inadequacy of current treatment options. Clin Infect Dis. 2014; 58:631–7.
- Shimada Y, Deguchi T, Nakane K, et al. Emergence of clinical strains of Mycoplasma genitalium harbouring alterations in ParC associated with fluoroquinolone resistance. Int J Antimicrob Agents. 2010;36:255–8.
- Couldwell DL, Tagg KA, Jeoffreys NJ, Gilbert GL. Failure of moxifloxaci treatment in Mycoplasma genitalium infections due to macrolide and fluoroquinolone resistance. Int J STD AIDS. 2013;24:822–8.
- Kikuchi M, Ito S, Yasuda M, et al. Remarkable increase in fluoroquinolone-resistant Mycoplasma genitalium in Japan. J Antimicrob Chemother. 2014;69:2376-82.
- Bissessor M, Tabrizi SN, Twin J, et al. Macrolide resistance and azithromycin failure in a Mycoplasma genitalium-infected cohort and response of azithromycin failures to alternative antibiotic regimens. Clin Infect Dis. 2015;60:1228–36.
- Read TRH, Jensen JS, Fairley CK, et al. Use of Pristinamycin for macrolide-resistant Mycoplasma genitalium infection. Emerg Infect Dis. 2018;24(2):328-335.
- Jensen JS, Cusini M, Gomberg M, Moi H. 2016 European guideline on Mycoplasma genitalium infections. JEADV. 2016;30(10):1650-6.
- Horner P, Donders G, Cusini M, et al. Should we be testing for urogenital Mycoplasma hominis, Ureaplasma parvum and Ureaplasma urealyticum in men and women? - a position statement from the European STI Guidelines Editorial Board. JEADV. 2018; [Epub ahead of print].
