Hepatitis C virus (HCV) infection is an important public health problem through the high levels of morbidity and mortality that it entails. Although the virus was discovered 30 years ago, the progress made in the structure and pathogenicity of the virus resulted in the development of extreme effective treatments. However, due to the current barriers to universal use of treatment, further efforts are needed to achieve the WHO desiderate to eradicate HCV infection by the year 2030.
Actualităţi şi perspective în terapia infecţiei cu virusul hepatitei C
Current issues and perspectives in the therapy of hepatitis C virus infection
First published: 20 noiembrie 2019
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/MED.132.6.2019.2661
Abstract
Rezumat
Infecţia cu virusul hepatitei C (VHC) reprezintă o problemă importantă de sănătate publică, prin nivelurile înalte de morbiditate şi mortalitate pe care le implică. Deşi virusul a fost descoperit în urmă cu 30 de ani, progresele făcute în structura şi patogenia virusului au dus la dezvoltarea unor tratamente extrem de eficiente. Cu toate acestea, din cauza barierelor actuale în utilizarea universală a tratamentului, sunt necesare eforturi suplimentare pentru a atinge dezideratul OMS de eradicare a infecţiei cu VHC până în anul 2030.
Introducere
Infecţia cu virusul hepatitei C (VHC) reprezintă o povară semnificativă pentru sănătatea publică, afectând aproximativ 1% din populaţia lumii. Se estimează că în prezent există aproximativ 71,1 milioane de persoane infectate cu VHC(1). În anul 2016, OMS a estimat că boala a fost responsabilă pentru 339.000 de decese, consecinţă a complicaţiilor evolutive ale infecţiei (ciroză hepatică, carcinom hepatocelular), şi este principala indicaţie pentru transplantul hepatic la nivel mondial(2).
Istoric
După descoperirea virusului hepatitei C, în 1989(3), odată cu apariţia după 1991 a primelor teste de screening(4), boala a fost recunoscută ca o problemă importantă de sănătate publică. În 1991, Food and Drug Administration (FDA) a aprobat utilizarea interferonului alfa-2b (Intron®) pentru tratamentul infecţiei cu VHC. Prin combinarea ribavirinei cu interferonul în anul 1998(5), a crescut numărul de pacienţi la care s-a obţinut răspuns virusologic susţinut (RVS), la 30-40% dintre pacienţii trataţi.
Anul 2001 aduce peginterferonul alfa-2b (PegIntron), urmat de peginterferon alfa 2-b (2002), care, prin combinarea cu polietilenglicol (PEG-IFN), moleculă cu timp de înjumătăţire mai mare, au permis administrări mai rare, comparativ cu forma nepegilată. Utilizarea interferonului pegilat a dus la obţinerea unor rate de RVS de aproximativ 40%, iar în combinaţie cu ribavirina, ratele de răspuns terapeutic au crescut până la 54-56%(7). Odată cu studiile efectuate s-a constatat că ratele de RVS depindeau mult de genotipul viral implicat, dar şi de anumite particularităţi ale pacientului (în special polimorfismul genei IL28B)(8). Aceste tratamente erau utilizate pentru 48 de săptămâni şi prezentau numeroase efecte adverse care în unele cazuri puteau duce la întreruperea lor.
Datorită progreselor obţinute în înţelegerea geneticii şi a mecanismelor de acţiune ale virusului, în anul 2011 au fost introduşi inhibitori de protează (boceprevir, telaprevir), care au fost adăugaţi tratamentului standard de până atunci („tripla terapie”) şi care au îmbunătăţit ratele de răspuns virusologic până la 75-83%(9,10). Cu toate acestea, efectele secundare cumulate cu ale interferonului şi ribavirinei le-au limitat utilizarea şi, odată cu apariţia medicamentelor cu acţiune antivirală directă, au fost retrase de pe piaţă în anii 2014 şi 2015.
Medicamentele cu acţiune antivirală directă (AAD)
În anul 2013 au fost aprobate primele medicamente (simeprevir şi sofosbuvir)(11) considerate cu adevărat active împotriva bolii. În următorii ani au fost aprobate mai multe medicamente care prin combinaţii au reuşit obţinerea de rate de RVS de peste 90%, indiferent de stadiul bolii hepatice(2). În ultimii ani, terapiile DAA au înlocuit la nivel global tratamentul PEG-IFN combinat cu ribavirină (RBV), ca standard de îngrijire pentru pacienţii cu hepatită cronică C. În plus, acestea au mai puţine efecte secundare, durate de tratament mai scurte şi aderenţă îmbunătăţită în comparaţie cu terapia anterioară. Din cauza impactului substanţial al infecţiei cu VHC la nivel global asupra pacienţilor, a familiilor lor şi sistemelor de sănătate publică, Organizaţia Mondială a Sănătăţii (OMS) a stabilit ca scop eliminarea infecţiei cu VHC până în 2030. Această abordare implică reducerea cu 80% a incidenţei VHC şi scăderea cu 65% a mortalităţii(12). Ca parte a strategiei de realizare a acestor obiective, OMS a inclus terapii AAD în ediţia sa din 2017 a Listei de medicamente esenţiale(13).
Principalele clase de AAD
Tratamentul hepatitei cronice cu VHC are două scopuri majore: obţinerea unui răspuns virologic susţinut, definit ca un nivel nedetectabil sau necuantificabil al ARN-HCV la 12 săptămâni de la finalizarea tratamentului(14), şi împiedicarea progresiei hepatitei cronice către ciroză, carcinom hepatocelular (CHC) sau decompensare a bolii ce poate duce la transplant hepatic. În urma identificării unor ţinte terapeutice, au fost dezvoltate mai multe clase de medicamente antivirale care, utilizate în combinaţii, reuşesc să blocheze replicarea virală.
Există trei clase principale de AAD, în funcţie de locul lor de acţiune. Primul grup cuprinde inhibitori de NS3/4A, care includ boceprevir, telaprevir, simeprevir, asunaprevir, grazoprevir şi paritaprevir – boostat cu ritonavir. Al doilea grup cuprinde inhibitori NS5A, care includ daclatasvir, ledipasvir, ombitasvir, elbasvir şi velpatasvir. Al treilea grup include inhibitori de nucleotide NS5B (sofosbuvir) şi inhibitori non-nucleozidici de polimerază (dasabuvir). Cele 11 medicamente AAD (molecule unice sau combinaţii de molecule) disponibile în prezent oferă majorităţii persoanelor cu infecţie cronică cu VHC posibilitatea de vindecare(15).
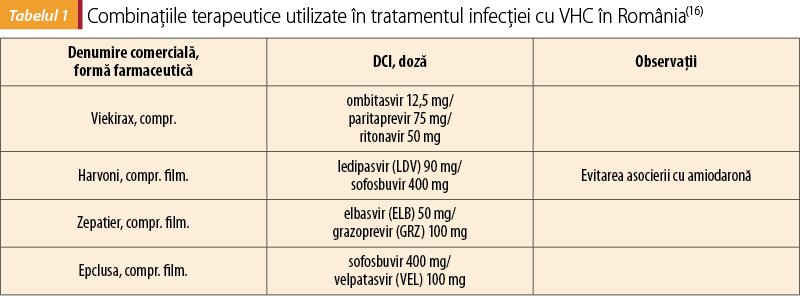
Aceste combinaţii terapeutice au fiecare indicaţii pentru diferitele genotipuri virale, statusul anterior al pacientului (naiv sau experimentat, cu tratament anterior PEG-IFN) sau în funcţie de stadiul bolii hepatice. AAD au fost împărţite în medicamente genotip-specifice şi medicamente pangenotipice. Se cunoaşte că VHC are 7 genotipuri şi de aceea au apărut ghiduri de tratament pentru fiecare în parte pentru maximizarea rezultatelor obţinute(15,17). Astfel, de exemplu, genotipul 1b, răspândit în America de Nord, Europa şi care este majoritar în România(18), beneficiază de majoritatea combinaţiilor terapeutice existente, în timp ce pentru genotipurile 2, 3, 5 şi 6 posibilităţile terapeutice sunt mai limitate(17). Studiul circulaţiei genotipurilor virale a arătat că în ultimii ani există o uşoară tendinţă de „uniformizare” a acestora în toate ariile geografice. Acest lucru este explicat de profilul majoritar al persoanelor nou infectate cu VHC: tineri, utilizatori de droguri i.v., cu disponibilitate mai mare de deplasare faţă de generaţiile anterioare. În România, prevalenţa genotipului 1b a scăzut de la 99,7% la 92,6%, în primul rând din cauza infecţiilor VHC la această grupă de risc(18). În plus, la utilizatorii de droguri i.v., prevalenţa infecţiei cu HIV este în creştere (mai ales la utilizatorii de droguri „etnobotanice”) şi, prin reinfecţii succesive, un pacient poate fi infectat cu mai multe genotipuri virale. Acest profil de infecţie este întâlnit în mai multe ţări şi de aceea OMS încurajează utilizarea medicamentelor pangenotipice, mai ales în cazurile în care genotiparea virală nu este posibilă(12). Astfel, regimurile pangenotipice, cum ar fi sofosbuvir/velpatasvir (SOF/VEL), le permit majorităţii pacienţilor cu VHC să fie trataţi cu strategii simple de tratament, indiferent de experienţa anterioară a tratamentului, de prezenţa sau absenţa cirozei, cu interacţiuni medicamentoase reduse şi necesităţi scăzute de ajustare a regimului sau de monitorizare a tratamentului(12).
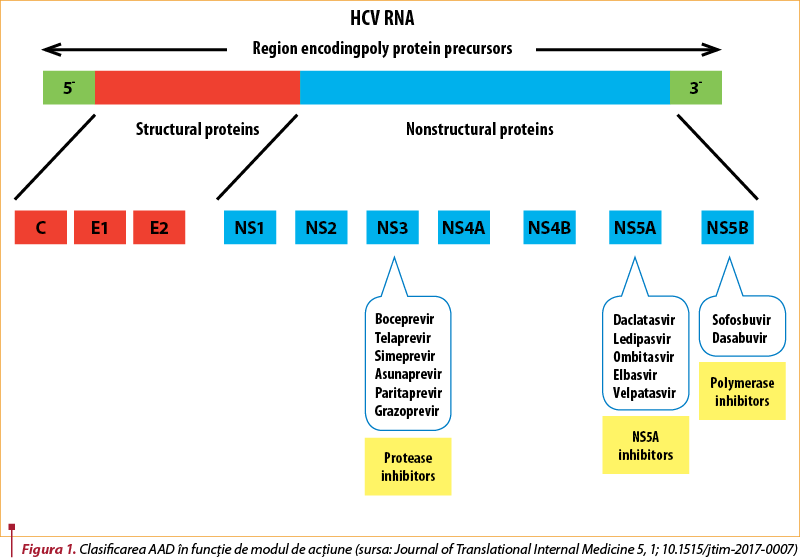
Alegerea regimurilor terapeutice
Ghidurile actuale (AASLD/ISA şi EASL)(15,17) nu mai recomandă prioritizarea pacienţilor în funcţie de stadiul fibrozei hepatice, al manifestărilor extrahepatice sau al bolilor asociate. Cu excepţia femeilor însărcinate şi a pacienţilor cu speranţă de viaţă redusă (din cauza unor patologii extrahepatice), tratamentul trebuie oferit tuturor persoanelor cu vârsta de peste 12 ani diagnosticate cu VHC, indiferent de stadiul bolii. Studii de cohortă la pacienţii netrataţi, desfăşurate pe termen lung, au evidenţiat o rată de progresie către CHC de 0,5% pe an la cei cu F0-F1 şi de 7,9% la cei cu F4(19). Într-un alt studiu, rata de supravieţuire la 15 ani a fost semnificativ mai bună statistic pentru cei care au prezentat RVS (93%), comparativ cu cei al căror tratament a eşuat (82%) sau cu cei care au rămas netrataţi (88%), indiferent de stadiul fibrozei hepatice(20). Tratamentul AAD a fost asociat, de asemenea, cu o reducere de 32% a mortalităţii în raport cu pacienţii netrataţi(21), iar la pacienţii care au obţinut RVS, reducerea mortalităţii la doi ani a fost de 79% la cei cu boală hepatică avansată şi de 56% la cei cu forme cu severitate redusă(22,23).
Alegerea schemelor de tratament trebuie făcută de medicul curant în funcţie de mai mulţi factori:
-
genotipul viral;
-
statusul de pacient naiv/experimentat la tratament (tratament anterior PEG-IFN sau DAA);
-
prezenţa cirozei hepatice (compensate sau nu);
-
coinfecţia cu HIV;
-
dacă pacientul a suferit un transplant hepatic;
-
dacă pacientul are insuficienţă renală.
Totodată, trebuie luate în consideraţie posibilele interacţiuni cu medicamente utilizate pentru alte afecţiuni. În ajutorul medicilor prescriptori există site-uri unde se pot evalua interacţiunile fiecărui medicament antiviral direct cu diverse medicamente (ex.: https://www.hep-druginteractions.org/checker, dezvoltat de Universitatea din Liverpool). Există medicamente a căror coadministrare cu AAD este interzisă, altele cu interacţiuni posibile, care necesită precauţie, iar altele care pot fi utilizate fără riscuri.
Impactul terapiilor DAA în practica clinică curentă
Deşi ratele de RVS sunt sensibil mai mici la pacienţii cu ciroză decompensată (76-84%)(24,25), utilizarea acestei medicaţii aduce o îmbunătăţire a ratelor de supravieţuire chiar peste limitele aşteptate. Astfel, într-un raport publicat în Marea Britanie s-a constatat că în perioada 2015-2017, după introducerea AAD, mortalitatea în rândul pacienţilor cu boală hepatică gravă a scăzut cu 16%. Acest procent a fost cu mult mai mare faţă de dezideratul OMS de reducere a mortalităţii cu 10% până în 2020(26).
În privinţa manifestărilor extrahepatice, studii efectuate în perioada tratamentelor bazate pe IFN au arătat că obţinerea RVS a fost asociată cu îmbunătăţiri ale vasculitei crioglobulinemice, ale bolilor limfoproliferative cu celule B şi a redus incidenţa rezistenţei la insulină şi a diabetului zaharat de tip 2(27). Introducerea terapiilor AAD a demonstrat un efect important în ameliorarea sau remisiunea clinică a manifestărilor crioglobulinemiei(28), a limfomului cu celulă B(29) şi a lichenului plan(30).
Probleme importante ridică tratamentul pacienţilor coinfectaţi cu virusul B (VHB). Astfel, în cazul pacienţilor cu infecţie B+C, obţinerea RVS în urma tratamentului AAD poate activa infecţia cu VHB, chiar şi în cazul infecţiilor oculte. De aceea, înainte de iniţierea tratamentului împotriva hepatitei C este obligatorie evaluarea prezenţei VHB. În cazul prezenţei acestuia, dovedită prin ADN-VHB detectabil în ser, se recomandă iniţierea în paralel a unui tratament profilactic anti-VHB cu analogi nucleozidici/nucleotidici (entecavir, tenofovir)(17). Acest tratament trebuie administrat încă 12 săptămâni după încheierea tratamentului DAA.
Pacienţii care prezintă coinfecţie HIV/VHC sunt expuşi riscului de fibroză hepatică accelerată şi de aceea se recomandă iniţierea tratamentului antiviral indiferent de stadiul bolii. Ratele obţinerii RVS în urma studiilor clinice au fost similare cu ale pacienţilor neinfectaţi cu HIV. Disponibilitatea mai multor regimuri antiretrovirale împotriva VHC şi HIV face posibil ca toţi pacienţii infectaţi cu HIV/VHC să primească în mod sigur şi cu succes tratament pentru VHC. Atunci când este indicat tratamentul atât pentru HIV, cât şi pentru VHC, regimurile de tratament ar trebui să fie selectate, luând în considerare potenţialele interacţiuni medicamentoase şi toxicităţi cumulative. În plus, din cauza căii comune de transmitere, pacienţii trebuie evaluaţi pentru prezenţa VHB şi privind imunitatea la infecţie (prezenţa anticorpilor anti-HBs). În cazul absenţei virusului B, dar şi al lipsei imunităţii, pacienţii trebuie vaccinaţi anti-VHB. Dacă virusul B este prezent, tratamentul antiretroviral ar trebui să cuprindă doi agenţi anti-VHB înainte de iniţierea terapiei DAA(31).
O problemă deosebită o reprezintă tratamentul DAA la persoanele utilizatoare de droguri i.v. Deşi reprezentau un grup populaţional cu mare risc de transmitere a infecţiei, aceşti pacienţi erau excluşi de la tratament în „epoca IFN”. Actualmente, tot mai multe date susţin iniţierea tratamentului inclusiv la consumatorii activi de droguri(12,32). Astfel, a apărut conceptul de „tratament ca prevenţie” în mai multe ţări din lume pentru că s-a demonstrat că rata reinfecţiilor este inferioară ratei de transmitere virală. De exemplu, în Islanda, în anul 2016 s-a lansat un program naţional (Treatment as Prevention for Hepatitis C) care oferă acces universal pacienţilor infectaţi şi prin care se încearcă un control mai bun al transmiterii virusului(33). Complexitatea tratamentului pentru VHC la aceşti pacienţi necesită o abordare multidisciplinară, fiind necesară o echipă compusă din medici, asistenţi medicali, asistenţi sociali şi profesionişti în sănătatea mintală.
Perspective
În era AAD, obiectivul eliminării VHC a devenit mai realist ca niciodată. Cu toate acestea, rămân câteva provocări şi probleme importante care merită mai multă atenţie în gestionarea VHC. Conform directivei OMS pentru eradicarea infecţiei la nivel global, până în anul 2030, 90% dintre pacienţi ar trebui diagnosticaţi şi 80% dintre ei ar trebui trataţi. Pentru realizarea acestui deziderat vor trebui surmontate măcar o parte din barierele actuale: dificultatea realizării unui screening eficient în cazul persoanelor la risc, de a evalua în toate cazurile nivelul viremiei sau al fibrozei hepatice, barierele de tratament în cazul genotipurilor cu rezistenţe mai mari la tratament, subgrupuri populaţionale dificil de tratat (bolnavi neasiguraţi medical, pacienţi coinfectaţi, post-transplant hepatic, utilizatori de droguri i.v. etc.), costul încă ridicat al tratamentelor actuale.
Una din barierele importante ale tratamentului o reprezintă costul încă ridicat al terapiilor DAA în multe ţări din lume. Deşi accesul la medicaţie s-a îmbunătăţit în ultimii ani, încă nu se poate vorbi despre generalizarea terapiilor DAA la nivel mondial. Astfel, un studiu efectuat în 2016 estima numărul de pacienţi trataţi la 1,5 milioane, în timp ce incidenţa infecţiei se afla la niveluri comparative(34). De aceea, este necesară o schimbare de paradigmă în privinţa accesibilităţii la tratament, în special în cazul grupelor vulnerabile, unde se întâlnesc şi cei mai mulţi pacienţi susceptibili de a fi surse de infecţie. Costul terapiei a scăzut în multe ţări dezvoltate, prin apariţia unor politici naţionale sau regionale coerente(35,36). În ţările în curs de dezvoltare au fost introduse pe scară largă medicamentele generice al căror cost este mult mai scăzut, realizându-se tratarea unui număr mare de pacienţi. Astfel, în cazul Egiptului, cu o prevalenţă foarte mare a infecţiei cu VHC, unde medicamentele generice au fost introduse încă din 2015, s-a realizat scăderea costurilor de la 900 USD la 84 USD per tratament. În ciuda numărului foarte mare de pacienţi, printr-o politică de screening proactiv şi prin accesibilitatea largă la tratament, această ţară este una din cele 12 ţări unde, conform estimărilor actuale, se vor putea atinge dezideratele OMS de eradicare a bolii(34).
Idealul de tratament ar fi utilizarea unor medicamente pangenotipice care să fie active împotriva tuturor tulpinilor virale. Din păcate, aceste preparate sunt încă scumpe şi sunt rezervate în special pacienţilor cu rezistenţe dovedite la AAD (regimuri „de salvare”). Pacienţii cu rezistenţă dovedită la AAD ar trebui trataţi cu celeritate pentru a descuraja răspândirea mutantelor rezistente. În plus, se consideră că este necesară dezvoltarea unor noi terapii antivirale pentru a depăşi barierele de rezistenţă ce pot apărea în viitor, cunoscută fiind variabilitatea genetică a virusului.
Dezvoltarea vaccinurilor împotriva infecţiei cu virusul hepatitei C este abordarea cea mai logică şi rămâne o prioritate a sănătăţii publice. Fără o vaccinare eficientă, utilizarea doar a DAA este puţin probabil să obţină eliminarea VHC. Din păcate, până acum nu s-a reuşit dezvoltarea unui vaccin eficient. Totuşi, printr-o nouă abordare, în prezent se încearcă dezvoltarea a două vaccinuri care, prin stimularea specifică a limfocitelor T (CD4 şi CD8), se realizează eliminarea hepatocitelor infectate şi apariţia unor anticorpi specifici(37). Aceste vaccinuri vor fi destinate în special persoanelor din categoriile la risc, care, deşi pot obţine RVS prin tratament specific, riscă să se reinfecteze şi să transmită boala. În plus, vaccinul ar fi foarte eficient în cazul persoanelor neinfectate, dar care nu ar putea fi tratate cu terapie AAD din cauza unor contraindicaţii medicamentoase.
Conflict of interests: The authors declare no conflict of interests.
Bibliografie
- Polaris Observatory HCV Collaborators. Global prevalence and genotype distribution of hepatitis C virus infection in 2015: a modelling study. Lancet Gastroenterol Hepatol. 2017;2:161–76.doi:10.1016/S2468-1253(16)30181-9.
- World Health Organization. Hepatitis C: fact sheet. Available at http://www.who.int/mediacentre/factsheets/fs164/en/. Updated: October 2017.
- Choo QL, Kuo G, Weiner AJ, Overby LR, Bradley DW, and Houghton M. Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome. Science. 1989; 244: 359-362.
- http://www.cosmosbiomedical.com/education/virology/hepatitiscvirus.shtml.
- Peginterferon Alfa-2b (Professional Patient Advice) - Drugs.com.
- Peginterferon Alfa-2a (Professional Patient Advice) - Drugs.com.
- Levin J. Comparing Pegasys and PegIntron at EASL 2008 Milan. EASL. 3rd Annual Meeting of the European Association For The Study Of The Liver Milan, Italy, April 23-27, 2008.
- Balagopal A, Thomas DL, Thio CL. IL28B and the control of hepatitis C virus infection. Gastroenterology. 2010;139(6):1865–1876. doi:10.1053/j.gastro.2010.10.004.
- Poordad F, et al. Boceprevir for Untreated Chronic HCV Genotype 1 Infection.
- N Engl J Med. 2011 March; 364 (13): 1195–206. doi:10.1056/NEJMoa1010494.
- Zeuzem S, Andreone P, Pol S, et al. Telaprevir for retreatment of HCV infection.
- N Engl J Med. 2011; 364 (25): 2417–28. doi:10.1056/NEJMoa1013086.
- Geddawy A, Ibrahim YF, Elbahie NM. Direct acting anti-hepatitis C virus drugs: Clinical pharmacology and future direction. Journal of Translational Internal Medicine. 2017; Volume 5:Issue 1, doi.org/10.1515/jtim-2017-0007.
- World Health Organization. Guidelines for the care and treatment of persons diagnosed with chronic hepatitis C virus infection. 2018. https://www.who.int/hepatitis/publications/hepatitis-c-guidelines-2018/en/.
- World Health Organization. WHO model list of essential medicines. 2017; http://www.who.int/medicines/publications/essentialmedicines/20th_EML2017_FINAL_amendedAug2017.pdf.ua=1.
- Terrault NA, Hassanein TI. Management of the patient with SVR. J Hepatol. 2016;65:S120-9.
- AASLD-IDSA HCV Guidance Panel, Hepatitis C Guidance 2018 Update: AASLD-IDSA Recommendations for Testing, Managing, and Treating Hepatitis C Virus Infection, Clinical Infectious Diseases, Volume 67, Issue 10, 15 November 2018, Pages 1477–1492, https://doi.org/10.1093/cid/ciy585.
- CNAS (2019):Anunţ privind reluarea procesului de negociere pe indicaţiile/ariile terapeutice aferente medicamentelor pentru care au fost încheiate contracte cost volum-rezultat - aria terapeutică: HEPATITA CRONICĂ VIRALĂ C (VHC) https//cnas.ro/media.
- European Association for the Study of the Liver. EASL Recommendations on Treatment of Hepatitis C 2018. J Hepatol (2018), https://doi.org/10.1016/j.jhep.2018.03.026.
- Vagu DC. Evaluarea genotipurilor VHC circulante în România. https://www.virology.ro/download/files/Doctorat%20IVN/rezumat%20teza%20Codruta%20Vagu%20%20RO.doc.
- Yoshida H, Shiratori Y, et al. Interferon therapy reduces the risk for hepatocellular carcinoma: national surveillance program of cirrhotic and noncirrhotic patients with chronic hepatitis C in Japan. IHIT Study Group. Inhibition of Hepatocarcinogenesis by Interferon Therapy. Ann Intern Med. 1999;131:174-181.
- Jezequel C, Bardou-Jacquet E, Desille Y, et al. Survival of patients infected by chronic hepatitis C and F0F1 fibrosis at baseline after a 15 year follow-up. Presented at: 50th Annual Meeting of the European Association for the Study of the Liver (EASL); April 22-26, 2015; Vienna, Austria.
- Carrat F. First prospective evidence of decreased mortality after direct acting antivirals in the French ANRS CO22 HEPATHER cohort. Hepatology. 2017;66:1271A.
- Backus LI, Belperio PS, Shahoumian TA, Mole LA. Impact of Sustained Virologic Response with Direct-Acting Antiviral Treatment on Mortality in Patients with Advanced Liver Disease. Hepatology. 2019;69:487-497.
- Backus LI, Belperio PS, Shahoumian TA, Mole LA. Direct-acting antiviral sustained virologic response: Impact on mortality in patients without advanced liver disease. Hepatology. 2018;68:827-838.
- Lanini S, Scognamiglio P, Mecozzi A, et al. Impact of new DAA therapy on real clinical practice: a multicenter region-wide cohort study. BMC Infect Dis. 2018;18(1):223. Published 2018 May 16. doi:10.1186/s12879-018-3125-6.
- Kwo P1, Fried MW et al. Daclatasvir and sofosbuvir treatment of decompensated liver disease or post-liver transplant hepatitis C virus recurrence in patients with advanced liver disease/cirrhosis in a real-world cohort. Hepatol Commun. 2018 Feb 27;2(4):354-363. doi: 10.1002/hep4.1156. eCollection 2018 Apr.
- Hepatitis C in England 2019.Working to eliminate hepatitis C as a major public health threat. https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/798270/HCV_in-England_2019.pdf
- Cacoub P, Desbois AC, Comarmond C, Saadoun D. Impact of sustained virological response on the extrahepatic manifestations of chronic hepatitis C: a meta-analysis. Gut. 2018;67:2025-2034.
- Gragnani L, Visentini M, et al. Prospective study of guideline-tailored therapy with direct-acting antivirals for hepatitis C virus-associated mixed cryoglobulinemia. Hepatology. 2016;64:1473-1482.
- Arcaini L, Besson C, et al. Interferon-free antiviral treatment in B-cell lymphoproliferative disorders associated with hepatitis C virus infection. Blood. 2016;128:2527-2532.
- Nagao Y, Kimura K, Kawahigashi Y, Sata M. Successful Treatment of Hepatitis C Virus-associated Oral Lichen Planus by Interferon-free Therapy with Direct-acting Antivirals. Clin Transl Gastroenterol. 2016;7:e179.
- https://aidsinfo.nih.gov/guidelines/html/1/adult-and-adolescent-arv/26/hcv-hiv.
- Martin NK, Vickerman P, Dore GJ, Hickman M. The hepatitis C virus epidemics in key populations (including people who inject drugs, prisoners and MSM): the use of direct-acting antivirals as treatment for prevention. Curr Opin HIV AIDS. 2015;10:374-380.
- Olafsson S, Tyrfingsson T, et al. Treatment as Prevention for Hepatitis C (TraP Hep C) - a nationwide elimination programme in Iceland using direct-acting antiviral agents. J Intern Med. 2018;283:500-507.
- Centre for Disease Analysis Foundation. Polaris Observatory. 2018. http://polarisobservatory.org/
- Iyengar S, Tay-Teo K, Vogler S, Beyer P, Wiktor S, de Joncheere K, Hill S. Prices, Costs, and Affordability of New Medicines for Hepatitis C in 30 Countries: An Economic Analysis. PLoS Med. 2016;13:e1002032.
- Ghinea N, Lipworth W, Day R, Hill A, Dore GJ, Danta M. Importation of generic hepatitis C therapies: bridging the gap between price and access in high-income countries. Lancet. 2017;389:1268–72.Return to ref 56 in article.
- Shoukry NH. Hepatitis C Vaccines, Antibodies, and T Cells. Front Immunol. 2018;9:1480. Published 2018 Jun 28. doi:10.3389/fimmu.2018.01480.
Articole din ediţiile anterioare
Gravida cu hepatită cronică virală B, în practica medicului de familie
Gravida cu hepatită B constituie o situație particulară, care necesită o abordare eficientă, astfel încât riscul transmiterii infecției în timpul s...
Dispensarizarea pacienţilor cu hepatită cronică virală C pre- şi post-tratament cu antivirale cu acţiune directă
Hepatita cronică virală C este o problemă mondială de sănătate. Incidenţa, prevalenţa şi mortalitatea ridicată cauzată de diversele stadii de evo...