Asthma is a chronic inflammatory disease of the airways, classically characterized by two pathogenic mechanisms: allergic and non-allergic. The clinical manifestations include dyspnoea, wheezing and cough, reversible upon removal of the trigger. Triggering factors, natural history and molecular biology are currently explained by mechanisms underlying the clinical management of asthma.
Abordări fiziopatogenice actuale în astmul bronşic la copil
Current physiopathogenic approaches to asthma in children
First published: 19 martie 2020
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Pedi.57.1.2020.3070
Abstract
Rezumat
Astmul bronşic reprezintă o boală inflamatorie cronică a căilor respiratorii, caracterizată clasic prin două mecanisme patogenice: alergic şi nonalergic. Manifestările clinice includ dispnee, wheezing şi tuse, reversibile la eliminarea elementului trigger. Factorii declanşatori, istoria naturală şi biologia moleculară sunt explicate în prezent prin mecanisme care stau la baza managementului clinic al astmului.
Potrivit statisticilor internaţionale, astmul bronşic este cea mai frecventă boală a copilăriei, fiind afectaţi aproximativ 6 milioane de copii la nivel mondial. Boala se regăseşte la toate grupele de vârstă în perioada copilăriei, fiind diagnosticată cel mai frecvent înainte de adolescenţă, iar sexul masculin este de două ori mai afectat decât cel feminin.
Se observă o creştere cu 76% a incidenţei astmului bronşic la vârsta pediatrică în ultima decadă, iar discuţiile actuale iau în considerare terenul atopic, expunerea la o varietate de alergeni şi particularităţile imunologice ale fiecărui individ (NIH, NHLBI, 2002).
Astmul bronşic la vârsta pediatrică reprezintă cea mai frecventă cauză de spitalizare la copii în SUA (470.000 cazuri anual), iar prezentările la UPU şi spitalizările au o tendinţă crescătoare. Este cea mai frecventă cauză de deces în copilărie, în special la anumite grupuri de risc (afro-americani). În SUA se înregistrează aproximativ 4000-5000 de decese anual din cauza astmului bronşic (Mannino DM et al., 2002).
Triggerii astmului sunt multipli: alergeni, exerciţiu fizic, infecţii respiratorii, medicamente, alimente, diverse alte patologii (refluxul gastroesofagian) sau stresul emoţional.
Clasic, astmul este caracterizat fiziopatogenic prin două evenimente succesive: iniţial bronhospasm, urmat ulterior de inflamaţia căilor respiratorii.
A. Faza iniţială apare la 30-60 de minute după expunerea la alergen şi se diminuează progresiv 30-90 de minute mai târziu. Este caracterizată în principal de bronhospasm, însoţit de hipersecreţie de mucus şi edem al căilor respiratorii. Aceste evenimente se traduc clinic prin dispnee, wheezing, tuse şi senzaţie de constricţie toracică – simptomele clasice de prezentare la medic.
B. Faza tardivă este caracterizată în principal de inflamaţie. Histamina şi alţi mediatori cresc reactivitatea căilor respiratorii, cauzând hiperreactivitate la alergeni şi la alţi stimuli, având drept consecinţă rezistenţa crescută a căilor respiratorii la fluxul aerian. Aceasta conduce la emfizem. Dacă inflamaţia căilor respiratorii nu este tratată, poate duce la modificări ireversibile în timp (remodelare).
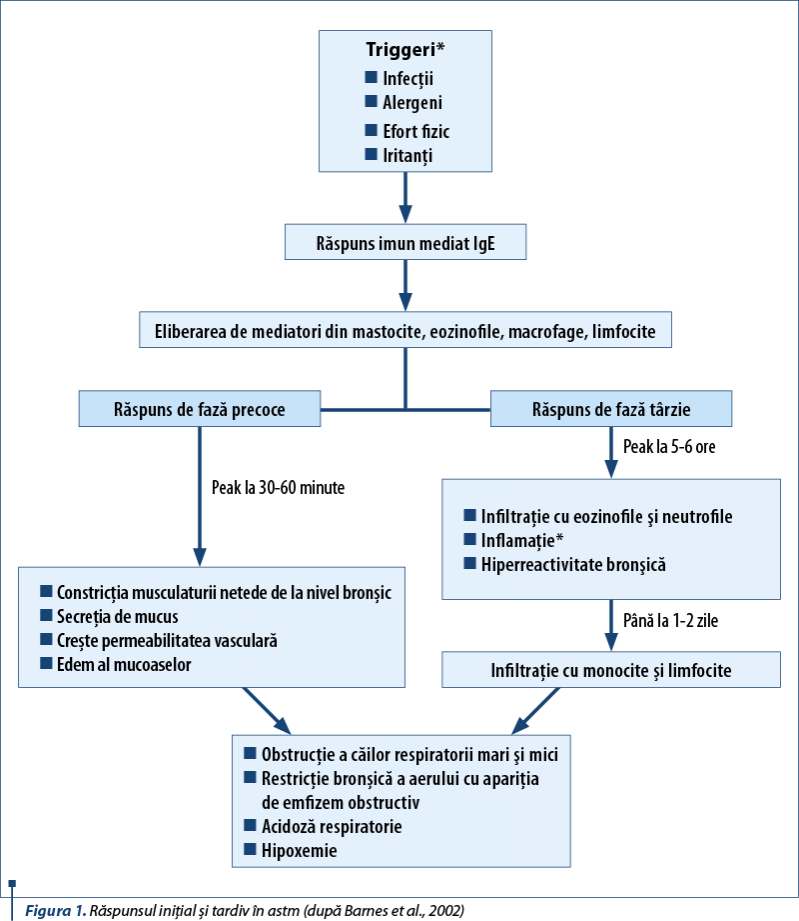
Astfel, ca rezultat al modificărilor fiziopatogenice, apar reducerea diametrului căilor respiratorii, creşterea rezistenţei căilor respiratorii la flux, concomitent cu inflamaţia mucoasei respiratorii, constricţia muşchiului neted şi producţia excesivă de mucus.
Wheezingul nu reprezintă un semn clinic cert pentru cuantificarea severităţii crizei astmatice. În crizele severe, „respiraţia şuierătoare” poate fi minimă sau poate lipsi, din cauza reducerii fluxului de aer în căile respiratorii. „Liniştea” auscultatorie este un semn clinic de gravitate, sugerând iminenţa insuficienţei respiratorii severe.
Circulaţia cu dificultate a aerului poate crea senzaţia de sufocare, ce duce la neliniştea şi agitaţia pacientului, intrându-se astfel într-un cerc simptomatic vicios. Mobilizarea secreţiilor poate deveni dificilă în aceste momente, accentuând anxietatea. Examenul clinic al pacientului în timpul crizei de astm relevă şi semne indirecte de hipoxemie: nelinişte, anxietate crescută, comportament inadecvat, tahicardie, hipertensiune arterială, puls paradoxal (scăderea tensiunii arteriale sistolice cu mai mult de 10 mmHg în inspir).
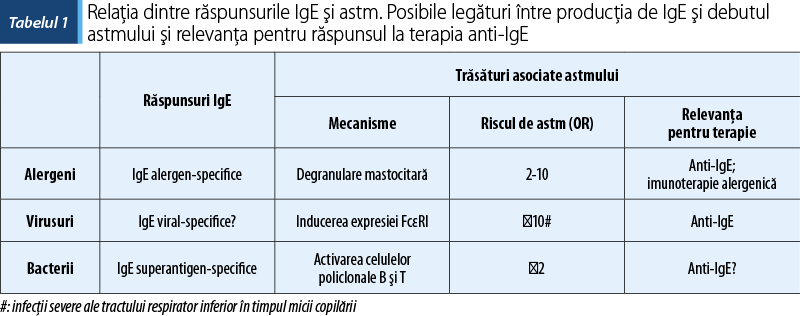
Imunoglobulinele E sunt un factor-cheie în astm. IgE reprezintă marca hipersensibilităţii de tip 1, dar mecanismele care reglementează producţia de IgE rămân încă în discuţie, nefiind pe deplin înţelese. Sinteza IgE are loc pe căi diferite, printr-un switch direct de clasă în centrele germinale ale celulelor B sau prin trecerea „secvenţială” de la IgM la IgG1 şi apoi de la IgG1 la IgE, care poate apărea în afara centrelor germinale.
Se discută în prezent despre endotipuri de astm, adică subtipuri de boală bazate pe mecanisme fiziopatologice imunologice distincte, care determină prezentări clinice variabile (fenotipuri). Identificarea acestora este esenţială pentru caracterizarea pacienţilor şi pentru o abordare terapeutică adecvată. În acest sens, identificarea triggerului este esenţială pentru caracterizarea complexă a fenotipului şi endotipului, cu consecinţe decizionale în alegerea terapiei optime (tabelul 1).
Alergenii sunt antigene din mediu capabile să inducă producţia de anticorpi IgE specifici. Legătura dintre sensibilizarea alergică (atopie) şi astm a fost observată de multă vreme. Un individ sensibilizat este posibil să devină clinic simptomatic la expunerea la alergen, iar această posibilitate depinde de mai mulţi factori: tipul de alergen la care este expus, doza, calea de administrare şi reactivitatea căilor respiratorii ale pacientului la un moment dat.
Deşi au fost identificate caracteristici comune ale alergenilor (marea majoritate sunt proteine sau glicoproteine <70 kDa), nu există nicio caracteristică structurală care să discrimineze alergenii de antigenii nealergici. Unii autori au speculat că potenţa alergenică ar putea fi atribuită faptului că majoritatea alergenilor nu au omologi bacterieni, spre deosebire de antigenii nealergeni ai aceleiaşi specii bacteriene. Cu toate acestea, conceptul este contestat după descoperirea recentă a IgE specifice Staphylococcus aureus la pacienţii cu astm asociat cu polipoză nazală. Funcţia biologică a alergenului este probabil un factor important, care determină alergenicitatea, precum şi astmagenicitatea acestuia (Emanuelsson C et al., 2007; Kowalski ML et al., 2011).
Rolul expunerii la alergeni (doză, moment) în momentul apariţiei unei boli alergice rămâne un subiect de dezbatere. S-a considerat iniţial că sensibilizarea are loc într-o manieră dependentă de doză, cel puţin pentru acarieni (Dermatophagoides pteronissinus, Dermatophagoides farinae). Pe de altă parte, sensibilizarea la animale de companie pare să urmeze o relaţie în formă de clopot, cu efecte de protecţie care apar la o doză mare de expunere, dacă dozele iniţiale de alergen la expunere au fost bine tolerate. Acest comportament diferit este atribuit proprietăţilor aerodinamice ale particulelor, care sunt mari pentru acarieni (>10 µm) şi limitate într-un rezervor de praf în absenţa perturbaţiilor atmosferice, în timp ce pentru animalele de companie diametrul este mai mic (<5 µm) şi densitatea lor este mai mică în aer. Este influenţată, astfel, expunerea unui individ, dozele de expunere fiind mult mai mici pentru acarieni; se consideră că nu se poate induce toleranţa.
În prezent, nu s-a ajuns la un consens în ceea ce priveşte vârsta, doza şi mecanismul prin care expunerea la alergeni va induce sensibilizarea, încât nu se poate realiza un model de predictibilitate pe termen scurt şi lung, cu scop de elaborare a noi pârghii terapeutice. Mai mult, efectele evitării alergenilor în managementul pe termen lung al astmului sunt variabile, depinzând bineînţeles de caracteristicile imunologice ale gazdei. Această observaţie sugerează că măsurile de evitare a alergenilor sunt insuficiente pentru a reduce în mod adecvat nivelurile de expunere sau, altfel spus, că boala va deveni, la un moment dat, independentă de alergeni (Sheffer AL et al., 2004).
Virusurile
Acestea reprezintă al doilea factor de risc major pentru dezvoltarea astmului la copil. Vorbim în special despre infecţiile respiratorii virale severe la vârstă mică (înainte de 3 ani), care au consecinţe pe termen lung. Riscul de dezvoltare a astmului bronşic este de până la 10 ori mai mare după infecţiile severe cu rinovirus.
În plus faţă de infecţia virală, sensibilizarea IgE la alergeni obişnuiţi (cum ar fi acarienii) ar putea creşte şi mai mult riscul de astm. Pacienţii cu astm nu prezintă mai multe răceli comune comparativ cu pacienţii nonastmatici, dar prezintă simptome mai severe şi o durată mai lungă a bolii.
Lukkarinen et al. (2017) caracterizează rinovirusul ca factor de risc pentru astm la vârsta de 7 ani pe baza primului episod sever de wheezing. Aproape toţi pacienţii (90%) luaţi în studiu au prezentat wheezing asociat infecţiilor respiratorii în copilăria mică. Interesant este faptul că astmul nonatopic la vârsta de 7 ani a fost asociat cu fumatul parental sau cu infecţia cu virusul sinciţial respirator (RSV) (fără dovezi de infecţie cu rinovirus). Pe lângă furnizarea de biomarkeri predictivi pentru astmul atopic versus nonatopic, acest studiu sugerează că mecanismele bolii induse de virus diferă între rinovirus şi RSV. De aceea, identificarea etiologică a infecţiei virale (deşi costisitoare în momentul actual în practică) poate fi un element de prognostic pentru evoluţia astmului pe termen lung.
Astmul alergic
Astmul alergic (sau atopic) se caracterizează prin dezvoltarea unui proces inflamator persistent de tip Th2 declanşat de expunerea la anumiţi alergeni inhalatori, care la persoanele sensibile activează epiteliul căilor respiratorii şi celulele dendritice, ducând la sinteza anticorpilor IgE specifici. Reexpunerea la alergen poate provoca activarea receptorilor FceRI de pe mastocite, producând degranularea acestora cu eliberare de mediatori ai inflamaţiei şi bronhoconstricţie imediată. Ulterior se observă o creştere a numărului de eozinofile la nivelul mucoasei şi, implicit, a răspunsului inflamator în fază tardivă.
Prezenţa IgE specific în ser este o caracteristică esenţială a astmului alergic, evidenţiată serologic sau de testarea cutanată, care oferă dovezi de reactivitate in vivo a mastocitelor (testarea cutanată). Eozinofilele sanguine sunt, de obicei, moderat crescute (400-1000/µL), iar pacientul prezintă deseori şi comorbidităţi: rinită alergică (50-90% din cazuri), dermatită atopică (40% din cazuri).
Fenotipul atopic în sine este determinat genetic, în special de polimorfismele cu un singur nucleotid la genele Th2 – locusul 17q12. Într-un studiu amplu, IgE seric ridicat a fost observat la copiii cu astm sever şi la adulţii cu astm cu debut precoce, în timp ce IgE seric foarte ridicat (>2000 kU/l) a fost, de asemenea, corelat cu severitatea dermatitei.Severitatea astmului alergic este asociată cu vârsta de debut. Astmul cu debut în copilărie poate fi asociat cu progresia către astm sever. Astmul cu debut tardiv, după pubertate, este asociat cu un declin accentuat al funcţiei pulmonare.
Astmul nonalergic (intrinsec)
Fenotipul „nonalergic” al astmului a fost descris pentru prima dată de Rackemann ca astm cu debut tardiv cauzat de un „fenomen necunoscut”. Acesta afectează 25-30% dintre pacienţi, la care există o serie de particularităţi: absenţa anticorpilor IgE specifici detectabili în ser, teste cutanate negative la aeroalergenii comuni, debutul nu este în copilărie, ci mai tardiv. Este afectat predominant sexul feminin, iar în familie nu există istoric de astm sau atopie. Se asociază frecvent cu rinosinuzita cronică, polipoza nazală, cu hipersensibilitatea la aspirină (adesea denumit sindromul de triadă Widal sau Samters) şi cu o evoluţie mai severă (Graefe H et al., 2012). Asocierea redusă cu istoricul familial, spre deosebire de bolile atopice, sugerează că mediul este mai important decât genetica la debutul bolii, iar implicarea IgE este locală, acesta fiind elementul patogenic emblematic.
Fenotiparea astmului
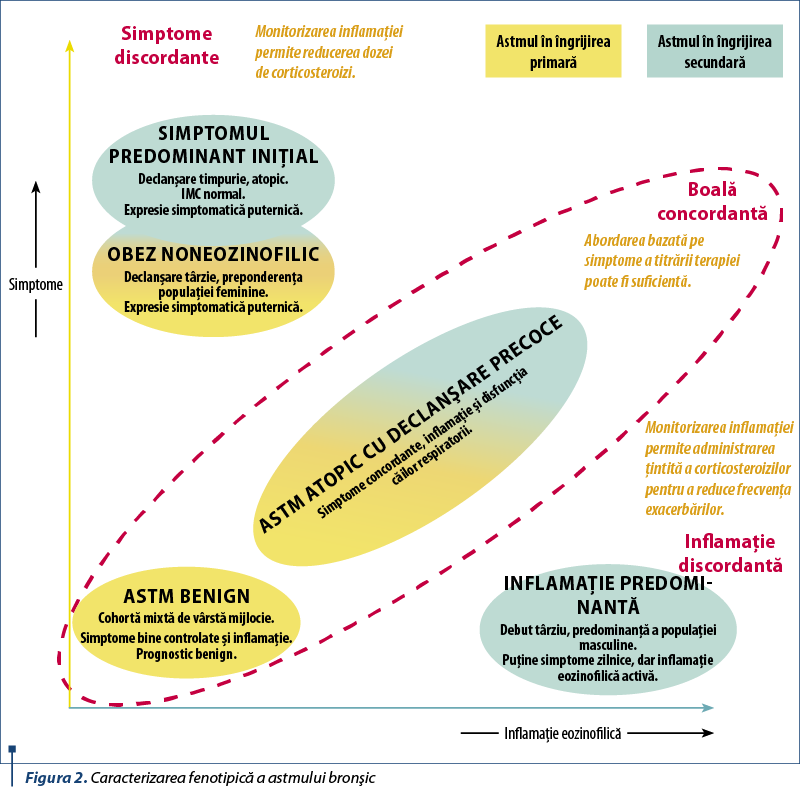
Astmul nu este o boală în sine, ci un sindrom în care principalul simptom îl reprezintă dispneea. În ultima perioadă, în lumina elucidărilor patogenice, complexitatea astmului bronşic a fost caracterizată fenotipic, cu scopul de a înţelege mai bine şi de a individualiza tratamentul, prevenţia şi controlul. Prin urmare, clasificarea fenotipurilor de astm este bazată pe terenul genetic, simptome, debut, evoluţie, infecţii şi pe funcţia respiratorie.
Biomarkerii reprezintă indicatori măsurabili de evaluare a statusului pacientului, care pot oferi informaţii multiple despre mecanismul fiziopatologic, istoricul bolii, severitatea, progresia şi răspunsul la tratament.
Medicina de precizie reprezintă o abordare nouă a pacientului, bazată pe managementul personalizat al bolii: endotiparea moleculară, imunologică şi funcţională, participarea pacientului sau a părintelui la decizia terapeutică şi considerarea aspectelor predictive şi preventive ale tratamentului. Este o abordare personalizată, complexă, pe baza elementelor de mai sus, dar la care şansele de aderenţă şi cunoaştere/control al simptomelor sunt mai bune decât la aplicarea unei terapii standardizate. Ghidurile actuale în vigoare ating problematica fenotipurilor de astm, cu aplicabilitate mai ales la vârsta pediatrică.
Concluzii
Astmul nu este o singură boală, ci un sindrom în care principalul simptom este dispneea. Sunt implicaţi factori genetici şi de mediu, iar tabloul clinic este variat, prin urmare clasificarea fenotipică se bazează pe simptome, debut, istoric, infecţii şi pe funcţia respiratorie. Fenotipul are la bază un endotip – mecanism patogenic complex. Deocamdată nu este clar dacă abordarea fenotipică are un avantaj clinic imediat, dar este utilă pentru prevenţie, control şi personalizarea tratamentului.
Conflict of interests: The authors declare no conflict of intersts.
Bibliografie
-
Barnes PJ, Drazen JM, Rennard SI, Thomson NC. Asthma and COPD: Basic Mechanisms and Clinical Management. Academic Press, 2002.
-
Emanuelsson C, Spangfort MD. Allergens as eukaryotic proteins lacking bacterial homologues. Mol Immunol. 2007; 44:3256-3260.
-
Graefe H, Roebke C, Schafer D, Meyer JE. Aspirin Sensitivity and Chronic Rhinosinusitis with Polyps: A Fatal Combination. Hindawi Publishing Corporation Journal of Allergy Volume. 2012; Article ID 817910, 10 pages, doi:10.1155/2012/817910.
-
Guidelines for the Diagnosis and Management of Asthma - Update on Selected Topics 2002. NIH, NHLBI. June 2002. NIH publication no. 02-5075.
-
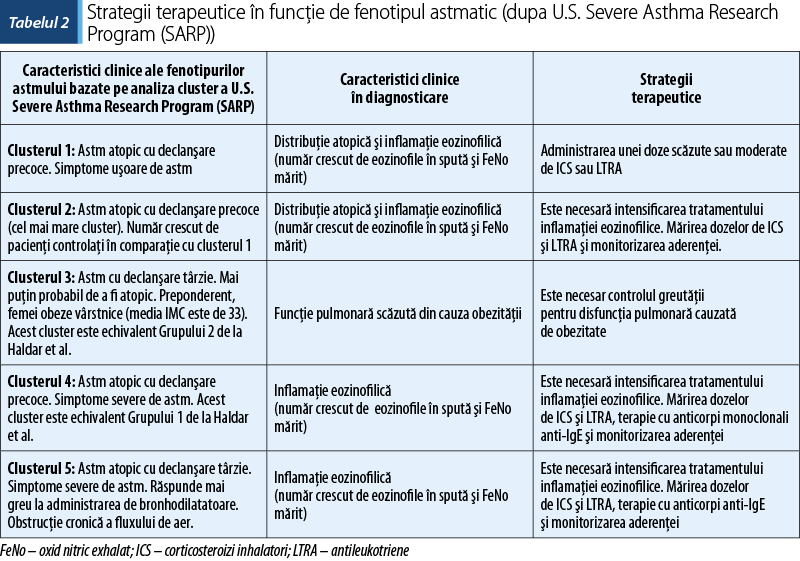
Haldar P, Pavord ID, Shaw DE et al. Cluster Analysis and Clinical Asthma Phenotypes. Am J Respir Crit Care Med. 2008 Aug 1; 178(3): 218–224.
-
Kowalski ML, Cieslak M, Perez-Novo CA, et al. Clinical and immunological determinants of severe/refractory asthma (SRA): association with Staphylococcal superantigen-specific IgE antibodies. Allergy. 2011; 66:32-38.
-
Lukkarinen M, Koistinen A, Turunen R, Lehtinen P, Vuorinen T, Jartti T. Rhinovirus-induced first wheezing episode predicts atopic but not nonatopic asthma at school age. J Allergy Clin Immunol. 2017; 140:988-95.
-
Mannino DM, Homa DM, Akinbami LJ, et al. Surveillance for asthma – United States, 1980-1999. MMWR Surveill Summ. 2002; 51:1-13.
-
Platts-Mills TA. Allergen avoidance in the treatment of asthma: problems with the meta-analyses. J Allergy Clin Immunol. 2008; 122: 694-696.
-
Sheffer AL. Allergen avoidance to reduce asthma-related morbidity. N Engl J Med. 2004; 351:1134-1136.
-
Woodcock A, Forster L, Matthews E, et al. Control of exposure to mite allergen and allergen-impermeable bed covers for adults with asthma. N Engl J Med. 2003; 349:225-236.
Articole din ediţiile anterioare
Provocări în pandemie: pneumotoraxul la copil
Pandemia de COVID-19 cu care încă ne confruntăm continuă să aducă noi provocări în gestionarea multor boli cronice care îşi modifică evoluţia.
Sindromul de lob mijlociu în alergia respiratorie - prezentare de caz
Sindromul de lob mijlociu este o entitate clinico-radiologică în care obstrucția parțială sau totală a lumenului bronhiei mijlocii prin procese inf...
Medicaţia antitermică şi astmul bronşic la copil
Utilizarea medicaţiei antitermice la pacienţii cu astm bronşic a generat unele controverse, cunoscute fiind din literatură interferenţele cu patoge...
Rolul alimentaţiei naturale în prevenţia unei probleme mondiale de sănătate publică: obezitatea la vârsta pediatrică
Obezitatea în rândul copiilor şi adolescenţilor a devenit o problemă globală de sănătate, cu o creştere semnificativă a prevalenţei în ultimii an...