Detectarea precoce a restricţiei de creştere intrauterină prin screening combinat
Early detection of intrauterine growth restriction by combined screening
Abstract
Intrauterine growth restriction may greatly influence the neonatal period by increasing perinatal morbidity and mortality. First trimester serum screening is commonly used to identify chromosomal anomalies. In recent studies, many authors have described the potential for the detection of pathological placentation through these markers. Several potential predictive markers, such as the Doppler study, 3D placental volume measurements and maternal serum markers, were studied. Modern assessment proposes a combined algorithm that uses fetal ultrasound, the Doppler evaluation of uterine arteries as well as biochemical markers for improving the prediction rate of restricted fetuses.Keywords
fetal growth restrictionscreeningultrasoundbiochemical markersRezumat
Restricţia de creştere intrauterină poate influenţa major perioada neonatală, prin creşterea morbidităţii şi mortalităţii perinatale. Screeningul seric de prim trimestru este folosit de rutină pentru identificarea anomaliilor cromozomiale. În ultimii ani, numeroşi autori au studiat potenţialul de depistare a placentaţiei patologice prin prisma acestor markeri. Au fost identificaţi câţiva markeri predictivi potenţiali, precum studiul Doppler, măsurătorile de volum 3D aie placentei şi markerii serului matern. Evaluarea modernă propune un algoritm combinat, care foloseşte studiul ecografic al fătului şi al anexelor fetale, studiul Doppler al arterelor uterine, precum şi markeri biochimici prin care se încearcă îmbunătăţirea ratei de predicţie a restricţiei de creştere intrauterină.Cuvinte Cheie
restricţie de creştere intrauterinăscreeningmarkeri sericiultrasonografieRestricţia de creştere intrauterină se referă la incapacitatea fătului de a ajunge la potenţialul său maxim de creştere determinat genetic, prin scăderea patologică a ratei de creştere fetală(1).
Prematuritatea şi malformaţiile congenitale reprezintă primele cauze de mortalitate perinatală, fiind urmate de retardul de creştere intrauterină şi consecinţele acestuia(2).
S-a dovedit că identificarea precoce a sarcinilor supuse complicaţiilor date de retardul de creştere intrauterină permite instituirea unui management eficient, care poate reduce semnificativ morbiditatea şi mortalitatea perinatală până la 4-5 ori(3).
O greutate scăzută la naştere este observată la 10% dintre sarcini, însă doar o mică parte dintre acestea au un substrat etiopatogenic patologic, respectiv restricţia de creştere.
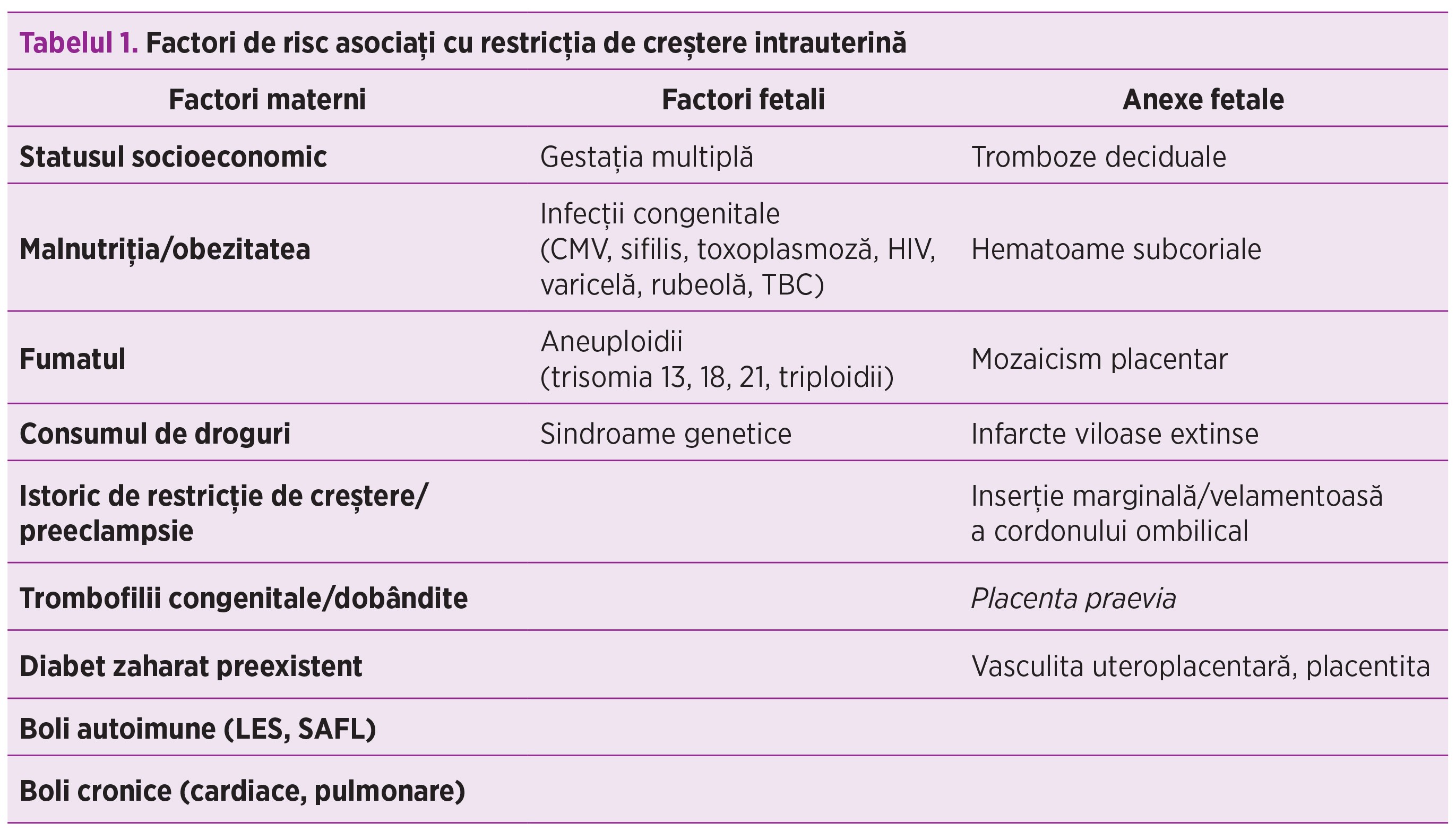
Există o paletă largă de factori de risc pentru restricţia de creştere intrauterină care pot fi identificaţi şi monitorizaţi în cadrul vizitelor prenatale (tabelul 1)(4).
Toţi aceşti factori sunt uşor de evaluat, dar au o valoare predictivă redusă.
Evaluarea modernă propune un algoritm combinat, care foloseşte studiul ecografic al fătului şi al anexelor fetale, studiul Doppler al arterelor uterine, precum şi stabilirea markerilor biochimici. Prin combinarea indicilor ultrasonografici cu parametrii biochimici şi istoricul matern se încearcă îmbunătăţirea ratei de predicţie a restricţiei. Această abordare combinată reflectă mecanisme etiopatogenice diferite: profilul alterat al velocităţilor pe arterele uterine sugerează afectarea invaziei arterelor spiralate şi vasculopatia asociată, în timp ce markerii biochimici demonstrează alterarea funcţiei placentare, având ca rezultat comun hipoxia cronică(5).
Un istoric pozitiv al factorilor de risc ai restricţiei de creştere poate ridica problema unei supravegheri atente, cu obiectivul specific al detectării timpurii a ratei de creştere patologică(6). Testele diagnostice suplimentare ar putea avea o relevanţă mai bună în cazul unei populaţii selectate cu risc ridicat(7). Cu toate acestea, unii factori clinici au arătat un impact diferit pentru fiecare caz, deoarece instrumentele eficiente de screening nu au fost încă dovedite(8).
Markeri ecografici
Evaluarea Doppler a arterelor uterine reprezintă o metodă neinvazivă, care poate identifica cele mai precoce semne de afectare a circulaţiei uteroplacentare. Poate fi folosită ca metodă de screening atât în trimestrul întâi, cât şi în trimestrul al doilea, pentru predicţia dezvoltării ulterioare a preeclampsiei, restricţiei de creştere intrauterină sau a riscului de moarte in utero(9).Invazia trofoblastică afectată a arterelor spiralate materne este asociată cu un risc crescut de dezvoltare ulterioară a restricţiei, preeclampsiei şi decolării de placentă. O serie de studii de screening care implică evaluarea impedanţei fluxului în arterele uterine a examinat valoarea potenţială a ecografiei Doppler în identificarea sarcinilor cu placentaţie patologică. Majoritatea variabilelor date de studiul arterelor uterine au fost analizate în studii transversale, fără a se ţine cont de faptul că placentaţia este un proces dinamic şi progresiv.
În 1994, North şi colab., iar în 1998, Irion şi colab. au subliniat faptul că studiul Doppler al arterelor uterine nu reprezintă un test screening de încredere pentru nulipare(10,11).
În anii 2000, mai multe studii legate de parametrii Doppler ai arterelor uterine în săptămânile 10-14 de gestaţie au subliniat valoarea slab predictivă pentru restricţia de creştere intrauterină, dar o predicţie mai bună pentru preeclampsia asociată cu retard de creştere şi pentru cea asociată cu naştere prematură la <32 SA(12).
Începând cu studiile lui Campbell şi Trudinger în anii 1980, evaluarea Doppler a arterelor uterine s-a dovedit a fi o tehnică cu rezultate promiţătoare în predicţia restricţiei de creştere. Atunci când compartimentul matern eşuează în transformarea sa dintr-un teritoriu cu rezistenţe înalte într-unul cu rezistenţe joase are loc invazia trofoblastică incompletă a arterelor spiralate, cu dezvoltarea ulterioară a insuficienţei placentare cronice progresive. În aceste cazuri, indicele de rezistenţă (RI) sau indicele de pulsatilitate (PI) sub percentila 90-95 ori prezenţa unui notch uni-/bilateral se asociază cu o valoare RI >0,55 şi o valoare PI>1,45(13).
De asemenea, există suficiente dovezi care demonstrează că invazivitatea trofoblastului este maximă în trimestrul întâi, ceea ce justifică iniţierea evaluării Doppler încă de atunci(14).
Cascada de modificări ale fluxului arterelor uterine cu debut în trimestrul întâi se corelează cu declanşarea ulterioară a complicaţiilor hipertensive şi ale retardului de creştere. Grupul cu cel mai mare risc pentru complicaţii neonatale este cel al gravidelor cu indicele de pulsatilitate persistent alterat. Mai multe studii au demonstrat puternica asociere între creşterea rezistenţelor pe arterele uterine în trimestrul doi şi apariţia restricţiei(9,10,15).
Fluxul end-diastolic scăzut şi prezenţa notch-ului sunt caractere fiziologice ale statusului non-gravidic şi ale fluxului arterelor uterine din primele săptămâni de sarcină. Persistenţa notch-ului diastolic peste 24 de săptămâni de sarcină se asociază cu invazie trofoblastică inadecvată(16).
Notch-ul diastolic traduce elasticitatea peretelui vascular. Acesta pare dependent de interacţiunea maternoplacentară şi reflectă gradul de decidualizare a arterelor spiralate(17).
Cei mai eficienţi factori predictivi pentru preeclampsie şi restricţie de creştere sunt PI crescut şi prezenţa notch-ului bilateral. Alţi indici Doppler nu şi-au dovedit eficienţa.
Morfogeneza placentei este direct influenţată de dezvoltarea hemodinamicii uteroplacentare.
După 1994, când Rubin şi colab. au descris tehnologia Power Doppler, mulţi cercetători au evaluat volumul placentar şi vascularizaţia acesteia folosind tehnica Color sau Power Doppler şi volumetria 3D/4D(18,19). Un alt element de studiu evaluat în trimestrul întâi au fost arterele spiralate. Mäkikallio şi colab. au descoperit că impedanţa acestora scade începând cu a cincea săptămână de gestaţie. Arterele uterine şi cele arcuate îşi pierd tonusul din a opta săptămână de gestaţie(20).
Un alt studiu, condus de Hung, a concluzionat faptul că evaluarea Doppler a arterelor spiralate între 13-19 săptămâni de gestaţie nu este un test screening sensibil pentru predicţia restricţiei la populaţia cu risc scăzut(21).
Mai multe studii, care au comparat prognosticul favorabil versus sarcini complicate prin restricţie de creştere, au subliniat faptul că testarea Doppler a arterelor spiralate nu a dovedit o valoare predictivă înaltă, fiind insuficientă ca screening pentru restricţia de creştere intrauterină(22).
Studiul ultrasonografic al pacientelor cu restricţie de creştere intrauterină cuprinde atât determinarea parametrilor biometriei fetale, cât şi evaluarea volumului placentar şi a cantităţii de lichid amniotic(23).
În ceea ce priveşte evaluarea volumului placentar în primul trimestru, Rizzo şi colab. au demonstrat, în 2009, o corelaţie semnificativă între volumul placentar redus şi greutatea scăzută la naştere (<percentila 10) la gravidele cu risc crescut şi valori scăzute ale PAPP-A(24).
În 2013, studiile revizuite au subliniat utilitatea folosirii Indexului de Vascularizaţie a patului placentar prin 3D Power Doppler în detectarea sarcinilor supuse riscului complicaţiilor. Acest index a demonstrat o rată de detecţie de 66,2%, faţă de studiul Doppler al arterelor uterine din trimestrul al doilea, cu o rată de detecţie de 50%(25).
Diagnosticarea restricţiei de creştere intrauterină depinde de acurateţea estimării vârstei gestaţionale. Datarea exactă în primul trimestru este esenţială, fiind posibilă datorită variabilităţii minime în secvenţa de apariţie a structurilor embrionare.
Morbiditatea şi mortalitatea neonatală în restricţia de creştere intrauterină (RCIU) se corelează direct cu gradul insuficienţei circulatorii şi cu deficitul de masă corporală.
Biometria fetală necesită compararea cu normogramele corespunzătoare vârstei gestaţionale, putând fi apreciată rata de creştere intrauterină. Este necesară luarea în calcul a valorilor maxime şi minime acceptabile pentru vârsta gestaţională. În studiile lui Baschat şi colab. s-a observat că valoarea predictivă pozitivă a circumferinţei abdominale şi a greutăţii fetale pentru diagnosticarea restricţiei de creştere este de 36,6% şi, respectiv, 50%(26). Parametrul fetal cu cea mai mare valoare predictivă este circumferinţa abdominală. De asemenea, se utilizează raportul dintre circumferinţa abdominală şi dimensiunile capului fetal, precum şi cu lungimea femurului fetal. În comparaţie cu raportul dintre circumferinţa craniului şi circumferinţa abdomenului, raportul dintre lungimea femurului şi circumferinţa abdomenului este constant pe tot parcursul sarcinii.
Un alt indicator al restricţiei de creştere intrauterină este indicele ponderal fetal (IP), care se calculează după formula: greutatea estimativă a fătului/lungimea femurului. Valoarea normală a IP este de 8,325. Dacă IP este mai mic de 7, creşte probabilitatea restricţiei de creştere fetală.
Alături de protocoalele ultrasonografice, screeningul serului matern este în curs de investigare extinsă, prin descoperirea de noi markeri biochimici corelaţi cu creşterea fetală.
Screeningul seric de prim trimestru este folosit uzual pentru identificarea anomaliilor cromozomiale. În ultimii ani, numeroşi autori au studiat potenţialul de depistare a placentaţiei patologice prin prisma acestor markeri. Au fost studiaţi câţiva markeri predictivi potenţiali, precum studiul Doppler, măsurătorile de volum 3D şi markerii serului matern. Cu toate acestea, sunt raportate diferenţe mari, şi chiar controversate, în ceea ce priveşte performanţa de screening. Studiile anterioare care au evaluat PAPP-A şi β-hCG liber măsurate în primul trimestru în corelaţie cu IUGR au oferit rezultate contradictorii.
Nivelurile scăzute ale ambilor markeri au fost raportate în mod constant ca fiind asociate cu restricţia de creştere intrauterină(27).
Valorile scăzute ale β-hCG nu au fost semnificative din punct de vedere statistic(27,28).
Un studiu recent a constatat o asociere pozitivă între nivelurile ridicate de β-hCG (>90 percentilă) şi restricţia de creştere intrauterină. Mai mult, acelaşi studiu a constatat o asociere semnificativă statistic între etnia afro-americană şi restricţia de creştere intrauterină, cu un risc relativ de 2, 7 şi valoarea p = 0,001(29).
Asocierea proteinei plasmatice asociate sarcinii (PAPP-A), proteină legată de factorul de creştere a insulinei, al cărei nivel depinde de volumul şi funcţia placentară, a fost evaluată în mai multe studii cu rezultate congruente. Această enzimă este unică printre alte proteaze multifuncţionale capabile să degradeze proteina-4 care leagă factorul de creştere insulino-dependent (IGFBP-4).
În anul 2000, Ong şi colab. au evaluat 5584 de sarcini unice la 10-14 săptămâni de gestaţie prin măsurarea β-hCG şi PAPP-A, constatând că nivelurile scăzute ale acestor markeri au fost asociate cu dezvoltarea ulterioară a complicaţiilor(30).
Nivelurile scăzute ale PAPP-A au fost menţionate ca predictori ai restricţiei de creştere intrauterină şi de Goetzinger şi colab. Sensibilitatea detectării restricţiei de creştere la un nivel al PAPP-A în primul trimestru sub percentila 5 variază între 8% şi 33%, iar PAPP-A, ca marker unic, este un instrument insuficient de screening pentru restricţia de creştere(31,13).
Mai mulţi autori au raportat o creştere semnificativă a valorilor hCG ale serului matern în trimestrul al II-lea la gravidele care au dezvoltat RCIU, variind de la 1,21 la 2,5 MOM(32,33), o creştere de aproximativ două până la trei ori a riscului de restricţie intrauterină fiind observată la pacientele cu niveluri crescute de hCG, inexplicabile, în al doilea trimestru(33).
În 2008, în numele Comitetului de Genetică al Societăţii de Obstetrică şi Ginecologie din Canada, Gagnon şi colab. au revizuit prognosticul obstetrical asociat cu niveluri anormale de markeri serici materni unici sau multipli utilizaţi în screeningul pentru aneuploidie. Au fost analizaţi PAPP-A, alfafetoproteina, β-hCG, estriolul, estriolul neconjugat, inhibina-A; printre concluzii, un PAPP-A scăzut inexplicabil (<0,4MM) şi/sau un hCG scăzut în primul trimestru au fost asociate cu o frecvenţă crescută a dezvoltării complicaţiilor neonatale(34).
În al treilea trimestru, valorile hCG sunt semnificativ mai mari la sarcinile cu restricţie, fiind asociate velocimetrii patologice ale arterei ombilicale şi insuficienţă placentară vasculară. În schimb, sarcinile complicate cu restricţie, dar cu parametri Doppler normali, arată niveluri normale de hCG(35).
În sarcină, hormonul de creştere pituitar este înlocuit de hormonul de creştere placentar, secretat de sinciţiotrofoblast(36). Se consideră că hormonul de creştere placentar joacă un rol important în funcţia şi dezvoltarea placentei, influenţând indirect creşterea fetală(37).
Factorii angiogenetici implicaţi în placentaţie, precum VEGF (factorul de creştere endotelial) şi PIGF (factorul de creştere placentar), au fost evaluaţi în multe studii(38). Dezechilibrul dintre factorii angiogenici şi antiangiogenici pare să se coreleze cu apariţia preeclampsiei şi a restricţiei de creştere(38).
Alţi markeri potenţiali pentru predicţia restricţiei sunt A-dezintegrinele şi metaloproteaza 12 (ADAM-12). Când sunt testate în primul trimestru, au o rată de detecţie între 7,16% şi 20%(39,40).
Concluzii
Restricţia de creştere intrauterină reprezintă o complicaţie gravă a sarcinii, cu prognostic fetal neonatal incert, evaluarea timpurie fiind subiectul principal al studiilor actuale. În obţinerea acestui deziderat este necesar un algoritm de diagnostic precoce, folosind modelul de creştere în primul trimestru, studiul Doppler al arterelor uterine, evaluarea volumului placentar şi a vascularizaţiei acesteia, în asociere cu markeri biochimici materni. Această patologie multifactorială face dificilă instituirea unui ghid unic de diagnostic şi management. În practica clinică actuală, detectarea timpurie a feţilor supuşi riscului restricţionării poate orienta managementul şi instituirea terapiilor precoce, în scopul reducerii morbidităţii şi mortalităţii perinatale.Bibliografie
1. Mandruzzato G, Antsaklis A, Botet F, Chervenak FA, Figueras F, Grunebaum A, Puerto B, Skupski D, Stanojevic M. Intrauterine restriction (IUGR). J Perinat Med. 2008; 36(4):277-281.
2. Iliadi-Tulbure C. Retardul de dezvoltare intrauterină (RDIU) al fătului: Aspecte contemporane de diagnostic şi metoda optimă de finalizare a sarcinii. Teză de doctor în medicină, Chişinău; 2008, 128.
3. Lindqvist PG, Molin J. Does antenatal identification of small for-gestational age fetuses significantly improve their outcome? Ultrasound Obstet Gynecol. 2005; 25:258–264.
4. Cunningham FG LK, Bloom SL, Hauth JC, Gilstrap III LC, Wenstrom KD. Fetal Growth Disorders.Williams Obstetrics, 22nd ed., Chapter 38, McGraw Hill, New York, 2008; 893-910.
5. Pilalis A, Souka AP, Antsaklis P, Daskalakis G, Papantoniou N, Mesogitis S, Antsaklis A. Screening for pre-eclampsia and fetal growth restriction by uterine artery Doppler and PAPP-A at 11-14 weeks' gestation. Ultrasound Obstet Gynecol. 2007; 29(2):135-140.
6. De Jong CL, Francis A, Van Geijn HP, Gardosi J. Customized fetal weight limits for antenatal detection of fetal growth restriction. Ultrasound Obstet Gynecol. 2000; 15(1):36-40.
7. Conde-Agudelo A, Villar J, Lindheimer M. World Health Organization systematic review of screening tests for preeclampsia. Obstet Gynecol. 2004; 104(6):1367-1391.
8. Farag K, Hassan I, Ledger WL. Prediction of preeclampsia: can it be achieved? Obstet Gynecol Surv. 2004; 59(6):464-82.
9. Bower S, Schuchter K, Campbell S. Doppler ultrasound screening as part of routine antenatal scanning: prediction of preeclampsia and intrauterine growth retardation. BJOG 1993; 100:989–994.
10. Irion O, Masse J, Forest JC, Moutquin JM. Prediction of preeclampsia, low birthweight for gestation and prematurity by uterine artery blood flow velocity waveforms analysis in low risk nulliparous women. BJOG 1998; 105: 422–429.
11. North RA, Ferrier C, Long D, Townend K, Kincaid-Smith P. Uterine artery Doppler flow velocity waveforms in the second trimester for the prediction of preeclampsia and fetal growth retardation. Obstet Gynecol. 1994; 83(3):378-386
12. Melchiorre K, Leslie K, Prefumo F, Bhide A, Thilaganathan B. Firsttrimester uterine artery Doppler indices in the prediction of small-for-gestational age pregnancy and intrauterine growth restriction. Ultrasound Obstet Gynecol. 2009; 33(5):524-529.
13. Zhong Y, Tuuli M, Odibo AO. First trimester assessment of placenta function and the prediction of preeclampsia and intrauterine growth restriction. Prenat Diagn. 2010; 30(4):293-308
14. Caniggia I, Winter J, Lye SJ, Post M. Oxygen and placental development during the first trimester: implications for the pathophysiology of pre-eclampsia. Placenta 2000; 21 (Suppl A):25–30
15. Albaiges G, Missfelder-Lobos H, Parra M, Lees C, Cooper D, Nicolaides KH. Comparison of color Doppler uterine artery indices in a population at high risk for adverse outcome at 24 weeks’ gestation. Ultrasound Obstet Gynecol 2003; 21:170–173.
16. Bolte AC, Dekker GA. Uterine artery Doppler as screening tool for preeclampsia. In Wildschut HJ, Weiner CP, editors. When to screen in obstetrics and gynecology. Philadelphia: Saunders Elsevier; 2006:408-419.
17. Hafner E, Schuchter K, Metzenbauer M, Philipp K. Uterine artery Doppler perfusion in the first and second pregnancies. Ultrasound Obstet Gynecol 2000; 16:625–629.
18. Rubin JM, Bude RO, Carson PL, Bree RL, Adler RS. Power Doppler US: a potentially useful alternative to mean frequency-based color Doppler US. Radiology. 1994; 190(3):853-861.
19. Pretorius DH, Nelson TR, Baergen RN, Pai E, Cantrell C. Imaging of placental vasculature using threedimensional ultrasound and color power Doppler: a preliminary study. Ultrasound Obstet Gynecol. 1998; 12(1):45-49.
20. Mäkikallio K, Tekay A, Jouppila P. Uteroplacental hemodynamics during early human pregnancy: a longitudinal study. Gynecol Obstet Invest. 2004; 58(1):49-54
21. Hung JH, Ng HT, Pan YP, Yang MJ, Shu LP. Color Doppler ultrasound, pregnancy-induced hypertension and small-for-gestational-age fetuses. Int J Gynaecol Obstet. 1997; 56(1):3-11.
22. Gebb J, Dar P. Colour Doppler ultrasound of spiral artery blood flow in the prediction of pre-eclampsia and intrauterine growth restriction. Best Pract Res Clin Obstet Gynaecol. 2011; 25(3):355-366.
23. Galan HL. Timing delivery of the growth-restricted fetus. In: Semin Perinatol. 2011; 35(5): 262-269.
24. Rizzo G, Capponi A, Pietrolucci ME, Capece A, Arduini D. First-trimester placental volume and vascularization measured by 3-dimensional power Doppler sonography in pregnancies with low serum pregnancy-associated plasma protein A levels. J Ultrasound Med. 2009; 28(12):1615-1622.
25. Hafner E, Metzenbauer M, Stümpflen I, Waldhör T. Measurement of placental bed vascularization in the first trimester, using 3D-power-Doppler, for the detection of pregnancies at-risk for fetal and maternal complications. Placenta. 2013; 34(10):892-898
26. Baschat A. A. et al. Umbilical Artery Doppler screening for detection of the small fetus in need of antepartum surveillance. In: Am J Obstet Gynecol, 2000; 182 (1Pt 1), 154-158.
27. Spencer, K., Yu, C. K. H., Cowans, N. J., Otigbah, C. and Nicolaides, K. H. Prediction of pregnancy complications by first-trimester maternal serum PAPP-A and free β-hCG and with second-trimester uterine artery Doppler. Prenat. Diagn. 2005, 25:949–953.
28. K Spencer, N J Cowans, K Avgidou, F Molina, K H Nicolaides. First-trimester biochemical markers of aneuploidy and the prediction of small-for-gestational age fetuses. Ultrasound in Obstetrics and Gynecology 2008; 31(1):15-19.
29. Goetzinger KR, Singla A, Gerkowicz S, et al. The efficiency of first-trimester serum analytes and maternal characteristics in predicting fetal growth disorders. Am J Obstet Gynecol. 2009; 201: 412.e1–412.e6
30. Ong CY, Liao AW, Spencer K, Munim S, Nicolaides KH. First trimester maternal serum free beta human chorionic gonadotrophin and pregnancy associated plasma protein A as predictors of pregnancy complications. BJOG. 2000;107(10):1265-1270.
31. Leung TY, Sahota DS, Chan LW, Law LW, Fung TY, Leung TN, Lau TK. Prediction of birth weight by fetal crown rump length and maternal serum levels of pregnancy-associated plasma protein-A in the first trimester. Ultrasound Obstet Gynecol. 2008; 31(1):10-14
32. Gonen R, Perez R, David M, Dar H, Merksamer R, Sharf M The association between unexplained second-trimester maternal serum hCG elevation and pregnancy complications. Obstet Gynecol 1992; 80:83–86.
33. Tanaka M, Natori M, Kohno H, Ishimoto H, Kobayashi T, Nozawa S. Fetal growth in patients with elevated maternal serum hCG levels. Obstet Gynecol 1993; 81:341–343.
34. Gagnon A, Wilson RD, Audibert F, Allen VM, Blight C, Brock JA, Désilets VA, Johnson JA, Langlois S, Summers A, Wyatt P; Society of Obstetricians and Gynaecologists of Canada Genetics Committee. Obstetrical complications associated with abnormal maternal serum markers analytes. J Obstet Gynaecol Can. 2008; 30(10):918-949.
35. BarthaJL, Comino-Delgado R, Arrabal J, Escobar MA. Third trimester maternal serum-HCG level and umbilical blood flow in fetal growth retardation. Int J Gynaecol Obstet. 1997; 57:27–31.
36. Hennen G, Frankenne F, Closset J, Gomez F, Pirens G, el Khayat N. A human placental GH: Increasing levels during second half of pregnancy with pituitary GH suppression as revealed by monoclonal antibody radioimmunoassays. Int J Fertil. 1985; 30:27–33
37. Frankenne F, Closset J, Gomez F, Scippo ML, Smal J, Hennen G. The physiology of growth hormones (GHs) in pregnant women and partial characterization of the placental GH variant. J Clin Endocrinol Metab. 1988; 66:1171–1180
38. Conde-Agudelo A, Papageorghiou AT, Kennedy SH, Villar J. Novel biomarkers for predicting intrauterine growth restriction: a systematic review and meta-analysis. BJOG. 2013; 120(6):681-94
39. Cowans NJ, Spencer K. First-trimester ADAM12 and PAPP-A as markers for intrauterine fetal growth restriction through their roles in the insulin-like growth factor system. Prenat Diagn. 2007; 27(3):264-271
40. Poon LC, Chelemen T, Granvillano O, Pandeva I, Nicolaides KH. First trimester maternal serum a disintegrin and metalloprotease 12 (ADAM12) and adverse pregnancy outcome. Obstet Gynecol. 2008; 112(5):1082-1089.


