Allergic reactions to legumes is a frequent form of food allergy in children, but now it also occurs more frequently in adults. The prevalence of legume allergy varies according to the type of legume and geographic area. The major legumes involved in allergic reactions include pea, soy, lentils and peanut. Few cases of allergy to pea or lentils were reported in Romania. It has been hypothesized that changes of diet such as increasing legumes consumption may be responsible for the increasing sensitization and allergic reactions. The allergic reactions could occur after consumption of both raw or cooked legumes and may have different clinical manifestations, from oral allergic syndrome to anaphylactic reactions. Another problem raises from cross-reactivity to other legumes or to pollen. Even though allergic reactions to legumes are rare in adults, they may represent a real problem due to the difficulty of legumes exclusion from diet and to possible cross-reactions to other allergens.
Alergia la legume – o provocare pentru medicul alergolog
Allergy to legumes – a challenge for allergist
First published: 24 decembrie 2018
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.2.4.2018.2130
Abstract
Rezumat
Alergia la legume este o formă frecvent întâlnită de alergie alimentară la copii, însă apare tot mai frecvent şi în populaţia adultă. Prevalenţa alergiei la legume diferă în funcţie de tipul de legumă consumat şi de aria geografică. Reacţii alergice au fost descrise după consum de mazăre, soia, linte sau arahide. În România au fost descrise cazuri izolate de alergie la legume, cum ar fi mazărea sau lintea. S-a ridicat ipoteza modificărilor de dietă care au condus la creşterea sensibilizării la legume şi apariţia reacţiilor alergice. Reacţiile alergice pot să apară după consumul atât de legume crude, cât şi preparate termic şi pot îmbrăca diferite forme de manifestare clinică, de la sindrom alergic oral până la reacţii anafilactice. O altă problemă pe care o ridică alergia la legume o reprezintă reacţiile încrucişate cu alte legume sau cu polenuri. Cu toate că reacţiile alergice induse de legume apar rar în populaţia adultă, ele constituie o problemă importantă, având în vedere dificultatea excluderii legumelor din alimentaţie şi a alergenilor care pot determina reacţii încrucişate.
Introducere
În ultimele două decade, alergiile alimentare sunt tot mai frecvent întâlnite în practica clinică. Reacţiile alergice induse de alimente pot îmbrăca diferite forme de manifestare clinică de la un pacient la altul sau chiar la acelaşi pacient, la expuneri repetate la alimentul incriminat. Cea mai severă formă de manifestare a alergiei alimentare, cu potenţial letal, este anafilaxia(1). Anafilaxia indusă de alimente îi afectează mai ales pe copii, dar şi pe adulţii. Prevalenţa alergiei alimentare este de 6-8% în populaţia pediatrică şi mai redusă (4%) la adulţi(2,3). Însă majoritatea datelor de epidemiologie se bazează mai ales pe raportările individuale şi mai puţin pe rezultatele din studiile controlate care să confirme prin test de provocare orală prezenţa alergiei alimentare.
90% dintre alergiile alimentare sunt determinate de opt grupe de alimente: lapte de vacă, ouă, peşte, arahide, soia, crustacee, făină de grâu şi diferite tipuri de nuci(2,4). Triggerul alimentar diferă la copil faţă de adult. La copii predomină alergia la proteinele din laptele vacă şi cea la ou – şi de cele mai multe ori acestea dispar la vârste mai mari sau în adolescenţă –, în timp ce la adult este mai frecventă alergia la arahide, nuci, crustacee şi legume(3,4).
Legumele aparţin familiei Fabaceae(2) şi reprezintă la ora actuală 27% din culturile din întreaga lume(5). Ele sunt tot mai mult utilizate în dietele actuale, întrucât reprezintă o sursă importantă de proteine, fibre, micronutrienţi şi grăsimi nesaturate. Consumul ridicat de legume este promovat ca fiind o dietă sănătoasă, întrucât se asociază cu reducerea riscului de boală coronariană şi cu reducerea LDL-colesterolului(6). Pe de altă parte, creşterea consumului de legume este responsabilă şi de creşterea sensibilizării şi de apariţia mai frecventă a alergiei(2,7).
Principalele legume care pot determina reacţii alergice sunt arahidele, soia, mazărea, fasolea, lintea şi lupinul. Prevalenţa alergiei la legume diferă în funcţie de specificul dietei şi de tipul de legumă consumat într-o anumită arie geografică(4,7). Astfel, în Spania, unde consumul de legume este frecvent, acestea reprezintă a cincea cauză de alergie alimentară la copil(8). Alergia la lupin este mai frecvent întâlnită în regiunea mediteraneană (prevalenţă 4,1%) faţă de restul Europei (1,6%)(9), în timp ce în India este mai frecventă alergia la năut(10). Alergia la arahide este frecvent întâlnită în SUA şi în Europa de Vest, în timp ce o prevalenţă mare a alergiei la soia se observă în Japonia(2,11). Aceste diferenţe geografice pot fi explicate prin tradiţiile culinare diferite, consumul preponderent al unor legume fiind responsabil de apariţia unui anumit tip de sensibilizare. Însă şi factorii genetici sau o expunere precoce la alte proteine alergenice pot explica aceste diferenţe în ceea ce priveşte prevalenţa alergiei la legume.
Alergenii implicaţi şi mecanismul de producere
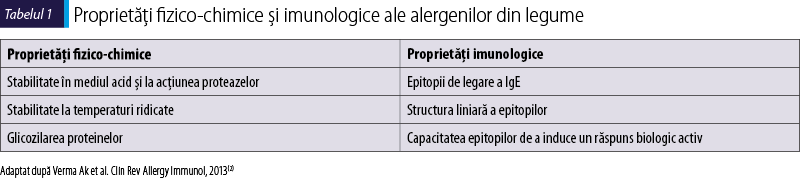
Legumele determină în cele mai multe cazuri un răspuns alergic IgE‑mediat. Proteinele cu potenţial alergenic din structura unor legume şi care sunt responsabile de răspunsul alergic la pacienţii sensibilizaţi pot fi identificate prin câteva caracteristici fizico-chimice şi imunologice(2,12).
Alergenii din legume sunt structuri proteice rezistente la acţiunea acidului clorhidric, iar unii dintre aceştia sunt relativ stabili la expunere la temperaturi ridicate (Ara h2 şi Ara h6). Astfel, antigenele determină sensibilizarea pacientului prin ingestie şi, mai rar, pe cale inhalatorie la pacienţii cu sensibilizare prealabilă la alergeni inhalatori(13). De asemenea, structura determinantului antigenic poate să ne aducă date privind posibilele reacţii încrucişate între diferite legume sau între acestea şi polenuri(2). Glicozilarea proteinelor antigenice creşte alergenicitatea acestora, fapt observat în cazul unor alergeni din arahide (Ara h1) sau soia (Gly m5). Principalele caracteristici ale alergenilor din legume sunt prezentate în tabelul 1. Aceste caracteristici sunt considerate condiţii preexistente pentru ca o proteină din structura legumelor să genereze un răspuns alergic la pacienţii sensibilizaţi. Legumele cel mai bine caracterizate din punctul de vedere al alergenilor sunt arahidele şi soia. Alergenii identificaţi din legume pot fi grupaţi în cinci mari familii şi superfamilii de proteine antigenice(5,14).
1. Proteinele de stocare sunt localizate în principal în seminţe, sâmburi, nuci şi sunt relativ stabile la temperaturi ridicate şi la acţiunea proteazelor(2). Între proteinele de stocare se regăsesc două mari grupe:
-
Cupinele, care includ globulinele 7S şi 11S(2,5). Alergenii majori Ara h1 şi Ara h3 din arahide se asociază cu reacţii alergice severe(5). De asemenea, alergenii Gly m5 şi Gly m6 din soia sunt asociaţi cu reacţii alergice severe la copii(15), dar nu şi în populaţia adultă, la aceştia fiind responsabili de reacţii uşoare(16). Lup an1 din lupin, Len c1 din linte, Pis s1 şi Pis s2 din mazăre sunt alergeni care fac parte din această superfamilie(5,17) .
-
Prolaminele, în care regăsim albumina 2S şi proteinele nonspecifice de transfer lipidic (ns-LTP)(5). Prolaminele reprezintă cel mai larg grup de proteine antigenice din structura legumelor. Astfel, şase alergeni din arahide aparţin acestei grupe (Ara h2, Ara h6, Ara h7, Ara h9, Ara h16 şi Ara h17). Dintre aceştia, Ara h2 şi Ara h6 sunt alergenii majori responsabili de apariţia reacţiilor alergice in vivo(18). Alergenul Gly m8 din soia face parte, de asemenea, din grupa prolaminelor, fiind un indicator al reacţiilor severe induse de legume atât la adulţi, cât şi la copii(16). Len c3 din linte şi Pis s3 din mazăre fac parte tot din grupa prolaminelor(5).
2. Profilinele sunt molecule de mici dimensiuni (12-15 kDa), cu o structură înalt conservativă, ceea ce explică reacţiile alergice încrucişate între alergenii din polenuri şi legume(19). În Europa Centrală şi de Sud, profilinele joacă un rol important în procesul de sensibilizare la polenuri, fiind implicate în aproximativ o treime din cazurile de alergie la polen(2). Profilinele de clasă 2 sunt sensibile la temperaturi ridicate şi la acţiunea proteazelor şi sunt principalii alergeni responsabili de apariţia sindromului alergic oral(2,5). Dintre alergenii din legume din grupa profilinelor, cei mai cunoscuţi sunt Ara h5 din arahide şi Gly m3 din soia, iar recent, în 2017, a fost descris şi Lup a5 din lupin(5).
3. Alergenii din superfamilia Bet v1. Bet v1 este alergenul major din polenul de mesteacăn, fiind responsabil de peste 90% dintre reacţiile alergice induse de acest polen. Este de fapt o proteină care intervine în mecanismele patogenetice, iar alergeni cu structură similară au fost descrişi şi în legume. Astfel, Ara h8 din arahide şi Gly m4 din soia fac parte din această familie(5). Alergenii similari Bet v1 sunt responsabili de reacţiile alergice după consum de arahide şi soia la pacienţii cu sensibilizare prealabilă la polen de mesteacăn(19) din Europa de Nord şi Centrală. Mai probabil, în aceste cazuri sensibilizarea s-a produs pe cale inhalatorie, prin expunere la polenul de mesteacăn. În general, alergenii din această superfamilie induc reacţii locale uşoare(20). Însă alergenul Gly m4 este responsabil de apariţia alergiilor severe atât în Europa, cât şi în Asia(21).
4. Defensinele sunt proteine din plante cu rol important în apărarea acestora împotriva patogenilor. Până în prezent au fost descrişi doi alergeni ca aparţinând acestei grupe (Ara h12 şi Ara h13), fiind implicaţi de asemenea în reacţiile alergice severe induse de arahide(22).
5. Oleosinele sunt proteine izolate din fracţiunile lipidice. Sunt alergeni nou identificaţi şi acceptaţi, fiind izolaţi prima dată din uleiul de arahide. Astfel Ara h10, Ara h11, Ara h14 şi Ara h15 au fost oficial încadraţi în această grupă de către WHO/IUIS Allergen Nomenclature Subcommittee, fiind asociaţi cu reacţii alergice severe(5). Oleosine au fost identificate şi în soia, însă nu s-a stabilit încă potenţialul lor alergenic(23).
Manifestările clinice ale alergiei la legume
Simptomele alergiei la legume sunt asemănătoare cu cele ale oricărei alergii alimentare. Manifestările clinice sunt similare în cea mai mare măsură, indiferent de tipul de legumă incriminat. Ingestia de legume crude sau preparate termic, precum şi inhalarea alergenilor din legume pot determina simptome cutanate, digestive, cardiovasculare sau respiratorii (figura 1).
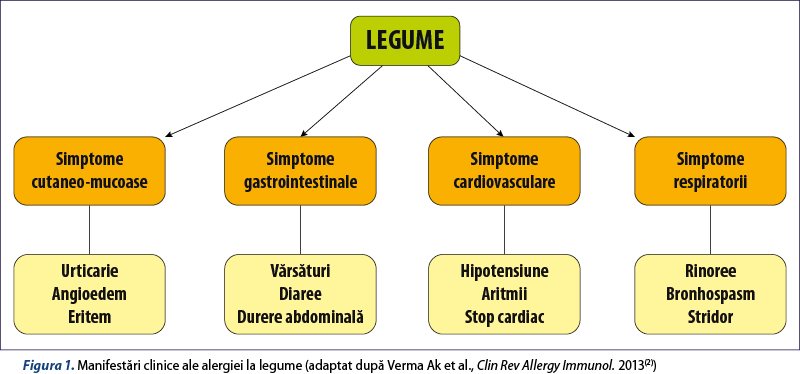
Simptomele pot avea intensitate şi localizare variabile, de la manifestări uşoare localizate (sindrom alergic oral) până la reacţii severe anafilactice, ameninţătoare de viaţă.
Diagnosticul alergiei la legume
Diagnosticul pozitiv al alergiei la legume se bazează în primul rând pe evaluarea alergologică amănunţită. O anamneză corect condusă poate identifica elementele unei reacţii de hipersensibilitate IgE‑mediată. Simptomele specifice unei alergii alimentare apar în primele 1-2,5 ore după consumul sau contactul cu alimentul incriminat. Uneori sunt necesare cantităţi infime de aliment pentru a produce o reacţie IgE‑mediată, iar manifestările apar la fiecare contact cu alergenul incriminat(24,25).
Standardul de aur în stabilirea diagnosticului pozitiv de alergie alimentară rămâne testul de provocare orală dublu-orb placebo controlat. Însă acest test presupune resurse materiale, este consumator de timp şi prezintă un risc crescut pentru pacient, întrucât poate induce reacţii anafilactice. Astfel, noi alternative mai sigure şi mai ieftine au fost testate de-a lungul anilor(24,26).
Testele cutanate prick şi IgE specifice sunt primele teste efectuate pentru a demonstra reacţia IgE‑mediată la legume. Testele cutanate prick sunt sigure chiar şi la pacienţii cu reacţii anafilactice în antecedente şi pot fi efectuate la orice vârstă, chiar dacă reacţia cutanată poate fi mai redusă la copiii mici şi vârstnici. Se recomandă utilizarea extractelor alergenice standardizate(27). Dacă nu sunt disponibile acestea sau se suspicionează un alergen minor, care nu este inclus în extracte, se poate realiza testarea prick din aliment proaspăt(28).
La pacienţii cu alergii alimentare, testele cutanate prick şi determinarea IgE specifice din sânge pot genera rezultate variabile. Aceste teste au o sensibilitate relativ bună (70-100%), dar aceasta este mai redusă în cazul alergenilor din legume şi o specificitate moderată (40-70%)(24). Sensibilitatea şi specificitatea sunt variabile, în funcţie de alergenul incriminat. Astfel, pentru alergia la arahide, sensibilitatea şi specificitatea testelor prick şi a IgE specifice sunt similare, fără să existe diferenţe între aceste metode diagnostice. Însă, în cazul alergiei la soia, IgE specifice au o sensibilitate mai mare decât testele prick, dar o specificitate mai redusă(24). Pentru celelalte legume nu au fost raportate studii comparative.
Cu toate acestea, cele două metode de diagnostic pot confirma sau infirma o reacţie IgE‑mediată, însă nu pot diferenţia între sensibilizare şi alergie clinic relevantă(24,28). Din aceste considerente, testele cutanate şi IgE specifice trebuie interpretate în contextul unui tablou clinic şi trebuie urmate de test de provocare orală (TPO) pentru confirmarea diagnosticului. Reacţii fals pozitive sunt înregistrate în ambele teste, însă o papulă de peste 7-8 mm şi/sau IgE specifice de peste 15 kU/l au valoare predictivă pozitivă mare pentru alergia la alune(25,26).
Testele patch nu se recomandă pentru diagnosticul de rutină al alergiei la legume(29).
Testul de provocare orală este necesar pentru confirmarea diagnosticului, pentru monitorizarea alergiei şi pentru confirmarea inducerii toleranţei orale(24,29). Acesta se poate efectua în sistem simplu sau dublu-orb. TPO dublu-orb placebo controlat este consumator de timp şi de resurse materiale, astfel încât se recomandă iniţial test simplu-orb, iar dacă acesta este negativ, se poate exclude o alergie alimentară. Titrarea dozelor este stabilită doar în cazul alergiei la arahide, unde se recomandă o creştere semilogaritmică începând de la 3 mg până la 3 g de proteină(24).
Alte teste diagnostice constituie abordări promiţătoare, dar necesită confirmare în studii ulterioare. Determinarea alergenului individual creşte specificitatea diagnostică. Astfel, pentru Ara h2, determinarea IgE specifice pentru acest alergen arată o sensibilitate de 100% şi o specificitate de 80%(30). Acelaşi rezultat pozitiv a fost demonstrat şi pentru alţi alergeni din plante, inclusiv pentru Gly m4 din soia.
Testul de activare a bazofilelor a fost utilizat în diagnosticul alergiilor la legume, în special pentru arahide, arătând o specificitate şi o valoare predictivă negativă mai mari decât testele prick sau IgE specifice(31). Dar rezultatele pozitive derivă din studii care au inclus un număr mic de pacienţi, sunt necesare condiţii de laborator şi este o testare scumpă, astfel încât rămâne în continuare un test diagnostic folosit mai ales în scop de cercetare.
Determinarea IgG serice nu are valoare diagnostică în alergia alimentară, inclusiv în cea la legume(29).
Dieta de eliminare a alimentului suspectat are, pe lângă valoare terapeutică, şi una diagnostică. Ea se bazează pe informaţiile obţinute în urma anchetei alergologice şi a testelor cutanate prick şi serologice. Durata acesteia trebuie să asigure ameliorarea simptomelor; în medie se recomandă o dietă de eliminare de 2-4 săptămâni. Dacă în acest interval nu se obţine ameliorarea simptomelor, se poate exclude alergia la alimentul respectiv(29).
Efectul procesării asupra alergenicităţii legumelor
Legumele pot fi supuse procesării termice în vederea stocării sau consumului imediat. Procesarea termică se poate face prin fierbere normală sau sub presiune ori prin prăjire(5). Procesarea termică poate modifica alergenicitatea legumelor, însă efectul este dependent de tipul de legumă, de tipul de procesare şi de durata acesteia.
Prin fierbere sunt procesate unele legume anterior consumului, cum ar fi lintea, năutul, fasolea verde, dar şi alunele, în China şi în unele state americane (Alabama, Georgia)(5). Prin fierbere scade alergenicitatea arahidelor, datorită transferului alergenilor cu greutate moleculară mică (Ara h2, Ara h6 şi Ara h7) în apa de fierbere(32). Reducerea alergenicităţii arahidelor prin fierbere constituie un avantaj în terapie, prin reducerea incidenţei şi severităţii reacţiilor induse de imunoterapia orală. Astfel, fierberea timp de două ore scade de 8 ori capacitatea de legare a alergenului din arahide de IgE specifice, iar extinderea procesării peste 12 ore a scăzut de 19 ori această reactivitate(33). În ceea ce priveşte procesarea termică a celorlalte legume, fierberea timp de 15 minute nu modifică semnificativ reactivitatea alergenilor din linte sau din năut comparativ cu legumele crude. Fierberea timp de 60 de minute alterează structura alergenilor, dar persistă încă reactivitatea acestora, sugerând că în structura legumelor menţionate predomină alergenii stabili la temperaturi ridicate(34). Fierberea timp de două ore sau încălzirea la microunde scade alergenicitatea proteinelor din soia(35), deşi o procesare de durată mai scurtă (o oră, 100 °C) nu modifică semnificativ reactivitatea acestora(36). Procesarea prin fierbere nu modifică reactivitatea alergenilor din lupin sau din linte, însă scade reactivitatea celor din mazăre. În ceea ce priveşte fierberea, în cazul fasolei verzi scade reactivitatea unor alergeni, însă creşte capacitatea de interacţiune a altora cu IgE specifice(37).
Însă procesarea prin prăjire creşte reactivitatea alergenilor din arahide şi capacitatea acestora de legare de IgE specifice de 90 de ori comparativ cu alergenii neprocesaţi termic(5,38). De asemenea, prin prăjire, alergenii devin mai rezistenţi la acţiunea enzimelor digestive. Aceste modificări au fost raportate pentru alergenii majori Ara h1, Ara h2, Ara h6 şi Ara h8(5,38). De asemenea, studii experimentale recente au arătat că arahidele prăjite cresc riscul de sensibilizare transmucoasă sau transcutanată, comparativ cu cele crude(39). În ceea ce priveşte prăjirea în tigaie în ulei, datele raportate sunt discordante. Iniţial s-a crezut că acest procedeu scade alergenicitatea arahidelor, însă această observaţie nu a fost ulterior confirmată(40). Nu există date privind modificarea reactivităţii alergenilor din linte, lupin, năut sau fasole verde(41). Însă procesarea prin prăjire scade reactivitatea alergenilor din mazăre(17,41).
Reacţii încrucişate între legume
Deşi s-au descris numeroase reacţii încrucişate între diferitele specii de legume in vitro, relevanţa lor clinică este redusă(5). Pentru unele legume însă relevanţa clinică este mai mare comparativ cu altele.
O reactivitate încrucişată importantă a fost descrisă între arahide şi lupin. Mai multe studii efectuate în diferite populaţii au arătat această reactivitate încrucişată. Astfel, la pacienţii cu alergie la arahide în Franţa s-a observat o rată de sensibilizare de 44%, dar interacţiuni relevante clinic au fost descrise doar în 28% dintre cazuri(42). Reactivitatea între arahide şi făina de lupin a fost menţionată în procent mai redus şi în Italia (17%)(43) sau Marea Britanie (4%)(5,44). Se pare că expunerea la făină de lupin creşte şi severitatea manifestărilor clinice, în special a astmului, la pacienţii cu alergie la arahide(45). Reacţii încrucişate relevante clinic au fost descrise şi între făina de lupin şi mazăre şi linte(2,5). Însă alergia la arahide se asociază foarte rar cu reacţii clinic relevante induse de consumul de linte, mazăre sau năut(2).
O altă reacţie încrucişată relevantă clinic a fost descrisă pentru arahide şi soia. Rata de raportare a acestei reacţii încrucişate diferă în literatură (6,5-15%), în funcţie de populaţia studiată (adulţi, copii) şi de regiunea geografică(2,5).
Reacţii încrucişate relevante clinic au fost descrise în special între linte, mazăre şi năut, mai ales în regiunea mediteraneană(17,46,47). Astfel, în studiul lui Ibanez et al.(47) s-au observat reacţii încrucişate relevante clinic, confirmate prin test de provocare orală între linte şi mazăre (73% dintre pacienţi), linte şi năut (69,4%), în timp ce soia şi fasolea verde au fost tolerate de toţi copiii cu alergii la alte legume(47).
Tratamentul alergiei la legume
Managementul unei alergii induse de consumul de legume include măsurile specifice oricărei alergii alimentare şi constă în măsuri pe termen scurt necesare pentru a trata o reacţie acută, precum şi măsuri pe termen lung pentru a reduce riscul şi pentru a preveni alte reacţii acute.
Există multe alimente care pot conţine proteine cu potenţial alergenic. Riscul unei reacţii acute este variabil între pacienţii cu alergie alimentară, de aceea trebuie în primul rând stratificat acest risc. Pacienţii cu reacţii anafilactice anterioare sau cu astm necontrolat, precum şi cei la care se identifică unii cofactori (AINS, efort fizic, mastocitoză) au un risc crescut de reacţii severe(26,29,48).
Educarea pacientului rămâne cheia succesului în tratamentul pe termen lung la pacienţii cu alergie la legume. În primul rând, trebuie instituită dieta de eliminare cu evitarea alimentului incriminat şi individualizarea acesteia la fiecare pacient în parte. O dietă de eliminare de lungă durată trebuie atent monitorizată, pentru a evita carenţele nutriţionale, în special la copii(29,48). De asemenea, cantitatea de aliment care este tolerată de pacient este diferită şi se poate modifica în timp, mai ales la copii(26). Dieteticianul poate sfătui pacientul şi familia cum se pot evita atât alimentul incriminat, cât şi alimentele ascunse în alte preparate.
Singura modalitate prin care pacientul poate afla informaţii despre conţinutul unui aliment procesat este eticheta produsului. Conform Consumers Regulation (EU) No. 1169/2011 (FDA)(49), există 15 alimente care sunt obligatoriu menţionate pe etichetă, printre care se regăsesc arahidele, soia şi lupinul şi produsele derivate din acestea. Însă există alimente procesate care pot conţine urme sau pot fi contaminate cu derivaţi din legume. Legumele nu se utilizează doar ca atare, ci sunt introduse în alimentele procesate ca aditivi, emulgatori sau stabilizatori. Citirea cu atenţie a etichetelor de către pacient este esenţială pentru a evita consumul accidental al alimentului incriminat(26). De asemenea, pacientul trebuie avizat despre consumul accidental de legume în restaurante şi fast-fooduri, mai ales în cele cu specific tradiţional, care includ anumite legume în mâncărurile de bază(26,29).
Educarea pacientului are în vedere şi recunoaşterea promptă a simptomelor şi aplicarea tratamentului de urgenţă, cu referire în special la autoadministrarea adrenalinei. Adrenalina autoinjectată trebuie prescrisă obligatoriu la pacienţii cu anafilaxie în antecedente, la cei cu astm persistent sau la cei care au avut anafilaxie indusă de efort(26,29). De asemenea, poate fi prescrisă la cei cu reacţii uşoare sau moderate, la cei care au avut reacţii după cantităţi infime de aliment sau la cei la care sunt prezenţi cofactorii menţionaţi(29). Pacienţii şi familia trebuie instruiţi în vederea utilizării corecte a autoinjectorului cu adrenalină.
Tratamentul profilactic cu antihistaminice H1 sau stabilizatori de membrană mastocitară nu se recomandă, deoarece nu şi-au dovedit eficienţa în prevenirea reacţiilor acute şi pot întârzia recunoaşterea simptomelor şi administrarea adrenalinei(29,48). Imunoterapia a fost testată doar în cazul alergiei la arahide, arătând rezultate favorabile(29,50). Au fost testate diferite căi de administrare a imunoterapiei. Administrarea sublinguală, deşi este sigură, nu s-a dovedit eficientă, la fel ca şi administrarea epicutană. Doar imunoterapia orală s-a dovedit eficientă şi sigură(50,51), asigurând desensibilizarea şi toleranţa unei cantităţi mai mari de arahide comparativ cu celelalte forme de imunoterapie. Au existat studii care au arătat că asocierea terapiei anti‑IgE (omalizumab) imunoterapiei orale cu arahide creşte cantitatea tolerată de pacient şi scade durata imunoterapiei orale, însă acest tratament nu este în momentul de faţă recomandat de rutină la pacienţii cu alergie la arahide(29). Sunt necesare studii extinse în vederea stabilirii eficienţei terapiei anti‑IgE în alergia alimentară. În cazul celorlalte legume care pot genera reacţii alergice au fost raportate doar cazuri sporadice de inducere a toleranţei orale.
Concluzii
Alergia la legume devine o alergie tot mai frecvent întâlnită atât la adult, cât şi la copil, prin modificarea stilului de viaţă şi a dietelor. Alergia la legume este variabilă, în funcţie de tipul de legumă consumat, de aria geografică şi de particularităţile gastronomice ale fiecărei ţări. Cunoaşterea caracteristicilor fizico-chimice şi imunologice ale alergenilor identificaţi în legume permite înţelegerea reacţiilor încrucişate şi modalitatea de schimbare a alergenicităţii prin prelucrare termică sau chimică. Aceste informaţii pot creşte acurateţea diagnostică şi pot simplifica recomandările pe termen lung necesare în vederea prevenirii unor noi reacţii alergice prin consum accidental. Sunt necesare studii ulterioare în scopul caracterizării complete a alergiei la legume şi pentru investigarea rolului imunoterapiei orale în obţinerea toleranţei pe termen lung.
Bibliografie
- Parrish CP, Kim H. Food-Induced Anaphylaxis: an Update. Curr Allergy Asthma Rep. 2018;18(8):41.
- Verma AK, Kumar S, Das M, Dwivedi PD. A comprehensive review of legume allergy. Clin Rev Allergy Immunol. 2013;45(1):30-46.
- Skypala I. Adverse food reactions – an emerging issue for adults. J Am Diet Assoc. 2011;111(12):1877‑91
- Leung ASY, Wong GWK, Tang MLK. Food allergy in the developing world. J Allergy Clin Immunol. 2018;141:76‑78.
- Cabanillas B, Jappe U, Novak N. Allergy to Peanut, Soybean, and Other Legumes: Recent Advances in Allergen Characterization, Stability to Processing and IgE Cross-Reactivity. Mol Nutr Food Res. 2018;62(1).
- Duranti M. Grain legume proteins and nutraceutical properties. Fitoterapia. 2006; 77:67‑82
- Abrams EM, Gerstner TV. Allergy to cooked, but not raw, peas: a case series and review. Allergy Asthma Clin Immunol. 2015;11(1):10.
- Martinez SIM, Ibanez MD, Fernandez Caldas E, Carnes J. In vitro and in vivo cross-reactivity studies of legume allergy in a mediterranean population. Int Arch Allergy Immunol. 2008;147:222‑30.
- Hieta N, Hasan T, Makinen-Kiljunen S, Lammintausta K. Lupin allergy and lupin sensitization among patients with suspected food allergy. Ann Allergy Asthma Immunol. 2009;103:233‑7.
- Patil SP, Niphadkar PV, Bapat MM. Chickpea: a major food allergen in the Indian subcontinent and its clinical and immunchemical correlation. Ann Allergy Asthma Immunol. 2001;87:140‑5.
- Dalal I, Binson I, Reifen R, Amitai Z, Shohat T, Rahmani S, et al. Food allergy is a matter of geography after all: sesame as a major cause of severe IgE‑mediated food allergic reactions among infants and young children in Israel. Allergy. 2002; 57:362‑365.
- Astwood JD, Leach JN, Fuchs RL. Stability of food allergens to digestion in vitro. Nat Biotechnol. 1996;14:1269‑73.
- Egger M, Mutschlechner S, Wopfner N, Gadermaier G, Briza P, Ferreira F. Pollen-food syndromes associated with weed pollinosis: an update from the molecular point of view. Allergy. 2006,61(4):461‑76.
- Jenkins JA, Griffiths-Jones S, Shewry PR, Breiteneder H, Mills EN. Structural relatedness of plant food allergens with specific reference to cross-reactive allergens: An in silico analysis. J Allergy Clin Immunol. 2005,1:115(1):163‑70
- Ito K, Sjölander S, Sato S, Movérare R, Tanaka A, Söderström L, et al. IgE to Gly m 5 and Gly m 6 is associated with severe allergic reactions to soybean in Japanese children. J Allergy Clin Immunol. 2011;128(3):673-5.
- Klemans RJ, Knol EF, Michelsen-Huisman A, Pasmans SG, de Kruijf-Broekman W, Bruijnzeel-Koomen CA, et al. Components in soy allergy diagnostics: Gly m 2S albumin has the best diagnostic value in adults. Allergy. 2013;68(11):1396-402.
- Sanchez-Monge R, Lopez-Torrejón G, Pascual CY, Varela J, Martin-Esteban M, Salcedo G. Vicilin and convicilin are potential major allergens from pea. Clin Exp Allergy. 2004,34 (11):1747‑53.
- Kulis M, Chen X, Lew J, Wang Q, Patel OP, Zhuang Y, et al. The 2S albumin allergens of Arachis hypogaea, Ara h 2 and Ara h 6, are the major elicitors of anaphylaxis and can effectively desensitize peanut-allergic mice. Clin Exp Allergy. 2012;42(2):326-36.
- Fernández Rivas M. Cross-reactivity between fruit and vegetables. Allergol Immunopathol (Madr). 2003;31(3):141-6.
- Fernández-Rivas M, Bolhaar S, González-Mancebo E, Asero R, van Leeuwen A, Bohle B, et al. Apple allergy across Europe: how allergen sensitization profiles determine the clinical expression of allergies to plant foods. J Allergy Clin Immunol. 2006; 118(2):481-8.
- Berneder M, Bublin M, Hoffmann-Sommergruber K, Hawranek T, Lang R. Allergen chip diagnosis for soy-allergic patients: Gly m 4 as a marker for severe food-allergic reactions to soy. Int Arch Allergy Immunol. 2013;161(3):229-33.
- Petersen A, Kull S, Rennert S, Becker WM, Krause S, Ernst M, et al. Peanut defensins: Novel allergens isolated from lipophilic peanut extract. J Allergy Clin Immunol. 2015;136(5):1295-301.e1-5.
- Cao Y, Zhao L, Ying Y, Kong X, Hua Y, Chen Y. The characterization of soybean oil body integral oleosin isoforms and the effects of alkaline pH on them. Food Chem. 201515;177:288-94.
- Soares-Weiser K, Takwoingi Y, Panesar SS, Muraro A, Werfel T, Hoffmann-Sommergruber K, et al. The diagnosis of food allergy: a systematic review and meta-analysis. Allergy. 2014;69(1):76-86.
- Lock RJ, Unsworth DJ. Food allergy: which tests are worth doing and which are not? Ann Clin Biochem. 2011;48(Pt 4):300-9.
- Stiefel G, Anagnostou K, Boyle RJ, Brathwaite N, Ewan P, Fox AT, et al. BSACI guideline for the diagnosis and management of peanut and tree nut allergy. Clin Exp Allergy. 2017;47(6):719-739.
- Chafen JJ, Newberry SJ, Riedl MA, Bravata DM, Maglione M, Suttorp MJ et al. Diagnosing and managing common food allergies: a systematic review. JAMA. 2010;303:1848‑1856.
- Heinzerling LM, Burbach GJ, Edenharter G, Bachert C, Bindslev-Jensen C, Bonini S, et al. GA(2)LEN skin test study I: GA(2)LEN harmonization of skin prick testing: novel sensitization patterns for inhalant allergens in Europe. Allergy. 2009;64(10):1498-506.
- Muraro A, Werfel T, Hoffmann-Sommergruber K, Roberts G, Beyer K, Bindslev-Jensen C, et al. EAACI food allergy and anaphylaxis guidelines: diagnosis and management of food allergy. Allergy. 2014;69(8):1008-25.
- Eller E, Bindslev‐Jensen C. Clinical value of component‐resolved diagnostics in peanut‐allergic patients. Allergy. 2013;68:190‑194.
- Glaumann S, Nopp A, Johansson SG, Rudengren M, Borres MP, Nilsson C. Basophil allergen threshold sensitivity, CD‐sens, IgE‐sensitization and DBPCFC in peanut‐sensitized children. Allergy. 2012;67:242‑247.
- Comstock SS, Maleki SJ, Teuber SS. Boiling and Frying Peanuts Decreases Soluble Peanut (Arachis Hypogaea) Allergens Ara h 1 and Ara h 2 But Does Not Generate Hypoallergenic Peanuts. PLoS One. 2016;11(6):e0157849.
- Tao B, Bernardo K, Eldi P, Chegeni N, Wiese M, Colella A, et al. Extended boiling of peanut progressively reduces IgE allergenicity while retaining T cell reactivity. Clin Exp Allergy. 46(7):1004-14.
- Cuadrado C, Cabanillas B, Pedrosa MM, Varela A, Guillamón E, Muzquiz M, et al. Influence of thermal processing on IgE reactivity to lentil and chickpea proteins. Mol Nutr Food Res. 2009;53(11):1462-8.
- Shibasaki M, Suzuki S, Tajima S, Nemoto H, Kuruome T. Allergenicity of major component proteins of soybean. Int. Arch. Allergy Immunol. 1980;:441‑448.
- Burks AW, Williams LW, Thresher W, Connaughton C et al. Allergenicity of peanut and soybean extracts altered by chemical or thermal denaturation in patients with atopic dermatitis and positive food challenges. J. Allergy Clin. Immunol. 1992;90:889‑897.
- Asero R, Mistrello G, Roncarolo D, Amato S, van Ree R. String bean-induced anaphylaxis. Allergy. 2001;56:259‑260
- Maleki SJ, Viquez O, Jacks T, Dodo H, Champagne ET, Chung SY, et al. The major peanut allergen, Ara h 2, functions as a trypsin inhibitor, and roasting enhances this function. J Allergy Clin Immunol. 2003;112(1):190-5.
- Mueller GA, Maleki SJ, Johnson K, Hurlburt BK, Cheng H, Ruan S, et al. Identification of Maillard reaction products on peanut allergens that influence binding to the receptor for advanced glycation end products. Allergy. 2013;68(12):1546-54.
- Verhoeckx KC, Vissers YM, Baumert JL, Faludi R, Feys M, Flanagan S, et al. Food processing and allergenicity. Food Chem Toxicol. 2015;80:223-40.
- Verma AK, Kumar S, Das M, Dwivedi PD. Impact of thermal processing on legume allergens. Plant Foods Hum Nutr. 2012;67(4):430-41.
- Cousin M, Verdun S, Seynave M, Vilain AC, Lansiaux A, Decoster A, et al. Phenotypical characterization of peanut allergic children with differences in cross-allergy to tree nuts and other legumes. Pediatr Allergy Immunol. 2017;28(3):245-250.
- Fiocchi A, Sarratud P, Terracciano L, Vacca E, Bernardini R, Fuggetta D, et al. Assessment of the tolerance to lupine-enriched pasta in peanut-allergic children. Clin Exp Allergy. 2009;39(7):1045-51.
- Shaw J, Roberts G, Grimshaw K, White S, Hourihane J. Lupin allergy in peanut-allergic children and teenagers. Allergy. 2008;63(3):370-3.
- Kanny G, Guerin L, Moneret-Vautrin DA. Risk of serious asthma due to lupine flour associated with peanut allergy. Rev Med Interne. 2000;21:191‑194.
- Pascual CY, Fernandez-Crespo J, Sanchez Pastor S, Ayuso R, Garcia Sanchez G, Martin-Esteban M. Allergy to lentils in Spain. Pediatr Pulmonol. 2001;Suppl 23:41‑3.
- Ibáñez MD, Martínez M, Sánchez JJ, Fernández-Caldas E. Legume cross-reactivity. Allergol Immunopathol (Madr). 2003;31(3):151-61.
- de Silva D, Geromi M, Panesar SS, Muraro A, Werfel T, Hoffmann‐Sommergruber K et al. Acute and long‐term management of food allergy: systematic review. Allergy. 2014;69:159‑167.
- Food Standard Agency. Food Allergen Labelling Technical Guidance. Food Standard Agency, 2015. https://www.food.gov.uk/sites/default/files/food-allergen-labelling-technical-guidance.pdf
- Anagnostou K, Clark A. Peanut immunotherapy. Clin Transl Allergy. 2014; 4:30.
- Anagnostou K, Clark A, King Y, Islam S, Deighton J, Ewan P. Efficacy and safety of high‐dose peanut oral immunotherapy with factors predicting outcome. Clin Exp Allergy. 2011; 41:1273‐81
Articole din ediţiile anterioare
Noutăţi în reacţiile de hipersensibilitate induse de analgezicele opioide
Medicamentele opioide reprezintă unele dintre cele mai potente analgezice de care dispunem la momentul actual, fiind folosite atât în terapia durer...
Alergia la grâu – aspecte clinice şi de management
Alergia la cereale este printre cele mai comune forme de alergie alimentară. Răspunsurile imunologice induse de proteinele din cereale pot fi IgE ş...
Hipersensibilitatea imediată la inhibitori de pompă de protoni – discuţii pe marginea unui caz de anafilaxie la lansoprazol
Inhibitorii de pompă de protoni reprezintă o clasă de medicamente frecvent utilizată în practica clinică, atât sub formă de prescripţie medicală, c...
Rolul diagnosticului molecular în anafilaxie
Anafilaxia reprezintă o reacţie alergică severă, cu potenţial letal, caracterizată prin debutul acut al simptomelor şi care necesită intervenţie me...