IL-31 în astm şi BPOC
IL-31 in asthma and COPD
Abstract
Background and aim. Cytokines represent key mediators in the onset and persistence of inflammatory process, in asthma and COPD. IL-31, which belongs to the IL-6 family, might act in a similar way as IL-6 at the beginning of the inflammatory process. Its role in atopic skin diseases has already been demonstrated, but there are conflicting results related to its role in respiratory allergic diseases. The aim of this study was the evaluation of IL-31 plasmatic level in patients with asthma or COPD and its correlation with clinical and lung functionparameters.
Materials and method. A total of 40 consecutive patients with bronchoobstructive diseases were included in the study. Twenty-two patients presented asthma and 18 patients had COPD. The evaluation included: the number of exacerbations in the last year, disease severity, spirometry. The plasmatic levels of IL-31 were determined in all patients.
Results. The mean age was higher in patients with COPD (43.4±13.3 vs. 64.94±6.95 years old; p=0.003). COPD was most frequently observed in males (77.8% vs. 26.3%; p=0.004), while asthma was diagnosed frequently in females (72.7% vs. 22.2%). IL-31 was significantly higher in patients with asthma (median 1269 pg/ml [338.36-2785.99)] versus COPD [median 481.79 pg/ml [178.74-1402.72]; p=0.015). IL-31 was positively correlated with the number of exacerbations in the last year (R=0.456; p=0.033) and asthma severity (R=0.541; p=0.009) and negatively correlated with FEV1 (R=-0.413; p=0.05) in patients with asthma. In patients with COPD, the number of exacerbations was negatively correlated with vital capacity (R=-0.523; p=0.026), but there were no correlations between the IL-31 level and the clinical and functional parameters.
Conclusions. IL-31 had increased plasmatic levels in patients with asthma. IL-31 may play a role in the severity and regression of lung function in asthmatic patients, but not in COPD patients.
Keywords
asthmaIL-31COPDRezumat
Introducere şi scop. Citokinele reprezintă mediatori-cheie în iniţierea şi persistenţa răspunsului inflamator atât în astm, cât şi în BPOC. IL-31, care aparţine familiei IL-6 de citokine, ar putea acţiona similar cu IL-6, fiind implicată mai probabil în iniţierea procesului inflamator. Rolul său în bolile alergice cutanate a fost deja demonstrat, dar rezultatele sunt contradictorii în ceea ce priveşte implicarea sa în bolile respiratorii alergice. Scopul studiului de faţă este acela de a evalua nivelul plasmatic al IL-31 la pacienţii cu astm sau BPOC şi corelarea sa cu manifestările clinice şi parametrii funcţionali respiratori.Materiale şi metodă. 40 de pacienţi cu boală bronhoobstructivă au fost incluşi în studiul de faţă: 22 de pacienţi cu astm şi 18 pacienţi cu BPOC. Pacienţii au fost evaluaţi clinic la includerea în studiu şi s-au analizat numărul de exacerbări de boală în ultimul an anterior prezentării, severitatea bolii şi funcţia pulmonară evaluată prin spirometrie. Nivelul plasmatic al IL-31 a fost analizat la toţi pacienţii.
Rezultate. Vârsta medie a fost mai mare la pacienţii cu BPOC (43,4 ± 13,3 faţă de 64,94 ± 6,95 ani, p = 0,003). BPOC a fost mai frecvent diagnosticat la bărbaţi (77,8% faţă de 26,3%, p = 0,004), în timp ce astmul bronşic a fost mai frecvent la femei (72,7% faţă de 22,2%). IL-31 a fost semnificativ mai mare la pacienţii cu astm faţă de cei cu BPOC [1269 (338,36‑2785,99) pg/ml versus 481,79 (178,74‑1402,72)] pg/ml (p = 0,015). La pacienţii astmatici, IL-31 s-a corelat pozitiv cu numărul de exacerbări din ultimul an (R = 0,456, p = 0,033) şi cu severitatea bolii (R = 0,541, p = 0,009), respectiv s-a corelat negativ cu FEV1 (R = –0,413, p = 0,05 ). La pacienţii cu BPOC, numărul exacerbărilor a fost corelat negativ cu capacitatea vitală (R = –0,523, p = 0,026), dar nu au existat corelaţii între nivelul IL-31 şi parametrii clinici şi funcţionali.
Concluzii. IL-31 este crescută la pacienţii cu astm. IL-31 poate reprezenta un marker de apreciere a severităţii şi regresiei funcţiei pulmonare la pacienţii astmatici, dar nu şi la pacienţii cu BPOC.
Cuvinte Cheie
astmIL-31BPOCIntroducere
Bolile pulmonare cronice reprezintă o patologie complexă, cu morbiditate şi mortalitate semnificative, în ciuda unor terapii de generaţie nouă care pot asigura un control adecvat al bolii. Astmul bronşic şi BPOC-ul afectează aproximativ 1 miliard de oameni, iar în ţările în curs de dezvoltare prevalenţa acestor două boli este în creştere, fie din cauza condiţiilor de viaţă, fie din cauza diagnosticului întârziat şi a inaccesibilităţii la terapiile moderne(1,2).
Bolile bronhoobstructive pulmonare sunt afecţiuni cu etiologie multifactorială în care atât factorii genetici, cât şi cei de mediu joacă un rol crucial(3). Sunt afecţiuni extrem de eterogene, ceea ce face dificilă selecţia terapiei optime. Deşi sunt afecţiuni cu manifestări şi prognostic diferite, în ambele boli se decelează un răspuns inflamator cronic. În BPOC, inflamaţia cronică se caracterizează prin creşterea numărului de neutrofile, macrofage şi de limfocite B şi T în căile aeriene(4). La pacienţii cu astm bronşic este descrisă o varietate de mecanisme fiziopatologice, chiar dacă manifestările clinice sunt similare(5). Eterogenitatea complexă a astmului este determinată de multitudinea de celule şi mediatori implicaţi în patogeneza bolii(6). Variabilitatea clinică inter‑ şi intraindividuală este sugerată de mecanisme fiziopatologice diferite. În astmul bronşic, în special cel alergic, decelăm un răspuns inflamator mediat Th2, dar există şi fenotipuri de astm în care ambele căi de răspuns, Th1 şi Th2, sunt prezente(5,6).
Citokinele reprezintă mediatori-cheie în generarea şi persistenţa procesului inflamator. Ele sunt sintetizate şi eliberate în fazele iniţiale ale procesului inflamator atât în astm, cât şi în BPOC. Sunt responsabile de recrutarea altor celule inflamatorii şi de activarea moleculelor de adeziune(7). În astmul bronşic alergic s-a observat că o serie de citokine determină producţia de IgE specifice, între acestea regăsindu-se IL-4, IL-5 şi IL-13(8). Terapiile ţintite anti-IL-5 şi anti-IL-4/IL-13 au condus la un control optim al astmului sever, însă există cazuri care nu prezintă un fenotip inflamator tipic răspunsului Th2. În BPOC însă, cercetările s-au axat în principal pe studiul citokinelor proinflamatorii specifice răspunsului de tip Th1 – şi în special asupra TNF-α. TNF-α este un activator al NF-κB, ceea ce ar putea amplifica răspunsul inflamator. Dar lipsa de răspuns a pacienţilor cu BPOC la terapia anti-TNF-α se datorează mai probabil implicării altor citokine proinflamatorii în cascada inflamatorie(3).
În ultimii ani, un interes deosebit a fost reprezentat de studiul IL-31 şi IL-33 ca posibili markeri ai inflamaţiei în astm. IL-31 aparţine familiei de citokine IL-6, fiind produsă în special de limfocitele Th2 şi în concentraţie mai mică de mastocite şi de celulele dendritice. Acţionează asupra receptorilor specifici IL-31R, principalele sale ţinte fiind fibroblastul şi eozinofilul(8). Însă recent au fost identificate şi alte izoforme ale IL-31, care sunt molecule solubile sau prezintă structură similară cu a altor citokine de tip Th1(8,9). Receptorul pentru IL-31 este exprimat în special în tegumente şi endoteliu, sugerând faptul că IL-31 ar putea juca un rol principal în reglarea funcţională la aceste niveluri(8). Unele studii sugerează că IL-31 stimulează citokinele proinflamatorii şi reglează proliferarea celulară şi remodelarea tisulară(9,10). IL-31 a fost intens studiată în bolile cutanate mediate Th2, cum ar fi dermatita atopică(8), însă recent a fost studiată şi în patogeneza astmului bronşic. IL-31 este implicată în procesul inflamator şi de remodelare de la nivelul căilor aeriene(11). Nivelul de IL-31 este semnificativ mai mare în serul şi în lichidul bronhoalveolar la pacienţii cu astm comparativ cu voluntarii sănătoşi, nivelul său fiind corelat cu severitatea bolii(12). Moaaz et al. au raportat rezultate similare şi la copiii astmatici, niveluri crescute de IL-31 fiind decelate la cei cu fenotipul atopic(13). În ceea ce priveşte rolul IL-31 în procesul inflamator din BPOC, datele lipsesc.
Studiul de faţă are ca obiectiv principal evaluarea nivelului plasmatic al IL-31 şi corelarea acestuia cu manifestările clinice şi funcţia pulmonară la pacienţii cu astm sau BPOC.
Materiale şi metodă
Studiul de faţă este un studiu analitic transversal care a inclus 40 de pacienţi cu boală bronhoobstructivă pulmonară. Protocolul de studiu a fost aprobat de Comisia de Etică a Universităţii de Medicină şi Farmacie „Iuliu Haţieganu”, Cluj-Napoca. Fiecare pacient a semnat consimţământul informat anterior includerii în studiu.
Pacienţii au fost împărţiţi în două subgrupuri, în funcţie de diagnosticul de boală: 18 pacienţi cu BPOC şi 22 de pacienţi cu astm.
Criteriile de includere au fost: pacienţi de peste 18 ani, cu diagnostic de novo de astm bronşic sau BPOC. Criteriile de excludere au fost: alte boli bronhoobstructive cronice, rinita alergică drept unică manifestare a atopiei, bronşite acute sau cronice infecţioase, alte boli autoimune cu componentă inflamatorie, astm sau BPOC care au primit anterior tratament cronic cel puţin trei luni anterior prezentării. Diagnosticul pozitiv de astm bronşic sau BPOC, precum şi evaluarea severităţii bolii s-au stabilit pe baza criteriilor menţionate în ghidurile de diagnostic şi tratament(14,15).
La includerea în studiu, pacienţii au fost evaluaţi clinic. Din anamneză s-au înregistrat:
datele demografice – vârstă, sex, mediul de locuit (urban/rural);
debutul bolii;
tipurile de simptome şi severitatea acestora;
antecedentele familiale de boală bronhoobstructivă;
comorbidităţile;
factori de risc asociaţi – fumatul.
Pe baza severităţii simptomelor s-a stabilit gradul de severitate al bolii.
După evaluarea clinică s-a efectuat explorarea funcţiei pulmonare prin spirometrie şi s-au înregistrat următorii parametri: capacitate vitală, VEMS şi PEF.
Probele de sânge (5 ml de sânge recoltat fără anticoagulant) s-au prelevat la vizita de includere în studiu. Probele prelevate au fost centrifugate în prima oră după recoltare timp de 5 minute, la 3000 rpm şi s-a separat serul. Serurile astfel obţinute au fost stocate la –80 °C până în momentul determinării. IL-31 a fost determinată din ser prin metoda ELISA (ELISA duoset R&D, USA). Probele şi standardele au fost pregătite şi diluate conform specificaţiilor producătorului. S-au considerat limitele de detecţie cele specificate de producător, iar valorile normale au fost considerate cele obţinute la voluntarii sănătoşi şi au fost menţionate de producător în manualul de utilizare.
Prelucrarea statistică
Datele obţinute au fost incluse în tabele Excel şi ulterior au fost analizate cu ajutorul programului de statistică SPSS version 20 (Chicago, IL, USA). Datele au fost exprimate ca variabile continue sau nominale. Variabilele nominale au fost exprimate sub formă de procente. Pentru variabilele continue s-a testat distribuţia normală/nonnormală cu ajutorul testului Kolmogorov-Smirnov şi au fost exprimate ca medie şi deviaţie standard.
Testele statistice utilizate au fost selecţionate în funcţie de tipul de distribuţie a datelor. S-a utilizat testul Mann-Whitney pentru analiza univariată a variabilelor continue. Testul ANOVA s-a utilizat în cazul comparării mai multor grupuri. Pentru a analiza corelaţia între doi parametri numerici s-au utilizat coeficienţii de corelaţie Pearson/Spearman. Testul chi pătrat s-a utilizat pentru a compara două variabile nominale. Nivelul de semnificaţie statistică a fost stabilit la o valoare p < 0,05.
Rezultate
Datele demografice ale pacienţilor incluşi în studiu sunt prezentate în tabelul 1.
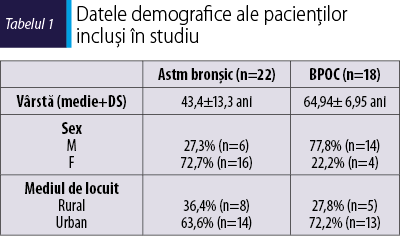
Vârsta pacienţilor cu BPOC a fost semnificativ mai mare decât a grupului cu astm bronşic (p = 0,003). Distribuţia pe sexe a fost de asemenea semnificativ diferită (p = 0,004). Astmul bronşic a fost mai frecvent observat la femei, în timp ce BPOC a fost semnificativ mai frecvent la bărbaţi. Mediul de locuit nu a diferit între cele două grupuri de studiu, majoritatea pacienţilor cu astm şi BPOC locuiau în mediul urban (p = 0,737).
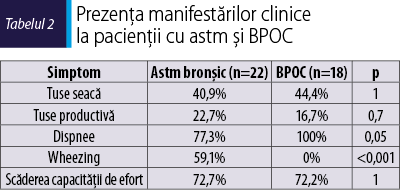
Evaluarea clinică iniţială a vizat prezenţa şi severitatea simptomelor specifice de astm şi BPOC. S-au cuantificat dispneea, tusea, wheezingul şi toleranţa la efort. Prezenţa simptomelor la includerea în studiu este redată în tabelul 2. Se observă că tusea, atât cea seacă, cât şi cea productivă, este prezentă atât la pacienţii cu astm, cât şi la cei cu BPOC în procentaje similare. Dispneea este un simptom prezent la toţi pacienţii cu BPOC, în timp ce wheezingul este prezent doar la pacienţii cu astm. Capacitatea de efort a pacienţilor este afectată similar în cele două grupuri.
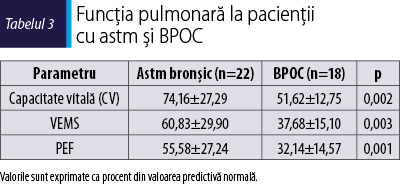
Numărul de exacerbări de boală care au condus la prezentarea la camera de gardă sau la medicul specialist a fost semnificativ mai mare la pacienţii astmatici comparativ cu cei cu BPOC (p = 0,015). Majoritatea pacienţilor cu astm bronşic au prezentat forme moderat‑severe de boală, 77% dintre pacienţii incluşi fiind cu medicaţie de fond de treapta 3-5. 13,3% au prezentat astm sever (treapta 5). La pacienţii cu BPOC s-a observat că formele moderat‑severe (treapta 3-4 GOLD) au fost dominante, fiind prezente la 94,5% dintre pacienţi. Acest aspect este confirmat şi de valorile parametrilor funcţionali. Funcţia pulmonară este semnificativ redusă la pacienţii cu BPOC comparativ cu cei cu astm (tabelul 3).
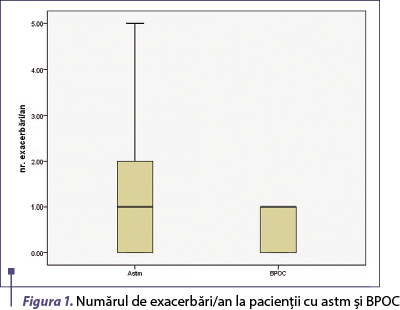
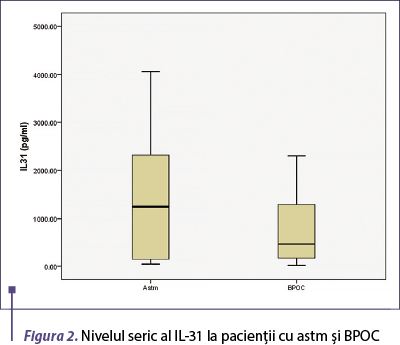
Nivelul seric al IL-31 a fost semnificativ mai mare la pacienţii cu boală bronhoobstructivă comparativ cu voluntarii sănătoşi (p = 0,001), fiind semnificativ crescut la pacienţii cu astm comparativ cu cei cu BPOC (p = 0,015) (figura 1).
Nivelul seric al IL-31 nu se corelează cu prezenţa unui simptom specific la pacienţii cu astm sau BPOC. Însă există o corelaţie pozitivă între acesta şi numărul de exacerbări de astm pe care pacienţii le-au avut în anul anterior examinării (R = 0,458, p = 0,033). Nu se constată o corelaţie între nivelul seric al IL-31 şi numărul de exacerbări de BPOC.
Figura 2. Nivelul seric al IL-31 la pacienţii cu astm şi BPOC
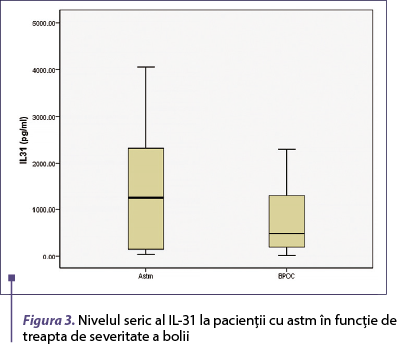
Nivelul seric al IL-31 este mai mare la pacienţii cu forme moderat‑severe de astm, dar diferenţa nu este semnificativă statistic (p = 0,08) (figura 2). Nivelul seric al IL-31 nu se corelează cu treapta de severitate la pacienţii cu BPOC.
Figura 3. Nivelul seric al IL-31 la pacienţii cu astm în funcţie de treapta de severitate a bolii
Nivelul seric al IL-31 se corelează negativ cu valoarea VEMS la pacienţii cu astm (R = –0,413, p = 0,05) şi cu valoarea predictivă a capacităţii vitale la pacienţii cu BPOC (R = –0,496, p = 0,041). Nivelurile plasmatice mai mari de IL-31 au fost raportate la pacienţii fumători comparativ cu ex-fumătorii la pacienţii cu BPOC, însă diferenţele nu au fost semnificative statistic. În grupul de pacienţi cu astm nu s-a înregistrat niciun pacient fumător, trei fiind foşti fumători care au prezentat niveluri mai mari de IL-31 comparativ cu nefumătorii.
Discuţie
Studiul de faţă evaluează rolul IL-31 la pacienţii cu astm şi BPOC, cu scopul de a investiga posibilul rol al său în patogeneza bolilor respiratorii bronhoobstructive.
Diferite mecanisme fiziopatologice sunt responsabile de inflamaţia cronică din căile aeriene superioare şi inferioare la pacienţii cu astm bronşic şi BPOC. Manifestările clinice specifice bolii pot să apară în corelaţie cu aceste modificări fiziopatologice, deşi sunt descrise cazuri fără simptomatologie clinic manifestă în care modificări minime inflamatorii sunt prezente în căile aeriene(16). Există câteva diferenţe bine stabilite între elementele celulare şi umorale implicate în ambele procese inflamatorii cronice(17). În ambele afecţiuni, răspunsul imun nu conduce la rezoluţia răspunsului inflamator, ci contribuie la progresia sa ulterioară. Este bine stabilit că mecanismele de apărare deficitare reprezintă principala cauză a progresiei BPOC, dar în cazul pacienţilor cu astm dezechilibrul mecanismelor imunoreglatoare reprezintă cauza inflamaţiei cronice(17,18).
În studiul de faţă au fost incluşi pacienţi cu astm şi BPOC. Vârsta medie a pacienţilor cu astm a fost semnificativ mai mare comparativ cu cea din alte studii publicate. Este cunoscut faptul că astmul este o boală a copilăriei, dar poate să apară şi la vârsta adultă, în evoluţia marşului alergic sau ca astm cu debut tardiv la vârsta adultă(14,19-21). Acest rezultat poate fi explicat prin faptul că în studiul de faţă au fost incluşi doar pacienţi adulţi cu forme persistente de astm, deci cu o evoluţie de durată. Nu au fost incluşi copii. Vârsta medie a pacienţilor cu BPOC a fost similară cu cea raportată în alte studii(14,21).
Diferenţele de prevalenţă a bolii între bărbaţi şi femei ar putea fi explicate prin etiologia diferită a bolii. Bolile alergice, printre care şi astmul bronşic, sunt mai frecvent întâlnite la femei la vârsta adultă(20,21), similar cu rezultatele obţinute în studiul de faţă. BPOC este semnalat mai frecvent la bărbaţi, deoarece fumatul este mai frecvent întâlnit la aceştia, fiind bine cunoscut faptul că fumatul reprezintă principala cauză a BPOC(14,21). Majoritatea pacienţilor incluşi în studiu provin din mediul urban, procentul fiind mai mare în rândul pacienţilor cu BPOC. Probabil că în mediul urban expunerea la particulele poluante este mai mare decât în zonele rurale, ceea ce explică o severitate mai mare a simptomelor şi un număr mai mare de exacerbări care conduc pacientul la medicul specialist. Pe de altă parte, accesibilitatea pacienţilor la serviciile de specialitate de alergologie şi pneumologie este mai mare în mediul urban decât în cel rural.
Simptomele la prezentare au fost asemănătoare, dar au existat şi diferenţe între pacienţii cu astm şi cei cu BPOC. Tusea seacă a fost cel mai frecvent întâlnit simptom în ambele grupuri de studiu. Deşi se cunoaşte că în astm tusea seacă este mai frecvent întâlnită(15,22), în BPOC predomină tusea productivă cu expectoraţie(14). Wheezingul a fost complet absent la pacienţii cu BPOC, în timp ce dispneea a fost prezentă la toţi aceşti pacienţi. Mai probabil, pacienţii incluşi în studiu nu au prezentat exacerbare în momentul evaluării, ci simptomatologie continuă cronică. La pacienţii cu astm, dispneea a lipsit din tabloul clinic la cinci pacienţi, mai probabil aceştia prezentând un fenotip de astm tusigen. În urma evaluării simptomatologiei s-a constatat că majoritatea pacienţilor prezent forme moderat‑severede boală în ambele grupuri de studiu, similar cu alte studii anterior publicate(14,15). În general, formele uşoare de astm pot fi tratate şi în mediu familial sau pot fi controlate la domiciliu, pe baza unui plan de acţiune în astm prestabilit de către medicul specialist. Pacienţii cu BPOC au avut de asemenea forme moderat severe, doar un pacient fiind cu stadiul II. BPOC este o boală cronică progresivă şi formele moderat‑severesunt cele cu prezentare la medicul specialist pentru evaluare.
Nivelul plasmatic al IL-31 a fost semnificativ mai mare la pacienţii cu astm sau BPOC comparativ cu valorile observate la voluntarii sănătoşi, în special la cei cu astm. IL-31 este o citokină care caracterizează răspunsul inflamator de tip Th2 prezent în astm şi niveluri crescute în ser au fost detectate şi în alte afecţiuni alergice, însă recent s-a ridicat ipoteza că IL-31 ar putea interveni în progresia răspunsului inflamator alergic în căile aeriene(11,23,24). Rezultate similare au fost obţinute şi în alte studii(11,12,23,24). De asemenea, Lai et al. au observat o corelaţie pozitivă între nivelul plasmatic al IL-31 şi severitatea simptomelor de astm(12). În studiul de faţă s-a observat o creştere progresivă şi proporţională a IL-31 în formele moderat‑severe de astm, însă diferenţele notate nu au atins pragul de semnificaţie statistică. Dar numărul de exacerbări de astm în anul anterior prezentării se corelează cu nivelul plasmatic al IL-31, ceea ce ar sugera o implicare a IL-31 în formele severe de boală. Rezultate similare care au arătat corelarea severităţii astmului cu nivelul bazal de IL-31 au fost raportate şi în studiul lui Lai et al.(12) Nu s-a observat însă o corelare între severitatea BPOC, numărul de exacerbări pe an şi nivelul de IL-31, ceea ce demonstrează că IL-31 este o componentă a răspunsului imun de tip Th2 întâlnit în astm, şi nu în BPOC.
IL-31 este implicată şi în reglarea funcţiei pulmonare, fiind negativ corelată cu parametrii funcţionali atât în astm, cât şi BPOC. Faptul că IL-31 nu se corelează cu manifestările clinice, dar nivelul său este negativ corelat cu capacitatea vitală la pacienţii cu BPOC sugerează faptul că IL-31 intervine în procesul de reparare bronşică, ceea ce determină creşterea rezistenţei la fluxul aerian şi obstrucţia bronşică. Rezultate similare au fost raportate şi în studiul lui Lai et al.(12), care au arătat o corelaţie negativă între valoarea IL-31 şi VEMS la pacienţii astmatici. IL-31 induce o exprimare crescută a citokinelor de tip Th2, cu augmentarea procesului inflamator cronic şi agravarea simptomelor clinice şi a parametrilor funcţionali respiratori. Astfel, IL-31, responsabilă de menţinerea inflamaţiei cronice, poate agrava bronhospasmul, cu apariţia wheezingului, fapt observat şi la pacienţii astmatici din studiul de faţă. În ceea ce priveşte rolul IL-31 în BPOC, până în prezent nu au fost publicate date în literatură. Rezultatele acestui studiu confirmă ipoteza că IL-31 acţionează în conjuncţie cu alţi mediatori pentru a stimula progresia inflamaţiei cronice atât în astm, cât şi în BPOC, având o influenţă mai mare în astm, unde predomină răspunsul de tip Th2.
Studiul de faţă evaluează pentru prima dată rolul IL-31 în două afecţiuni bronhoobstructive cu mecanisme fiziopatologice diferite şi uneori intricate. Principala limită a studiului este reprezentată de numărul mic de pacienţi incluşi în ambele grupuri. Din această cauză, nu s-a putut realiza analiza univariată pe subgrupuri de pacienţi (de exemplu, fumători, trepte de severitate etc.). De asemenea, nu s-a evaluat evoluţia IL-31 sub tratament specific antiinflamator inhalator.
Concluzii
Nivelul IL-31 este crescut la pacienţii cu astm şi BPOC, fiind semnificativ mai mare la astmatici. La pacienţii astmatici, IL-31 se corelează cu severitatea bolii şi cu declinul funcţiei pulmonare.
Bibliografie
-
World Health Organization. Chronic Respiratory Diseases.[Internet; cited 2019 March 11]. Available from: https://www.who.int/respiratory/about_topic/en/
-
Burney P, Jarvis D, Perez-Padilla R. The global burden of chronic respiratory disease in adults. Int J Tuberc Lung Dis. 2015 Jan;19(1):10-20.
-
Barnes PJ. Inflammatory mechanisms in patients with chronic obstructive pulmonary disease. J Allergy Clin Immunol. 2016 Jul;138(1):16-27.
-
Barnes PJ. Targeting cytokines to treat asthma and chronic obstructive pulmonary disease. Nat Rev Immunol. 2018 Jul;18(7):454-466.
-
Russell RJ, Brightling C. Pathogenesis of asthma: implications for precision medicine. Clin Sci (Lond). 2017 Jun 30;131(14):1723-1735.
-
Lambrecht BN, Hammad H. The immunology of asthma. Nat Immunol. 2015;16(1):45‑56.
-
Barnes PJ. Asthma. In: Loscalzo J. Harrison’s Pulmonary and Critical Care Medicine. 2nd edition. United States of America:Mcgraw Hill Education;2013.pag 66-76
-
Murdaca G, Greco M, Tonacci A, Negrini S, Borro M, Puppo F, Gangemi S. IL-33/IL-31 Axis in Immune-Mediated and Allergic Diseases. International Journal of Molecular Sciences. 2019; 20(23):5856.
-
Zhang Q, Putheti P, Zhou Q, Liu Q, Gao W. Structures and biological functions of IL-31 and IL-31 receptors. Cytokine Growth Factor Rev. 2008, 19, 347–356.
-
Gibbs BF, Patsinakidis N, Raap U. Role of the Pruritic Cytokine IL-31 in Autoimmune Skin Diseases. Front. Immunol. 2019, 10, 1–6.
-
Ip WK, Wong CK, Li ML, Li PW, Cheung PF, Lam CW. Interleukin-31 induces cytokine and chemokine production from human bronchial epithelial cells through activation of mitogen-activated protein kinase signalling pathways: Implications for the allergic response. Immunology 2007, 122, 532–541.
-
Lai T, Wu D, Li W, Chen M, Yi Z, Huang D, et al. Interleukin-31 expression and relation to disease severity in human asthma. Sci Rep. 2016, 6, 1–9
-
Moaaz M, Abo El-Nazar S, Abd El-Rahman M, Soliman E. Stem Cell Factor and Interleukin-31 Expression: Association with IgE among Egyptian Patients with Atopic and Nonatopic Bronchial Asthma. Immunol. Invest. 2016, 45, 87–106.
-
Global Initiative for Chronic Obstructive Lung Disease(GOLD).Global strategy for the diagnosis,management and prevention of chronic obstructive pulmonary disease 2018[Internet].Chapter 1:Definition and overview.[updated 2018; cited March 11]. Available from: https://goldcopd.org/wp-content/uploads/2017/11/GOLD-2018-v6.0-FINAL-revised-20-Nov_WMS
-
Global initiative for asthma(GINA). Global strategy for asthma management and prevention, 2018. Available from:https://ginasthma.org/wp-content/uploads/2018/04/wms-GINA-2018-report-V1.3-002
-
Canonica GW, Complati E. Minimal persistent inflammation in allergic rhinitis: implications for current treatment strategies. Clin Exp Immunol. 2009;158:260-271.
-
Saetta M. Airway pathology of COPD compared with asthma. Eur Respir Rev. 1997; 7: 211‑215.
-
Stankiewicz W1, Dabrowski MP, Chcialowski A, Plusa T. Cellular and cytokine immunoregulation in patients with chronic obstructive pulmonary disease and bronchial asthma. Mediators Inflamm. 2002 Oct;11(5):307-12.
-
Daneshmandi S, Pourfathollah AA, Pourpak Z, Heidarnazhad H, Kalvanagh PA. Cytokine gene polymorphism and asthma susceptibility, progress and control level. Mol Biol Rep. 2012;39(2):1845-53
-
de Marco R, Cappa V, Accordini S, Rava M, Antonicelli L, Bortolami O, et al. Trends in the prevalence of asthma and allergic rhinitis in Italy between 1991 and 2010. Eur Respir J. 2012;39(4):883-92.
-
de Marco R, Marcon A, Rossi A, Antó JM, Cerveri I, Gislason T, et al. Asthma, COPD and overlap syndrome: a longitudinal study in young European adults. Eur Respir J. 2015;46(3):671-9.
-
Kay AB. Allergy and allergic diseases. N Engl J Med. 2001;344:30-37.
-
Chattopadhyay S, Tracy E, Liang P, et al. Interleukin-31 and oncostatin-M mediate distinct signaling reactions and response patterns in lung epithelial cells. J Biol Chem. 2007;282:3014–26.
-
Lei Z, Liu G, Huang Q, et al. SCF and IL-31 rather than IL-17 and BAFF are potential indicators in patients with allergic asthma. Allergy. 2008;63:327–32.





