Obesity is a public health issue, and it has recently recorded significant increases in incidence. Obesity is a chronic disease associated with multiple health risks. Some eating disorders favor obesity. Other eating disorders such as anorexia are associated with extremely low body weight. In general, eating disorders have extremely complicated mechanisms of appearance, the psychiatric component making them difficult to manage. Many eligible overweight or obese patients are currently not treated, although there are several antiobesity drugs with proven efficacy. Current treatment guidelines recommend the long-term administration of an antiobesity drug, such as liraglutide, lorcaserin, and prolonged-release combinations naltrexone/bupropion and phentermine/topiramate, associated with hypocaloric diet and physical activity.
Ce poate face farmacistul pentru pacienţii săi adulţi cu tulburări de alimentaţie sau obezitate?
What can the pharmacist do for his adult patients with eating disorders or obesity?
First published: 25 aprilie 2019
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/FARM.187.2.2019.2333
Abstract
Rezumat
Obezitatea este o problemă de sănătate publică, în ultimul timp înregistrându-se creşteri importante ale incidenţei. Obezitatea este o boală cronică, asociată cu multiple riscuri pentru sănătate. Unele tulburări de alimentaţie favorizează apariţia obezităţii. Alte tulburări de alimentaţie, precum anorexia, sunt asociate cu greutate corporală extrem de redusă. În general, tulburările de alimentaţie au mecanisme de apariţie extrem de complicate, componenta psihiatrică făcându-le dificil de gestionat. Obezitatea este subtratată în prezent, deşi există medicamente cu eficacitate dovedită. Ghidurile de tratament actuale recomandă administrarea pe termen lung (ani) a medicaţiei cronice antiobezitate, precum liraglutid, lorcaserină şi combinaţiile cu cedare prelungită naltrexon/bupropion şi fentermină/topiramat, asociată dietei hipocalorice şi activităţii fizice.
De ce sunt importante obezitatea şi tulburările de alimentaţie şi ce poate face farmacistul
Obezitatea este o boală cronică ce îi afectează atât pe adulţi, cât şi pe copii, cu o incidenţă în continuă creştere mai ales în lumea dezvoltată şi care are multiple consecinţe asupra sănătăţii fizice şi psihice şi asupra calităţii vieţii celor afectaţi.
Am ales să vorbim în această lucrare şi despre tulburările de alimentaţie, pentru că bulimia, mâncatul compulsiv şi altele pot duce la obezitate.
În Europa se estimează că, în 2014, mai mult de jumătate dintre adulţi (51,6%) sunt supraponderali sau obezi, cu o rată mai mare în cazul bărbaţilor (59,1%) decât al femeilor (44,7%)(1).
Caucazienii cu un stil de viaţă occidental având un Indice de Masă Corporală (IMC) între 25 şi 29,9 kg/m2, sunt consideraţi supraponderali, iar cei cu IMC peste 30 kg/m2 sunt diagnosticaţi ca obezi. Valorile crescute ale circumferinţei taliei se consideră că sporesc riscurile asociate obezităţii; pentru rasa albă, aceste valori sunt 93 cm la bărbaţi, respectiv 79 cm la femei. Indicele de masă corporală (engl. BMI – body mass index) se calculează împărţind greutatea corporală (în kg) la pătratul înălţimii (în m)(2).
Obezitatea trebuie tratată ca orice altă boală cronică. Cei mai mulţi pacienţi care scad în greutate prin diferite intervenţii revin la greutatea iniţială în aproximativ cinci ani; de aceea, este necesar managementul obezităţii pe termen lung. Mecanismele compensatoare care determină revenirea la greutatea iniţială încep să fie cunoscute: încetinirea metabolismului cu scăderea consumului de energie(3), modificări ale senzaţiilor de foame şi saţietate care conduc la creşterea cantităţii de alimente ingerate(4) şi modificări ale sensibilităţii la insulină şi ale numărului adipocitelor care favorizează depunerea de grăsime(5).
Obezitatea este în prezent subtratată. O analiză din 2017 conchide că doar 2% dintre pacienţii din SUA eligibili pentru tratament conform ghidurilor actuale primesc medicaţie antiobezitate. Aceasta, în ciuda disponibilităţii în farmacii a unor medicamente care produc scădere ponderală, mai multe în SUA decât în Uniunea Europeană, care este mai restrictivă în autorizarea medicamentelor(5). Date despre nivelul de prescriere a medicaţiei antiobezitate din alte zone ale lumii nu sunt disponibile, dar se poate presupune că subutilizarea acestor medicamente este generalizată. Putem vorbi aşadar despre o problemă de terapie medicamentoasă de tip underuse, când pacienţi care ar putea beneficia de pe urma medicaţiei nu sunt trataţi.
Reglarea senzaţiei de foame şi de saţietate
Fiziopatologia obezităţii implică factori care reglează apetitul, consumul de energie şi stocarea de energie. Greutatea corporală este reglată la mai multe niveluri, care intervin simultan şi se influenţează unele pe altele:
-
factori metabolici şi hormonali, care tind să menţină constantă greutatea corporală; acestora li se opun factori care imprimă o tendinţă de creştere uşoară a greutăţii corporale pe parcursul întregii vieţi;
-
sistemul de recompensă, influenţat de proprietăţile apetisante ale mâncării;
-
factori psihologici de care depind autocontrolul şi valorizarea de sine;
-
factori sociali(4).
Factorii care influenţează cognitiv şi emoţional foamea şi saţietatea sunt factori biologici şi factori de mediu. Factorii biologici pot fi factori genetici, epigenetici şi factori care ţin de dezvoltarea intrauterină (obezitatea maternă prenatală, gravida fumătoare, restricţii de creştere intrauterină). Macromediul modern influenţează comportamentele alimentare prin disponibilitatea crescută a mâncării (în cea mai mare parte a lumii), prin modificarea calităţii şi proprietăţilor hranei (alimente procesate, cu conţinut caloric mare), prin norme şi structuri sociale şi culturale, prin impactul larg pe care îl au televiziunea şi tehnologia şi prin perturbatorii endocrini (substanţe obesogene, de tipul fumului de ţigară, bisfenolului A, poluării atmosferice, ftalaţilor, care modifică metabolismul, crescând riscul de obezitate, mai ales dacă expunerea este la vârstă fragedă). Micromediul modern care influenţează mâncatul se referă la tipul de alimente pe care alegem să le consumăm, la activitatea fizică, la somn (cantitatea şi calitatea acestuia) şi la ritmul circadian, la expunerea la stres şi gestionarea lui(6,7).
Obezitatea se datorează unui dezechilibru dintre aportul de energie şi consumul de energie, care conduce în timp la stocare crescută de energie, sub formă de ţesut adipos. Cauzele acestui dezechilibru sunt multifactoriale. La majoritatea indivizilor obezi predomină factorii genetici, iar la alţii factorii de mediu joacă un rol important (accesibilitatea alimentelor în societatea de consum, sedentarismul etc.)(8,6).
Căi complexe neurohormonale, hormoni gastrointestinali şi diferite molecule semnalizatoare participă împreună la reglarea apetitului. La nivelul SNC, zone importante în reglarea poftei de mâncare (apetitului) sunt hipotalamusul, sistemul limbic, trunchiul cerebral, hipocampusul şi scoarţa cerebrală. Cea mai importantă zonă care reglează echilibrul energetic este nucleul arcuat hipotalamic, unde sunt localizaţi neuroni care exprimă fie factorii orexigeni NPY (neuropeptida Y) şi AgPr (agouti-related protein), fie factorii anorexigeni POMC (pro-opiomelanocortina) şi CART (cocaine and amphetamine related transcript). Efectul cumulativ al inhibării sau activării acestor neuroni orexigenici sau anorexigenici de către diferite semnale provenite din periferie (de la nivelul tubului digestiv sau ţesutului adipos) sau de la alte reţele neurale duce fie la efecte anabolice, cu creşterea cantităţii de alimente ingerate şi scăderea consumului de energie (prin activarea receptorilor Y1 sau Y5 din nucleul paraventricular hipotalamic), fie la efecte catabolice, cu scăderea cantităţii de alimente ingerate şi cu creşterea arderii de energie (prin activarea de către aMSH, hormonul astimulator al melanocitelor, provenit din POMC, a receptorilor 3 şi 4 pentru melanocortină tot de la nivel hipotalamic)(4-6).
Neurotransmisiile cerebrale au şi ele rol un important în reglarea foamei şi saţietăţii. Implicaţiile adrenergice, serotoninergice, dopaminergice şi GABA-ergice asupra apetitului şi saţietăţii sunt printre primele cercetate de oamenii de ştiinţă care studiază echilibrul alimentar; probabil de aceea la aceste niveluri au fost dezvoltate cele mai multe substanţe folosite în obezitate, dar şi în tulburări de alimentaţie; unele dintre aceste medicamente sunt încă folosite, la altele s-a renunţat pentru că aveau profil farmacotoxicologic nefavorabil. Iar în prezent se dezvoltă şi încep să se folosească şi alte medicamente, cu mecanisme de acţiune diferite(8). Astfel, la nivel hipotalamic, stimularea receptorilor serotoninergici 5-HT1A şi a receptorilor adrenergici a2 creşte consumul de alimente, iar stimularea receptorilor serotoninergici 5-HT2C şi a receptorilor adrenergici a1 şi b2 scade consumul de alimente(8). Stimularea receptorilor dopaminergici de la nivelul nucleului accumbens duce la creşterea cantităţii de alimente ingerate; transmisia dopaminergică de la acest nivel este implicată în modularea plăcerii şi a comportamentului de recompensă asociat mâncatului(5). La nivelul amigdalei, stimularea receptorilor opioizi, în special m, conduce la apetit alimentar crescut.
Semnale preprandiale şi postprandiale (din perioada digestivă ) provenite de la nivelul aparatului digestiv, împreună cu schimbări ale concentraţiilor plasmatice ale nutrienţilor contribuie şi ele la reglarea consumului de alimente. Astfel, hormonii gastrointestinali GLP-1 (glucagon-like peptide 1), colecistokinina şi peptida YY, scad ingestia de alimente. Aceştia sunt eliberaţi la trecerea prin tubul digestiv a alimentelor care se digeră. GLP-1 are şi importante efecte incretinomimetice, stimulând eliberarea insulinei din pancreas, ca răspuns la hiperglicemia care se instalează postprandial. Insulina scade şi ea apetitul. Grelina este secretată preprandial de celulele oxintice din fundul stomacului şi creşte aportul alimentar prin stimularea receptorilor de la nivelul neuronilor hipotalamici care exprimă NPY şi AgRP(9); de aceea ea este numită şi hormonul foamei(6-8).
Leptina este o substanţă secretată de celulele adipoase, fiind un barometru pentru cantitatea de grăsime stocată în corp. La normoponderali, leptina scade apetitul; obezii sunt însă rezistenţi la leptină şi la aceştia sunt prezente niveluri crescute de leptină. În procesul de slăbire, nivelurile de leptină pot scădea şi atunci se transmite un semnal compensator către creier, de creştere a senzaţiei de foame, prin care organismul încearcă să îşi menţină constantă greutatea(7,8).
Leptina şi grelina circulante îşi manifestă efectele antagonice atât direct asupra hipotalamusului, dar şi prin intermediul nervului vag(6).
Toate aceste mecanisme intricate arată cât de importantă este pentru supravieţuirea organismului reglarea apetitului. Dacă un mecanism orexigen este afectat, altul îi ia locul. Acest fapt explică de ce este atât de greu să slăbim şi mai ales de ce după pierderea în greutate tendinţa naturală a organismului este de a-şi reface masa corporală. Tocmai de aceea intervenţiile farmacologice antiobezitate trebuie să fie pe termen lung, când se practică.
Tulburări de alimentaţie asociate cu obezitatea
Mâncatul compulsiv apare atunci când cantităţi foarte mari de mâncare sunt consumate în timp scurt, fiind asociat cu o senzaţie subiectivă de pierdere a controlului asupra cantităţii ingerate şi cu remuşcări după aceea. Nu sunt prezente comportamente compensatoare (inducerea vomei, folosirea de purgative), ceea ce diferenţiază această afecţiune de bulimia nervosa. Obezitatea este severă, greutatea corporală variază în limite largi şi de obicei sunt prezente tulburări psihologice pronunţate(7).
Mâncatul nocturn este însoţit de anorexie dimineaţa şi se manifestă cu hiperfagie seara şi insomnie noaptea. Cel puţin 25-50% din totalul zilnic de alimente sunt consumate după cină(7).
Medicamente care determină modificări ale greutăţii corporale
Medicamentele pot determina creşteri ale greutăţii corporale, prin mecanisme încă incomplet elucidate. Astfel de medicamente, precum şi alternativele de preferat la supraponderali şi obezi, pentru că fie scad greutatea corporală, fie nu o influenţează sunt prezentate în tabelul 1.
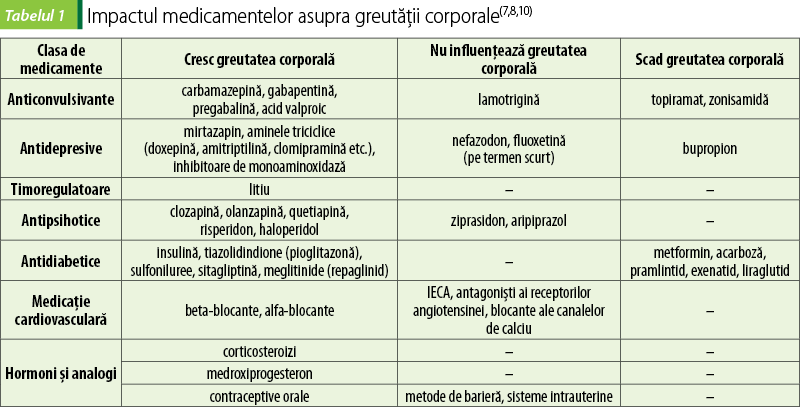
Obezitatea şi complicaţiile ei
Obezitatea este un factor major de morbiditate şi mortalitate. Ea contribuie la apariţia şi agravarea sindromului metabolic şi a diabetului zaharat, prin dezvoltarea rezistenţei la insulină. În bolile cardiovasculare, obezitatea este un factor de risc, fiind frecvent asociată cu dislipidemiile(7).
Obezitatea favorizează instalarea steatozei hepatice nonalcoolice, care poate contribui la dezvoltarea cirozei hepatice. Depunerile de pietre la nivelul vezicii biliare sunt mai frecvente la obezi. Refluxul gastroesofagian este favorizat de obezitate, deoarece cantităţile mari de alimente ingerate pun presiune crescută pe sfincterul esofagian inferior. Infertilitatea şi sindromul ovarului polichistic sunt şi ele asociate cu obezitatea(7).
Apneea de somn apare când excesul de grăsime de la nivelul gâtului apasă pe căile respiratorii în timpul nopţii. Respiraţia se opreşte pentru scurt timp de sute de ori pe noapte, conducând la sforăituri zgomotoase şi scăzând calitatea somnului, cu apariţia somnolenţei diurne. Apneea de somn creşte riscul hipertensiunii, aritmiilor cardiace şi sindromului metabolic. De sine stătător sau secundar apneei de somn, poate să apară sindromul de hipoventilaţie din obezitate (sindromul Pickwickian), cu hipercapnie, reducerea sensibilităţii la dioxid de carbon ca stimulator al respiraţiei, hipoxie, cor pulmonale şi risc de moarte prematură(7).
Infecţiile cutanate sunt comune la obezi, deoarece aceştia transpiră mai mult, iar transpiraţia stagnează în pliurile cutanate şi favorizează dezvoltarea ciupercilor şi bacteriilor patogene(7).
Osteoartrita, tendinitele şi fasciitele, guta, tromboembolismul venos şi embolismul pulmonar sunt şi ele mai frecvente la obezi şi supraponderali decât la cei cu o greutate normală a corpului(7).
Multe tipuri de cancer sunt favorizate de obezitate: cancerul de sân, colorectal, de vezică biliară, endometrial, hepatic, ovarian, pancreatic, de prostată etc.(8)
Intervenţia terapeutică în obezitate
Abordarea terapeutică actuală a obezităţii se face centrat pe pacient, medicii şi farmaciştii trebuind să prezinte şi să ofere acestuia metoda sau combinaţiile de metode optime pentru pacient. Opţiunile terapeutice includ:
-
modificări ale stilului de viaţă, care pot conţine diete hipocalorice şi activitate fizică;
-
medicaţie antiobezitate;
-
chirurgie bariatrică.
Management nefarmacologic
Intervenţiile nefarmacologice sunt primele care se aplică pentru controlul greutăţii corporale. Ele trebuie încorporate în stilul de viaţă, menţinerea greutăţii optime după slăbire fiind o provocare pe perioada întregii vieţi.
Dieta şi mişcarea fizică sunt axele intervenţiilor nefarmacologice; combinate, dau rezultate mai bune decât practicate separat.
Pentru pierdere în greutate se recomandă o dietă hipocalorică bazată pe un deficit caloric zilnic de 500-1000 kcal/zi; adică, aportul caloric zilnic trebuie să fie în jur de 800-1200 kcal. Respectată adecvat 6 luni, dieta săracă în calorii poate să producă o scădere a greutăţii corporale de 8%. Dietele cu conţinut foarte scăzut de calorii, sub 800 kcal/zi, nu sunt în general recomandate(8).
Activitatea fizică trebuie să conţină minim 150 de minute pe săptămână de activitate fizică de intensitate cel puţin moderată. Pentru potenţarea pierderii în greutate, o oră de activitate fizică pe zi este necesară(8).
Tehnicile comportamentale de automonitorizare a dietei şi activităţii fizice pot fi foarte eficiente în managementul greutăţii corporale.
Management farmacologic
Primele abordări farmacologice ale obezităţii s-au făcut cu amfetamine anorexigene. Toxicitatea destul de mare a acestora şi potenţialul lor de farmacodependenţă nu permit însă administrarea pe perioade lungi a acestor medicamente. Pe de altă parte, la întreruperea unui astfel de tratament, organismul are tendinţa naturală de a recupera greutatea pierdută.
Înţelegerea mecanismelor fiziopatologice care stau la baza obezităţii a condus la înţelegerea nevoii ca medicamentele antiobezitate să fie unele care se administrează pe o perioadă mai lungă. În prezent, există mai multe medicamente pentru care sunt realizate studii de până la câţiva ani, care demonstrează eficacitatea şi siguranţa în utilizare.
Criteriul de eficacitate necesar pentru autorizarea unui medicament antiobezitate de către EMA în Uniunea Europeană şi de către FDA în SUA este demonstrarea într-un studiu clinic de fază 3 a pierderii a cel puţin 5% din greutatea corporală, la grupul tratat, comparativ cu grupul placebo, sau a pierderii a cel puţin 5% din greutatea corporală la minimum 35% dintre pacienţii trataţi; aceste criterii se aplică medicamentelor destinate administrării cronice, evaluarea făcându-se după un an de administrare a substanţelor(5).
Scăderea greutăţii corporale cu 5% din greutatea iniţială este însoţită de îmbunătăţiri semnificative ale tensiunii arteriale, ale profilului lipidic şi ale toleranţei la glucoză. Din păcate, o scădere atât de mică în greutate, deşi benefică pentru sănătate, nu este neapărat însoţită de modificări estetice vizibile şi este uneori nemulţumitoare pentru pacienţii care încearcă să slăbească; aceştia pot deveni relativ uşor demotivaţi în a menţine intervenţiile pe care le practică pentru a slăbi(8).
În prezent, ghidurile de tratament consideră că medicamentele antiobezitate ar trebui prescrise pacienţilor cu IMC de peste 30 kg/m2 sau, în prezenţa comorbidităţilor (HTA, dislipidemie, diabet zaharat tip 2, apnee de somn), la cei cu IMC de peste 27 kg/m2, dacă după 6 luni de modificări comportamentale, dietă şi activitate fizică pacienţii nu au scăzut în greutate(2,11-13).
Deoarece scăderea în greutate cea mai importantă se obţine prin combinarea dietei cu activitate fizică şi cu administrare de medicamente, este important ca pacienţii să fie consiliaţi asupra importanţei adoptării unui stil de viaţă sănătos. Eficacitatea medicamentelor antiobezitate variază considerabil, aşa că pacienţii trebuie avertizaţi asupra acestui aspect. Medicamentele antiobezitate se folosesc în cele mai mici doze eficace şi tratamentul trebuie întrerupt dacă nu se atinge o scădere ponderală de 4-5% după 3-4 luni de tratament cu doxa maximă tolerată de pacient(5).
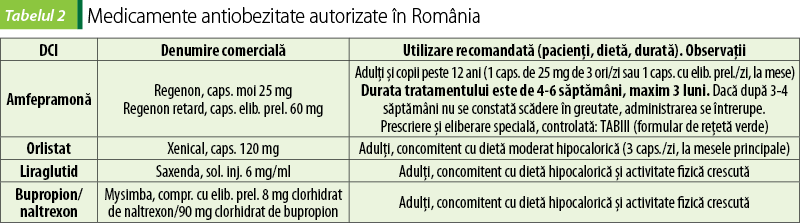
Cu excepţia orlistatului, toate medicamentele antiobezitate sunt contraindicate în sarcină.
În Uniunea Europeană (deci şi în România) sunt autorizate pentru punerea pe piaţă următoarele medicamente antiobezitate:
-
medicamente destinate a fi administrate pe perioade limitate, maximum câteva luni: amfepramona (cunoscută în SUA sub denumirea difenilpropion);
-
medicamente destinate tratamentului cronic, de durată (se pot administra câţiva ani): orlistat, liraglutid şi combinaţia bupropion-naltrexon.
În SUA există pe piaţă mai multe medicamente autorizate pentru a fi folosite în obezitate. Din categoria medicamentelor cu durată limitată de administrare sunt disponibile şi alte amine simpatomimetice pe lângă dietilpropion: fentermină, benzfetamină, fendimetrazină, metamfetamină. Pentru administrarea cronică se folosesc, pe lângă medicamentele disponibile şi în EU, lorcaserin şi combinaţia cu eliberare prelungită fentermină-topiramat(14). Reacţiile adverse şi revenirea la greutatea iniţială după întreruperea tratamentului au făcut ca amfetaminele să fie din ce în ce mai puţin folosite, fiind preferate în prezent pentru controlul greutăţii medicamentele administrate pe termen lung.
Amfepramona
Amfepramona este o amină simpatomimetică anorexigenă care acţionează prin stimularea eliberării catecolaminelor din terminaţiile nervoase presinaptice. Catecolaminele, prin acţiune la nivelul hipotalamusului lateral, inhibă centrul foamei şi scad apetitul alimentar(15).
Din cauza neselectivităţii de acţiune, stimularea adrenergică periferică realizată de amfepramonă poate să conducă la HTA, tahicardie, dureri precordiale, tahipnee şi midriază. Mai pot apărea hipertensiune pulmonară, reacţii psihotice sau psihoze, stări depresive, nervozitate, agitaţie, tulburări de somn şi vertij, stare tensională, iritabilitate, ameţeli sau cefalee, diskinezii, tulburări de vedere, hiperexcitabilitate, anxietate, euforie, disforie, tremor, uscăciunea mucoasei bucale, constipaţie, greaţă, diaree, crampe abdominale, gust neplăcut, impotenţă sau modificări de libidou, depresie medulară, reacţii alergice sau pseudoalergice cutanate. Poate să apară scăderea pragului convulsivant.
Amfepramona are un risc de dependenţă care trebuie luat în seamă la prescriere; potenţialul de farmacodependenţă face ca medicamentul să aibă un regim controlat de eliberare (medicament psihotrop, eliberat pe formulare verzi de prescriere – TABIII). Poate produce tulburări psihice. Întreruperea bruscă a tratamentului poate determina astenie psihică şi stări depresive. Intoxicaţia cronică se manifestă prin dermatoze severe, insomnie marcată, iritabilitate, hiperactivitate şi tulburări de personalitate(15).
Amfepramona este contraindicată în hipersensibilitate, tahicardie paroxistică, tahiaritmie, feocromocitom, hipertiroidism, forme severe de angină pectorală, glaucom cu unghi închis, hipertensiune pulmonară, HTA severă, antecedente sau afecţiuni cardiovasculare sau cerebrovasculare, antecedente sau afecţiuni psihice incluzând anorexia nervoasă şi depresia, tendinţă la abuz de medicamente, dependenţă de droguri sau alcool, ateroscleroză avansată, copii < 12 ani. Nu se asociază cu orice alt produs anorexigen cu activitate centrală, din cauza riscului de hipertensiune pulmonară, potenţial letală(15).
Amfepramona se foloseşte cu precauţie în insuficienţa renală, în afecţiuni ale prostatei cu retenţie urinară, în boli metabolice (de exemplu, diabetul zaharat) şi în boli cardiace.
Administrarea se face oral, o capsulă moale de 25 mg de trei ori pe zi sau o capsulă cu eliberare prelungită de 60 mg o dată pe zi; ultima administrare trebuie să fie cu cel puţin 4 ore înainte de culcare, pentru a evita insomnia. Durata uzuală a tratamentului este de 4-6 săptămâni şi sub nicio formă nu trebuie să depăşească 3 luni. Dacă după o lună de tratament pacientul nu scade în greutate, tratamentul se întrerupe(15).
Pe parcursul tratamentului se monitorizează regulat tensiunea arterială, EKG-ul, funcţia renală şi nivelul electroliţilor plasmatici şi se fac evaluări psihiatrice. Monitorizarea glicemiei la pacienţii diabetici trebuie să se facă mai des şi pot fi necesare scăderi ale dozei de insulină sau antidiabetice orale(8,15).
Orlistat
Orlistatul se foloseşte pentru scăderea în greutate, asociat unei diete hipocalorice, mai ales sărace în grăsimi. Lipazele gastrointestinale sunt esenţiale pentru absorbţia trigliceridelor cu lanţ lung; lipazele facilitează golirea stomacului şi secreţiile pancreatice şi biliare. Orlistatul se absoarbe puţin după administrare orală şi acţionează prin inhibarea activităţii lipazelor gastrice şi pancreatice. Consecutiv, scade absorbţia grăsimilor cu aproximativ 30%(8).
Eficacitatea orlistatului a fost dovedită într-un studiu clinic randomizat, prospectiv, dublu‑orb, care a durat 4 ani. 3305 pacienţi au fost aleatoriu împărţiţi în două grupuri, toţi adoptând modificări de stil de viaţă care favorizează pierderea în greutate. Grupul care a primit 120 mg orlistat de trei ori pe zi a înregistrat o scădere medie a greutăţii corporale semnificativ statistic mai mare decât grupul placebo (5,8 kg faţă de 3 kg, p<0,001). Şi alte beneficii au fost obţinute cu orlistat. Orlistatul a scăzut incidenţa diabetului zaharat de tip 2 şi a scăzut nivelurile de colesterol total şi LDL-colesterol, independent de scăderea în greutate(16).
Cele mai frecvente reacţii adverse ale orlistatului sunt flatulenţa, senzaţia de defecaţie iminentă, evacuarea unor materii fecale grase, incontinenţă fecală cu emisii de materii grase; mai rar, pot apărea nefrotoxicitate şi nefrolitiază, hepatotoxicitate şi pancreatită(17). Din cauza malabsorbţiei, este scăzută absorbţia vitaminelor liposolubile, de aceea se recomandă administrarea de preparate multivitaminice.
Reacţiile adverse neplăcute (scaune lichide, pătarea lenjeriei cu eliminări uleioase, dureri rectale etc.) scad aderenţa pacienţilor la acest tratament altfel destul de sigur în privinţa reacţiilor adverse sistemice şi care are şi alte beneficii asupra sănătăţii în afara scăderii în greutate. Eficacitatea în scăderea greutăţii este moderată, acesta fiind alt motiv pentru care nu e folosit pe scară mai largă. Totuşi, rămâne o variantă foarte utilă pentru pacienţii care nu tolerează medicamente antiobezitate care acţionează la nivel central, cei cu hiperglicemie preprandială sau cu hiperlipidemie(6), precum şi la pacienţii cu tendinţă la constipaţie(18).
Dozele uzuale sunt o capsulă de 120 mg orlistat imediat înainte, în cursul sau în cel mult o oră după fiecare masă principală (deci de trei ori pe zi). Dacă o masă este sărită sau nu conţine lipide, administrarea orlistatului nu trebuie făcută la acea masă. Orlistatul se foloseşte asociat unei diete echilibrate, moderat hipocalorice, cu maxim 30% conţinut caloric provenit din lipide(17).
Orlistatul este contraindicat în alăptare, colestază şi sindrom cronic de malabsorbţie(17). Poate modifica absorbţia anticoagulantelor orale cumarinice (acenocumarol) şi a ciclosporinei, de aceea nu se recomandă administrarea asociată sau este necesară monitorizarea atentă a concentraţiilor plasmatice de ciclosporină sau a INR, în cazul acenocumarolului(5). Orlistatul poate scădea absorbţia levotiroxinei, a antiretroviralelor şi a anticonvulsivantelor. Administrarea la momente diferite poate minimiza aceste interacţiuni, dar este necesară prudenţă. Femeile cu diaree severă după orlistat şi care folosesc contraceptive orale trebuie sfătuite să adopte altă metodă contraceptivă, absorbţia contraceptivului putând fi scăzută, cu risc de sarcină(8).
Din cauza riscului potenţial de afectare hepatică, pacienţii trebuie sfătuiţi să raporteze medicului sau farmacistului apariţia semnelor de afectare hepatică: icter, discoloraţii galbene ale pielii sau ochilor, urină închisă la culoare, fecale deschise la culoare. Funcţia hepatică se monitorizează, dacă apar simptome de disfuncţie hepatică. Alţi parametri care se monitorizează pe perioada tratamentului cu orlistat sunt: IMC, glicemia la pacienţii diabetici, funcţia tiroidiană la pacienţii cu afecţiuni tiroidiene(8).
Orlistatul în doză mică este singurul medicament antiobezitate disponibil fără prescripţie medicală, deoarece este cel mai bine studiat şi are cel mai mic risc de reacţii adverse pe termen lung(5). Un produs comercial OTC cu 60 mg orlistat (Alli®) este autorizat pentru punerea pe piaţă în UE, dar el nu mai este disponibil momentan în România.
Liraglutid
Liraglutid este singurul medicament antiobezitate care se administrează injectabil.
Liraglutid este un medicament incretinomimetic, folosit şi în tratamentul diabetului zaharat de tip 2. Liraglutid este un agonist al receptorilor GLP-1(19). Acesta stimulează eliberarea pancreatică postprandială de insulină, ceea ce îl face un medicament foarte potrivit pentru controlul greutăţii corporale în cazul pacienţilor obezi cu diabet zaharat de tip 2, prediabet sau toleranţă alterată la glucoză. Pacienţii care raportează lipsa senzaţiei de saţietate după mese pot şi ei beneficia de acest medicament, deoarece liraglutidul acţionează similar GLP-1 endogen, eliberat ca urmare a digestiei alimentelor, care stimulează receptori din creier, cu reducerea apetitului(8).
Eficacitatea liraglutidului în tratamentul obezităţii a fost pusă în evidenţă în mai multe studii. Studiul SCALE-Obesity and Prediabetes a fost un studiu randomizat, dublu‑orb, placebo-controlat, cu durată de un an. A înrolat 3731 de pacienţi supraponderali sau obezi, fără diagnostic de diabet zaharat de tip 2, însă din care 61,2% aveau prediabet. Pacienţii au fost randomizaţi în două grupuri, unul primind liraglutid 3 mg o dată pe zi, subcutanat, celălalt placebo. Pacienţii din grupul cu liraglutid au slăbit în medie 8,4 kg, faţă de 2,8 kg pierdute de grupul-martor. Liraglutidul a îmbunătăţit şi indicele glicemic şi a scăzut tensiunea arterială, circumferinţa taliei şi prevalenţa prediabetului, precum şi riscul de progresie către diabet zaharat de tip 2(20,21).
Studiul SCALE-Diabetes este un studiu randomizat, placebo‑controlat, dublu‑orb, care a urmărit timp de un an 846 de adulţi obezi sau supraponderali, care aveau şi diabet zaharat de tip 2. Pacienţii din grupul care a primit 3 mg pe zi liraglutid au pierdut în medie 6% din greutatea corporală iniţială, comparativ cu grupul care a primit placebo, unde scăderea ponderală a fost de 2%(22).
În studiul SCALE-Maintenance s-a administrat liraglutid unor pacienţi supraponderali sau obezi în continuarea unei diete prin restricţie calorică, în urma căreia pacienţii pierduseră cel puţin 5% din greutatea iniţială. Studiul randomizat, placebo-controlat, dublu‑orb, a avut durata de un an şi a înrolat 422 de pacienţi. Liraglutidul, asociat dietei şi exerciţiilor fizice, a menţinut pierderea în greutate iniţială şi chiar a accentuat-o (scădere ponderală suplimentară de 6,2% în grupul care a primit 3 mg liraglutid zilnic, comparativ cu 0,2% în grupul placebo). Mai mult, liraglutidul a îmbunătăţit şi unii factori de risc cardiovascular(23).
Principalele efecte adverse sunt greaţa şi vărsăturile, diareea sau constipaţia, dispepsia, pancreatita şi afectarea biliară. Tulburările gastrointestinale sunt cea mai frecventă cauză de întrerupere prematură a tratamentului, dar ele pot fi minimizate prin iniţierea tratamentului cu doze crescătoare. S-au raportat cazuri rare de pancreatită acută. Deoarece liraglutidul determină creşterea frecvenţei cardiace, pulsul trebuie monitorizat pe parcursul tratamentului.
Nu se foloseşte la pacienţii cu antecedente personale sau familiale de carcinom medular tiroidian sau neoplazie endocrină multiplă de tip 2, deoarece liraglutidul are risc de dezvoltare a tumorilor tiroidiene(5). Nu se foloseşte în insuficienţă hepatică sau insuficienţă renală severă ori în caz de hipersensibilitate(24).
Deoarece liraglutidul întârzie golirea stomacului, absorbţia altor medicamente administrate simultan poate fi interferată. Se pare însă că eficacitatea clinică a medicamentelor administrate simultan nu este afectată; totuşi, la iniţierea tratamentului cu liraglutid, INR-ul pacienţilor care iau anticoagulante orale de tip acenocumarol trebuie monitorizat mai des(24).
Dacă se administrează în asociere cu medicaţie antidiabetică, există risc de hipoglicemie; monitorizarea glicemiei şi ajustarea medicaţiei hipoglicemiante (mai ales insulină şi sulfoniluree) sunt necesare(8).
Un alt dezavantaj, pe lângă faptul că se administrează injectabil, este preţul crescut.
Administrarea Saxenda®, soluţia injectabilă care conţine liraglutid în stilou injector preumplut, se face subcutanat, o dată pe zi, aproximativ la acelaşi moment al zilei, la nivelul coapsei, abdomenului sau în partea superioară a braţului. Pentru îmbunătăţirea tolerabilităţii gastrice, administrarea se începe cu 0,6 mg pe zi, apoi după prima săptămână doza se creşte treptat, adăugând săptămânal câte 0,6 mg, până la o doză de menţinere de 3 mg/zi. În cazul în care uită să ia medicamentul, pacienţii trebuie sfătuiţi că o doză omisă în primele 12 ore faţă de ora obişnuită a administrării se administrează cât mai repede posibil, iar dacă sunt mai puţin de 12 ore până la următoarea administrare, doza omisă nu se mai ia şi se continuă administrările cu următoarea doză programată(24).
Dacă după 12 săptămâni de administrare a 3 mg pe zi nu se obţine o scădere în greutate de minimum 5% din valoarea iniţială, tratamentul se întrerupe(24).
În România este autorizat pentru folosire în tratamentul diabetului zaharat de tip 2 şi un medicament care conţine tot 6 mg/ml liraglutid, Victoza®, soluţie injectabilă în stilou preumplut. Dozele de liraglutid folosite în diabet sunt mai mici decât cele folosite la obezi; nu se recomandă doze zilnice mai mari de 1,8 mg pe zi(17).
Naltrexon/bupropion SR
Combinaţia este autorizată în tratamentul obezităţii în SUA de către FDA din 2014, iar în UE de către EMA din 2015. Ambele medicamente sunt folosite şi singure. Naltrexon este un antagonist competitiv al receptorilor opioizi m, autorizat în SUA pentru tratamentul dependenţei de opioide şi dependenţei de alcool. Interesant, medicamentul are şi două indicaţii orfane: hepatita autoimună şi nevralgia postherpetică(14). Bupropiona este folosită atât în SUA, cât şi în Europa ca antidepresiv (Elontril®, compr. elib. modif. 150 mg) şi în tratamentul dependenţei de nicotină, ca suport al renunţării la fumat (Zyban®, compr. elib. prel. 150 mg). Bupropiona este un inhibitor al recaptării dopaminei şi noradrenalinei.
Mecanismul de acţiune al acestei combinaţii în controlul apetitului este încă incomplet elucidat. Bupropiona stimulează la nivelul nucleului arcuat al hipotalamusului neuronii POMC care eliberează -MSH, care apoi se leagă şi stimulează receptorii melanocortinei 4 (MC4-R). Acest lucru duce la scăderea apetitului. Simultan cu eliberarea -MSH, neuronii POMC eliberează şi -endorfină, un agonist endogen al receptorilor opioizi m. Legarea -endorfinei la receptorii m opioizi de pe neuronii POMC mediază o buclă de feedback negativ pe neuronii POMC, cu scăderea eliberării de -MSH. Se presupune că naltrexona blochează această autoinhibiţie, permiţând o activare mai puternică şi mai de durată a neuronilor POMC, crescând astfel efectele bupropionei asupra balanţei energetice(25).
Eficacitatea combinaţiei a fost investigată în mai multe studii clinice. Studiul COR-I(26) a fost un studiu randomizat, dublu‑orb, placebo-controlat, cu durata de un an, cu 1742 de pacienţi. Pacienţii care au primit în urma randomizării combinaţia naltrexon/bupropion în forme farmaceutice cu cedare lentă (SR – slow release) în doze de 32 mg/360 mg zilnic au pierdut în medie 6,1% din greutatea iniţială, cei care au primit aceleaşi medicamente în doze de 16 mg/320 mg au pierdut 5% din greutate, iar greutatea medie a lotului-martor a scăzut cu 1,3%.
Un alt studiu clinic randomizat, dublu‑orb, controlat placebo, a inclus 505 pacienţi supraponderali sau obezi şi diabetici, care au primit timp de un an, în plus faţă de modificările comportamentale de stil de viaţă, naltrexon/bupropion SR sau placebo. Grupul tratat cu medicamente antiobezitate a pierdut în greutate 5% faţă de momentul iniţial, pe când grupul placebo, doar 1,8%. În plus, grupul tratat a înregistrat îmbunătăţiri în nivelul HbA1C şi al unor factori de risc(27).
Principalele reacţii adverse ale asocierii naltrexon/bupropionă au fost greaţa şi vărsăturile, constipaţia sau diareea, durerile de cap, ameţelile, insomnia şi xerostomia(8).
Combinaţia este contraindicată la pacienţii în tratament cronic cu analgezice opioide şi în preajma întreruperii bruşte a folosirii cronice a alcoolului, benzodiazepinelor, barbituricelor şi antiepilepticelor (naltrexonul poate precipita sindromul de abstinenţă). Nu se administrează simultan cu medicamente IMAO(8). Deoarece bupropiona scade pragul convulsivant, combinaţia este contraindicată în epilepsie. Insuficienţa hepatică şi insuficienţa renală severe şi tumorile cerebrale contraindică folosirea. Naltrexon/bupropion SR nu trebuie folosit în bulimie sau anorexie curente sau în antecedente. Pe parcursul tratamentului, consumul de alcool etilic trebuie limitat sau evitat(25).
Pe parcursul tratamentului se monitorizează IMC, aportul caloric şi cel lipidic, glicemia, pulsul şi tensiunea arterială, funcţia hepatică şi apariţia ideaţiei suicidare.
Bupropiona este metabolizată de CYP2B6, medicamentele inductoare ale acestei izoenzime (rifampicină, carbamazepină) putând scădea eficacitatea bupropionei. Bupropiona inhibă CYP2D6, cu posibila supradozare relativă a unor medicamente metabolizate de acesta: ISRS, antidepresive amine triciclice, antipsihotice(8).
Pentru limitarea senzaţiei de greaţă, care este principalul efect advers la iniţierea terapiei, şi îmbunătăţirea acceptării tratamentului, dozele se cresc treptat: se începe cu un comprimat pe zi dimineaţa timp de o săptămână, a doua săptămână se ia un comprimat de două ori pe zi, a treia săptămână două comprimate dimineaţa şi unul seara, pentru ca din a patra săptămână să se continue cu doza de menţinere, câte două comprimate de două ori pe zi, dimineaţa şi seara. Mesele bogate în grăsime cresc absorbţia celor două substanţe, cu risc mai mare de reacţii adverse. Dacă după 16 săptămâni de administrare a acestei doze de menţinere, pacientul nu pierde cel puţin 5% din greutatea corporală iniţială, tratamentul se întrerupe(25).
Efectele bupropionei la nivelul sistemului de recompensă fac ca asocierea naltrexon/bupropionă să fie o alegere bună în abordarea obezităţii pentru pacienţii care dezvoltă comportamente de dependenţă faţă de mâncare şi care tânjesc după mâncare, precum şi pentru cei care încearcă să se lase de fumat sau de alcool (în combaterea acestei dependenţe, naltrexonul este cel care ajută), dar şi la pacienţii deprimaţi(18).
Lorcaserină
Lorcaserina este un agonist al receptorilor serotoninergici 5-HT2C, care acţionează pe aceşti receptori serotoninergici localizaţi pe neuronii anorexigenici POMC de la nivelul hipotalamusului. Activarea acestor receptori duce la scăderea apetitului, cu scăderea cantităţii de alimente ingerate şi cu creşterea saţietăţii(8).
Lorcaserina nu este autorizată pentru a fi folosită în tratamentul obezităţii în UE, dar ea se foloseşte în SUA din 2012 şi în alte zone ale lumii(6).
Eficacitatea lorcaserinei a fost investigată în studiul BLOSSOM(28), un studiu cu durata de un an, randomizat, dublu‑orb, placebo-controlat. În studiu au intrat 4008 pacienţi cu IMC între 30 şi 45 kg/m2 sau între 27 şi 29,9 kg/m2, afectaţi de cel puţin o patologie legată de obezitate; nu au fost înrolaţi pacienţi cu evenimente cardiovasculare recente, HTA sau diabet zaharat. Pacienţii au fost împărţiţi aleatoriu în trei grupuri: un grup a primit 10 mg lorcaserină de două ori pe zi, un grup a primit lorcaserină 10 mg o dată pe zi, iar al treilea grup a fost martorul. Pacienţii cu 20 mg de lorcaserină pe zi au scăzut, în medie, în greutate cu 5,8 kg, cei cu 10 mg de lorcaserină pe zi au slăbit în medie 4,9 kg, iar lotul-martor a înregistrat o scădere ponderală de 2,9 kg. Au pierdut 5% din greutatea corporală iniţială 47,2% dintre pacienţii trataţi cu lorcaserină 10 mg de două ori pe zi şi 40,2% dintre cei care au luat 10 mg lorcaserină numai o dată pe zi, comparativ cu 25% în grupul placebo.
Studiul BLOOM(29) a fost un studiu de doi ani, randomizat, dublu orb, placebo-controlat, care a înrolat 3182 de pacienţi supraponderali sau obezi care au primit 52 de săptămâni fie 10 mg lorcaserină de două ori pe zi, fie placebo. La sfârşitul perioadei, pacienţii care primiseră lorcaserină fie au continuat cu aceeaşi doză de lorcaserină încă 52 de săptămâni, fie au început să primească placebo. Pacienţii care au primit doi ani lorcaserină au slăbit în medie 5,8 kg (faţă de 2,2 kg în grupul-martor), iar modificarea ponderală s-a păstrat într-o mai mare proporţie comparativ cu pacienţii care după un an de lorcaserină au fost trecuţi pe placebo.
Studiul BLOOM-DM(30) este un studiu randomizat, dublu‑orb, placebo-controlat, în care 604 pacienţi obezi diabetici, aflaţi sub tratament cu metformină, sulfoniluree sau ambele, au fost împărţiţi aleatoriu în trei grupuri, unul primind 10 mg de lorcaserină de două ori pe zi, altul lorcaserină 10 mg pe zi, al treilea grup primind placebo. În acest studiu, grupul cu doza mai mică de lorcaserină a slăbit puţin mai mult (5 kg) decât grupul care a primit 20 mg lorcaserină zilnic (4,7 kg), dar ambele au scăzut în greutate mult mai mult decât lotul-martor (1,6 kg).
Cele mai frecvente reacţii adverse ale lorcaserinei sunt cefaleea, ameţeala, constipaţia, oboseala şi uscăciunea gurii. Rar, pot apărea tulburări psihiatrice, priapism şi niveluri serice crescute de prolactină(8). Unii autori consideră că lorcaserina este cel mai bine tolerată dintre toate medicamentele antiobezitate disponibile în prezent(5).
Selectivitatea pentru receptorii serotoninergici 5-HT2C face ca lorcaserina să nu aibă unele dintre reacţiile adverse care au făcut să se renunţe la agonişti serotoninergici mai puţin selectivi: fenfluramina producea halucinaţii, datorate activării receptorilor 5-HT2A, valvulopatii cardiace şi hipertensiune pulmonară, ca urmare a activării receptorilor 5-HT2B. Pacienţii cu insuficienţă cardiacă congestivă trebuie să folosească cu precauţie acest medicament(6). Pacienţii trebuie totuşi instruiţi să raporteze medicului apariţia dispneei şi edemelor, care pot fi simptome ale unei disfuncţii valvulare(8).
Lorcaserina nu se foloseşte în administrare concomitentă cu alte medicamente care cresc nivelurile de serotonină (ISRs, antidepresive amine triciclice, IMAO, tramadol, petidină, triptani antimigrenoşi, anxioliticul buspirona, dextormetorfan, antiemeticele metoclopramid şi ondansetron), deoarece creşte riscul apariţiei sindromului serotoninergic. Nu se asociază nici cu medicamente care acţionează la nivel dopaminergic, din cauza riscului de apariţie a unor simptome asemănătoare celor din sindromul neuroleptic malign. În SUA, fentermina este o substanţă controlată, care se eliberează pe formulare speciale, din cauza potenţialului de abuz(8).
Lorcaserina se administrează în doze de 10-20 mg pe zi, iar dacă după 12 săptămâni de tratament greutatea pacientului nu scade cu minimum 5%, administrarea se opreşte(8).
Fentermină/topiramat ER
În SUA, asocierea fentermină/topiramat cu eliberare prelungită (ER – extended release) este autorizată de FDA pentru a fi folosită în managementul obezităţii din 2012, fiind cel mai eficace medicament antiobezitate în prezent(5). În Uniunea Europeană, EMA a refuzat, în acelaşi an, autorizarea combinaţiei, din considerente legate de siguranţă: risc de tahicardie cu consecinţe necunoscute pe termen lung asociat fenterminei şi riscuri psihiatrice (depresie şi anxietate) şi cognitive (probleme de memorie şi atenţie), asociate topiramatului(31).
Folosirea combinaţiei permite utilizarea unor doze mai mici din fiecare medicament, cu scăderea reacţiilor adverse. Fentermina este încă aprobată pentru scăderea apetitului în SUA, 15-37,5 mg/zi, cu o utilizare permisă de maximum trei luni(6).
Fentermina este o amină simpatomimetică asemănătoare structural amfetaminei, dar cu efect stimulator SNC mai mic şi cu potenţial de abuz mult redus. Reducerea apetitului se datorează stimulării la nivelul transmisiilor adrenergice şi dopaminergice, prin creşterea eliberării neuromediatorilor în fanta sinaptică(6).
Topiramatul este un medicament antiepileptic şi folosit în profilaxia migrenei. Se crede că eficacitatea în controlul apetitului se datorează modulării receptorilor GABA-ergici, inhibării anhidrazei carbonice şi antagonizării glutamatului(18).
Eficacitatea asocierii dintre doze mici de fentermină şi topiramat, condiţionate în forme farmaceutice cu eliberare prelungită, a fost demonstrată în studiul CONQUER32), un studiu dublu‑orb, placebo-controlat, care a înrolat 2487 de pacienţi cu IMC între 27 şi 45 kg/m2, cu doi sau mai mulţi factori de risc. Durata tratamentului a fost de un an, pacienţii fiind randomizaţi într-un grup placebo, un grup care a primit fentermină/topiramat ER 7,5 mg/46 mg zilnic şi un grup care a primit fentermină/topiramat ER 15 mg/92 mg pe zi. Scăderea ponderală medie a grupului cu dozele mai mari de medicamente a fost de 9,8 kg, a grupului cu dozele mai mici a fost de 7,8 kg, iar a grupului-martor a fost de 1,2 kg. 70% dintre pacienţii care au primit fentermină/topiramat ER 15 mg/92 mg pe zi au pierdut minimum 5% din greutatea iniţială; acelaşi lucru s-a petrecut şi cu 62% dintre pacienţii care au primit fentermină/topiramat ER 7,5 mg/46 mg, în timp ce în grupul-martor această scădere ponderală a apărut doar la 21% dintre pacienţi. Scăderi mai mari decât placebo ale tensiunii arteriale, circumferinţei taliei, concentraţiilor lipidelor plasmatice şi glicemiei à jeun s-au înregistrat la pacienţii care au primit fentermină/topiramat ER 15 mg/92 mg.
Studiul SEQUEL(33) a extins studiul CONQUER, înrolând 227 de pacienţi din studiul anterior. Aceleaşi doze de medicamente au fost administrate încă 52 de săptămâni. După cei doi ani de administrare, pacienţii cu fentermină/topiramat ER 15 mg/92 mg pe zi au slăbit în medie 10,9 kg, cei cu fentermină/topiramat ER 7,5 mg/46 mg pe zi au pierdut în medie 9,6 kg, iar grupul-martor, 2,1 kg. Rezultatele benefice asupra celorlalţi parametri metabolici s-au păstrat, în plus înregistrându-se şi o scădere a nivelului trigliceridelor la grupul tratat cu fentermină/topiramat ER 15 mg/92 mg pe zi, semnificativ mai mare decât la grupul-martor.
Cele mai frecvente reacţii adverse ale combinaţiei apărute în studiile clinice au fost constipaţia, xerostomia, paresteziile, disgeuzia şi insomnia. Mai pot apărea ideaţie suicidară şi tulburări de memorie şi concentrare. Acidoza metabolică, hipopotasemia (mai ales la pacienţii care folosesc simultan diuretice care elimină potasiul) şi creşterea creatininemiei sunt alte reacţii adverse posibile(6).
Topiramatul este asociat cu riscul de glaucom secundar cu unghi închis, iar fentermina poate să producă midriază prin stimularea adrenergică; din aceste motive, asocierea este contraindicată în glaucom. Combinaţia nu se administrează la mai puţin de 14 zile distanţă de medicamente IMAO, din cauza riscului de crize hipertensive. Hipertiroidismul necontrolat este o altă contraindicaţie(8).
Topiramatul este un cunoscut teratogen, cu risc de fisuri orofaciale, de aceea combinaţia este contraindicată gravidelor şi femeilor la vârstă fertilă care nu folosesc metode contraceptive eficace(18).
Pe parcursul tratamentului se monitorizează pulsul, deoarece fentermina poate să producă tahicardie. Concentraţiile serice de electroliţi şi creatininemia trebuie monitorizate(8).
Dozele se cresc treptat. Dacă după 12 săptămâni de tratament greutatea pacientului nu scade cu minimum 5%, administrarea se opreşte. Combinaţia fentermină/topiramat este în SUA un medicament cu regim controlat de eliberare, din cauza riscului de abuz(8).
Chirurgie bariatrică
Chirurgia bariatrică reprezintă intervenţia cea mai eficientă pentru scăderea în greutate. Constă în alterări ale stomacului, ale intestinului sau ale ambelor structuri anatomice, pentru a limita consumul alimentelor, prin micşorarea volumului stomacului, şi absorbţia nutrienţilor. Este indicată în cazul obezităţii morbide, cu un IMC de peste 40 kg/m2, sau în prezenţa unor complicaţii severe hipertensive, diabetice, dislipidemice sau apnee de somn, la pacienţi cu IMC de peste 35 kg/m2. Pacienţii eligibili pentru operaţie trebuie să aibă un risc operator acceptabil, să fie bine instruiţi şi motivaţi şi să fi încercat fără succes alte intervenţii de management al greutăţii corporale(8).
Chirurgia bariatrică este din ce în ce mai folosită pentru managementul obezităţii, deoarece asociază reducerea semnificativă a riscurilor de accident vascular cerebral, infarct miocardic, decese cardiovasculare, precum şi incidenţa diabetului de tip 2 şi a unor tipuri de cancer(8).
În general, procedurile se efectuează laparoscopic. Cel mai frecvent efectuate proceduri sunt:
-
bypass‑ul gastric – izolarea unei mici părţi din stomac, care se conectează apoi artificial cu jejunul proximal;
-
gastrectomia longitudinală (gastric sleeve) – micşorarea stomacului, cu îndepărtarea porţiunii dorsale a stomacului;
-
aplicarea unui inel gastric (gastric banding) – montarea unui inel reglabil, care împarte stomacul în două porţiuni, alimentele stagnând în porţiunea superioară, pentru că trec greu prin inelul îngust, cu creşterea senzaţiei de saţietate(7).
Toate metodele sunt restrictive, limitând volumul stomacului, dar cele mai multe antrenează şi importante modificări neuroendocrine. După bypass gastric şi după gastrectomie, nivelurile hormonilor gastrointestinali precum GLP-1 şi peptida YY cresc, contribuind în cele din urmă la senzaţia de saţietate şi la scăderea în greutate. Creşterea sensibilităţii la insulină are loc imediat după operaţie, înainte de apariţia unei pierderi semnificative în greutate; de multe ori, diabetul zaharat de tip 2 recent instalat al obezilor se poate remite după chirurgie bariatrică; chiar dacă nu, este necesară adaptarea dozelor de medicaţie antidiabetică. Apar modificări ale microbiomului intestinal, care pot şi ele să contribuie la modificarea greutăţii(7).
Îngrijirea pacientului după chirurgie bariatrică implică intervenţia farmacistului. Imediat după operaţie, formele farmaceutice solide nu se folosesc; de asemenea, este foarte importantă monitorizarea atentă a medicamentelor cu indice terapeutic mic. Din cauza modificării anatomiei şi fiziologiei gastrice normale, postoperator pacienţii sunt adesea expuşi riscului de deficienţe severe de micronutrienţi (vitamina B12) şi anemie. De aceea, suplimentarea empirică cu multivitamine şi minerale este esenţială pentru prevenirea deficienţelor nutriţionale la pacienţii operaţi (se administrează mai ales calciu, vitamina D, acid folic, tiamină, fier elemental şi vitamina B12)(8).
Chirurgia bariatrică poate modifica şi absorbţia medicamentelor. Aclorhidria, suprafaţa intestinală redusă pentru absorbţie şi modificările metabolismului medicamentului la nivel intestinal (prin afectarea enzimelor citocromului P450 sau a pompelor transportoare de eflux) pot duce la modificări importante de biodisponibilitate, precum cele raportate pentru unele antibiotice antimicrobiene, imunosupresoare, anticonvulsivante, antidepresive triciclice, ISRS sau levotiroxină(8).
Tulburările de alimentaţie
Tulburările de alimentaţie sunt din ce în ce mai larg acceptate ca tulburări psihiatrice. Managementul lor este dificil, pentru că pacienţii afectaţi sunt în general refractari la tratament. Intervenţiile farmacologice nu sunt susţinute încă de dovezi concluzive. Cea mai eficientă metodă de tratament rămâne în prezent psihoterapia, mai ales terapia comportamental-cognitivă, care are dezavantajul de a fi costisitoare şi de durată.
Tulburările de alimentaţie cele mai frecvente sunt:
-
anorexia nervosa
-
bulimia nervosa
-
mâncatul compulsiv (binge eating disorder)
-
sindromul mâncatului noaptea (night eating syndrome)
-
alte tulburări de alimentaţie(34).
Tulburările de alimentaţie conduc la greutăţi corporale extreme sau la variaţii ale greutăţii corporale. Obezitatea se instalează în unele cazuri de bulimia nervosa, mâncat compulsiv sau mâncat noaptea; anorexia nervosa poate conduce la înfometare cronică şi subnutriţie. Toate tulburările de alimentaţie cresc morbiditatea şi mortalitatea şi scad calitatea vieţii.
Alte afecţiuni psihiatrice (depresie, schizofrenie, anxietate generalizată, tulburări obsesiv compulsive şi tulburări de personalitate) sunt frecvente la pacienţii care suferă de tulburări de alimentaţie.
Scopurile tratamentului în tulburările de alimentaţie sunt:
-
stabilizarea medicală:
-
gestionarea comorbidităţilor medicale acute şi cronice; prevenirea complicaţiilor;
-
reluarea menstruaţiei, dacă aceasta a dispărut;
-
-
reabilitarea nutriţională:
-
atingerea unei greutăţi adecvate înălţimii;
-
stabilirea unor tipare de masă care promovează sănătatea şi conexiunile sociale;
-
-
normalizarea comportamentului alimentar:
-
încetarea comportamentelor restrictive sau excesive de alimentaţie şi compensatorii;
-
eliminarea comportamentelor alimentare dezordonate sau ritualice;
-
-
stabilizarea psihosocială:
-
evaluarea şi tratamentul comorbidităţilor psihologice;
-
restabilirea reţelei sociale şi responsabilităţilor sociale;
-
corectarea simptomelor psihologice asociate cu tulburările de alimentaţie;
-
îmbunătăţirea imaginii de sine(35).
-
Anorexia nervoasă
Cele mai multe cazuri de anorexie nervoasă apar la adolescente şi femei tinere. Pacientele refuză să se hrănească şi să îşi menţină măcar greutatea corporală minimă adecvată, se tem că sunt sau pot deveni grase, au o imagine de sine distorsionată şi sunt amenoreice cel puţin trei luni consecutiv (criterii de diagnostic al anorexiei nervoase)(34).
Pericolul major este reprezentat de subnutriţie, care poate conduce la moarte în cazurile grave.
Medicamentele pot fi utile în managementul anorexiei nervoase abia după o minimă restabilire a greutăţii corporale, care trebuie realizată preferabil cu ajutorul formulelor lichide de nutriţie orală(36).
Pentru managementul de durată al anorexiei nervoase, pe lângă psihoterapie se pot folosi antidepresive (ineficiente în managementul acut) de tip fluoxetină, 20-60 mg/zi, sau antipsihotice precum risperidona, 0,5-2,5 mg/zi, olanzapină, 2,5-15 mg/zi, sau quetiapină, 50-800 mg/zi. Aceste medicamente favorizează creşterea în greutate şi reduc simptome precum depresia, anxietatea şi tulburările obsesiv-compulsive(36,37).
Bulimia nervoasă
Bulimia nervoasă se diagnostichează prin mâncatul compulsiv, comportamentul compensatoriu inadecvat pentru a preveni creşterea în greutate (folosirea de laxative-purgative şi diuretice, precum şi inducerea vomei) şi o autoevaluare influenţată nejustificat de greutatea şi forma corporală(34).
Administrarea de medicamente pare să fie mai puţin eficace decât psihoterapia singură; combinarea celor două metode pare a fi cea mai bună abordare. Farmacoterapia este eficace şi poate fi inclusă în regimul iniţial de tratament, împreună cu reabilitarea nutriţională şi psihoterapia. Dacă nu sunt disponibile servicii nutriţionale specializate şi/sau psihoterapie, administrarea de medicamente ca singură metodă terapeutică este rezonabilă.
ISRS-urile sunt medicamentele de primă alegere în bulimia nervoasă: fluoxetin (doze mai mari decât cele antidepresive, 60 mg/zi) sau, dacă acesta nu este tolerat sau răspunsul nu este satisfăcător, sertralin, escitalopram sau fluvoxamină. Topiramatul sau alte antidepresive pot fi şi ele folosite (antidepresive triciclice, trazodon sau IMAO). Administrarea medicamentelor trebuie să se facă 6-12 luni. Recăderile sunt frecvente(36).
Concluzii
Farmacistul poate să identifice pacienţii afectaţi de obezitate sau tulburări de alimentaţie şi să recomande adresarea către medic. Farmacistul trebuie să le explice pacienţilor săi care sunt riscurile asociate acestor afecţiuni şi că există modalităţi eficace, dar nu facile, de intervenţie medicamentoasă. Farmacistul poate monitoriza siguranţa folosirii medicamentelor antiobezitate şi trebuie să insiste pe importanţa aderenţei la medicaţie, la diete alimentare adecvate şi la activitate fizică.
Bibliografie
- Eurostat/European Commission. Overweight and obesity - BMI statistics. Statistics Explained. 2019. Accesat 2019 Apr 1. https://ec.europa.eu/eurostat/statistics-explained/index.php/Overweight_and_obesity_-_BMI_statistics
- Toplak H, Woodward E, Yumuk V, Oppert J-M, Halford JCG, Frühbeck G. 2014 EASO Position Statement on the Use of Anti-Obesity Drugs. Obes Facts. 2015;8(3):166–74.
- Fothergill E, Guo J, Howard L, Kerns JC, Knuth ND, Brychta R, et al. Persistent metabolic adaptation 6 years after „The Biggest Loser” competition. Obesity. 2016;24(8):1612–9.
- Bessesen DH. Regulation of body weight: What is the regulated parameter? Physiol Behav. 2011;104(4):599–607. http://dx.doi.org/10.1016/j.physbeh.2011.05.006
- Bessesen DH, Van Gaal LF. Progress and challenges in anti-obesity pharmacotherapy. Lancet Diabetes Endocrinol. 2018;6(3):237–48. http://dx.doi.org/10.1016/S2213-8587(17)30236-X
- Srivastava G, Apovian CM. Current pharmacotherapy for obesity. Nat Rev Endocrinol. 2018;14(1):12–24. http://dx.doi.org/10.1038/nrendo.2017.122
- Youdim A. Obesity. 2018 [accesat 2019 Apr 10]. https://www.merckmanuals.com/professional/nutritional-disorders/obesity-and-the-metabolic-syndrome/obesity
- Sheehan AH, Chen JT, Yanovski JA, Calis KA. Obesity. In: DiPiro JT, Talbert RL, Yee GC, Matzke GR, Wells BG, Posey LM, editors. Pharmacotherapy: A Pathophysiologic Approach. 10th ed. McGraw-Hill Medical; 2017.
- Korner J, Leibel RL. To Eat or Not to Eat – How the Gut Talks to the Brain. N Engl J Med. 2003;349(10):926–8.
- Apovian CM, Aronne LJ, Bessesen DH, McDonnell ME, Murad MH, Pagotto U, et al. Pharmacological management of obesity: An endocrine society clinical practice guideline. J Clin Endocrinol Metab. 2015 Feb 1 [accesat 2019 Apr 10];100(2):342–62. https://academic.oup.com/jcem/article-lookup/doi/10.1210/jc.2014-3415
- Yumuk V, Tsigos C, Fried M, Schindler K, Busetto L, Micic D, et al. European Guidelines for Obesity Management in Adults. Obes Facts. 2015 [accesat 2019 Apr 10];8(6):402–24. www.karger.com/ofawww.karger.com/ofa
- NICE. Obesity: identification, assessment and management | Clinical Guidelines 189. NICE; 2014 [accesat 2019 Apr 10]. https://www.nice.org.uk/guidance/cg189/chapter/1-Recommendations#pharmacological-interventions
- NHLBI Obesity Education Initiative. The Practical Guide Identification, Evaluation, and Treatment of Overweight and Obesity in Adults NHLBI Obesity Education Initiative. NIH Publication (2000) Number 00-4084. 2000 [accesat 2019 Apr 16]. p. 9–11. https://www.nhlbi.nih.gov/files/docs/guidelines/prctgd_c.pdf
- Medscape. Drugs&Diseases. 2019 [accesat 2019 Apr 17]. https://reference.medscape.com/features/cases
- ANMDM. Regenon. Rezumatul Caracteristicilor Produsului. Ultima actualizare iunie 2016. 2016
- Muls E, Kolanowski J, Scheen A, Van Gaal L, ObelHyx Study Group. The effects of orlistat on weight and on serum lipids in obese patients with hypercholesterolemia: a randomized, double-blind, placebo-controlled, multicentre study. Int J Obes. 2001;25(11):1713–21.
- Marineci CD, Chiriţă C. Agenda medicală. Ediţia de buzunar. Bucureşti: Editura Medicală; 2019.
- Saunders KH, Umashanker D, Igel LI, Kumar RB, Aronne LJ. Obesity Pharmacotherapy. Med Clin North Am. 2018;102(1):135–48. https://doi.org/10.1016/j.mcna.2017.08.010
- Wadden TA, Foreyt JP, Foster GD, Hill JO, Klein S, O’Neil PM, et al. Weight loss with naltrexone SR/bupropion SR combination therapy as an adjunct to behavior modification: The COR-BMOD trial. Obesity. 2011 Jan 17;19(1):110–20.
- Le Roux CW, Astrup A, Fujioka K, Greenway F, Lau DCW, Van Gaal L, et al. 3 years of liraglutide versus placebo for type 2 diabetes risk reduction and weight management in individuals with prediabetes: a randomised, double-blind trial. Lancet. 2017 Apr 8;389(10077):1399–409.
- Pi-Sunyer X, Astrup A, Fujioka K, Greenway F, Halpern A, Krempf M, et al. A Randomized, Controlled Trial of 3.0 mg of Liraglutide in Weight Management. N Engl J Med. 2015 Jul 2;373(1):11–22.
- Davies MJ, Bergenstal R, Bode B, Kushner RF, Lewin A, Skjøth TV, et al. Efficacy of Liraglutide for Weight Loss Among Patients With Type 2 Diabetes. JAMA. 2015 Aug 18;314(7):687.
- Wadden TA, Hollander P, Klein S, Niswender K, Woo V, Hale PM, et al. Weight maintenance and additional weight loss with liraglutide after low-calorie-diet-induced weight loss: The SCALE Maintenance randomized study. Int J Obes. 2013 Nov 1;37(11):1443–51.
- EMA. Saxenda. Rezumatul Caracteristicilor Produsului. Ultima actualizare iulie 2018. 2018.
- EMA/CHMP. Mysimba. Rezumatul caracteristicilor produsului. Ultima actualizare august 2018. 2018
- Greenway FL, Fujioka K, Plodkowski RA, Mudaliar S, Guttadauria M, Erickson J, et al. Effect of naltrexone plus bupropion on weight loss in overweight and obese adults (COR-I): A multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2010 Aug 21;376(9741):595–605.
- Hollander P, Gupta AK, Plodkowski R, Greenway F, Bays H, Burns C, et al. Effects of Naltrexone Sustained-Release/Bupropion Sustained-Release Combination Therapy on Body Weight and Glycemic Parameters in Overweight and Obese Patients With Type 2 Diabetes. Diabetes Care 2013;36:4022-4029. Diabetes Care. 2014 Dec 1;37(2):587–587.
- Fidler MC, Sanchez M, Raether B, Weissman NJ, Smith SR, Shanahan WR, et al. A One-Year Randomized Trial of Lorcaserin for Weight Loss in Obese and Overweight Adults: The BLOSSOM Trial. J Clin Endocrinol Metab. 2011 Oct;96(10):3067–77.
- Smith SR, Weissman NJ, Anderson CM, Sanchez M, Chuang E, Stubbe S, et al. Multicenter, Placebo-Controlled Trial of Lorcaserin for Weight Management. N Engl J Med. 2010 Jul 15;363(3):245–56.
- O’Neil PM, Smith SR, Weissman NJ, Fidler MC, Sanchez M, Zhang J, et al. Randomized Placebo-Controlled Clinical Trial of Lorcaserin for Weight Loss in Type 2 Diabetes Mellitus: The BLOOM-DM Study. Obesity. 2012 Jul 16;20(7):1426–36.
- CHMP. Refusal of the marketing authorisation for Qsiva (phentermine / topiramate) Outcome of re-examination What is Qsiva? What was Qsiva expected to be used for?. 2013 [accesat 2019 Apr 10]. www.ema.europa.eu
- Gadde KM, Allison DB, Ryan DH, Peterson CA, Troupin B, Schwiers ML, et al. Effects of low-dose, controlled-release, phentermine plus topiramate combination on weight and associated comorbidities in overweight and obese adults (CONQUER): a randomised, placebo-controlled, phase 3 trial. Lancet. 2011 Apr 16;377(9774):1341–52.
- Garvey WT, Ryan DH, Look M, Gadde KM, Allison DB, Peterson CA, et al. Two-year sustained weight loss and metabolic benefits with controlled-release phentermine/topiramate in obese and overweight adults (SEQUEL): a randomized, placebo-controlled, phase 3 extension study. Am J Clin Nutr. 2012 Feb 1;95(2):297–308.
- American Psychiatric Association. American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition. Arlington, VA, American Psychiatric Association. Arlington. 2013. 991 p.
- AED: A guide to medical care aed report 2016 | 3rd Edition. Critical Points for Early Recognition and Medical Risk Management in the Care of Individuals with Eating Disorders. 2016; www.aedweb.org/Medical_Care_Standards
- Stoner SC, Ruehter VL. Eating Disorders. In: DiPiro JT, Talbert RL, Yee GC, atzke GR, Wells BG, Posey LM, editors. Pharmacotherapy: A Pathophysiologic Approach. 10th ed. McGraw-Hill Medical; 2017
- National Institute for Health and Care Excellence. Eating disorders: recognition and treatment. Natl Inst Heal Care Excell. 2017.
Articole din ediţiile anterioare
Preparate utilizate pentru tratamentul obezităţii
Excesul de greutate şi obezitatea au devenit bolile civilizaţiei secolului XXI şi constituie o problemă de sănătate publică în rândul populaţiei la...
Amidonul rezistent şi impactul asupra sindromului metabolic
Până la sfârşitul lui 1980 se credea că amidonul este digerat complet şi absorbit în intestinul subţire uman. Amidonul este cel mai răspândit poliz...
Despre tendinţa la obezitate a copiilor
Copilăria este o etapă a vieții căreia trebuie să i se acorde o atenție specială, iar obezitatea infantilă reprezintă o problemă de sănătate cu car...
Obezitatea şi sistemul imunitar
Obezitatea este o problemă de sănătate publică, fiind recunoscută la ora actuală ca boală ce cauzează complicaţii grave precum diabetul zaharat, af...