After graduating from the Pharmacy School, there are several career paths that a young professionals can follow. One of the many opportunities to start the career is working for a pharmaceutical company, in the Department of Pharmacovigilance, that has the main goal the patient‘s safety. There are different types of activities that make up a highly effective pharmacovigilance system which supports the medicine throughout its lifecycle, from the first human studies to the post marketing phase. The aim of this article is to describe a personal experience after nine years of working in the field of pharmacovigilance of several pharmaceutical companies, to raise awareness among healthcare professionals regarding the importance of reporting of the adverse events and to share how pharmaceutical companies use this information to continuously monitor the safety of their medicines.
Farmacovigilenţa – posibil parcurs de carieră pentru farmacişti
Pharmacovigilance – possible career journey for pharmacists
First published: 30 septembrie 2022
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Farm.207.4.2022.7091
Abstract
Rezumat
După absolvirea Facultăţii de Farmacie, există mai multe cariere pe care tinerii profesionişti le pot urma. Una dintre numeroasele şanse de a începe cariera este aceea de a lucra pentru o companie farmaceutică, în Departamentul de farmacovigilenţă. Acest departament are ca obiectiv principal siguranţa pacientului. Există diferite tipuri de activităţi care alcătuiesc un sistem de farmacovigilenţă eficient, care susţine siguranţa medicamentului pe tot parcursul ciclului său de viaţă, de la primele studii pe oameni până la faza postmarketing. Obiectivele acestui articol sunt acelea de a descrie o perspectivă personală după nouă ani de experienţă în domeniul farmacovigilenţei, în mai multe companii farmaceutice, de a informa profesioniştii din domeniul sănătăţii cu privire la importanţa raportării evenimentelor adverse şi de a împărtăşi modul în care companiile farmaceutice utilizează aceste informaţii pentru a monitoriza continuu profilul de siguranţă al medicamentelor lor.
Numele meu este Lavinia Radulian şi aş vrea să vă împărtăşesc parcursul carierei mele. Am absolvit Facultatea de Farmacie de la Universitatea de Medicină şi Farmacie „Carol Davila”, din Bucureşti, în 2012. Fiind dornică să îmi încep cariera în acest domeniu, am ales să lucrez în farmacia comunitară, aceasta fiind şi prima alegere firească odată cu absolvirea facultăţii. În această perioadă mi-a plăcut foarte mult lucrul în receptură, dar în egală măsură şi interacţiunea cu pacienţii. În timpul meu liber obişnuiam să citesc reviste de specialitate şi mi-am dat seama că sunt o persoană orientată mai mult spre ştiinţă şi că aş vrea să fac un pas mai departe în acest domeniu. Prin urmare, m-am gândit să caut un loc de muncă în industria farmaceutică, fără să ştiu cu certitudine care sunt responsabilităţile diferitelor departamente dintr-o companie farmaceutică. Prin urmare, am decis să candidez la toate ofertele de locuri de muncă ce nu aveau legătură cu farmacia comunitară, neştiind însă ce departament ar fi cel mai potrivit pentru mine.
În acest fel a început cariera mea în domeniul farmacovigilenţei (PV) acum mai bine de nouă ani. Am candidat la un afnunţ online pentru un rol de Drug Safety Officer într-o companie farmaceutică. Nu ştiam exact ce înseamnă farmacovigilenţa şi, pentru că voiam să mă pregătesc pentru primul meu interviu, am citit definiţiile din manualul de Farmacologie pe care îl aveam din facultate. Apoi am început să caut cărţi pe Amazon, pentru Kindle-ul meu. O carte precum Pharmacovigilance, a practical approach(1) ar fi fost foarte folositoare pentru mine în acel moment. Primele mele interviuri au mers bine, chiar dacă am simţit că au fost unele dintre cele mai grele interviuri din cariera mea. Acestea au acoperit o gamă largă de subiecte, inclusiv discutarea interacţiunilor medicamentoase, întrebări legate de patologie, precum şi abilitatea de traducere în/din limba engleză. Am primit postul şi îmi amintesc că am fost foarte fericită.
Am început să lucrez în farmacovigilenţă la mijlocul verii, în grupul de procesare din acest departament. Pe măsură ce am primit traininguri de specialitate, am aflat că farmacovigilenţa este ştiinţa care cuprinde activităţile legate de detectarea, evaluarea, înţelegerea şi prevenirea efectelor adverse sau a oricărei alte probleme legate de siguranţa medicamentelor(2). De asemenea, am înţeles de ce incidentul cu talidomidă (1961) a fost atât de important şi de ce am învăţat atât de des în timpul facultăţii despre el. Acesta a fost momentul de început în evoluţia farmacovigilenţei, momentul în care autorităţile de reglementare a medicamentului şi companiile farmaceutice au înţeles că siguranţa medicamentelor este importantă şi trebuie monitorizată îndeaproape pentru toate produsele farmaceutice. Şase ani mai târziu, în 1967, Organizaţia Mondială a Sănătăţii (OMS) a primit mandatul de a începe un proiect de cercetare privind monitorizarea internaţională a rapoartelor privind reacţiile adverse ale medicamentelor, acest proces continuând până în prezent. Începând cu 2010, Agenţia Europeană a Medicamentelor (EMA) a elaborat un Ghid pentru bunele practici în farmacovigilenţă (GVP)(3). GVP-urile au fost implementate începând cu anul 2012 şi acestea au reprezentat o transformare majoră a reglementărilor de farmacovigilenţă în UE. Astăzi, GVP-urile conţin 16 module, numerotate de la I la XVI, fiecare modul concentrându-se pe un aspect specific al sistemului de farmacovigilenţă.
Obiectivele de bază ale legislaţiei UE aplicabile în materie de farmacovigilenţă sunt:
-
prevenirea efectelor nocive cauzate de reacţiile adverse care decurg din utilizarea medicamentelor autorizate în/în afara termenilor autorizaţiei de punere pe piaţă sau ca urmare a expunerii profesionale a oamenilor;
-
promovarea utilizării sigure şi eficiente a medicamentelor, în special prin furnizarea în timp util către pacienţi, profesionişti din domeniul sănătăţii şi public a informaţiilor cu privire la siguranţa medicamentelor.
Farmacovigilenţa este, aşadar, o activitate care contribuie la protecţia sănătăţii pacienţilor şi a sănătăţii publice(4). Farmacovigilenţa este prezentă pe tot parcursul ciclului de viaţă al produsului, de la primele studii efectuate la oameni şi până la administrarea ultimei cutii de produs de pe piaţă.


Prin urmare, primul lucru pe care îl înveţi într-o companie farmaceutică îl reprezintă informaţiile minime necesare în scopul raportării şi unde poţi raporta evenimentele adverse.
Un eveniment advers (AE) este orice eveniment medical nefavorabil asociat cu utilizarea unui medicament la om, indiferent dacă există sau nu o relaţie de cauzalitate. O reacţie adversă a unui medicament (ADR) este un eveniment advers pentru care s-a stabilit o relaţie de cauzalitate. În scopul raportării, pentru toate AE primite din surse spontane se consideră existenţa unei relaţii de cauzalitate. Informaţiile referitoare la AE sunt adunate sub forma unui raport individual de siguranţă (Individual Case Safety Report – ICSR). Deţinătorii autorizaţiei de punere pe piaţă (DAPP) sunt întotdeauna încurajaţi să raporteze orice eveniment advers, indiferent de calitatea informaţiei pe care o au în acel moment. Se recomandă profesioniştilor din domeniul sănătăţii să încerce să adune cel puţin cele patru cerinţe minime pentru un ICSR valid:
1. Existenţa unui raportor – persoana care raportează nu trebuie neapărat să fie pacientul.
2. Existenţa unui pacient identificabil (să se cunoască sexul sau vârsta/grupa de vârstă).
3. Să existe administrarea unui medicament (să existe date clare în ceea ce priveşte medicamentul administrat, nu este necesară denumirea comercială, dar este necesară cel puţin substanţa activă; clasa de medicamente nu este considerată suficientă).
4. Detalii clare despre eveniment – o descriere a evenimentului. Rapoartele conform cărora pacientul a avut „efecte secundare” nu sunt considerate valide.
Desigur, cu cât există mai multe detalii, cu atât mai bine. Alte informaţii utile includ istoricul medical al pacientului sau istoricul familial (dacă este relevant), medicaţia concomitentă şi orice detalii privind administrarea medicamentului (cum ar fi doza, data la care a început tratamentul etc.). Detaliile referitoare la momentul evenimentului (evenimentelor), tratamentul primit şi deznodământul evenimentelor sunt, de asemenea, importante. Totuşi, nu este nevoie să povesteşti întreaga viaţă a pacientului dacă acest lucru nu este de interes. Chiar dacă reacţia adversă apărută după administrarea medicamentului este descrisă în prospect, este necesar să o raportaţi. În acest fel, profilul de siguranţă al produsului poate fi monitorizat nu numai pentru noile evenimente adverse, ci şi pentru modificarea frecvenţei reacţiei adverse în cazul medicamentelor pentru care este deja inclusă în prospect.
Puteţi raporta toate aceste informaţii către producător, mai ales dacă marca este cunoscută. De asemenea, Agenţia Naţională a Medicamentului şi a Dispozitivelor Medicale (ANMDM) are o pagină web cu instrucţiuni privind modul de raportare a unei reacţii adverse la medicament prin poştă sau online (https://www.anm.ro/medicamente-de-uz-uman/farmacovigilenta/%20raporteaza-o-reactie-adversa/).
Producătorii colectează toate aceste informaţii în baza lor de date de siguranţă, care conţine rapoarte primite din diverse surse, cum ar fi articole din literatură, rapoarte spontane (raportate de la consumatori sau profesionişti din domeniul sănătăţii), rapoarte primite de la autorităţile de reglementare a medicamentului, mai multe tipuri de studii postmarketing şi cazurile grave din studiile clinice. Pentru armonizare în industrie, sunt folosite dicţionarele pentru a colecta toate aceste informaţii. Pentru evenimentele adverse se foloseşte dicţionarul MedDRA (https://www.meddra.org/ ), iar pentru medicamente, Dicţionarul OMS de medicamente. De asemenea, evenimentele adverse sunt evaluate în privinţa gravităţii. Chiar dacă gravitatea poate fi diferită în funcţie de situaţie şi este influenţată de judecata medicală, există şase criterii de gravitate utilizate la nivel mondial:
1. Eveniment advers care se soldează cu deces.
2. Eveniment advers care pune viaţa în pericol.
3. Eveniment advers care necesită spitalizare imediată sau prelungirea spitalizării existente.
4. Eveniment advers care duce la dizabilitate persistentă sau semnificativă.
5. Eveniment advers care este o anomalie congenitală sau un defect congenital.
6. Evenimente medicale importante care pot să nu pună imediat viaţa în pericol sau să ducă la deces ori spitalizare, dar pot pune în pericol pacientul sau pot necesita intervenţie (medicală ori chirurgicală) pentru a preveni unul dintre celelalte rezultate enumerate în definiţia de mai sus.
Deşi nu toate evenimentele sunt evaluate ca fiind grave, este important să raportaţi şi evenimentele care nu sunt grave. Un exemplu este fotosensibilitatea cauzată de aplicarea locală a ketoprofenului. Fotosensibilitatea include atât reacţiile fototoxice, cât şi pe cele fotoalergice(5). Aceste reacţii cutanate pot include evenimente uşoare, cum ar fi dermatită, erupţii cutanate, urticarie şi vezicule pe piele. În 2009, Autoritatea de Reglementare a Medicamentului din Franţa a decis să suspende utilizarea topică a ketoprofenului din cauza fotosensibilizării. O analiză amplă a evenimentelor adverse cutanate şi a evenimentelor adverse de fotosensibilizare a fost efectuată de DAPP şi de profesioniştii din EMA(6). Analiza a concluzionat că numărul de raportări de reacţii adverse cutanate, inclusiv fotoalergie, este scăzut în întreaga UE şi că riscul acestor reacţii adverse ar putea fi redus cu ajutorul măsurilor adecvate de minimizare a riscului, cum ar fi: limitarea accesului la medicament prin eliberarea pe bază de prescripţie medicală, avertismente consolidate privind expunerea la soare incluse în prospect, precum şi sfaturi despre încetarea utilizării topice a ketoprofenului în cazul în care apar reacţii cutanate, inclusiv când se utilizează ketoprofen împreună cu octocrilenă, dar şi comunicarea suplimentară a acestui risc către profesioniştii din domeniul sănătăţii şi către pacienţii.
Există un schimb constant de ICSR între producători şi EMA. Producătorii trebuie să raporteze toate ICSR grave în termen de 15 zile de la data iniţială de primire, iar rapoartele negrave, în termen de 90 de zile. Când informaţiile raportate iniţial sunt limitate sau există informaţii inconsecvente, DAPP încearcă să contacteze raportorul sau medicul curant pentru a colecta mai multe detalii cu privire la evenimentele care au avut loc. Îmi amintesc prima dată când am trimis o solicitare de informaţii suplimentare către Autoritatea de Reglementare a Medicamentului şi a Produselor de Sănătate (MHRA) din Marea Britanie. Eram atât de anxioasă în legătură cu asta. A fost e-mailul meu destul de politicos? Am fost suficient de clară? Îmi aduc aminte de emoţiile de atunci chiar şi astăzi. Dar, odată cu trecerea timpului, acest lucru a devenit rutină.
Una dintre perioadele mele cele mai dragi din călătoria mea în domeniul farmacovigilenţei a fost cea în care eram responsabilă cu procesarea cazurilor din literatura medicală. Simt că această perioadă mi-a modelat cariera viitoare. Lucram pentru o companie farmaceutică care era DAPP pentru mai mult de 100 de substanţe active în întreaga lume, iar echipa mea era responsabilă cu monitorizarea literaturii de specialitate la nivel mondial, pentru informaţii despre siguranţa medicamentelor, dar în principal pentru ICSR. Activitatea mea zilnică a fost să citesc mai multe articole ştiinţifice din care să extrag informaţiile şi să le introduc în baza de date de siguranţă a producătorului. Am avut şansa să citesc mii de articole din diverse arii terapeutice. Ca tânăr profesionist, m-a ajutat foarte mult în viitoarea mea carieră faptul că am putut acumula informaţii variate despre mecanismele de acţiune a medicamentelor, însă şi despre patologia bolilor şi despre reacţii adverse rare dar grave, precum sindromul Steven‑Johnson sau necroliza epidermică toxică. O întâmplare interesantă a fost momentul în care am putut să îmi diagnostichez soţul cu eritem multiform doar pe baza cunoştinţelor mele din articolele de literatură pe care le-am citit de-a lungul anilor.
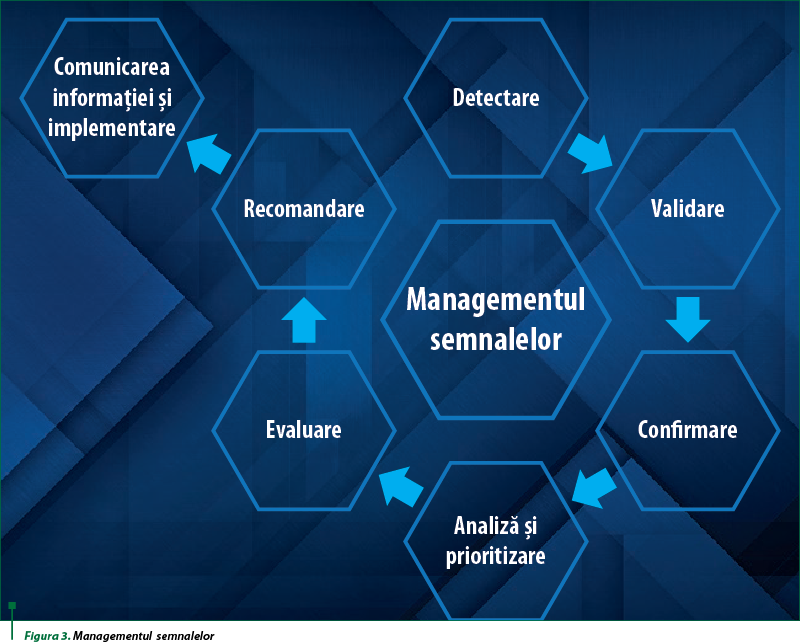
O altă parte a farmacovigilenţei implică procesul de detectare a semnalului. În cursul acestui proces sunt utilizate mai multe surse, inclusiv baza de date privind siguranţa a DAPP(1). Detectarea semnalului descrie o serie de abordări analitice menite să identifice schimbări în tiparul datelor primite.
Un semnal, aşa cum este definit de Consiliul Internaţional pentru Armonizare (ICH), este informaţia care provine din una sau mai multe surse, inclusiv din observaţii şi experimente, care sugerează o nouă relaţie potenţială de cauzalitate sau informaţii noi despre o relaţie de cauzalitate deja cunoscută între o acţiune şi un eveniment sau un set de evenimente conexe, fie ele negative sau benefice; relaţie de cauzalitate care este evaluată a fi de o eventualitate suficientă pentru a justifica o acţiune de verificare(1). Un semnal nu indică o relaţie cauzală directă între un eveniment medical şi un medicament, ci este în esenţă doar o ipoteză care, împreună cu date şi argumente, justifică necesitatea unei evaluări suplimentare.
Când lucraţi în acest domeniu al farmacovigilenţei, analizaţi o mulţime de date. Începeţi de la revizuirea periodică a cazurilor din baza de date a DAPP, în care verificaţi că documentaţia disponibilă conţine suficiente dovezi care demonstrează existenţa unei noi asocieri potenţiale de cauzalitate sau a unui nou aspect al unei asocieri cunoscute şi, prin urmare, o analiză ulterioară a semnalului ar fi necesară. În această etapă a analizei se iau în considerare diverse informaţii, precum mecanismul de acţiune cunoscut al medicamentului, patologia bolii de bază a pacientului şi medicamentele concomitente sau cosuspecte administrate. Este un proces complex de la detectarea semnalului până la introducerea evenimentului în prospectul produsului. Întregul proces implică evaluarea mai multor surse de informaţii, cum ar fi datele din studiile clinice, nonclinice şi toxicologice, împreună cu literatura de specialitate publicată. În acest proces, evaluarea cauzalităţii joacă un rol important. Evaluarea cauzalităţii reacţiilor adverse este o metodă utilizată pentru estimarea puterii relaţiei dintre expunerea la medicament(e) şi apariţia reacţiilor adverse(7). Cred că toţi profesioniştii din domeniul sănătăţii au înţeles cât de importante sunt determinarea cauzalităţii, precum şi diferenţierea dintre aceasta şi asocierea temporală, în timpul pandemiei de COVID-19 şi a campaniei de vaccinare ulterioare. Nu toate evenimentele apărute în cazul unui pacient după administrarea medicamentului sunt datorate celui din urmă. Cu toate că o relaţie temporală puternică este un factor important pentru evaluarea cauzalităţii, acesta nu este singurul factor şi nici nu este suficient să avem informaţii numai despre acesta pentru a stabili relaţia de cauzalitate. Alte elemente-cheie în determinarea cauzalităţii pot fi: un mecanism de acţiune plauzibil, un efect doză‑dependent, rezolvarea evenimentului odată cu stoparea administrării medicamentului. Recent, când le-am explicat procesul unor colegi noi, ei mi-au spus că simt că munca noastră este similară cu cea din seria TV Dr. House şi, personal, aş tinde să le dau dreptate. Găsesc acest proces foarte interesant şi care implică multă cercetare ştiinţifică. Ceea ce îmi place cel mai mult din întregul proces de detectare a semnalului este echipa multidisciplinară care lucrează împreună. În timpul evaluării semnalului se discută cu diverse echipe, precum cea de toxicologie şi cea de epidemiologie, şi poţi afla mai multe informaţii noi despre farmacodinamica produsului. Îmi amintesc că, în urmă cu câţiva ani, a fost detectat un semnal dintr-un articol de literatură care descrie o interacţiune medicamentoasă. A fost foarte interesant, deoarece trebuia să avem o discuţie extinsă în echipă pentru a încerca să identificăm dacă există un mecanism de acţiune plauzibil. În cele din urmă, am ajuns la concluzia că evenimentul advers se datora patologiei pacientului, care avea o boală rară, şi nu era un eveniment advers apărut ca urmare a unei interacţiuni între două medicamente.
După confirmarea unui semnal, acesta este inclus în prospect. De asemenea, în funcţie de gravitatea evenimentului, pot fi necesare măsuri suplimentare de minimizare a riscului sau comunicări care au ca scop siguranţa pacientului. Aceste comunicări se fac către autorităţile de reglementare a medicamentului, cât şi către profesionişti din domeniul sănătăţii şi către pacienţi. Aceştia sunt paşi foarte importanţi în menţinerea siguranţei pacientului. Limitările de utilizare, monitorizarea atentă a pacienţilor sau detalii suplimentare privind procedura de administrare sunt exemple de măsuri suplimentare de minimizare a riscului.
Pentru monitorizarea profilului de siguranţă al produsului se realizează evaluarea periodică a raportului risc-beneficiu. Evaluarea trebuie transmisă agenţiilor de reglementare a medicamentului, inclusiv EMA, pentru revizuire ulterioară. Frecvenţa acestor evaluări se face în funcţie de ciclul de viaţă al produsului şi poate varia de la şase luni pentru produsele nou aprobate pe piaţă până la 28 de ani pentru produsele vechi şi cu un profil de siguranţă stabilit.
Sper că v-a plăcut experienţa mea şi acum aveţi o imagine mai clară despre ce este farmacovigilenţa şi cât de importantă este aceasta pentru siguranţa pacienţilor. Dacă aţi găsit domeniul farmacovigilenţei interesant şi doriţi să aflaţi mai multe despre el, urmăriţi cursurile şi oportunităţile disponibile din domeniul farmacovigilenţei.
Bibliografie
-
Doan T, Renz C, Lievano F, Bhattacharya M, Scarazzini L. Pharmacovigilance, a practical approach. Elsevier, 2019.
-
https://www.ema.europa.eu/en/human-regulatory/overview/pharmacovigilance-overview. [Online]
-
https://www.ema.europa.eu/en/human-regulatory/post-authorisation/pharmacovigilance/good-pharmacovigilance-practices. [Online]
-
https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-good-pharmacovigilance-practices-module-i-pharmacovigilance-systems-their-quality-systems_en.pdf. [Online]
-
Bagheri H, Lhiaubet V, Montastruc JL, Chouini-Lalanne N. Photosensitivity to ketoprofen: mechanisms and pharmacoepidemiological data. Drug Saf. 2000;22(5):339-349.
-
https://www.ema.europa.eu/en/documents/referral/questions-answers-review-marketing-authorisations-topical-formulations-ketoprofen_en.pdf.
-
Smyth RL, Peak M, Turner MA, et al. ADRIC: Adverse Drug Reactions In Children – a programme of research using mixed methods. Southampton (UK): NIHR Journals Library; June 2014
Articole din ediţiile anterioare
Armonizarea legislaţiei naţionale privind produsele cosmetice în contextul uniformizării dreptului european în materie
Prima reglementare europeană a produselor cosmetice a fost realizată prin Directiva 76/768/CEE a Consiliului din 27 iulie 1976 privind apropierea l...
Substanţe medicamentoase restricţionate la conducătorii auto
Există o preocupare tot mai mare în întreaga lume cu privire la consumul de medicamente şi siguranţa rutieră. Rezultatele studiilor epidemiologice ...
Profilaxia complicaţiilor postantibioterapie. Noi perspective
Dezvoltarea competenţelor antreprenoriale ale cercetătorilor din sănătate poate contribui atât la creşterea randamentului inovării şi implicit la î...
Dieta mediteraneeană – de la plan alimentar şi stil de viaţă la includerea în ghidurile terapeutice
În ultimii ani, tendinţa generală este de a se acorda o atenţie tot mai mare nutriţiei şi stării de sănătate, evaluate pe tot parcursul ciclului vi...