ALECENSA
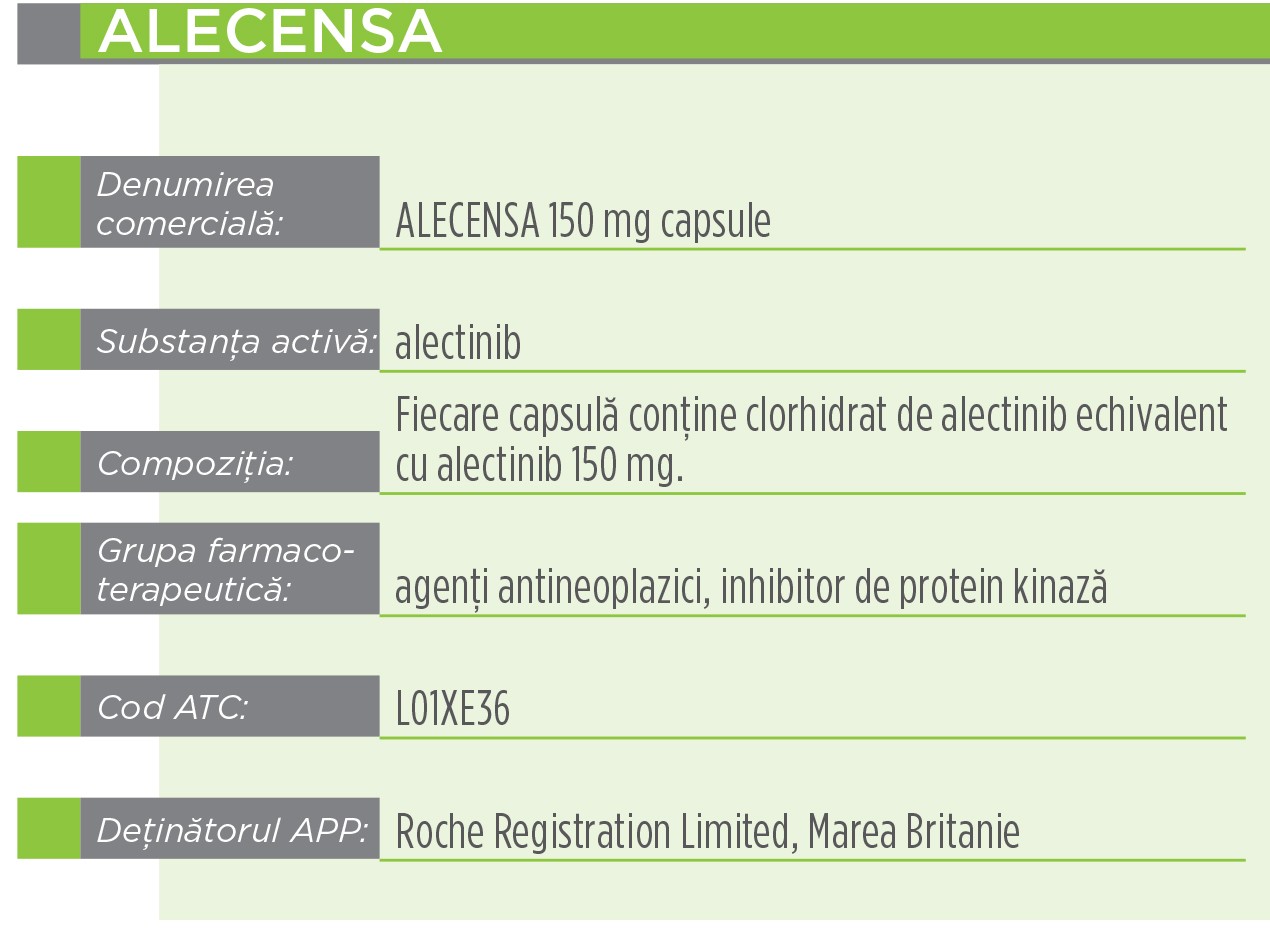
Indicaţii terapeuticeAlecensa este indicat ca monoterapie pentru tratamentul pacienților adulți cu neoplasm pulmonar fără celule mici (NSCLC) avansat, cu status pozitiv pentru kinaza din limfomul anaplazic (ALK), tratați anterior cu crizotinib.
Mecanism de acțiune
Alectinib este un inhibitor puternic și cu selectivitate înaltă al tirozin kinazelor ALK și RET. În studiile preclinice, inhibarea activității tirozin kinazei ALK a dus la blocarea căilor de semnalizare intracelulară, inclusiv STAT 3 și PI3K/AKT și la inducerea morții celulelor tumorale (apoptoză).
Produsul conține o entitate moleculară nouă și a fost autorizat prin procedura centralizată de către EMA (Agenția Europeană a Medicamentului). CHMP (Comitetul pentru medicamente de uz uman), pe baza evaluării calității, siguranței și eficacității din datele prezentate, consideră că produsul Alecensa prezintă un raport beneficiu-risc pozitiv și de aceea recomandă eliberarea autorizației de punere pe piață condiționată. Ca urmare a deciziei Comisiei Europene, autorizația de punere pe piață este validă pe întreg teritoriul Uniunii Europene.
Acest medicament face obiectul unei monitorizări suplimentare. Acest lucru va permite identificarea rapidă de noi informații referitoare la siguranță. Profesioniștii din domeniul sănătății sunt rugați să raporteze orice reacții adverse suspectate.
OLUMIANT
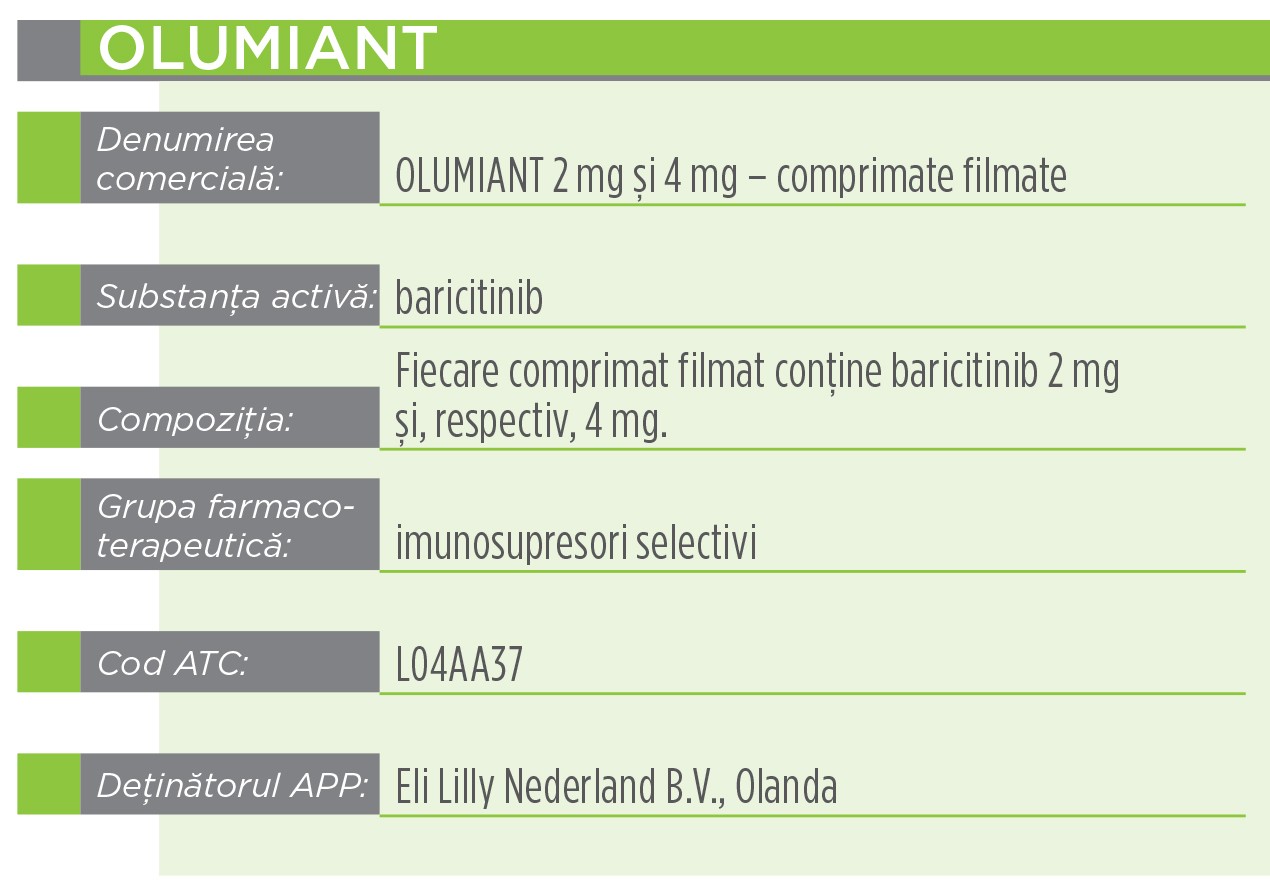
Indicaţii terapeuticeOlumiant este indicat în tratamentul poliartritei reumatoide active, moderată până la severă, la pacienți adulți care nu au răspuns adecvat sau care au intoleranță la unul ori mai multe medicamente antireumatice modificatoare de boală. Olumiant poate fi administrat ca monoterapie sau în asociere cu metotrexat.
Mecanism de acțiune
Baricitinib este un inhibitor selectiv și reversibil al kinazei Janus (JAK)1 și JAK2. În probele de enzime izolate, baricitinib a inhibat activitățile JAK1, JAK2, tirozin-kinazei 2 și JAK3 cu valori IC50 de 5,9, 5,7, 53 și > 400 nM, respectiv.
Kinazele Janus (JAK) sunt enzime care transformă semnalele intracelulare din receptori celulari de suprafață pentru mai multe citokine și factori de creștere implicați în hematopoieză, inflamație și funcția imună.
În calea semnalelor intracelulare, protein kinazele Janus fosforilează și activează transductorii de semnal și activatorii transcrierii (STAT), care activează expresia genelor din celulă. Baricitinib modulează aceste căi de semnalizare prin inhibarea parțială a activității enzimatice JAK1 și JAK2, reducând astfel fosforilarea și activarea proteinelor STAT.
Produsul este o entitate moleculară nouă și a fost autorizat prin procedura centralizată de către EMA (Agenția Europeană a Medicamentului). CHMP (Comitetul pentru medicamente de uz uman), pe baza evaluării calității, siguranței și eficacității din datele prezentate, consideră că produsul Olumiant prezintă un raport beneficiu-risc pozitiv și de aceea recomandă eliberarea autorizației de punere pe piață. Ca urmare a deciziei Comisiei Europene, autorizația de punere pe piață este validă pe întreg teritoriul Uniunii Europene. Acest medicament face obiectul unei monitorizări suplimentare. Acest lucru va permite identificarea rapidă de noi informații referitoare la siguranță. Profesioniștii din domeniul sănătății sunt rugați să raporteze orice reacții adverse suspectate.
TRUXIMA
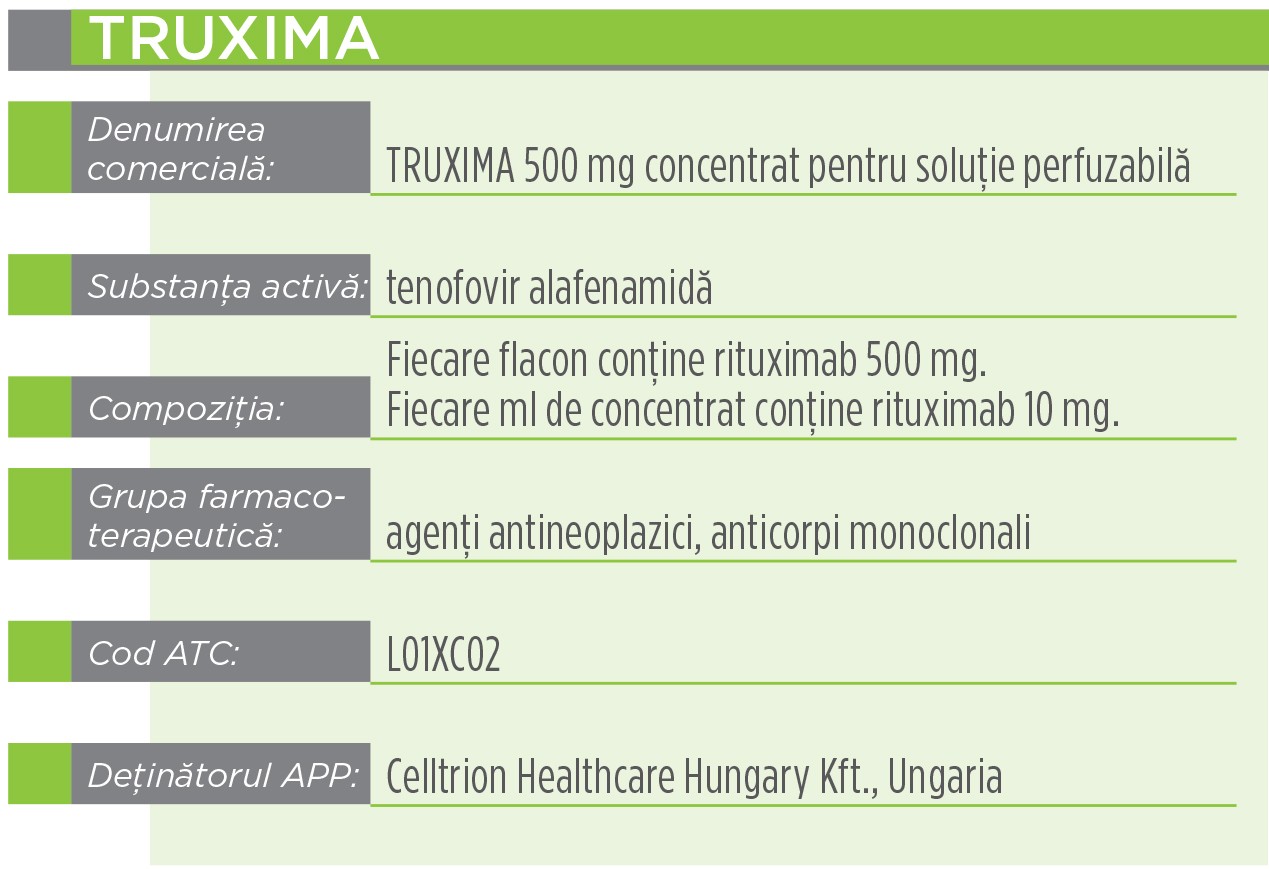
Indicaţii terapeuticeTruxima este utilizat la adulți pentru următoarele indicații:
- Limfom non-Hodgkin (LNH)
Terapia de întreținere cu Truxima este indicată pentru tratamentul pacienților cu limfom folicular care au răspuns la terapia de inducție.
Monoterapia cu Truxima este indicată pentru tratamentul pacienților cu limfom folicular stadiile III-IV chimiorezistent ori care a recidivat de două sau mai multe ori după chimioterapie.
Truxima este indicat pentru tratamentul pacienților cu limfom non-Hodgkin difuz cu celulă mare B, cu marker CD20 pozitiv, în asociere cu chimioterapie CHOP (ciclofosfamidă, doxorubicină, vincristină, prednisolon).
- Leucemie limfocitară cronică (LLC)
- Poliartrită reumatoidă
S-a demonstrat că Truxima reduce rata de progresie a afectării articulare, determinată prin metode radiologice, și îmbunătățește funcția fizică, atunci când se administrează în asociere cu metotrexat.
Granulomatoză cu poliangeită și poliangeită microscopică
Truxima, administrat în asociere cu glucocorticoizi, este indicat pentru inducerea remisiunii la pacienții adulți cu granulomatoză cu poliangeită (Wegener) (GPA) activă, severă și poliangeită microscopică (MPA).
Mecanism de acțiune
Rituximab se leagă specific de antigenul transmembranar CD20, care este o fosfoproteină neglicozilată, situată pe limfocitele pre-B și B mature. Antigenul este prezent la > 95% din numărul total al limfoamelor non-Hodgkin cu celule B. CD20 se găsește atât pe celulele B normale, cât și pe cele maligne, dar nu pe celulele stem hematopoietice, pe celulele pro-B, pe celulele plasmatice normale sau pe alt tip de țesut normal. Acest antigen nu pătrunde în interior după legarea anticorpilor și nu se desprinde de pe suprafața celulară. CD20 nu circulă în plasmă ca un antigen liber și de aceea nu intră în competiție pentru legarea anticorpilor.
Fragmentul Fab al rituximab se leagă de antigenul CD20 de pe limfocitele B și devine capabil să medieze distrugerea celulelor B pe calea domeniului Fc. Printre mecanismele posibile ale distrugerii celulare se numără citotoxicitatea dependentă de complement (CDC), care rezultă din legarea C1q, și citotoxicitatea celulară dependentă de anticorpi (ADCC), mediată prin unul sau mai mulți receptori Fcγ pe suprafața granulocitelor, macrofagelor și celulelor NK. De asemenea, s-a demonstrat că legarea rituximab la antigenul CD20 de pe suprafața limfocitelor B induce moartea celulară prin apoptoză.
Produsul este un biosimilar și a fost autorizat prin procedura centralizată de către EMA (Agenția Europeană a Medicamentului). Produsul original este Mabthera, al companiei Roche Registration Limited, și a fost autorizat prin procedură centralizată în 1998. CHMP (Comitetul pentru medicamente de uz uman), pe baza evaluării calității, siguranței și eficacității din datele prezentate, consideră că produsul Truxima prezintă un raport beneficiu-risc pozitiv și de aceea recomandă eliberarea autorizației de punere pe piață. Acest medicament face obiectul unei monitorizări suplimentare. Acest lucru va permite identificarea rapidă de noi informații referitoare la siguranță. Profesioniștii din domeniul sănătății sunt rugați să raporteze orice reacții adverse suspectate.