Selectarea şi utilizarea raţională a preparatelor enzimatice pancreatice
Selection and rational use of pancreatic enzyme drugs
Abstract
Exocrine insufficiency of the pancreas, caused by a wide range of diseases and pathological conditions of the pancreas, stomach, intestines, liver and biliary system, as well as some functional conditions, is reduced to disorders of digestion, absorption and nutrition and requires careful evaluation for developing appropriate treatment strategies. Fluctuations in the arsenal of pancreatic enzyme replacement drugs on the market are due to insufficient and inadequate response determined by the composition, dosage form, activity of enzymes and dosing regimens. Experimental and clinical studies are devoted to: obtain enzymatic drugs of vegetal, bacterial, fungal and synthetic origin; new drug forms (minimicrospheres, nanofibers); review of indications for administration; systematization and optimization of the administration way and dosing regimen; specify the particularities of management of patients with exocrine insufficiency of different etiologies. Particular attention should be paid to improving the knowledge of practicing physicians in the field of enzyme replacement therapy and educating patients with exocrine insufficiency of the pancreas. The complex approach to the problems of pancreatic pathology will allow the accomplishement of a rational and personalized therapy.Keywords
exocrine pancreatic insufficiencyenzyme replacement drugsenzyme replacement therapyRezumat
Insuficienţa exocrină a pancreasului, cauzată de o gamă variată de maladii şi stări patologice ale pancreasului, stomacului, intestinului, ficatului şi sistemului biliar, precum şi de unele stări funcţionale, se reduce la dereglarea proceselor de digestie, absorbţie şi nutriţie şi necesită o evaluare minuţioasă pentru elaborarea strategiilor adecvate de tratament. Fluctuaţiile arsenalului de preparate enzimatice de substituţie ale pancreasului pe piaţă se datorează răspunsului insuficient şi neadecvat determinat de componenţa, forma medicamentoasă, activitatea enzimelor şi regimurilor de dozare. Studiile experimentale şi clinice sunt consacrate: obţinerii preparatelor enzimatice de origine vegetală, bacteriană, fungică şi sintetică; formelor medicamentoase noi (minimicrosfere, nanofibre); revederii indicaţiilor pentru administrare; sistematizării şi optimizării modalităţii de administrare şi regimului de dozare; specificării particularităţilor de conduită la pacienţii cu insuficienţă exocrină de diferite cauze. O atenţie deosebită este necesar de atribuit perfectării cunoştinţelor medicilor practicieni în domeniul terapiei enzimatice de substituţie şi educării pacienţilor cu insuficienţă exocrină a pancreasului. Abordarea complexă a problemelor patologiei pancreatice va permite realizarea unei terapii raţionale şi personalizate.Cuvinte Cheie
insuficienţă exocrină a pancreasuluipreparate enzimatice de substituţieterapie enzimatică de substituţieIntroducere
Pancreatita cronică (PC) este o afecţiune fibroinflamatorie cronică, progresivă şi ireversibilă, cu lezarea celulelor acinare, ductale şi insulare, care provoacă tulburări şi dizabilităţi într-o proporţie semnificativă la persoanele afectate. Prevalenţa pancreatitei cronice la populaţia generală în contextul bolilor cronice este rar estimată în studiile epidemiologice. Pancreatita cronică are o incidenţă anuală de 4–12 la 100 000 de persoane, în creştere la nivel mondial. Prevalenţa PC a fost estimată la circa 50 la 100 000 de persoane, dar aceasta este o subestimare semnificativă, având în vedere incidenţa şi supravieţuirea medie, ceea ce sugerează că real ar constitui 100–200 la 100 000 de persoane. Într-o evaluare bazată pe interogarea populaţiei dintr-un stat din SUA, s-a raportat că prevalenţa pancreatitei cronice a fost de 42 la 100 000 de persoane. Prevalenţa a fost cea mai mare în grupa de vârstă 45-74 de ani, iar la bărbaţi, comparativ cu femeile, a fost de 52 faţă de 34 la 100 000 de persoane. Conform unui sondaj realizat la nivel naţional în Japonia, prevalenţa a fost similară – de 52 la 100 000 de persoane. Printre factorii etiologici se pot menţiona toxinele de mediu (expunerea prelungită la alcool şi fumat), hiperlipidemie, mutaţii genetice unice şi/sau multiple şi boli autoimune. Pancreatita cronică este o maladie progresivă, cu variaţii marcante ale durerilor abdominale şi simptome gastrointestinale, care afectează foarte mult calitatea vieţii şi cauzează dezvoltarea insuficienţei exocrine a pancreasului şi diabetului zaharat cu reducerea semnificativă a supravieţuirii în 15-20 de ani de la diagnostic. Analiza şi sistematizarea datelor referitoare la managementul insuficienţei exocrine a pancreasului a fost concluzionată în ghidul Uniunii Europene de Gastroenterologie şi al Colegiului American de Gastroenterologie(2,4,10,13,17,18,20,24,25).
Materiale şi metodă
Prin selectarea şi analiza datelor publicate în baza de date PubMed (serviciul Bibliotecii Naţionale de Medicină a Institutului Naţional de Sănătate al Statelor Unite – US National Library of Medicine, National Institut of Health), Cochrane databases, Google Scholar Academic şi în alte surse online prin intermediul cuvintelor-cheie „pancreatic exocrine insufficiency”, „pancreatic enzyme replacement therapy”, „pancreatin”, „chronic pancreatitis”, „treatment of chystic fibrosis”, „malabsorption”, „maldigestion”, „microbial lipases”, „pancreatic lipase”, „chronic pancreatitis treatment guidelines”, „pancreatic cancer” etc., s-au selectat sursele bibliografice din anii 2011-2022, dintre care s-au folosit circa 30 de lucrări care au corespuns obiectivelor. În baza articolelor de metaanaliză, a review-urilor, a ghidurilor şi a publicaţiilor experimentale şi clinice selectate s-au efectuat: o caracterizare a preparatelor enzimatice pancreatice de substituţie după origine, componenţă şi formele medicamentoase; o elucidare a particularităţilor mecanismelor de acţiune; o specificare a indicaţiilor şi particularităţilor pentru administrare; o recapitulare a dozelor şi principiilor de dozare; o identificare a cauzelor efectului suboptim al tratamentului. Rezultatele analizei au permis tragerea câtorva concluzii practice şi au servit drept suport pentru optimizarea terapiei enzimatice de substituţie.
O gamă variată de maladii şi stări patologice ale tubului digestiv (boli organice şi funcţionale ale sistemului biliar, gastrită, duodenită, ulcer peptic, pancreatită, hepatită şi ciroză hepatică, tulburări ale florei intestinale, sindrom ischemic abdominal) pot fi cauza dereglărilor funcţionale şi/sau organice ale tractului gastrointestinal, cu dereglarea secreţiei, absorbţiei şi motilităţii şi, respectiv, a procesului interconectat şi complex de digestie a alimentelor. Principalele sindroame ale tulburărilor digestive includ: maldigestia, malabsorbţia şi malnutriţia. Maldigestia reprezintă o dereglare a digestiei cavitare care poate fi determinată de: insuficienţa exocrină a pancreasului în pancreatita cronică, pancreatectomia subtotală, cancer şi fistule pancreatice, fibroza chistică; inactivarea enzimelor digestive şi scăderea activităţii enterokinazei în intestin în gastroduodenită, ulcerul duodenal, disbioza intestinului subţire, sindromul Zollinger-Ellison; tulburările tranzitului conţinutului intestinal şi amestecarea enzimelor cu chimul alimentar în sindromul colonului iritabil, stările după vagotomie, stază gastrică şi duodenală, pseudoobstrucţie intestinală; diminuarea activităţii enzimelor (ca urmare a „diluţiei”) în sindromul după rezecţia gastrică şi colecistectomie, disbioza intestinului subţire; dereglările secreţiei de colecistokinină, pancreozimină, secretină; deficitul de acizi biliari în intestinul subţire în obstrucţia biliară, hepatită, ciroza biliară primară, patologia părţii terminale a intestinului subţire şi disbioza acestuia, tratamentul cu colestiramină; insuficienţa gastrică după gastrectomie, în gastrita atrofică. Malabsorbţia şi malnutriţia se caracterizează prin dereglări ale digestiei parietale şi absorbţiei care pot fi cauzate de: deficit de dizaharidaze (deficit congenital şi dobândit de lactază sau de dizaharidaze – invertază, trehalază, izomaltază); distrofia şi apoptoza enterocitelor (boala Crohn, boala celiacă, sarcoidoză, radiaţii, enterite ischemice etc.); tulburări ale efluxului limfei din intestine (obstrucţie a canalelor limfatice) cu limfoangiectazie, limfom, tuberculoză intestinală, carcinoid; dereglări combinate în diabetul zaharat, giardioză, hipertiroidism, hipogamaglobulinemie, amiloidoză, SIDA. Din diversitatea cauzelor dereglărilor de digestie, cele mai frecvente sunt determinate de patologia pancreasului cu progresia spre insuficienţă exocrină (insuficienţă pancreatică primară), dar în practica medicală se poate constata şi insuficienţa pancreatică secundară (hepatogenă – cologogenă –, gastrogenă, enterogenă şi vasculară). Dereglările de digestie şi dispepsia, de rând cu maladiile organice, sunt determinate destul de frecvent de afecţiunile funcţionale ale tubului digestiv, inclusiv erori banale ale dietei şi abuzurile alimentare(7,8,21).
Una dintre cele mai frecvente acuze de adresare la medicul de familie şi medicul gastroenterolog reprezintă dispepsia, care din limba greacă (dyspeptein), se traduce ca dereglare a digestiei. Variantele dispepsiei, din punct de vedere clinic, se subdivizează în gastrică, intestinală şi biliară. Dispepsia gastrică se manifestă prin senzaţia de plenitudine, disconfort în epigastru, senzaţia de saturaţie rapidă, eructaţie, pirozis, greaţă, vomă, anorexie. Dispepsia intestinală are următoarele manifestări: flatulenţă, meteorism, diaree, constipaţie, scaun instabil, iar cea biliară: diminuarea apetitului, amărăciune, variaţii ale scaunului (constipaţie, diaree), meteorism, senzaţia de disconfort, greutate şi distensie în hipocondrul drept. Digestia alimentelor (proteinelor, glucidelor, lipidelor) sub acţiunea sistemelor enzimatice se defineşte ca digestia realizată începând cu cavitatea bucală (amilaza), stomac (acidul clorhidric, pepsina) şi intestinul subţire (enzimele pancreatice şi intestinale, bila). Procesele principale au loc la nivelul intestinului subţire în trei etape consecutive: digestia cavitară (intestinală), digestia membranară (parietală) şi absorbţia. Digestia cavitară include formarea chimului şi hidroliza componentelor alimentelor într-o stare oligo- şi monomerică. Un rol-cheie în digestia cavitară le revine enzimelor pancreatice. Lanţurile scurte de proteine, carbohidraţi şi grăsimi, formate în procesul de hidroliză cavitară, sunt ulterior scindate prin mecanismele de digestie membranară în stratul de mucus parietal, cu participarea enzimelor pancreatice adsorbite pe nutrienţi. Hidroliza finală a nutrienţilor are loc pe membrana externă a enterocitelor cu ajutorul hidrolazelor intestinale. Ultima etapă, absorbţia, se reduce la transferul componentelor scindate ale nutrienţilor din lumenul intestinal în sânge şi limfă(7,8,21).
Dezvoltarea sindroamelor de maldigestie şi malabsorbţie poate fi asociată nu numai cu o scădere a producţiei de diferite enzime digestive, în primul rând pancreatice, ci şi cu inactivarea lor, diluarea concentraţiei lor în lumenul intestinal, tranzitul rapid al conţinutului intestinal şi amestecarea neadecvată a enzimelor cu bolul alimentar. Diminuarea producţiei de enzime pancreatice poate fi asociată cu afectarea pancreasului, precum şi cu scăderea producţiei de pancreozimină şi secretină. Astfel, insuficienţa exocrină a pancreasului poate fi caracterizată ca primară sau secundară. Insuficienţa pancreatică primară se datorează scăderii digestiei intracavitare în maladiile pancreasului însuşi, care produce mai puţine enzime (pancreatită cronică, rezecţie pancreatică, chisturi, tumori, fibroză chistică etc). În insuficienţa pancreatică secundară, pancreasul este capabil să producă şi să elibereze o cantitate suficientă de enzime digestive, dar acţiunea acestora nu este pe deplin realizată. Insuficienţa pancreatică secundară poate fi de origine hepatogenă (cologogenă), gastrogenă, enterogenă sau vasculară. În insuficienţa hepatogenă (hologenă), activarea lipazei în lumenul intestinal este redusă din cauza unei cantităţi mici de acizi biliari sau a asincronismului în fluxul de bilă, enzime pancreatice şi chim în duoden, determinate de hipomotilitatea vezicii biliare, colelitiază, starea după colecistectomie sau de afecţiuni colestatice hepatice. Împiedicarea emulsionării grăsimilor şi activarea lipazei pancreatice în aceste condiţii duce la steatoree. Insuficienţa pancreatică gastrogenă se dezvoltă în condiţii hipoacide, după rezecţia stomacului, şi se formează din cauza stimulării insuficiente a pancreasului de secretină. Hiposecreţia gastrică poate fi compensată temporar de stresul funcţional al pancreasului, care duce treptat la epuizarea acestuia. Concomitent, hiposecreţia gastrică poate determina contaminarea microbiană a duodenului şi jejunului, care perturbă absorbţia şi modifică pH-ul în lumenul intestinal. Aceşti factori împiedică acţiunea enzimelor pancreatice, chiar dacă sunt produse în cantităţi normale. Insuficienţa pancreatică enterogenă este asociată în principal cu contaminarea bacteriană, care determină nu numai afectarea membranelor mucoasei intestinului subţire de către flora patogenă, dar şi de endotoxinele secretate de această floră. Endotoxinele deteriorează membranele celulare, perturbă transportul transmembranar ionic, provoacă fragmentarea acizilor nucleici, induc formarea de produse de oxidare a radicalilor liberi şi perturbă metabolismul colesterolului şi acizilor biliari. Endotoxinele, absorbite în sânge, afectează hepatocitele şi pancreatocitele, care contribuie ulterior la asocierea insuficienţei enterogene şi hepatogenice şi pancreatice primare. Insuficienţa enterogenă se dezvoltă şi în bolile asociate cu patologia mucoasei intestinului subţire (boala celiacă, boala Crohn etc.). Insuficienţa pancreatică vasculară conduce la perturbarea microcirculaţiei în organele abdominale cu ischemia mucoasei şi/sau staza venoasă şi limfatică. E necesar de reţinut că preparatele enzimatice de substituţie ale pancreasului (PESP) sunt mai eficiente în tulburările digestiei intracavitare (cu o scădere a producţiei de enzime şi cu încălcarea implementării acţiunii lor în lumenul intestinal) şi mai puţin eficiente în tulburările digestiei parietale, tulburările digestive combinate, precum şi în dereglarea efluxului limfei din intestin. Preparatele de substituţie vor fi de elecţie în insuficienţa pancreatică primară, iar în insuficienţa pancreatică secundară, în primul rând ar trebui să se influenţeze cauza care reduce activitatea enzimelor şi abia apoi să se combine PESP. De asemenea, trebuie înţeles clar că prin prescrierea PESP, medicul urmăreşte nu numai să reducă manifestările digestive ale maldigestiei şi malabsorbţiei (diaree, steatoree, flatulenţă, dureri abdominale), ci şi numeroase manifestări datorate lipsei de aport de substanţe plastice, vitamine sau electroliţi(7,8,21).
Insuficienţa exocrină a pancreasului, caracterizată prin secreţia pancreatică inadecvată a enzimelor digestive şi a bicarbonatului, este una dintre cele mai semnificative complicaţii ale PC, care afectează peste 50% dintre pacienţii diagnosticaţi cu dereglarea digestiei, absorbţiei şi metabolismului nutrienţilor. O insuficienţă exocrină severă a pancreasului poate să se dezvolte între cinci şi zece ani de la un diagnostic iniţial de PC şi poate rezulta ca o complicaţie a pancreatitei acute necrozante, a fibrozei chistice, a diabetului zaharat, a cancerului pancreatic şi ca urmare a unei intervenţii chirurgicale de bypass sau rezecţie a duodenului şi/sau pancreasului. Reducerea absorbţiei de lipide, inclusiv acizi graşi esenţiali, vitamine liposolubile (A, D, E, K), calciu, magneziu, zinc, tiamină şi acid folic, poate fi responsabilă de complicaţii sistemice variate, precum osteopenie/osteoporoză, fracturi cu traumatisme, boli cardiovasculare şi infecţii. Aceste complicaţii se dezvoltă pe fundalul problemelor de sănătate în asociere cu anumiţi factori sociali, geografici sau de altă natură, dar prin subestimarea consecinţelor PC. Unele studii sugerează că majoritatea pacienţilor cu insuficienţă exocrină a pancreasului sunt subtrataţi, probabil din cauza utilizării insuficiente a terapiei de substituţie a enzimelor pancreatice, a programării suboptime în legătură cu mesele sau a controlului insuficient al debitului de suc gastric. Acestea pot fi determinate de formele medicamentoase ale preparatelor de substituţie enzimatică autorizate (granule, tablete, capsule gastrorezistente, capsule cu microsfere şi/sau minimicrosfere), selectarea adecvată a indicaţiilor pentru administrare, stabilirea dozelor eficiente şi criteriilor de eficacitate, elaborarea algoritmilor de conduită cu evitarea eşecurilor terapeutice(2,4,19,25).
Pentru asigurarea eficacităţii, PESP trebuie să corespundă unor cerinţe: să fie de origine diferită (animalieră, vegetală, bacteriană, fungică), active în diferite situaţii clinice; să posede o eficacitate clinică dovedită; să conţină doze suficiente de componente „active” care să asigure hidroliza completă a nutrienţilor în lumenul duodenului; să fie rezistente la acidul clorhidric şi pepsină; să se amestece uniform şi rapid cu alimentele cu evacuarea simultană în duoden; să manifeste o acţiune optimă la un pH de 5-7,5; să asigure o eliberare rapidă a enzimelor în intestinul subţire la un pH de 5,5-6; să asigure o activitate înaltă a enzimelor timp de cel puţin 2 ore; să fie în forme medicamentoase adecvate scopului tratamentului şi în conformitate cu compoziţia declarată pe etichetă; să fie convenabile pentru administrarea în pediatrie; să se asigure o omogenitate serială a medicamentului; să fie bine tolerate (absenţa unui miros şi gust neplăcut) şi în funcţie de doza administrată de către pacienţi; să nu posede toxicitate şi efecte adverse(1,7,8,21,23).
Factorii care micşorează activitatea lipazei: instabilitatea în sucul gastric; inactivarea de proteaze; eliberarea asincronizată cu bolul alimentar din stomac; amestecarea insuficientă cu chimusul duodenal şi acizii biliari; eliberarea rapidă a enzimelor în duoden (figura 1).
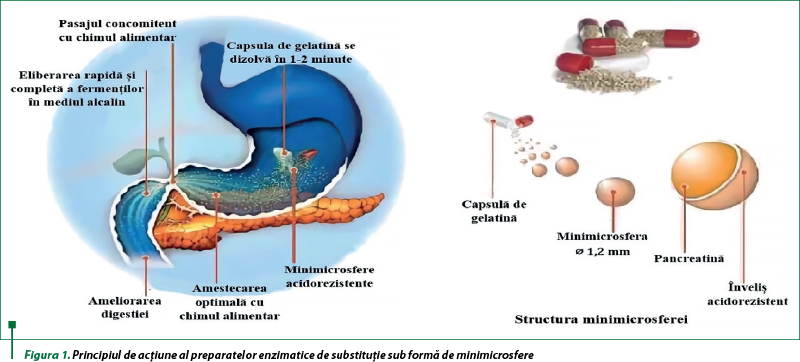
Există diferenţe marcante în rata de eliberare a lipazei din preparate în funcţie de forma medicamentoasă şi, în principal, de dimensiunea microsferelor, care determină viteza de eliberare în intestinul subţire. Sferele cu diametrul de 2,4 şi 3,2 mm se golesc mai lent decât cele de 1 mm şi nu pot ajunge în intestinul subţire concomitent cu alimentele ingerate. Astfel, în practica curentă, microsferele acoperite enteric sau minimicrosferele cu dimensiunea sub 2 mm (optim 1,4±0,3) sunt preparatele de alegere. S-a demonstrat că minimicrosferele cu diametrul de 1–1,2 mm sunt eliberate simultan cu masa şi sunt asociate cu o eficacitate terapeutică cu 25% mai mare în comparaţie cu microsfere de 1,8−2 mm care încă funcţionează satisfăcător(7,8,12,15,16,23).
În funcţie de origine, componenţă şi doza de pancreatină a PESP, se clasifică în:
A. Preparate de origine animalieră:
I. Preparate monocomponente (conţin doar pancreatină)
1) cu doze mici de pancreatină (≤10000 UL): pancreatină*, Triferment forte®*, Mezim®*, Mezim forte®*, Creon®*, Pancreazim®*, Agizim®*, Pro-digestiv®, Pancitrat®, Prolipază®, Ermital®, Pancreon®, Pangrol®, Licrează® etc.;
2) cu doze majore de pancreatină (>25000 UL): Creon®*, Trizim®*, Pro-digestiv®, Pancreon®, Eurobiol®, Pancitrat®, Ermital®, Somilaza®, Pancrelipază®, Panzinorm forte®.
II. Preparate combinate:
1) pancreatină + extract de bilă + hemicelulază (celulază): Digestal®, Festal®, Festal Neo®, Ferestal forte®, Panstal®, Pancral®, Menzim®, Cotazim forte®, Rustal®, Tagestal®, Enzistal®, Panolaz®, Ipental® etc;
2) pancreatină + extract de bilă + extract din mucoasa gastrică: Panzinorm®, Panzinorm forte® (conţine pepsină);
3) pancreatină + extract de bilă + extract din plante: Enzimtal®, Pepzim®, Nutrizim®, Pancurmen®;
4) pancreatină +bromelină + papaină + rutozidă – Wobenzim®*;
5) pancreatină + substanţe adsorbante (simeticonă etc.): Pancreoflet®, Pepfiz® etc.
B. Preparate pe bază de enzime vegetale sau fungice – Enzimtal®, Oraza®, Solizim®, Elzim®, Milaza-100®, Pepfiz® – sau asocierea acestora cu pancreatina: combizim forte, digolaza, rosim etc.
C. Preparate pe bază de lipaze bacteriene: Bacillus spp., Pseudomonas spp., Staphylococcus spp. şi Burkholderia spp., Escherichia coli, Bacillus subtilis, Pichia pastoris şi Saccharomyces cerevisiae.
D. Preparate pe bază de lipaze fungice: Penicillium expansum, Trichoderma, Penicillium chrysogenum; Aspergillus niger, Rhizopus arrhizus, Rhizopus oryzae, Aspergillus oryzae.
E. Preparate pe bază de lipază prin biotehnologie – lipromatază etc.
F. Preparate pe bază de lactază: lactază, tilactază, Silact®, Lacdigest®, Lactaid®, Direglat® sau combinate: Digest 365® etc.(1,3,7,8,27)
Notă: * preparate înregistrate în Republica Moldova.
Lipazele de origine microbiană
Dezvoltarea tehnologiilor de inginerie genetică a permis cercetări mai aprofundate şi cuprinzătoare pe expresia genei lipazei, structura şi funcţia proteinei, precum şi mecanismul de acţiune la nivel molecular. Tehnologiile de clonare moleculară au facilitat generarea de sisteme pentru exprimarea lipazelor derivate din Escherichia coli, Bacillus subtilis, Pichia pastoris şi Saccharomyces cerevisiae. Eforturile actuale de cercetare se concentrează pe screeningul diferitelor tulpini de lipază, modificarea genelor de lipază existente, analiza funcţiei modificate a lipazei şi aplicabilitatea mai largă a lipazelor de origine microbiană. Lipazele microbiene sunt deosebit de diverse în natură, iar activitatea lipazei este de o importanţă centrală la toate organismele vii, deoarece modulează procesele fiziologice critice implicate în digestie şi absorbţie, precum şi metabolismul grăsimilor şi lipoproteinelor. În comparaţie cu animalele şi plantele, microorganismele cuprind o mare varietate de specii, suferă o creştere şi reproducere rapidă, sunt de obicei uşor de manipulat experimental şi pot fi asociate cu variaţii genetice semnificative. Lipazele microbiene au căpătat o atenţie largă datorită selectivităţii, stabilităţii şi substratului larg. Totodată, lipazele produse de unele microorganisme care trăiesc în condiţii extreme au proprietăţi şi prezintă enzime extracelulare secretoare, care pot fi izolate, purificate şi disponibile pentru producţia pe scară largă. Dintre microorganisme, lipaza este cea mai abundentă în bacterii, ciuperci şi drojdii. Cele mai comune surse bacteriene pentru lipaze includ Bacillus spp., Pseudomonas spp., Staphylococcus spp. şi Burkholderia spp. Lipaza bacteriană a catalizat cele mai multe tipuri de reacţii hidrolitice şi a demonstrat cele mai înalte niveluri de activitate şi stabilitate. Lipazele fungice au fost utilizate pe scară largă într-o varietate de aplicaţii biotehnologice datorită stabilităţii, specificităţii şi uşurinţei de producţie. Lipazele izolate din Thermomyces lanuginosus, Rhizopus oryzae şi Aspergillus niger au o valoare industrială importantă. Lipazele izolate din Candida antarctica şi Candida rugosa au fost folosite pentru producţie şi cercetare(27).
Lipazele microbiene sunt comparativ mai valoroase decât cele de origine vegetală sau animalieră datorită varietăţii de activităţi catalitice disponibile, randamentului ridicat de producţie şi simplităţii manipulării genetice, absenţei fluctuaţiilor sezoniere, aprovizionării sistematice, stabilităţii mai sigure şi mai convenabile şi ratei de creştere de microorganisme foarte bogate în medii economice. Izolatele bacteriene oferă activităţi la un pH optim neutru sau alcalin. Tulpinile bacteriene (Pseudomonas alcaligenes, P. aeruginosa, P. fragi, P. fluorescens BJ 10, Bacillus subtilis, B. nealsonii S2MT) şi fungice (Penicillium expansum, Trichoderma, Penicillium chrysogenum, Aspergillus niger) produc lipaze în cantităţi mai mari. Se estimează că, datorită mai multor beneficii ale lipazelor microbiene faţă de lipazele animaliere şi vegetale, cererea de surse microbiene va creşte semnificativ în viitorul apropiat, datorită gamei lor largi de aplicaţii în viaţa cotidiană şi în medicină(3).
Lipazele pancreatice umane şi porcine sunt uşor inactivate de proteaze, de aceea pentru preparatele care conţin acest tip de lipază este recomandabil să conţină o cantitate redusă de proteaze pentru a asigura supravieţuirea lipazelor. Eficacitatea poate fi sporită prin utilizarea diferitor enzime fungice (lipaza din Rhizopus arrhizus, Aspergillus niger, Rhizopus oryzae şi Aspergillus oryzae) şi enzime bacteriene (lipaza din Burkholderia cepacia şi Burkholderia plantarii). Enzimele fungice sunt mai puţin stabile decât cele bacteriene şi îşi pierd rapid o parte semnificativă din activitatea lor în prezenţa acizilor biliari. Activitatea lipazelor bacteriene se menţine într-o măsură mai mare în tractul gastrointestinal decât lipaza pancreatică din porcine, iar utilizarea acestor tipuri de enzime poate reduce semnificativ cantitatea de lipază necesară pentru tratarea steatoreei(26).
Preparatele enzimatice microbiene şi fungice sunt obţinute prin fermentaţie, care este un proces natural şi este realizat de microorganismele prezente în alimente. Enzimele de origine vegetală, bacteriană şi fungică, spre deosebire de cele animaliere, îşi păstrează activitatea la un pH larg, de la 3 la 9, şi cu o biodisponibilitate bună, respectiv nu au nevoie de o acoperire fiabilă rezistentă la acid şi/sau de administrare de antisecretorii. Hidrolazele microbiene sunt eliberate în stomac, ceea ce asigură o hidroliză anterioară şi mai uniformă a substraturilor alimentare. Stabilitatea într-un mediu acid al lipazei de origine microbiană, fungică şi vegetală este deosebit de importantă, deoarece conservarea activităţii sale este crucială pentru a asigura eficacitatea terapiei de substituţie. Este importantă păstrarea activităţii lipazei şi în caz de acidifiere a conţinutului duodenal, cu o scădere a producţiei de bicarbonat pancreatic în cazul insuficienţei pancreatice exocrine severe. La pacienţii cu pancreatită cronică şi hipoaciditate gastrică sau cu rezecţie gastrică, prezenţa unui mediu neutru sau alcalin este defavorabilă pentru preparatele enzimatice de origine animalieră care conţin microsfere. În acest caz, dizolvarea capsulei este mai lentă şi se reţine eliberarea enzimelor şi amestecarea acestora cu alimentele, în timp ce evacuarea bolului alimentar din stomac este accelerată. Enzimele de origine microbiană şi fungică nu trebuie să fie încapsulate, deoarece sunt active într-o gamă largă a nivelului de pH(7,21).
Un alt avantaj al lipazei de origine microbiană este absenţa necesităţii activării ei de către acizii biliari. Lipaza de origine animală, pentru a asigura lipoliza, necesită activare prin prezenţa acizilor biliari, situaţie dificilă în caz de deficienţă de bilă în duoden în patologia hepatică şi/sau biliară. Suplimentarea cu componente biliare sau coleretice a preparatelor de origine animalieră poate cauza efecte nedorite (creşte presiunea osmotică, se dezvoltă diareea osmotică şi secretorie, creşte sarcina funcţională asupra ficatului, este afectată mucoasa tubului digestiv). Lipaza bacteriană (dar nu fungică) nu este inactivată de acizii biliari la concentraţii obişnuite, fapt important la pacienţii cu insuficienţa sfincterului Oddi şi după colecistectomie, când este posibil un exces de acizi biliari în lumenul duodenului(7,21).
Enzimele de origine microbiană, fungică şi vegetală au o specificitate mai largă a substratului decât enzimele de origine animalieră, din aceste considerente nu necesită introducerea obligatorie a unor componente suplimentare de hidrolizare (celulază/hemicelulază). Suplimentarea acestora în unele preparate (Digest 365®) este argumentată pentru ameliorarea flatulenţei. Preparatele de origine microbiană, vegetală şi fungică sunt rezistente la proteazele care reduc activitatea lipazei şi la inhibitorii enzimei pancreatice, care determină menţinerea activităţii şi au un efect terapeutic mai adecvat. Enzimele de origine microbiană, fungică şi vegetală nu suprimă secreţia pancreatică sau chiar pot să o stimuleze, datorită faptului că mecanismele de feedback, care sunt incluse în duoden ca răspuns la aportul de enzime de origine extrinsecă, nu au loc ca urmare a diferenţelor de structură. Preparatele respective pot fi utilizate la pacienţii cu hipersensibilitate la pancreatină(7).
Preparatele pe bază de lactază
Lactaza, enzimă produsă de vilozităţile intestinale, hidrolizează lactoza în galactoză şi glucoză, iar deficitul de lactază reprezintă principala cauză a malabsorbţiei lactozei. Concentraţiile mari de lactază sunt prezente în mod normal la nou-născuţi, dar după sistarea alăptării activitatea sa scade la majoritatea oamenilor în mod genetic, conducând la aşa-numita malabsorbţie primară a lactozei. Hipolactazia secundară poate rezulta din lezarea marginii periei mucoasei intestinale subţiri sau creşterea timpului de tranzit gastrointestinal. Intoleranţa la lactoză este definită când malabsorbţia lactozei provoacă simptome gastrointestinale. Substituirea lactazei native prin utilizarea enzimelor exogene, derivate din drojdii sau ciuperci, cu lactază exogenă microbiană (obţinută din drojdii sau ciuperci) poate fi considerată o opţiune terapeutică de încredere. Lactaza exogenă poate fi administrată cu lapte sau sub formă de capsule/tablete înainte de a consuma produse lactate. Actualmente sunt disponibile un şir de preparate cu activităţi variate ale lactazei precum Silact® (30 000 UI), Lactdigest® (2 250 UI), Lactaid® (9 000 UI), Digerlat® (100 000 UI) şi DairyEase® (3 000 UI). Enzimele obţinute din diferite microorganisme prezintă o eficacitate diferită în hidroliza lactozei. Studiile comparative au arătat că lactaza derivată din K. lactis prezintă o eficacitate mai mare decât lactaza din A. niger. S-a demonstrat că diferite forme medicamentoase ale preparatelor de lactază (Lactogest® – capsulă de gel moale, Lactaid® – caplet şi DairyEase® – comprimat masticabil), în comparaţie cu placebo, au ameliorat semnificativ simptomele(11).
Preparatele combinate pe bază de lactază (Digest 365®) sunt utilizate în caz de deficienţă de lactoză (cu o frecvenţă de 12‑93%), manifestată prin dispepsie intestinală (flatulenţă, diaree) la utilizarea produselor care conţin lactoză (produsele lactate). Preparatul Digest 365® are o activitate lipolitică mai mică faţă de preparatele pancreatinei, dar, datorită priorităţilor enumerate anterior, patogenetic asigură un efect terapeutic în cazul dispepsiei de diferite origini (aport excesiv, schimbul naturii hranei în timpul călătoriilor etc.). Medicamentul poate fi prescris ca parte a terapiei complexe pentru pacienţii cu pancreatită cronică uşoară, cu rezultate normale ale testului de elastază fecală, dar cu dispepsie, la pacienţii cu diabet zaharat, în pregătirea pentru investigaţii radiologice sau pentru examenul ultrasonografic(7).
Lipaza prin naontehnologii
În vederea optimizării formelor de livrare a PESP au fost dezvoltate anumite tehnologii, inclusiv nanoformulări cu ajutorul unor sisteme transportoare. În acest context ciclodextrinele (CD), oligozaharide ciclice compuse din unităţi de D-glucopiranoză legate prin legături α 1-4-glicozidice, datorită structurii moleculare speciale şi comportamentului amfifil (regiunea interioară a cavităţii hidrofobe şi marginea hidrofilă exterioară), sunt capabile să formeze complexe de incluziune solubile în apă cu molecule organice slab solubile în apă. Ciclodestrinele, precum dextrinele liniare, nu sunt toxice pentru oameni şi sunt o alegere preferată de industria farmaceutică pentru îmbunătăţirea solubilităţii în apă a ingredientelor active în diferite formulări farmaceutice. Ca exemplu de astfel de medicamente amintim Caverject® Dual intravenos (un medicament care conţine α-CD, menit să trateze disfuncţia erectilă), β-CD cu conţinut de cetirizină şi γ-CD picături oftalmice Voltaren Ophtha®. Ciclodextrinele sunt capabile să îmbunătăţească proprietăţile biocatalitice ale enzimelor şi pot creşte eficacitatea diferitelor formulări, dar necesită o planificare precisă, deoarece la subdozare sau supradozare pot afecta eficacitatea preparatului. Una dintre limitările majore ale utilizării enzimelor ca biocatalizatori este că acestea sunt capabile să exprime doar o parte din activitatea lor în medii nenaturale. Implementarea unor astfel de transformări într-o reacţie în fază eterogenă poate depăşi problemele de solubilitate, dar astfel de procese controlate de difuzie sunt în mod inerent mai lente decât cele într-o fază omogenă. Prin utilizarea CD se poate creşte solubilitatea în apă a substratului şi se poate asigura o conversie biocatalitică mai eficientă a moleculelor organice slab solubile în apă, precum şi atenua efectul inhibitor al substratului sau al produsului în anumite reacţii enzimatice, prin complexarea componentei interferente(26).
Investigaţiile experimentale au studiat efectul CD selectate asupra activităţii enzimatice a lipazelor din Burkholderia cepacia şi Aspergillus oryzae prin metode de nanoformulare prin hidroliza palmitatului de p-nitrofenil ca o transformare naturală şi larg acceptată pentru a explora activitatea specifică a lipazei. Cercetările au constatat că activitatea lipazelor din Burkholderia cepacia şi din Aspergillus oryzae a fost foarte sensibilă la hidroliza palmitatului de p-nitrofenil în funcţie de raportul de greutate CD/lipază imobilizat în nanofibre. Activitatea formulei nanofibroase a fost comparabilă a medicamentelor selectate, iar în unele cazuri aceasta a arătat o activitate hidrolitică mai mare, care merită să fie studiată şi să se optimizeze condiţiile de producere a nanofibrelor. Urmează să fie efectuată livrarea compoziţiei în tractul intestinal corespunzător, iar cea mai evidentă soluţie de formulare ar putea fi încapsularea într-un material solid. Captarea lipazelor în nanofibrele polimerice poate fi o metodă unică, rapidă, reglabilă şi măsurabilă pentru formularea solidă a enzimelor sensibile prin aplicarea tehnicii de electrofilare şi poate fi un instrument promiţător de formulare în capsule, care poate asigura absorbţia ţintită adecvată a enzimelor formulate(26).
Preparate de lipază obţinute prin biotehnologie
Liprotamaza este un PESP nou, obţinut prin biotehnologie, care conţine trei enzime digestive: un cristal de lipază reticulată (lipază-CLEC), o protează cristalizată şi o amilază amorfă, formulată într-un raport de 1:1:0,15 fără acoperire enterică. Lipaza-CLEC a fost concepută pentru a asigura stabilitatea enzimei în mediul acid al stomacului. Dacă se poate dovedi că liprotamaza este la fel de eficientă ca şi PERT-urile derivate din porcine, riscurile asociate cu PERT-urile derivate din porcine prezentate mai sus pot fi evitate. Studiile clinice la pacienţii cu fibroză chistică au demonstrat că tratamentul cu liprotamază a determinat o creştere semnificativă a absorbţiei a grăsimilor şi de azot la o doză fixă de lipază per masă (32500 de unităţi), fără a ţine cont de aportul de grăsimi sau greutatea subiecţilor(14).
Studiile comparative ale lipazei din liprotamază cu pancrelipază de origine animalieră au demonstrat că există diferenţe considerabile determinate de faptul că pancreasul animalelor secretă o serie de forme de lipaze, colipaze şi fosfolipaze, iar terapia ideală de înlocuire a lipazei trebuie să aibă activitate împotriva unei game largi de substraturi. Lipaza, din componenţa liprotamazei, spre deosebire de pancrelipază, este capabilă să digere diverse trigliceride, preferând hidroliza lanţurilor de acizi graşi de lungime scurtă şi medie faţă de lanţul lung, fără a necesita cofactori. Utilizarea unei singure lipaze modificate fizico-chimic în liprotamază pare să nu substituie în mod adecvat multiplele lipaze naturale porcine care sunt prezente în pancrelipază. În condiţii clinice e posibil ca unii subiecţi să răspundă bine la liprotamază, în timp ce alţii nu vor răspunde adecvat, cauzele fiind rezerva pancreatică variabilă şi disponibilitatea relativă a lipazelor endogene. Concomitent, variabilitatea răspunsului poate fi determinată de dietă, liprotamaza fiind cea mai eficientă cu anumite substraturi lipidice. Lipaza reticulată din liprotamază este mai puţin solubilă decât lipazele din PESP din porcine la pH sub 6, sugerând că solubilitatea variabilă la pacienţi ar putea explica răspunsul variabil şi că dozele mai mari de liprotamază ar putea fi mai eficiente. Doza maximă definită de protocol (10000 unităţi de lipază/kg/zi) şi ajustările maxime ale dozei (până la 50% creştere faţă de doza anterioară) pot limita capacitatea de a optimiza doza de liprotamază. Totuşi, s-a sugerat că doza singură nu ar putea să asigure o digestie suficientă a lipidelor prin formula actuală a liprotamazei, de aceea s-a optat pentru modificarea formulării liprotamazei sau a gradului de reticulare a lipazei, ce ar putea creşte eficacitatea acesteia(14).
Indicaţiile preparatelor enzimatice de substituţie a pancreasului
Varietatea mecanismelor patogenetice şi a nosologiilor însoţite de maldigestie, malabsorbţie şi malnutriţie determină spectrul de indicaţii pentru PESP, care pot fi subdivizate în: 1) afecţiunile pancreasului – pancreatita cronică cu insuficienţă pancreatică exocrină; starea de după rezecţia pancreasului; chisturi mari, tumori ale pancreasului (reducerea volumului parenchimului funcţional); obstrucţia canalelor pancreatice; diabetul zaharat; sindromul Zollinger-Ellison; fibroză chistică (mucoviscidoza); deficit enzimatic izolat determinat genetic; hipoplazia congenitală a pancreasului (sindromul Schwachman, sindromul Johanson-Blizzard) sau atrofia acestuia (sindromul Clark-Headvild); 2) afecţiunile stomacului – gastrita cronică cu hiposecreţie gastrică sau achilie; stări după rezecţia stomacului; sindromul de dumping; 3) afecţiunile intestinului subţire şi gros – boala celiacă; maladii inflamatorii intestinale (colita ulcerativă, boala Crohn); sindromul intestinului scurt; sindrom de creştere bacteriană excesivă în intestinul subţire; 4) afecţiunile ficatului şi căilor biliare – hepatita colestatică (colangită biliară primară, colangită sclerozantă primară); stări după colecistectomie; colecistita cronică cu disfuncţie hipomotorie a vezicii biliare; disfuncţie a vezicii biliare şi/sau a sfincterului lui Oddi; 5) afecţiunile funcţionale ale tubului digestiv – sindromul dispepsiei funcţionale neulcerogene; dereglări disfuncţionale ale tractului biliar; meteorism; sindromul colonului iritabil cu predominanţa diareii; 6) afecţiuni diverse – condiţii după iradiere; deficit de enzime la vârstnici (organe digestive „îmbătrânite”); alimentare monotonă; repaus prelungit la pat; pregătirea pentru ultrasonografie; 7) afecţiunile determinate de abuzuri alimentare; trecerea la un regim alimentar impus. Preparatele enzimatice de substituţie a pancreasului sunt frecvent utilizate în practica medicală de medicii de familie, medicii gastroenterologi, internişti, pediatri, chirurgi etc., într-o gamă largă de indicaţii, precum şi de persoanele bolnave şi sănătoase fără consult medical, deoarece acestea se eliberează fără prescripţie medicală. Creşterea arsenalului de PESP monocomponente şi combinate, concomitent cu elucidarea mecanismelor patofiziologice ale maladiilor şi stărilor patologice însoţite de maldigestie, malabsorbţie şi malnutriţie, deschide medicului noi posibilităţi de abordare raţională a farmacoterapiei şi de realizare a unei medicaţii personalizate. Totodată, creşterea posibilităţii utilizării cu scop de autotratament a PESP de către pacienţi determină folosirea lor iraţională, îndeosebi administrarea episodică în multe dereglări funcţionale ale tubului digestiv(1,8).
Înţelegerea aspectelor fiziopatologice ale consecinţelor nutriţionale ale insuficienţei exocrine a pancreasului (IEP) de către medici este esenţială pentru a creşte supravieţuirea şi calitatea vieţii la pacienţii cu funcţie pancreatică compromisă, ca urmare a secreţiei insuficiente de enzime pancreatice şi bicarbonat pentru a menţine o digestie normală. Afectarea digestiei poate determina malabsorbţie şi malnutriţie, precum şi perturbarea funcţiilor motorii şi secretorii ale tubului digestiv. Insuficienţa exocrină a pancreasului poate fi nediagnosticată la unii pacienţi cu alte tulburări gastrointestinale, precum sindromul colonului iritabil, în special formele uşoare sau moderate. Fibroza chistică (FC) sau pancreatita cronică (PC) determină pierderea parenchimului pancreatic, cancerul pancreatic poate provoca obstrucţia ductului pancreatic, boala celiacă cauzează scăderea stimulării pancreatice, sindromul Zollinger-Ellison duce la inactivarea enzimelor pancreatice, gastrectomia sau duodenopancreatectomia pot duce la scăderea şi întârzierea stimulării pancreatice şi la pierderea parenchimului pancreatic. Conştientizarea şi educarea în conduita IEP pot fi necesare pentru creşterea supravieţuirii şi a calităţii vieţii pe termen lung ale pacienţilor cu maladii severe şi cronice(15).
Scopul tratamentului insuficienţei exocrine a pancreasului se reduce la normalizarea digestiei pentru a îmbunătăţi calitatea vieţii şi longevitatea. Terapia enzimatică de substituţie a pancreasului (TESP), piatra de temelie a managementului IEP, a demonstrat că restabileşte masa corporală, reduce eliminarea lipidelor prin scaun, ameliorează durerile abdominale şi îmbunătăţeşte calitatea vieţii, fără efecte secundare semnificative. Impactul TESP asupra supravieţuirii pe termen lung în pancreatita cronică nu a fost studiat, dar s-a demonstrat că aceasta îmbunătăţeşte ratele de supravieţuire la pacienţii cu cancer pancreatic şi după o intervenţie chirurgicală asupra pancreasului. În pofida acestor beneficii, dovezile sugerează că, în condiţii clinice, frecvent nu se iniţiază un tratament suficient şi nu se substituie adecvat preparatele enzimatice. Astfel, unele studii au arătat că TSEP s-a indicat doar la 21% dintre pacienţii cu cancer pancreatic, în timp ce circa 70% au raportat simptome cauzate de maldigestia grăsimilor. Concomitent, eficacitatea tratamentului rămâne o problemă de importanţă majoră, relevată prin faptul că circa 68% din pacienţi cărora le-au fost administrate preparate enzimatice au avut steatoree şi 39% au prezentat pierdere în greutate. În acest context sunt necesare măsuri de îmbunătăţire în gestionarea IEP, în special în ceea ce priveşte iniţierea şi optimizarea TSEP. Acestea pot fi atinse prin disponibilitatea unei game variate de preparate enzimatice de substituţie, individualizarea dozării şi sincronizării TSEP, alături de incertitudinea cu privire la modul de monitorizare şi optimizare a tratamentului la nonrespondenţi(16,19,23).
Principiile de dozare
Pentru asigurarea unui aport suficient de enzime prin PESP, este necesar să consultăm aspectele fiziologice. Producţia fiziologică de lipază, la prezenţa chimului în duoden timp de patru ore, este între 48 0000 şi 96 0000 de unităţi după o masă standard. Steatoreea survine când producţia de lipază scade sub 10% din normal, iar cantitatea de lipază necesară pentru digestia normală ar fi de la 24 000 la 48 000. La administrarea preparatelor enzimatice, aportul de lipază exogenă ar constitui doar o treime din lipaza endogenă eficientă, probabil din cauza denaturării parţiale de către acidul gastric şi a eliberării tardive în intestinul subţire distal. În privinţa acestui aspect există mai multe viziuni cu privire la doza optimă de PESP. Studiile controlate randomizate au arătat că PESP ar fi eficiente la doze de 72 000-75 000 UI la mesele principale şi de 36 000-50 000 UI la gustări. Orientările europene recente recomandă o doză iniţială minimă de 40 000-50 000 UI la mesele principale pentru adulţii cu pancreatită cronică şi jumătate din doză la gustări. Clubul Pancreatic Australasian sugerează o doză iniţială de 25 000-40 000 UI de lipază cu alimente. Ghidurile din Australia şi Noua Zeelandă, pentru adulţii cu fibroză chistică, recomandă dozarea PESP pe baza gramelor de grăsime din dietă: 500-4 000 UI lipază/gram de grăsime consumat, ce echivalează cu 12000-92000 UI lipază pentru o masă de 600 de calorii în care 35% din calorii provin din grăsimi. Ghidurile ESPEN-ESPGHAN-ECFS pentru fibroza chistică sugerează suplimentarea PESP în UI lipază/kg/masă sau o doză iniţială de 500 UI lipază/kg/masă (30 000 UI lipază pentru un adult de 60 kg la o masă normală). Cerinţa de a cuantifica grăsimile alimentare necesită pacienţi foarte motivaţi şi se adaugă la provocarea de a gestiona IEP în această populaţie. Necesităţile în PESP pentru pacient variază în funcţie de etiologia IEP, de funcţia pancreatică reziduală şi de aportul alimentar şi se pot schimba în timp. Din aceste considerente, este necesară o abordare individualizată a PESP, alături de necesitatea revizuirii şi titrării în funcţie de gradul de malabsorbţie. Se recomandă ca dozele iniţiale de PESP să fie de 50 000-75 000 UI lipază la mese şi 25 000-50 000 UI lipază la gustări, cu revizuirea permanentă a dozelor. La pacienţii cu cancer pancreatic se recomandă să se iniţieze cu o doză la intervalul superior recomandat, deoarece s-a demonstrat că acestea îmbunătăţesc prompt şi adecvat supravieţuirea şi calitatea vieţii(8,12,16,23).
La pacienţii cu cancer pancreatic, în conformitate cu ghidurile europene şi cu o revizuire a PESP în cancerul pancreatic, se recomandă o doză iniţială de 40 000-50 000 UI lipază la fiecare masă şi 25 000 UI la fiecare gustare. Totuşi pacienţii pot avea grade diferite de IEP şi pot necesita o adaptare individuală a dozei. Astfel, pacienţii care au suferit o pancreatectomie completă au nevoie de doze iniţiale mai mari de PESP. Ajustarea dozei iniţiale trebuie evaluată pe baza ameliorării rapide a simptomelor clinice, iar eficacitatea PESP poate fi evaluată pe baza ameliorării simptomelor legate de maldigestie (steatoree, pierdere în greutate, flatulenţă) şi normalizarea stării nutriţionale a pacienţilor. Evaluarea stării nutriţionale a pacienţilor se poate efectua prin parametri antropometrici şi analitici, inclusiv investigaţiile biochimice pentru oligoelemente, vitamine liposolubile, lipoproteine, albumină, prealbumină şi proteine ce cuplează retinol(16,22).
Timpul administrării
Eficacitatea PERT necesită amestecarea enzimelor cu chim şi evacuarea lor sincronizată în duoden. Momentul administrării PERT influenţează, prin urmare, rezultatele clinice. Un studiu randomizat, pe trei căi, a evaluat efectul administrării de minimicrosfere acoperite enteric înainte, în timpul sau după mese la 24 de pacienţi cu pancreatită cronică. Procentul de pacienţi care au obţinut digestia normală a grăsimilor a fost cel mai mare la pacienţii care au luat PEST în timpul meselor (63%), comparativ cu înainte sau după masă (50% şi 54%). Prin urmare, se recomandă administrarea PEST în timpul meselor, distribuită uniform pe parcursul mesei, dacă se ia mai mult de o capsulă(5,12,16,23).
Efecte adverse
Preparatele enzimatice de substituţie a pancreasului sunt în general bine tolerate. Tratamentul se poate asocia cu simptome gastrointestinale uşoare, precum dureri în epigastru, greaţă şi balonare. Colonopatia fibrozoasă este o complicaţie desul de rară, mult discutată, raportată la copiii cu fibroză chistică la utilizarea de doze mari de PESP. Se recomandă ca doza de enzimă să nu depăşească 10 000 UI lipază/kg/zi, care la trei mese şi două gustări pe zi echivalează cu 150 000 UI lipază la mese şi cu 75 000 UI lipază la gustări pentru un adult de 60 kg(5,15,23).
S-a estimat că PESP provoacă frecvent constipaţie. Incidenţa constipaţiei constituie 1-10% şi este cauzată de hidroliza excesivă a lipidelor cu diminuarea motilităţii intestinale. S-au propus următoarele variante ale dezvoltării şi interpretării constipaţiei: utilizarea de doze mai mari decât necesită situaţia clinică; neînţelegerea între medic şi pacient privind interpretarea frecvenţei scaunului; marker care constată că preparatul acţionează efectiv; prezenţa unor comorbidităţi care predispun la constipaţie; utilizarea concomitentă a altor medicamente care predispun la constipaţie; hipodinamia; utilizarea insuficientă a lichidelor şi a fibrelor alimentare. Analiza minuţioasă a cauzelor constipaţiei va permite întreprinderea de măsuri nonfarmacologice, iar în unele situaţii poate fi binevenită lactuloza, care prin diminuarea intoxicaţiei, producerii de citochine proinflamatorii, a colesterolului endogen şi a acţiunii prebiotice, va ameliora patologia pancreatică(8).
Monitorizarea răspunsului
Prescrierea PESP se asociază, de regulă, cu o îmbunătăţire relativ rapidă a simptomelor de maldigestie, precum steatoreea şi pierderea în greutate. Eficienţa terapiei de substituţie nu trebuie evaluată doar pe baza simptomelor clinice, ci şi prin controlul markerilor serici ai nutriţiei (vitaminele liposolubile, proteinele ce cuplează retinolul, albumină, prealbumină şi minerale/oligoelemente, inclusiv fier, zinc şi magneziu), care pot fi scăzuţi la pacienţii asimptomatici(16,23).
Managementul răspunsului neadecvat
Un răspuns neadecvat la PESP trebuie evaluat sistematic prin: verificarea valabilităţii şi modului de depozitare a preparatelor; respectarea conformităţii de către pacient, în special în ceea ce priveşte momentul administrării în raport cu mesele şi gustările; utilizarea formelor medicamentoase şi a preparatelor cu doze adecvate pentru a reducere povara numărului de comprimate sau capsule; analiza istoricului alimentar cu identificarea oportunităţii de individualizare a PESP în funcţie de mărimea şi conţinutul de grăsimi al fiecărei mese, ceea ce poate fi mai eficient decât un regim cu doză fixă. În cazul în care aceşti factori au fost elucidaţi, se va lua în considerare creşterea dozei de enzimă (de 2-3 ori, până la maximum 10 000 UI lipază/kg). Ca alternativă se poate lua în considerare terapia adjuvantă cu antisecretoare gastrice, care cresc pH-ul gastric şi eficacitatea PESP. Trebuie remarcat că există dovezi limitate care să susţină supresia acidă adjuvantă în IEP cauzată de fibroza chistică. E necesar de reţinut că o proporţie semnificativă de pacienţi cu IEP pot demonstra un răspuns neadecvat doar la preparatele PESP cu înveliş enterosolubil, posibil ca urmare a reducerii secreţiei pancreatice de bicarbonat, care neutralizează chimusul acid. La un pH intraduodenal mai mic de 5, învelişul enteric nu se va dizolva la timp şi eliberarea enzimei va avea loc în intestinul subţire distal. În caz că maldigestia nu răspunde prin educarea pacientului, optimizarea dozei PESP şi terapia antisecretoare adjuvantă, trebuie evaluate alte cauze, precum: creşterea excesivă a bacteriilor în intestinul subţire; malabsorbţia acizilor biliari; boala celiacă; boala inflamatoare a intestinului; intoleranţa la lactoză(16,23).
Abuzurile alimentare reprezintă una dintre cele mai frecvente cauze de utilizare a PESP, inclusiv fără a consulta un medic. În aceste cazuri are loc dereglarea raportului componentelor de bază ale alimentaţie cu predominarea lipidelor (animaliere şi vegetale) şi glucidelor, inclusiv a fibrelor nedigerabile. Deseori, abuzurile alimentare sunt asociate cu utilizarea alcoolului, care, în doze mici (până la 50 ml 40%), stimulează digestia, iar în doze mai mari o inhibă marcant, cu agravarea dispepsiei. În cazul abuzurilor alimentare se dezvoltă toate variantele de dispepsie (gastrică, intestinală, biliară), determinate de administrarea unui volum şi a unei componenţe a hranei ce depăşeşte posibilităţile digestiei, cu acuze variate. Utilizarea suplimentară a PESP în cazul abuzului alimentar este argumentată prin influenţarea mecanismelor patofiziologice pentru restabilirea echilibrului dintre volumul şi componenţa hranei (îndeosebi a lipidelor) şi activitatea enzimelor pancreatice în duoden. Creşterea volumului de alimente ingerat determină o hidroliză insuficientă a bolului alimentar la nivelul stomacului cu evacuarea în duoden, care prin mecanisme reflectorii comandă o secreţie suplimentară de enzime pancreatice care nu poate fi realizată la moment. Aceste mecanisme cauzează duodenostază, cu reţinerea pasajului bolului prin duoden. Creşterea presiunii în lumenul duodenului determină spasmul pilorusului cu diminuarea evacuării din stomac şi gastrostază. Staza gastrică şi duodenală este responsabilă de simptomele caracteristice abuzului alimentar(7,8,21).
Pacienţii cu cancer pancreatic prezintă o categorie specială de pacienţi cu afectarea pancreasului, care necesită elaborarea unor recomandări referitoare la utilizarea PESP. Incidenţa IEP la pacienţii cu cancer pancreatic operabil sau inoperabil se estimează la 50-100% şi, respectiv, 46-100%, care poate fi atribuită creşterii tumorii, cu obstrucţia ductului pancreatic, lezarea parenchimului pancreatic, infiltrarea duodenală, şi modificărilor anatomice postoperatorii relevante după rezecţia tumorii cu tulburări profunde ale amestecării intraluminale coordonate a chimului cu secreţiile biliopancreatice. Insuficienţa exocrină a pancreasului la pacienţii cu cancer inoperabil nu se poate manifesta întotdeauna cu simptome precum steatoreea, iar IEP severă, cu niveluri de elastază-1 fecală de peste 20 µg/g, este un factor independent asociat cu un prognostic nefavorabil la aceşti pacienţi şi, prin urmare, ar trebui abordată(15).
La pacienţii cu cancer pancreatic, dezvoltarea IEP va depinde de caracteristicile tumorii primare şi de atrofia parenchimului pancreasului. Astfel, la pacienţii cu cancer pancreatic metastatic, tumora primară este uneori foarte mică sau situată în coada pancreatică şi, dacă se păstrează o cantitate suficientă de ţesut pancreatic, este puţin probabil ca aceşti pacienţi să dezvolte IEP. Studiile funcţiei exocrine la bolnavii cu cancer pancreatic sunt limitate, foarte mici şi eterogene, cu obiective care au vizat starea nutriţională şi masa corporală, dar nu şi funcţia exocrină în special. Beneficiul clinic al PESP la pacienţii cu cancer pancreatic inoperabil este contradictoriu, fie prin influenţarea stării nutriţionale, a masei corporale sau a markerilor nutriţionali serici. La pacienţii cu cancer pancreatic inoperabil şi îngrijitorii lor s-a constatat dificultatea de a gestiona simptomele intestinale şi problemele dietetice complexe, determinate de lipsa de informaţii despre malabsorbţie şi gestionarea simptomelor IEP. Intervenţiile pentru ameliorarea malnutriţiei fac parte din îngrijirea paliativă şi de susţinere. Scopul PESP se reduce la creşterea calităţii vieţii şi prelungirii duratei vieţii. O metaanaliză a unor studii observaţionale sugerează că PESP în cancerul pancreatic inoperabil a crescut capacitatea de prelungire a duratei vieţii, precum şi proporţia de pacienţi care au putut fi trataţi prin chimioterapie şi numărul de cicluri de terapie. Un studiu nerandomizat a relevat că utilizarea PESP la pacienţii cu rezecţie a cancerului pancreatic a dus la o reducere a diareii şi meteorismului(15,22).
Probabilitatea de apariţie a IEP la pacienţii cu cancer pancreatic după intervenţia chirurgicală pancreatică este foarte mare, necesitând o monitorizare cu atenţie a simptomelor clinice care indică insuficienţa exocrină. Aceasta trebuie evaluată în funcţie de localizarea tumorii, de tipul de intervenţie chirurgicală efectuată sau de prezenţa atrofiei în restul pancreasului postoperator, precum şi prin aprecierea stării nutriţionale. E necesar de reţinut că IEP poate fi prezentă deja preoperatoriu, îndeosebi când este implicat capul pancreasului. PESP reprezintă terapia standard pentru IEP la pacienţii cu rezecţia pancreasului. Dovezile clinice limitate privind eficacitatea PESP după rezecţie au demonstrat eficacitatea acesteia prin ameliorarea simptomelor de malabsorbţie (îmbunătăţirea digestiei grăsimilor şi proteinelor, creşterea masei corporale) şi o creştere a duratei vieţii după intervenţia chirurgicală. Din aceste considerente, se recomandă iniţierea imediată a PESP în caz de IEP diagnosticată pe baza probabilităţii şi/sau a simptomelor clinice. Scopul PERT la pacienţii cu cancer pancreatic operat constă în ameliorarea simptomelor de malabsorbţie, îmbunătăţirea stării nutriţionale şi creşterea capacităţii bolnavilor de a fi apţi pentru începerea chimioterapiei adjuvante(15,22).
Utilizarea PESP pentru controlul durerii în PC a făcut obiectul mai multor studii randomizate. S-a estimat că formele medicamentoase tradiţionale fără protecţie gastrică, iar uneori şi microtabletate ar fi capabile să amelioreze durerea, în timp ce preparatele gastrorezistente nu au arătat niciun efect. În prezent, suplimentarea PESP nu este recomandată pentru ameliorarea durerii în PC, deşi poate avea efecte benefice asupra disconfortului abdominal legat de IEP (meteorism, flatulenţă). Iraţionalitatea administrării PESP în oprirea evoluţiei sindromului algic din PC se estimează a fi determinată de: preparatele enzimatice tabletate cu activitate proteazică înaltă fără înveliş protector nu sunt înregistrate în majoritatea ţărilor postsovietice şi europene; eficacitatea redusă din cauza inactivării lipazei de către proteaze; retenţia preparatelor în stomac până în perioada interprandială ca urmare a dimensiunilor mari şi a asincronismului evacuării în duoden. În Recomandările Europene Unificate de Diagnosticare şi Tratament al Pancreatitei Cronice şi Colegiului American de Gastroenterologie se estimează că PESP în IEP pot reduce durerea determinată de dereglările motilităţii, de meteorism, dar nu vor influenţa durerea pancreatică cauzată de distensia capsulei pancreasului de edem, ischemie sau de perinevritele nervilor intrapancreatici(6,9,12,16).
Concluzii
Analiza şi sistematizarea literaturii în domeniu ne-au permis să elucidăm un şir de aspecte ale perspectivelor de dezvoltare a preparatelor enzimatice de substituţie a pancreasului în funcţie de origine (bacteriană, fungică, vegetală, biotehnologică, nanoformulări), forma medicamentoasă şi diametrul particulelor (microsfere, minimicrosfere, nanofibre), conţinutul, dozele şi raportul amilazei, lipazei şi proteazelor. Studiul aprofundat al patogenezei maldigestiei, malabsorbţiei şi malnutriţiei, al corelaţiilor secreţiei gastrice, intestinale, pancreatice şi bilei, al mecanismelor fiziopatologice ale maladiilor şi stărilor patologice care determină insuficienţa exocrină a pancreasului poate deschide noi perspective în evidenţierea unor markeri specifici care ar contribui la selectarea şi utilizarea raţională şi individualizată a terapiei enzimatice de substituţie.
Bibliografie
-
Bacinschi N, Voloc A. Preparatele enzimelor de substituţie pancreatică: consideraţii şi recomandări. Bucureşti, România. Farmacist.ro. 2020;3(194): 28‑33. doi: 10.26416/Farm.193.3.2020. ISSN 1584-6539.
-
Brennan GT, Saif MW. Pancreatic Enzyme Replacement Therapy: A Concise Review. JOP. 2019;20(5):121-125.
-
Chandra P, Enespa, Singh R, Arora PK. Microbial lipases and their industrial applications: a comprehensive review. Microb Cell Fact. 2020 Aug 26;19(1):169. doi: 10.1186/s12934-020-01428-8.
-
de la Iglesia-García D, Huang W, Szatmary P, Baston-Rey I, Gonzalez-Lopez J, Prada-Ramallal G, Mukherjee R, Nunes QM, Domínguez-Muñoz JE, Sutton R; NIHR Pancreas Biomedical Research Unit Patient Advisory Group. Efficacy of pancreatic enzyme replacement therapy in chronic pancreatitis: systematic review and meta-analysis. Gut. 2017 Aug;66(8):1354-1355. doi: 10.1136/gutjnl-2016-312529.
-
Gan C, Chen YH, Liu L, Gao JH, Tong H, Tang CW, Liu R. Efficacy and safety of pancreatic enzyme replacement therapy on exocrine pancreatic insufficiency: a meta-analysis. Oncotarget. 2017 Oct 7;8(55):94920-94931. doi: 10.18632/oncotarget.21659.
-
Gardner TB, Adler DG, Forsmark CE, Sauer BG, Taylor JR, Whitcomb DC. ACG Clinical Guideline: Chronic Pancreatitis. Am J Gastroenterol. 2020 Mar;115(3):322-339. doi: 10.14309/ajg.0000000000000535.
-
Gubergriţ NB, Beleaeva NV, Klocikov AЕ et al. Differenţialinîi podhod k zamestitelinoi terapii pri vneşnesecretornoi nedostatocinosti podjeludocinoi jelezî. Zdorovia Ucrainî. 2020;1(470).
-
Gubergriţ NB, Beleaeva NV, Klocikov AЕ et al. Preimuşcestva I terapevticeskie vozmojnosti preparatov pişcevaritelinîh fermentov nejivotnogo proishojdenia. Vestnic Cluba Pancreatologov. 2018;2(47):37-49.
-
Gubergriţ NB, Beleaeva NV. Pancreatologhia: razvenciannîe mifî. Vestnic Cluba Pancreatologov. 2020;3(48):38-43.
-
Hart PA, Conwell DL. Chronic Pancreatitis: Managing a Difficult Disease. Am J Gastroenterol. 2020 Jan;115(1):49-55. doi: 10.14309/ajg.0000000000000421.
-
Ianiro G, Pecere S, Giorgio V, Gasbarrini A, Cammarota G. Digestive Enzyme Supplementation in Gastrointestinal Diseases. Curr Drug Metab. 2016;17(2):187-93. doi: 10.2174/138920021702160114150137.
-
Ivaşkin VT, Maev IV, Ohlobîstin AV et al. Kliniceschie recomendaţii Rosiiskoi gastroănterologhiceskoi assoţiaţii po diagnostike i leceniu ăczocrinnoi nedostatocinosti podjeludocinoi jelezî. Ross Z Gastroenterol Gepatol. Koloproktol. 2017;27(2):54-80.
-
Khan M, Rutkowski W, Vujasinovic M, Löhr JM. Adherence to European Guidelines for Treatment and Management of Pancreatic Exocrine Insufficiency in Chronic Pancreatitis Patients. J Clin Med. 2021 Jun 21;10(12):2737. doi: 10.3390/jcm10122737.
-
Konstan MW, Wagener JS, Wilschanski M et al. A comparison of liprotamase, a non-porcine pancreatic enzyme replacement therapy, to porcine extracted pancrelipase in a noninferiority randomized clinical trial in patients with cystic fibrosis. Clin. Invest. (Lond.). 2018;8(4):147–154.
-
Layer P, Kashirskaya N, Gubergrits N. Contribution of pancreatic enzyme replacement therapy to survival and quality of life in patients with pancreatic exocrine insufficiency. World J Gastroenterol. 2019 May 28;25(20):2430-2441. doi: 10.3748/wjg.v25.i20.2430.
-
Besselink M, Mayerle J, Lerch MM, Haas S, Akisik F, Kartalis N, Iglesias-Garcia J, Keller J, Boermeester M, Werner J, Dumonceau JM, Fockens P, Drewes A, Ceyhan G, Lindkvist B, Drenth J, Ewald N, Hardt P, de Madaria E, Witt H, Schneider A, Manfredi R, Brøndum FJ, Rudolf S, Bollen T, Bruno M; HaPanEU/UEG Working Group. United European Gastroenterology evidence-based guidelines for the diagnosis and therapy of chronic pancreatitis (HaPanEU). United European Gastroenterol J. 2017 Mar;5(2):153-199. doi: 10.1177/2050640616684695.
-
Olesen SS, Juel J, Graversen C, Kolesnikov Y, Wilder-Smith OH, Drewes AM. Pharmacological pain management in chronic pancreatitis. World J Gastroenterol. 2013 Nov 14;19(42):7292-301.
-
Pham A, Forsmark C. Chronic pancreatitis: review and update of etiology, risk factors, and management. F1000Res. 2018 May 17;7. pii: F1000 Faculty Rev-607.
-
Perbtani Y, Forsmark CE. Update on the diagnosis and management of exocrine pancreatic insufficiency. F1000Res. 2019 Nov 26;8:F1000 Faculty Rev-1991. doi: 10.12688/f1000research.20779.1.
-
Petrov MS, Yadav D. Global epidemiology and holistic prevention of pancreatitis. Nat Rev Gastroenterol Hepatol. 2019 Mar;16(3):175-184.
-
Plotnikova ЕI. Roli enzimov nejivotnogo proishojdenia pri naruşeniah pişcevarenia razlicinoi ătiologhii. Leciaşcii vraci. 2019;1:56-61.
-
Roeyen G, Berrevoet F, Borbath I, Geboes K, Peeters M, Topal B, Van Cutsem E, Van Laethem JL. Expert opinion on management of pancreatic exocrine insufficiency in pancreatic cancer. ESMO Open. 2022 Feb;7(1):100386. doi: 10.1016/j.esmoop.2022.100386.
-
Shandro BM, Nagarajah R, Poullis A. Challenges in the management of pancreatic exocrine insufficiency. World J Gastrointest Pharmacol Ther. 2018 Oct 25;9(5):39-46. doi: 10.4292/wjgpt.v9.i5.39.
-
Singh VK, Yadav D, Garg PK. Diagnosis and Management of Chronic Pancreatitis: A Review. JAMA. 2019 Dec 24;322(24):2422-2434.
-
Working Party of the Australasian Pancreatic Club, Smith RC, Smith SF, Wilson J, Pearce C, Wray N, Vo R, Chen J, Ooi CY, Oliver M, Katz T, Turner R, Nikfarjam M, Rayner C, Horowitz M, Holtmann G, Talley N, Windsor J, Pirola R, Neale R. Summary and recommendations from the Australasian guidelines for the management of pancreatic exocrine insufficiency. Pancreatology. 2016 Mar-Apr;16(2):164-80. doi: 10.1016/j.pan.2015.12.006.
-
Tóth GD, Kazsoki A, Gyarmati B, Szilágyi A, Vasvári G, Katona G, Szente L, Zelkó R, Poppe L, Balogh-Weiser D, Balogh GT. Nanofibrous Formulation of Cyclodextrin Stabilized Lipases for Efficient Pancreatin Replacement Therapies. Pharmaceutics. 2021 Jun 27;13(7):972. doi: 10.3390/pharmaceutics13070972.
-
Yao W, Liu K, Liu H, Jiang Y, Wang R, Wang W, Wang T. A Valuable Product of Microbial Cell Factories: Microbial Lipase. Front Microbiol. 2021 Sep 20;12:743377. doi: 10.3389/fmicb.2021.743377.





