Retinopathy of prematurity (ROP) is a vasoproliferative disease of the retina developed by preterm or low birth weight infants, to the emergence of which a multitude of factors contribute. The pathophysiology is not completely understood, restricting treatment and prevention of this devastating disease. The disease may present mild or it can progress to retinal detachment and final blindness. As the survival rate of premature newborns increases, so does the incidence of retinopathy of prematurity.
Retinopatia de Prematuritate (ROP)
Retinopathy of prematurity
First published: 15 martie 2016
Editorial Group: MEDICHUB MEDIA
Abstract
Rezumat
Retinopatia de prematuritate (ROP) este o afecţiune vasoproliferativă a retinei dezvoltată la nou-născuţii prematuri sau cu greutate mică la naştere, la apariţia căreia contribuie o multitudine de factori. Fiziopatologia este încă incomplet înţeleasă, limitând prevenirea şi tratamentul acestei afecţiuni devastatoare. Boala poate prezenta forme uşoare sau poate evolua spre dezlipire de retină, cu orbire finală. Pe măsură ce rata de supravieţuire a nou-născuţilor prematuri creşte, creşte şi incidenţa retinopatiei de prematuritate.
Introducere
Retinopatia de prematuritate (ROP) este o boală multifactorială vasoproliferativă ce afectează nou-născuţii prematuri, cauzată de o dezvoltare vasculară anormală a retinei, fiind una din principalele cauze de cecitate la copilul mic(1).
Conform Organizaţiei Mondiale a Sănătăţii, cecitatea dobândită în copilărie are implicaţii semnificative emoţionale, sociale şi economice, mai ales în condiţiile în care multe cauze de orbire la copii, printre care şi ROP, pot fi prevenite sau tratate. În plus, cecitatea este asociată cu creşterea mortalităţii copiilor în ţările în curs de dezvoltare(2).
Iniţial descrisă ca fibroplazie retrolentală, de către Theodore L. Terry, în Boston, în 1942, a fost considerată principala cauză de orbire la copii în SUA, între anii 1940 şi 1950(3).
În 1951, Campbell a sugerat că efectele toxice ale oxigenului suplimentar administrat necontrolat nou-născuţilor sunt responsabile pentru ROP, subliniind importanţa menţinerii sarcinii dincolo de săptămâna a 33-a şi limitarea utilizării terapiei profilactice cu oxigen la tratamentul cianozei(4). Studii ulterioare, în acelaşi deceniu, au confirmat faptul că un nivel ridicat de oxigen conduce la obliterarea vaselor de sânge din retina neonatală(5,6) şi, ca urmare, incidenţa ROP a scăzut de la 50% în 1950 la 4% în 1965(7). În următoarele două decenii, în ciuda monitorizării atente a oxigenului administrat nou-născuţilor, incidenţa a reînceput să crească(8,9) şi s-a ajuns la concluzia că, de această dată, responsabilă a fost creşterea ratei de supravieţuire a nou-născuţilor cu greutate foarte mică la naştere, 750-999 g, şi nu factori iatrogenici noi(10,11).
Incidenţa ROP
Datele din literatură arată că, în ţările dezvoltate economic, proporţia cecităţii la copil este de 600 la 10 milioane de persoane, din care 60 de cazuri sunt cauzate de retinopatia de prematuritate, spre deosebire însă de ţările în curs de dezvoltare, unde proporţia cecităţii la copil ajunge la 1.800 la 10 milioane de persoane, dintre care 450 de cazuri au drept cauză retinopatia de prematuritate(12).
Incidenţa apariţiei retinopatiei de prematuritate (ROP) este invers proporţională cu greutatea la naştere (GN) şi cu vârsta gestaţională (VG)(13) şi, în plus, odată cu dezvoltarea tehnologică şi modernizarea unităţilor de terapie intensivă neonatală, au crescut şi ratele de supravieţuire a prematurilor cu vârsta gestaţională ≤28 săptămâni şi, ca urmare, a crescut şi incidenţa ROP(14,15,16).
Etiopatogenie
În săptămâna a 16-a debutează vascularizaţia normală a retinei, centrifug de la nivelul nervului optic, având ca punct de pornire vasele hialoidiene, astfel încât, în jurul săptămânii 36-40, ramurile ajung să vascularizeze complet retina nazală şi temporală şi îşi încetează progresia(17,18).
Ca urmare a tranziţiei nou-născutului prematur de la viaţa intrauterină la condiţiile agresive ale mediului extrauterin, retina va fi imatură, incompletă sau anormal vascularizată (neovascularizaţie) de vase care pot prolifera, conducând la sângerare şi tracţiune, ce pot progresa până la dezlipire de retină şi cecitate(19).
Din cauza expunerii vaselor retiniene unui mediu extern foarte bogat în oxigen, comparativ cu nivelul uşor hipoxic al mediului intrauterin (PaO2 >80 cmH2O faţă de PaO2 <30 cmH2O), scade secreţia factorului de creştere vasculară endotelială - VEGF, cu vasoconstricţia şi involuţia secundară a vaselor retiniene, care nu mai primesc semnale de proliferare(20,21).
Hipoxia ulterioară provoacă o a doua fază cronică, caracterizată de proliferarea vasculară şi de formarea şuntului arterio-venos la nivelul celulelor gliale, conducând uneori la involuţie sau la cicatrice permanente şi pierderea vederii(22,23).
În perioada intrauterină, fătul primeşte IGF-1 (factorul de creştere insulinic 1), prin intermediul placentei, transfer care încetează în momentul naşterii(24). Alţi factori de creştere care influenţează fiziopatologia retinopatiei de prematuritate sunt hormonul de creştere somatotrop (STH), angiopoietina şi factorul de creştere beta derivat din plachete (PDGF beta)(25) (tabelul 1).
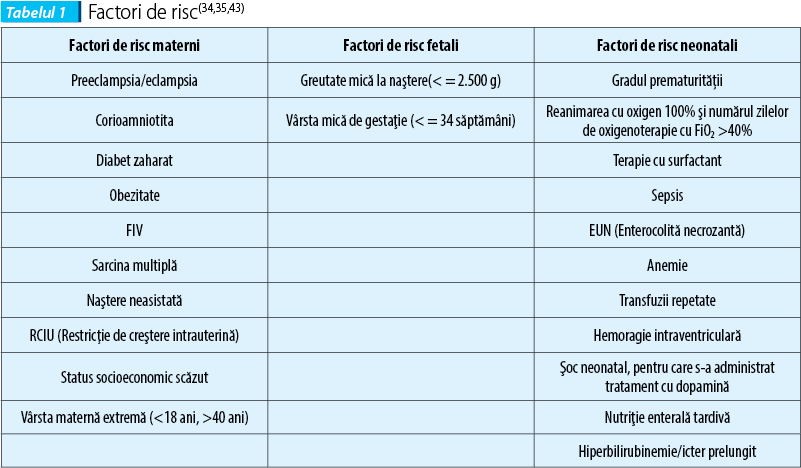
De remarcat este şi polimorfismul genetic ce poate altera funcţia unor gene care controlează vascularizaţia retiniană, motiv pentru care boala este mai frecventă la caucazieni, comparativ cu rasa neagră şi de două ori mai frecventă la băieţi decât la fete. De asemenea, factorii socioeconomici sunt importanţi, ROP fiind mai frecventă în zonele cu populaţie defavorizată, un posibil motiv fiind dispensarizarea precară/nedispensarizarea gravidei(26).
Prenatal, pot contribui numeroşi factori materni, cum ar fi fumatul, diabetul, preeclampsia şi administrarea de beta-blocante mamei, anterior naşterii. De asemenea, intervalul mic dintre sarcini şi nedispensarizarea sarcinii reprezintă factori potenţiali pentru naşterea prematură şi apariţia ROP(27). Şi nu în ultimul rând, mijloacele de fertilizare asistată (mai ales fertilizarea in vitro) contribuie la incidenţa crescută a ROP, prin apariţia sarcinilor multiple, ce pot conduce la naştere prematură(28,29).
Există o legătură semnificativă între durata şi concentraţia administrării oxigenului şi severitatea retinopatiei, motiv pentru care se recomandă a fi evitate fluctuaţiile în concentraţia oxigenului administrat, alternarea hipoxie/hiperoxie stimulând neovascularizaţia retiniană, într-o mai mare măsură decât hipoxia sau hiperoxia izolate. De aceea, toţi prematurii care necesită oxigen suplimentar trebuie monitorizaţi prin pulsoximetrie pentru a menţine un target de SpO2 între 88-92% şi a evita variaţiile de SpO2(30). Hipoxia, oxigenarea insuficientă, acidoza constituie, de asemenea, factori de risc prin nivelul crescut de CO2 din sânge, care influenţează metabolismul retinian şi produc supraexprimarea VEGF, cu consecinţe asupra vederii.
Transfuziile repetate de sânge/masă eritrocitară pot determina ROP, prin faptul că hemoglobina adultă primită de aceşti copii furnizează aport suplimentar de oxigen la nivelul ţesuturilor, datorită curbei de disociere a oxigenului, diferită de cea a hemoglobinei fetale. În plus, afectarea şi modificarea parametrilor cardiovasculari, cum ar fi pulsul, pH-ul şi temperatura, pot modifica, de asemenea, curba de disociere a oxihemoglobinei(31).
Implicat în apariţia ROP este şi deficitul de vitamină E, iar laptele femeilor care au născut prematur are un nivel mai ridicat de vitamină E, de 2-3 ori mai mare în colostru şi în laptele prematur decât în laptele matur(32). Intensitatea luminii ambientale din secţiile de neonatologie nu are nici un efect asupra apariţiei retinopatiei de prematuritate, conform studiului Light-ROP, ce evaluează efectul reducerii luminii ambientale asupra incidenţei retinopatiei(33,42).
Clasificare
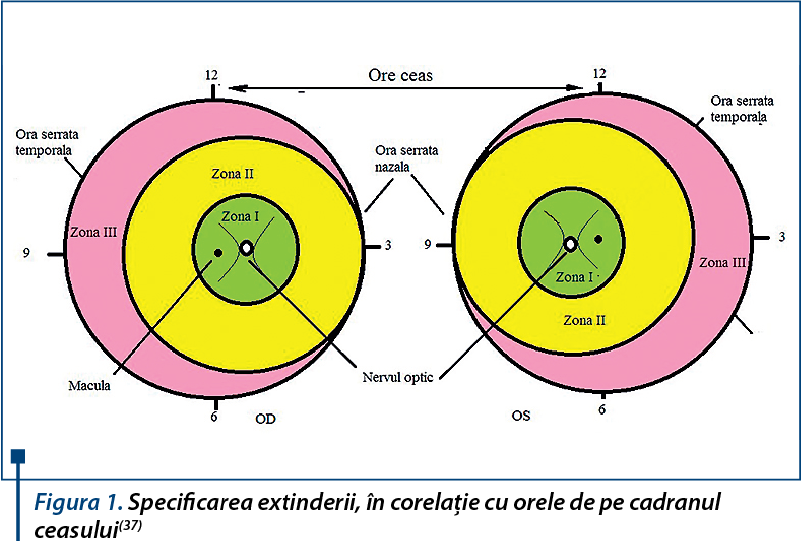
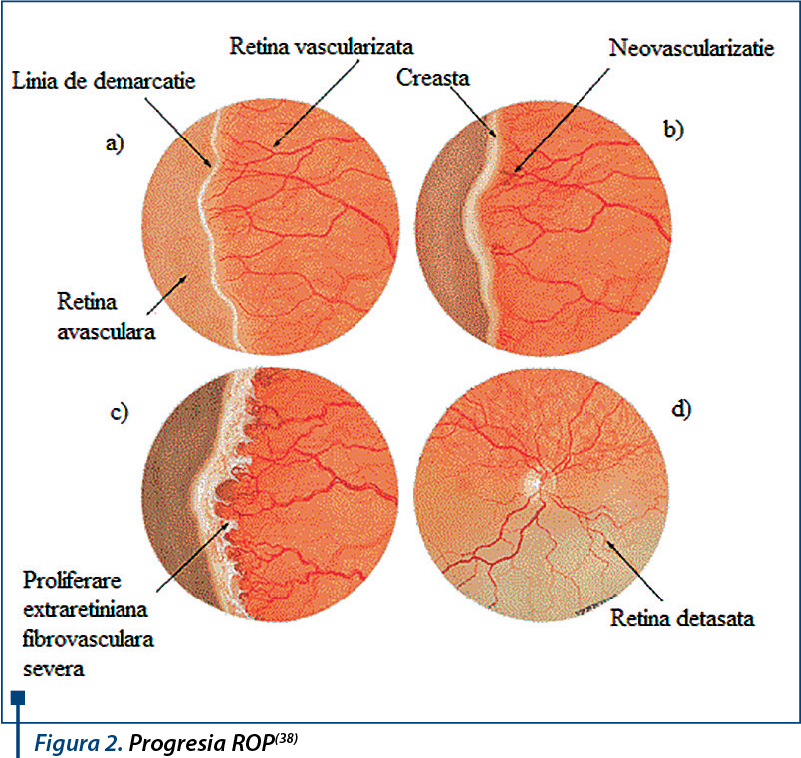
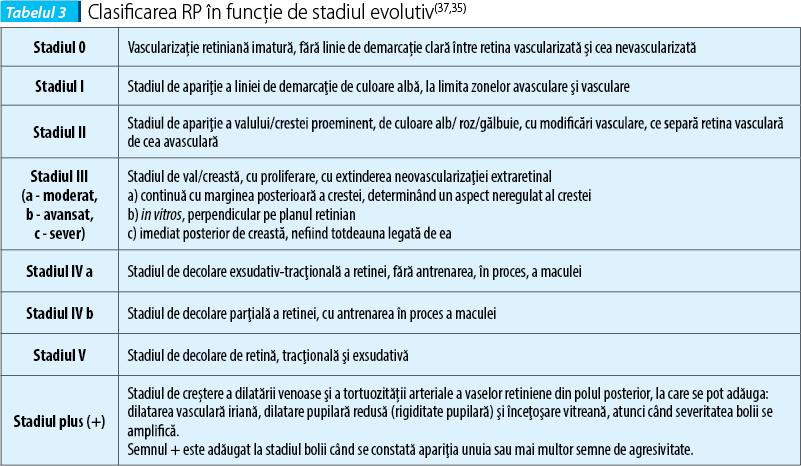
Retinopatia de prematuritate se defineşte prin 3 parametri: localizare, extindere şi stadiu evolutiv. Există trei zone concentrice nervului optic, care descriu gradul de dezvoltare vasculară a retinei(35,36) (tabelul 1, tabelul 2, tabelul 3, figura 1, figura 2). Din cauza creşterii fiziologice în dimensiuni a globului ocular, va creşte şi zona retiniană periferică hipoxică şi se va forma o zonă de ischemie, ce va determina creşterea ulterioară a nivelului de VEGF, având ca efecte: apariţia tortuozităţii şi sinuozităţii vaselor retiniene, urmate de apariţia angiogenezei - neovascularizaţie retiniană. Ulterior, proliferarea fibrovasculară va conduce la apariţia unei fibroze intravitreene, ce va determina, în timp, dezlipirea totală sau parţială a retinei(39).

Screening
ROP-ul nedepistat şi netratat în timp util poate duce la cecitate, motiv pentru care, în 2002, Ministerul Sănătăţii a iniţiat Programul Naţional pentru Screening şi Tratament al ROP în România, desemnând drept coordonator al acestui program Institutul pentru Ocrotirea Mamei şi Copilului „Prof. Dr. Alfred Rusescu” Bucureşti. Început iniţial în Bucureşti, programul de screening s-a extins, în 2-3 ani, în marile oraşe ale ţării, fiind efectuat, în 2015, în 11 centre de pe tot cuprinsul ţării.
Conform protocolului din România, sunt incluşi în screening obligatoriu toţi copiii cu VG ≤34 săptămâni şi/sau cu GN ≤2.000 g, precum şi copiii cu VG mai mare de 34 săptămâni, dacă au avut anumiţi factori de risc asociaţi: oxigenoterapie cu FiO2 >40%, sepsis neonatal, enterocolită necrozantă, anemie +/- transfuzii, şoc neonatal, administrare de dopamină/cafeină(35,40).
Screening-ul corect, respectiv examinarea tuturor copiilor prematuri dintr-o maternitate, se face doar în centrele de nivel trei, copiii născuţi în alte centre sau unităţi fiind transportaţi cu ambulanţa sau aduşi de părinţi; acest fenomen nu este controlabil şi poate duce, din nefericire, la omiterea unora din screening şi la apariţia cazurilor de orbire(41).
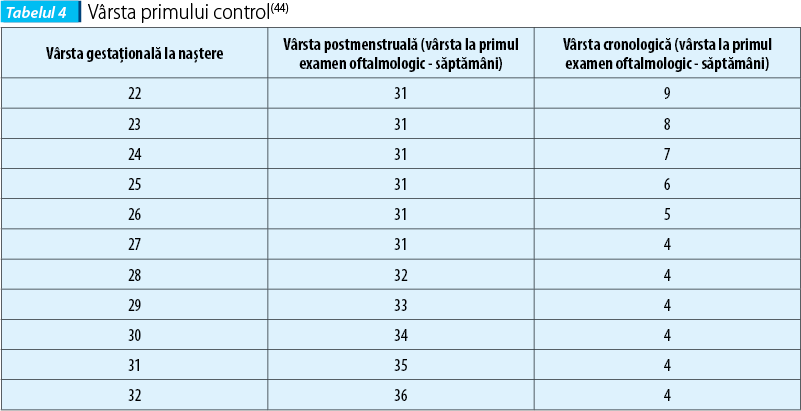
Medicul neonatolog trebuie să solicite consult oftalmologic la orice nou-născut cu VG mai mică sau egală cu 34 de săptămâni şi GN egală sau sub 2.000 grame, la 4 săptămâni de viaţă, dar nu înainte de 31 de săptămâni, vârsta corectată. Momentul examinării iniţiale se bazează atât pe vârsta postmenstruală (PMA), cât şi pe vârsta cronologică (CA) şi se realizează pentru a detecta 99% dintre copiii cu risc asociat de a dezvolta ROP. Primul control se face la 4 săptămâni de la naştere, dar nu înainte de 31 de săptămâni (tabelul 4). Controalele se fac la interval de 7 sau 14 zile, în funcţie de agresivitatea afecţiunii, până la regresia post-tratament sau spontan.
Tratament
Scopul principal al programului de screening este depistarea precoce a cazurilor care necesită tratament. În funcţie de severitate, acesta este:
- „Gold Standard” - laser-terapie (ROP zona II)(45,40).
- Injecţie intravitreană cu bevacizumab - în formele severe (retinopatia agresivă posterioară AP-ROP)(46).
- Chirurgie vitreoretiniană (în centre din afara ţării) - pentru stadiile 4/5 (dezlipire de retină)(47).
Retinopatia de prematuritate poate fi tratată cu succes doar dacă este diagnosticată la timp. Tratamentul se iniţiază la 24-72 de ore de la diagnosticare. Cu toate că, în România, în ultimii ani, rezultatele tratamentului, instituit la timp, sunt asemănătoare celor din ţările vestice (peste 95% sunt favorabile), încă sunt copii nevăzători, aproape întotdeauna pentru că nu au fost examinaţi şi trataţi la timp.
Prevenţie şi profilaxie
1. Respectarea sistemului regional de organizare a maternităţilor, astfel încât copii care la naştere au VG mai mică de 32 de săptămâni şi greutatea sub 1.500 de grame să fie născuţi sau transferaţi în maternităţile de nivel 3.
2. Tratamentul antenatal:
- dispensarizarea corectă a gravidelor, în vederea prevenirii naşterilor premature, datorită riscului redus de a dezvolta ROP al nou-născutului la termen;
- administrarea de cortizon gravidei, în toate cazurile de sarcină cu VG între 24 şi 34 de săptămâni, având ca efect scăderea ratei de detresă respiratorie a nou-născutului, a oxigenoterapiei, a ventilaţiei mecanice, a hemoragiei intraventriculare, a enterocolitei ulcero-necrotice, a sepsisului neonatal şi a decesului neonatal;
- diagnosticul şi tratamentul precoce al corioamniotitei şi sepsisului puerperal, pentru evitarea afectării fetale(27).
3. Respectarea protocolului de resuscitare neonatală şi de administrare suplimentară de oxigen: SaO2 între 88% şi 92%, cu evitarea fluctuaţiilor mari.
4. Standardizarea îngrijirii neonatale, în vederea reducerii ratei şi tratării precoce a sepsisului neonatal, nutriţia enterală precoce şi adecvată, educaţia medicală periodică a personalului medical.
5. Includerea în Programul de Screening a tuturor copiilor din grupa de risc, pentru a putea beneficia la timp de tratament(40).
Screening-ul pentru ROP este o necesitate a prematurilor îngrijiţi în secţiile de neonatologie, în compartimentele de terapie intensivă neonatală, efectuarea în timp util prevenind ROP.
Concluzii
Managementul cât mai bun al factorilor de risc implicaţi în etiopatogenia bolii, cu respectarea unor reguli simple, duce la scăderea incidenţei ROP, respectiv transportul in utero în centrele de nivel 3 al copiilor prematuri, respectiv al celor născuţi sub 32 de săptămâni de gestaţie sau/ şi sub 1.500 de grame, precum şi al copiilor mai mari, cu factori de risc asociat. De asemenea, administrarea steroizilor antenatali, respectarea protocolului de resuscitare neonatală şi a administrării suplimentare de oxigen, reducerea sepsisului neonatal, nutriţia enterală timpurie, personalul mediu bine educat şi în număr suficient contribuie la scăderea ratei ROP. Profilaxia, screening-ul şi terapia în echipa obstetrician - neonatolog - oftalmolog sunt cauze ale diminuării ROP, în condiţiile asigurării asistenţei medicale specifice unei categorii de prematuri cu multipli factori de risc pentru patologii sechelare.
Bibliografie
2. Gilbert C, Foster A. Childhood blindness in the context of VISION 2020 - The right to sight. Bull World Health Organ. 2001; 79(3):227-32.
3. Terry TL. Retrolental fibroplasia. J Pediatr. 1946;29:770-3.
4. Campbell K. Intensive oxygen therapy as a possible cause of retrolental fibroplasia; a clinical approach. Med J Aust. 1951, 14;2(2):48-50.
5. Patz A, Hoeck LE, De La Cruz E. Studies on the effect of high oxygen administration in retrolental fibroplasia. I Nursery observations. Am J Ophthalmol, 1952;35(9):1248-53.
6. Ashton N, Ward B, Serpell G. Effect of oxygen on developing retinal vessels with particular reference to the problem of retrolental fibroplasia. Br J Ophthalmol, 1954; 38(7):397-43.
7. Hatfield EM. Blindness in infants and young children. Sight Sav Rev, 1972;42(2):69-89.
8. Phelps DL. Retinopathy of prematurity: an estimate of vision loss in the United States-1979. Pediatrics 1981; 67:924–6.
9. Gibson DL, Sheps SB, Schechter MT, et al. Retinopathy of prematurity: a new epidemic? Pediatrics 1989; 83:486–92.
10. Keith CG, Doyle LW, Kitchen WH, et al. Retinopathy of prematurity in infants of 24–30 weeks’ gestational age. Med J Aust 1989; 150:293–6.
11. Valentine PH, Jackson JC, Kalina RE, et al. Increased survival of low birth weight infants: impact on the incidence of retinopathy of prematurity. Pediatrics 1989; 84:442–5.
12. Gilbert C. Changing challenges in the control of blindness în children. Eye, 2007, 2:1338–43.
13. Amer M, Jafri WH, Nizami AM, Shomrani AI, Al-Dabaan AA, Rashid K, Retinopathy of prematurity: are we missing any infant with retinopathy of prematurity? Br J Ophthalmol, 2012; 96(8):1052-5.
14. Gunn DJ, Cartwright DW, Gole GA. Incidence of retinopathy of prematurity in extremely premature infants over an 18-year period. Clin Exp Ophthalmol, 2012;40:93–9.
15. Austeng D, Källen KB, Ewald UW, et al. Incidence of retinopathy of prematurity in infants born before 27 weeks’ gestation în Sweden. Arch Ophthalmol 2009;127:1315–9.
16. Austeng D, Blennow M, Ewald U, et al. Incidence of and risk factors for neonatal morbidity after active perinatal care: extremely preterm infants study in Sweden (EXPRESS). Acta Paediatr 2010;99:978–92.
17. Kanski Jack Kanski Clinical Ophthalmology 2007:606-611.
18. Amer M, Jafri WH, Nizami AM, Shomrani AI, Al-Dabaan AA, Rashid K, Retinopathy of prematurity: are we missing any infant with retinopathy of prematurity? Br J Ophthalmol, 2012 Aug; 96(8):1052-5.
19. Heckmann M. Pathogenesis of retinopathy of prematurity. Ophthalmol, 2008; 105(12):1101-7.
20. Saugstad OD. Oxygen and retinopathy of prematurity. J Perinatol, 2006;26 Suppl 1:S46-50; discussion S63-4.
21. Reynolds JD. The management of retinopathy of prematurity. Paediatr Drugs. 2001; 3:263–72.
22. Pizzarello L, Abiose A, Ffytche T, Duerksen R, Thulasiraj R, Taylor H, Faal H, Rao G, Kocur I, Resnikoff S. VISION 2020: The Right to Sight: a global iniţiative to eliminate avoidable blindness. Arch Ophthalmol, 2004;122(4):615-20.
23. Heckmann M. Pathogenesis of retinopathy of prematurity. Ophthalmologe, 2008; 105(12):1101-7.
24. Harrell SN, Brandon DH. Retinopathy of prematurity: the disease process, classifications, screening, treatment, and outcomes. Neonatal Netw, 2007;26:371–8.
25. Smith LE. IGF-1 and retinopathy of prematurity in the preterm infant. Biol Neonate. 2005; 88(3):237-44.
26. Gilbert C, Fielder A, Gordillo L, Quinn G, Semiglia R, Visintin P et al. Characteristics of infants with severe retinopathy of prematurity în countries with low, moderate, and high levels of development: implications for screening programs. Pediatrics, 2005;115:e518–e525.
27. Ghidul Naţional de Urmărire a Nou-născutului cu Risc, MS, 2011.
28. García-Serrano JL, Ramirez García MC, Piñar-Molina R. Retinopathy of prematurity in multiple births: risk analysis for plus disease. Arch Soc. Esp Oftalmol, 2009; 84:191-8.
29. Riazi-Esfahani M, Alizadeh Y, Karkhaneh R, et al. Retinopathy of Prematurity: Single versus Multiple-Birth Pregnancies. J Ophthalmic Vis Res;2008; 3(1):47–51.
30. Leone TA, Rich W, Finer NN. A survey of delivery room resuscitation practices in the United States. Pediatrics. 2006 Feb; 117(2):e164-75.
31. Leah A. Owen, M. Elizabeth Hartnett. Current Concepts of Oxygen Management in Retinopathy of Prematurity. J Ophthalmic Vis Res. 2014;9(1): 94–100.
32. Brion LP, Bell EF, Raghuveer TS. Vitamin E supplementation for prevention of morbidity and mortality in preterm infants. Cochrane Database Syst Rev 2003:CD003665.
33. Reynolds JD et al. Lack of efficacy of light reduction in preventing retinopathy of prematurity. Light Reduction in Retinopathy of Prematurity (LIGHT-ROP) Cooperative Group. N Engl J Med. 1998;338(22):1572-6
34. http://iomc.ro/uploads/files/Prevenirea%20retinopatiei%20de%20prematuritate.pdf
35. Ghid clinic pentru neonatologie – Urmărirea nou-născutului cu risc pentru sechele neurologice şi de dezvoltare. Asociaţia de Neonatologie din România, 2011.
36. Internaţional Committee for the Classification of Retinopathy of Prematurity. The Internaţional Classification of Retinopathy of Prematurity revisited. Arch Ophthalmol.2005;123:991–9.
37. The Internaţional Classification of Retinopathy of Prematurity, 2005.
38. Lai AKW, Fu ZJ, Lo AC. Stem Cell Therapy for Retinopathy of Prematurity. Anat Physiol, 2013;3:126.
39. Hellström, Ann et al. Retinopathy of prematurity. The Lancet, 2013, 382(9902):1445-57.
40. Vatavu I, Nascutzy C, Ciomartan T, Brezan F, Anca I, Stoicescu S: Retinopatia de prematuritate – rezultatele screeningului pe un lot de 1.783 prematuri în perioada septembrie 2002 – 31 decembrie 2007, Oftalmologia, 2010; LIV:110-8.
41. American Academy of Pediatrics, American Association for Pediatric Ophthalmology and Strabismus, American Academy of Ophthalmology: Screening examination of premature infants for retinopathy of prematurity. Pediatrics, 2006;117(2): 572-6.
42. Reynolds JD, Dobson V, Quinn GE, et al. CRYO-ROP and LIGHT-ROP Cooperative Study Groups Evidence-based screening criteria for retinopathy of prematurity: Natural history data from the CRYO-ROP and LIGHT-ROP studies. Arch Ophthalmol. 2002;120:1470–6.
43. Multicenter trial of cryotherapy for retinopathy of prematurity. Preliminary results. Cryotherapy for Retinopathy of Prematurity Cooperative Group. Arch Ophthalmol. 1988;106(4):471-9.
44. American Academy of Pediatrics, Section on Ophthalmology. American Academy of Ophthalmology. American Association for Pediatric Ophthalmology and Strabismus. Screening examination of premature infants for retinopathy of prematurity. Pediatrics, 2006;117:572–6.
45. Uparkar M et al. Laser photocoagulation (810 nm diode) for threshold retinopathy of prematurity: a prospective randomized pilot study of treatment to ridge and avascular retina versus avascular retina alone. Int Ophthalmol, 2011;31(1):3-8.
46. Mintz-Hittner HA, Kennedy KA, Chuang AZ. Efficacy of Intravitreal Bevacizumab for Stage 3+ Retinopathy of Prematurity. N Engl J Med 2011; 364:603-15.
47. Subhadra Jalali, et al. Serious adverse events and visual outcomes of rescue therapy using adjunct bevacizumab to laser and surgery for retinopathy of prematurity. The Indian Twin Cities Retinopathy of Prematurity Screening database Report number 5. Arch Dis Child Fetal Neonatal Ed 2013;98:4 F327-F33.
Articole din ediţiile anterioare
Screening-ul şi diagnosticul diabetului gestaţional
Diabetul gestaţional se defineşte ca intoleranţa la carbohidraţi apărută sau descoperită în timpul sarcinii. Acesta apare la femeile predispuse să ...
Testarea genetică prenatală neinvazivă prin AND liber fetal - metodă de screening pentru sarcinile cu risc înalt de malformaţii fetale
Domeniul screeningului şi al diagnosticului genetic prenatal neinvaziv pare a fi revoluţionat de introducerea testării ADN-ului fetal liber din sân...
HTLV: a new issue in prenatal screening?
Human T-cell leukemia virus-1 (HTLV-1) is the first infectious agent proven to cause cancer, and research suggests that HTLV-1 may be considered am...
Markeri ultrasonografici indirecţi în diagnosticul spina bifida fără sindroame genetice asociate în trimestrul al II-lea de sarcină
Introducere. Spina bifida este o anomalie fetală non-letală, însă prognosticul, evoluţia şi calitatea vieţii feţilor născuţi cu această malformaţie...