Introduction. The objective of this review is to provide an overview to the family doctor on the management of congenital anomalies of the kidney and urinary tract (CAKUT) in children, in order to guide the pediatric patient with these anomalies to specialized services as soon as possible, significantly contributing to the prevention of the onset of chronic kidney disease in adults. Methodology. We conducted a review of the medical literature that included articles and studies published on this topic (PubMed, Cochrane, BMJ, Elsevier, JAMA Network, The Lancet, New England Journal of Medicine, Springer Nature, Wiley). Conclusions. CAKUT includes a spectrum of malformations that can occur in the kidneys, ureters, bladder and/or urethra. More than half of cases resolve spontaneously by the end of gestation or during the first year of life. In the absence of prenatal diagnosis, cases of CAKUT are largely diagnosed postnatally, typically due to a urinary tract infection, gastrointestinal symptoms, or the detection of an abdominal mass during palpation. Prenatal and postnatal ultrasonographic information is essential for postnatal assessment and management. A subset of infants may benefit from continuous antibiotic prophylaxis. CAKUT is the main cause of end-stage renal disease in childhood, which requires dialysis or transplantation, and contributes significantly to the onset of chronic kidney disease in adults. A multidisciplinary team approach is required for the diagnosis and treatment of these complex disorders.
Optimizarea managementului anomaliilor congenitale renale şi ale tractului urinar la copii – algoritmi eficienţi
Optimizing management of congenital renal and urinary tract anomalies in children – efficient algorithms
First published: 29 martie 2024
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Med.157.1.2024.9452
Abstract
Rezumat
Introducere. Obiectivul acestei revizuiri este de a oferi o imagine de ansamblu medicului de familie asupra managementului anomaliilor congenitale ale rinichiului şi tractului urinar (ACRTU) la copil, pentru a orienta cât mai prompt pacientul pediatric cu aceste anomalii către serviciile specializate, contribuind semnificativ la prevenirea apariţiei bolii renale cronice la adult. Metodologie. Am efectuat o revizuire a literaturii de specialitate medicală care a cuprins articolele şi studii publicate pe această temă (PubMed, Cochrane, BMJ, Elsevier, JAMA Network, The Lancet, New England Journal of Medicine, Springer Nature, Wiley). Concluzii. ACRTU include un spectru de malformaţii care pot apărea la nivelul rinichilor, ureterelor, vezicii urinare şi/sau uretrei. Mai mult de jumătate din cazuri se rezolvă spontan până la sfârşitul gestaţiei sau în timpul primului an de viaţă. În lipsa unui diagnostic prenatal, cazurile de ACRTU sunt diagnosticate în mare parte după naştere, în general pentru o infecţie a tractului urinar, simptome gastrointestinale sau prin decelarea unei mase abdominale la palparea abdomenului. Informaţiile ultrasonografice prenatale şi postnatale sunt esenţiale pentru evaluarea postanatală şi management. Un subgrup de sugari ar putea beneficia de profilaxia continuă cu antibiotice. ACRTU constituie cauza principală a bolii renale în stadiul terminal din copilărie, care necesită dializă ori transplant şi contribuie semnificativ la apariţia bolii renale cronice la adult. Este necesară o abordare într-o echipă multidisciplinară pentru diagnosticul şi tratamentul acestor tulburări complexe.
Obiectivul acestei revizuiri este de a oferi o imagine de ansamblu medicului de familie asupra managementului anomaliilor congenitale ale rinichiului şi tractului urinar la copil, pentru a înţelege şi a orienta cât mai prompt pacientul pediatric cu aceste anomalii către serviciile specializate, contribuind semnificativ la prevenirea apariţiei bolii renale cronice la adult.
Anomaliile congenitale ale rinichilor şi tractului urinar – ACRTU (congenital anomalies of the kidneys and urinary tracts; CAKUT) sunt tulburări embrionare care apar în timpul dezvoltării intrauterine şi care constau într-un spectru de defecte la nivelul rinichilor şi al căilor de evacuare a urinei, ce includ ureterele, vezica urinară şi uretra(1,2).
Hidronefroza antenatală (HAN), definită ca dilatarea renală a pelvisulului şi/sau calicelor, este cea mai frecventă anormalie detectată prenatal ecografic, care apare în 0,5-1% din totalul sarcinilor(3-5). Deşi este postulat în general ca un marker al ACRTU, o tulburare specifică nu a putut fi identificată. Cu toate acestea, este bine cunoscut faptul că rezultatul depinde de etiologia subiacentă. Pe de altă parte, mai mult de jumătate din cazurile de HAN se rezolvă spontan până la sfârşitul gestaţiei sau în timpul primului an de viaţă(5).
Simptomatologia ACRTU
În lipsa unui diagnostic prenatal, restul cazurilor de ACRTU sunt diagnosticate în mare parte după naştere, în general pentru o infecţie a tractului urinar, manifestări gastrointestinale care pot evolua până la deshidratare sau creşterea în volum a abdomenului, cu palparea unei mase abdominale.
-
Simptome urinare: oligurie, incontinenţă, frecvenţă, poliurie şi/sau infecţie a tractului urinar(6).
-
Simptome abdominale: masă abdominală, distensie, durere şi/sau diaree(6).
-
Alte simptome: polidipsie, edem, hipertensiune arterială, vărsături şi deshidratare(6).
Infecţia tractului urinar (ITU)
Infecţia tractului urinar la copii şi adolescenţi poate fi manifestarea clinică precoce a unei anomalii congenitale a rinichilor şi tractului urinar. E. coli este responsabilă pentru 80-90% din episoadele de pielonefrită acută dobândită în comunitate, mai ales la copii(7-11).

ITU în populaţia pediatrică este asociată cu complicaţii pe termen lung, inclusiv hipertensiune arterială, insuficienţă renală, cicatrice renale şi tulburări de creştere(12).
ITU are tendinţa de a fi mai frecventă la fetiţe decât la băieţi, dar băieţii prezintă ITU la o vârstă mai mică decât fetiţele(11).
Golirea incompletă a vezicii urinare facilitează un mediu pentru proliferarea bacteriană, iar refluxul vezico-ureteral (RVU) permite fluxul retrograd al urinei infectate în căile urinare superioare, ducând la pielonefrită şi cicatrice renale ulterioare(11).
Nou-născuţii şi sugarii mai mici de 3 luni pot avea, la debut, simptome vagi şi nespecifice ale bolii care sunt dificil de interpretat, inclusiv eşecul de a se dezvolta, refuzul alimentelor, diaree, iritabilitate, letargie, urină urât mirositoare, hipotermie, febră, icter asimptomatic şi oligurie sau poliurie(7,10).
La sugarii între 3 luni şi 2 ani, febra este simptomul principal şi adesea singurul semn care indică o infecţie(7,10). Febra se asociază cu manifestări nespecifice, cum ar fi: pierderea poftei de mâncare, vărsături, dureri abdominale, deshidratare, creşterea slabă în greutate, care se regăseşte frecvent la această grupă de vârstă; poate fi rar asociată cu semne sau simptome specifice legate de tractul urinar, cum ar fi disuria urinară sau urina urât mirositoare(7).
La copiii mai mari (2-5 ani), pentru că sunt capabili să verbalizeze simptomele, acestea vor fi mai specific identificate în mod obişnuit: durere abdominală, mai ales suprapubiană, febră, frisoane, polachiurie, micţiune imperioasă, urină tulbure, urină urât mirositoare, durere de flanc şi sensibilitate în unghiul costovertebral(7,10).
După vârsta de 5 ani, sunt identificate clasicele simptome ale tractului urinar: disuria, disconfort suprapubian sau pe flanc, incontinenţa urinară, sensibilitatea la palpare în unghiul costovertebral(7) sau simptome mai puţin frecvente, cum ar fi enurezisul secundar la un copil antrenat anterior la toaletă(7,13).
Ghidul NICE nu recomandă examen imagistic la copiii cu vârsta de peste 6 luni aflaţi la primul episod de infecţie de tract urinar necomplicată şi care răspund la tratament în 48 de ore, recomandând ecografia renală şi de tract urinar numai la copiii cu vârsta sub 6 luni, deoarece identificarea anomaliilor de tract urinar ar trebui să se facă în cadrul îngrijirilor prenatale de rutină(14). Spre deosebire de NICE, ghidul AAP recomandă ecografia urinară la toţi copiii cu vârsta cuprinsă între 2 şi 24 de luni cu infecţie urinară febrilă, deşi recunoaşte importanţa ecografiei din îngrijirile prenatale de rutină în identificarea precoce a anomaliilor congenitale renale şi de tract urinar(15).
Infecţiile urinare recurente apar la 30-50% dintre copii, după prima ITU. Dintre acestea, aproximativ 90% apar la trei luni după episodul iniţial(11). Escherichia coli a fost agentul cauzal pentru 71% din ITU la primul episod şi pentru 40% din infecţiile recurente la pacienţii pediatrici(11).
Hipertensiunea arterială este un factor de risc care se dezvoltă în general precoce la pacienţii pediatrici cu boală renală cronică (BRC), având o prevalenţă ridicată în această populaţie. Hipertensiunea arterială a fost definită ca TA sistolică, TA diastolică sau ambele, depăşind percentila 95, unde au fost efectuate măsurători în timpul vizitelor medicale(16).
Deoarece activarea sistemului renină-angiotensină-aldosteron este cel mai important mecanism în HTA la copiii cu ACRTU, terapia de primă linie presupune utilizarea inhibitorilor acestei axe, inclusiv inhibitori ai enzimei de conversie a angiotensinei şi blocanţi ai receptorilor angiotensinei II de tip I, care, de asemenea, promovează un efect antifibrotic. Studii recente au arătat un profil bun de siguranţă pentru utilizare la pacienţii cu boală renală cronică şi, de asemenea, la cei cu rinichi solitar. Hipertensiunea arterială este un factor de risc independent pentru progresia bolii renale şi trebuie gestionată prompt pentru protecţia renală, în special în rândul pacienţilor cu ACRTU, cauza principală a bolii renale cronice în populaţia pediatrică(16).
Recomandările Societăţii Europene de Hipertensiune (ESH) din 2016 au susţinut că ţinta TA la copiii cu BRC ar trebui să fie sub percentila 50 la cei cu proteinurie şi sub 75 la pacienţii fără proteinurie. Recomandările AAP din 2017 au susţinut o ţintă terapeutică mai strictă, sub percentila 50 în ambele cazuri, cu excepţia situaţiei în care apar simptome de hipotensiune arterială(16,17).
Recomandările actuale ale Asociaţiei Americane de Cardiologie consideră măsurarea ambulatorie a valorilor tensiunii arteriale – ABPM (holter) ca standard de aur pentru monitorizarea controlului TA. Justificarea acestor recomandări se bazează pe asocierea mai puternică dintre măsurătorile TA în ambulatoriu şi leziunile în organele-ţintă, în comparaţie cu citirile TA luate în cabinet, observate la copiii cu şi fără BRC în studii observaţionale multiple(16). În plus, măsurarea holter este foarte utilă pentru diagnosticarea hipertensiunii mascate, a hipertensiunii nocturne sau în timpul efortului ori în alte circumstanţe, acest lucru nefiind posibil folosind măsurătorile ocazionale din cabinetele medicale. În ghidul din 2017, AAP recomandă la copiii şi adolescenţii cu insuficienţă renală cronică (IRC) şi antecedente de hipertensiune arterială o evaluare ABPM cel puţin o dată pe an pentru a depista hipertensiunea mascată(17).
HTA asociată cu proteinuria
Proteinuria, pe lângă hipertensiunea arterială, este un alt factor de risc independent important pentru progresia bolii renale, creşterea tensiunii arteriale ducând la creşterea presiunii intraglomerulare, hiperfiltrare şi creşterea excreţiei urinei de proteine. Asociat cu aceasta, principalul mecanism fiziopatologic implicat în hipertensiunea arterială în BRC este activarea sistemului renină-angiotensină-aldosteron (SRAA), cu creşterea angiotensinei II. Acest lucru favorizează, de asemenea, creşterea locală a presiunii intraglomerulare, pe lângă stimularea eliberării locale de citokine şi activarea căilor inflamatorii, agravând hipertrofia glomerulară, scleroza, inflamaţia tubulointerstiţială şi fibroza, provocând leziuni renale suplimentare şi, prin urmare, proteinurie. Prin urmare, controlul hipertensiunii ar trebui evaluat împreună cu proteinuria, iar alegerea de primă linie a agenţilor inhibitori SRAA devine irefutabilă, deoarece aceştia oferă o renoprotecţie superioară, fiind antiproteinurice şi potenţial antifibrotice renale(16).
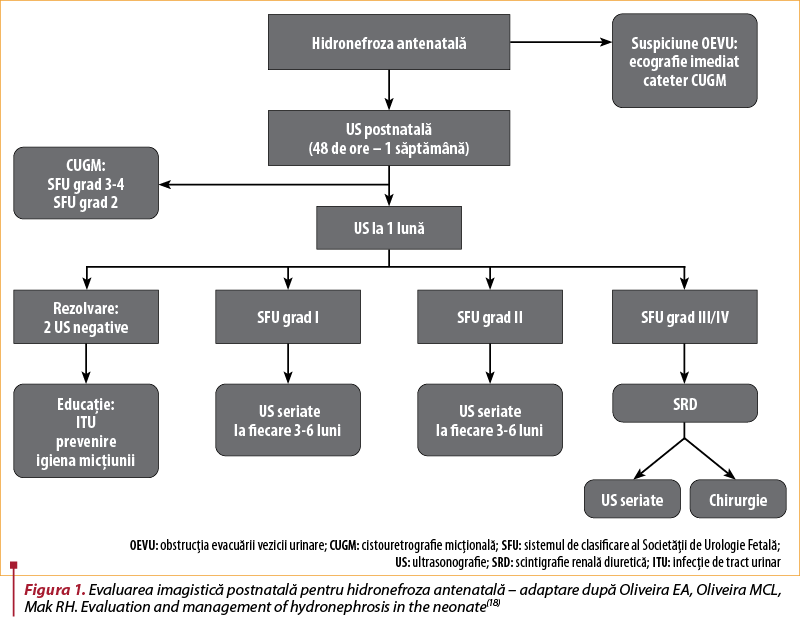
Management
În mod obişnuit, există mai multe modalităţi de imagistică utilizate în evaluarea postnatală a HAN, scopul final al oricărei strategii imagistice fiind de a discerne care dintre pacienţi ar putea beneficia de intervenţie chirurgicală şi care ar putea fi cel mai bine asistaţi prin supraveghere continuă:
-
Ecografia renală(18).
-
Cistouretrografie micţională (voiding cystourethrography; VCUG) – absolut indicată imediat postnatal pentru nou-născuţii cu suspiciune de obstrucţie de evacuare a vezicii urinare, cel mai frecvent prin valve uretrale posterioare, în evaluarea RVU, megauretere, ureterocel şi anomalii de duplicare renală(18).
-
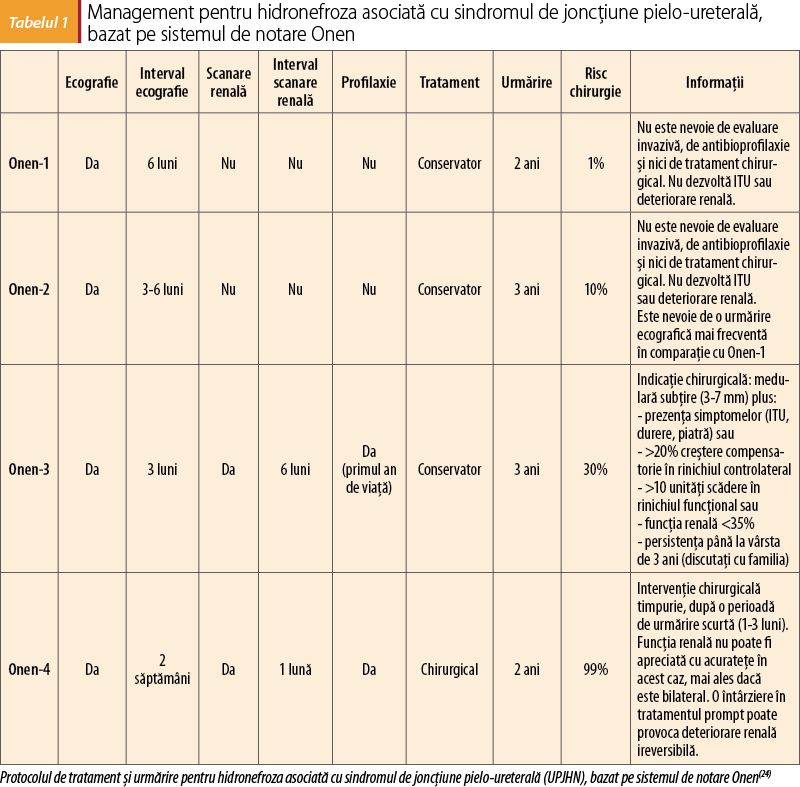
Scintigrafie renală diuretică (diuretic renal scintigraphy; DRS): cea mai frecventă investigaţie utilizată pentru a determina prezenţa obstrucţiei tractului urinar superior la sugarii cu HAN, fără RVU: HAN moderată unilaterală cu hidronefroză postnatală persistentă, HAN severă, hidronefroza postnatală moderată sau severă, hidronefroza cu anomalii ale vezicii urinare sau uretrale ori cu ureter dilatat şi hidronefroza asociată cu oligohidramnios(18). Într-un studiu bine conceput, s-a concluzionat că DRS ar trebui să fie efectuat doar la pacienţii cu APD >30 mm, dilataţie caliceală majoră şi/sau subţierea parenchimului(18,19).
-
Urografie prin rezonanţă magnetică: poate oferi detalii anatomice şi evaluarea funcţiei renale într-o singură investigaţie; ca obstacole, se menţionează costul ridicat şi necesitatea sedării sugarului(18).
-
Hidronefroza antenatală (HAN) este un marker al potenţialelor anomalii renale congenitale, dar de obicei nu poate identifica o anumită boală.
Mesaje-cheie(18):
-
HAN este un marker-surogat al anomaliilor renale potenţial congenitale.
-
HAN uşoară se va rezolva adesea spontan.
-
HAN moderate până la severe sunt frecvent asociate cu ACRTU.
-
Informaţiile ultrasonografice prenatale şi postnatale sunt esenţiale pentru evaluarea postanatală şi management.
-
Este necesară o abordare într-o echipă multidisciplinară pentru diagnosticul şi tratamentul acestor tulburări complexe.
-
Un subgrup de sugari cu HAN ar putea beneficia de profilaxia continuă cu antibiotice; tratamentul non-chirurgical ar trebui luat în considerare ori de câte ori este posibil pentru aceşti sugari.
Antibioprofilaxia
Există o lipsă de consens cu privire la utilizarea antibioprofilaxiei continue (APC) imediat post-partum şi până la prima ecografie efectuată după naştere la sugarii cu dilatare a tractului urinar decelată antepartum(20), episoadele febrile întâlnindu-se la până la 40% dintre copiii cu DTU severă(21).
Sugarii cu scoruri DTU normale/cu risc scăzut au fost mai puţin probabil să primească APC decât cei cu DTU cu risc mediu/înalt (23% versus 77%; P <0,001). Nu a existat nicio diferenţă privind APC în funcţie de sex, asigurări sau statusul de circumcis în cazul băieţilor; vârsta mediană când au dezvoltat ITU a fost de 59 de zile (interval: 2-84); printre cei care au dezvoltat ITU, imagistica iniţială a avut loc semnificativ mai târziu (66 faţă de 28 de zile)(20).
APC a fost oferită în mod convenţional copiilor cu infecţii urinare recurente sau celor cu risc, inclusiv copiilor diagnosticaţi cu HAN, RVU, ureterocel şi alte ACRTU. Nou-născuţii cu HAN au un risc de 12 ori mai mare pentru spitalizare, predominant în primul an de viaţă, iar RVU este prezent la aproximativ 10-15% dintre copiii cu hidronefroză prenatală(10).
Factorii de risc pentru suprainfecţie la cei cu HAN sunt(21):
-
Sexul feminin cu hidroureteronefroză de grad înalt (lungimea relativ mai scurtă a uretrei, asociată cu colonizarea înaltă şi constantă a perineului de către organismele enterice)(10,21).
-
Băieţii necircumcişi cu hidroureteronefroză de grad înalt (prepuţul este un potenţial rezervor de agenţi patogeni bacterieni)(10,21,22).
-
Hidroureteronefroza(10,21).
-
Refluxul vezico-ureteral(10,21), mai ales cel de grad sever(12,22).
-
Obstrucţia joncţiunii ureterovezicale (copiii cu dilatare ureterală >11 mm fără antibioprofilaxie au avut un risc de 5,54 ori mai mare de apariţie a ITU febrile comparativ cu cei menţinuţi pe profilaxie)(22).
-
Lipsa profilaxiei antibiotice continue(21,22).
În cazul hidronefrozei, majoritatea studiilor au arătat un beneficiu minim al antibioprofilaxiei, aceasta având beneficii în contextul HAN cu factori de risc independenţi, cum ar fi RVU de grad înalt, obstrucţia joncţiunii ureterovezicale şi dilatare ureterală(12). În prezent, majoritatea urologilor pediatri preferă antibioprofilaxia, dacă hidronefroza este severă şi asociată cu RVU de grad înalt(12).
Din punctul de vedere al dezvoltării, RVU poate fi clasificat în două tipuri(12):
1. Primar
-
cel mai frecvent tip;
-
apare printr-o joncţiune ureterovezicală (UVJ) defectuoasă.
2. Secundar
-
funcţional (de exemplu, disfuncţie a vezicii urinare sau a intestinului şi vezică neurogenă);
-
anatomic, de tip obstrucţie (de exemplu, valvă uretră posterioară).
RVU este gradat. În funcţie de gradul de dilataţie şi morfologia sistemului colector renal, RVU îi corespund cinci grade, gradul I fiind cel mai uşor (într-un ureter nedilatat) şi gradul V fiind cel mai grav (adică dilatarea grosieră a ureterului, a pelvisului şi a calicelor).
Diagnosticul de RVU se pune prin cistouretrogramă micţională (VCUG), iar managementul depinde de gradul acestuia şi de cauza subiacentă(12).
Dovezile actuale sugerează că APC reduce rata de recurenţă a ITU până când refluxul se rezolvă, dar majoritatea RVU de grad inferior se rezolvă spontan, pe măsură ce copilul creşte(12).
Medicii ar trebui să fie, de asemenea, conştienţi de efectele sugerate dar incerte ale antibioprofilaxiei pe termen lung la copii, astfel încât beneficiile acesteia ar trebui cântărite în raport cu riscul pentru rezistenţă bacteriană crescută (TMP/SMX) şi efectele secundare ale medicaţiei. APC constă în prescrierea zilnică de antibiotice la un sfert până la jumătate din doza terapeutică obişnuită. Nitrofurantoina, TMP/SMX, amoxicilina şi cefalosporinele sunt antibioticele cel mai frecvent utilizate în prevenirea ITU, dar au reacţii adverse la copii (nitrofurantoina – tulburări gastrointestinale şi reacţii cutanate; TMP/SMX mai ales din cauza componentei sulfametoxazol – cel mai frecvent, reacţii cutanate). Expunerea la antibiotice în primul an de viaţă se asociază cu un risc crescut de a dezvolta boli atopice, inclusiv eczeme, wheezing, astm şi alergii mai târziu în viaţă. Mecanismul de bază a fost rezumat în aşa-numita ipoteză a igienei, care sugerează că dezvoltarea într-un mediu din ce în ce mai igienic, cu expunere microbiană redusă, ar putea creşte răspunsurile imune atopice(12).
Rolul antibioprofilaxiei (ABP) în managementul hidronefrozei (HN), RVU şi al ureterocelului este controversat. Scopul principal al ABP este de a preveni ITU în populaţia pediatrică cu risc şi la sugarii diagnosticaţi cu HN, RVU, ureterocel şi alte ACRTU(12). Un anumit beneficiu al ABP a fost demonstrat la pacienţii afectaţi de HN şi RVU de grad înalt(12). În schimb, studiile care au inclus HN uşoară şi RVU de grad redus nu au arătat beneficii prin utilizarea pe termen lung a APC(12). Sunt disponibile date limitate privind utilizarea APC în cazul ureterocelului. În prezent, nu există linii directoare definitive. Studiile clinice actuale nu au fost efectuate în funcţie de sex, starea circumciziei, alegerea antibioticului, gradul RVU şi HN, precum şi prezenţa unor factori de risc independenţi suplimentari. Unele studii au avut putere statistică limitată, iar alte studii au fost vechi, având mai mult de 10 ani. Efectuarea de studii randomizate, placebo-controlate, este probabil esenţială pentru dezvoltarea unor recomandări clare(12).
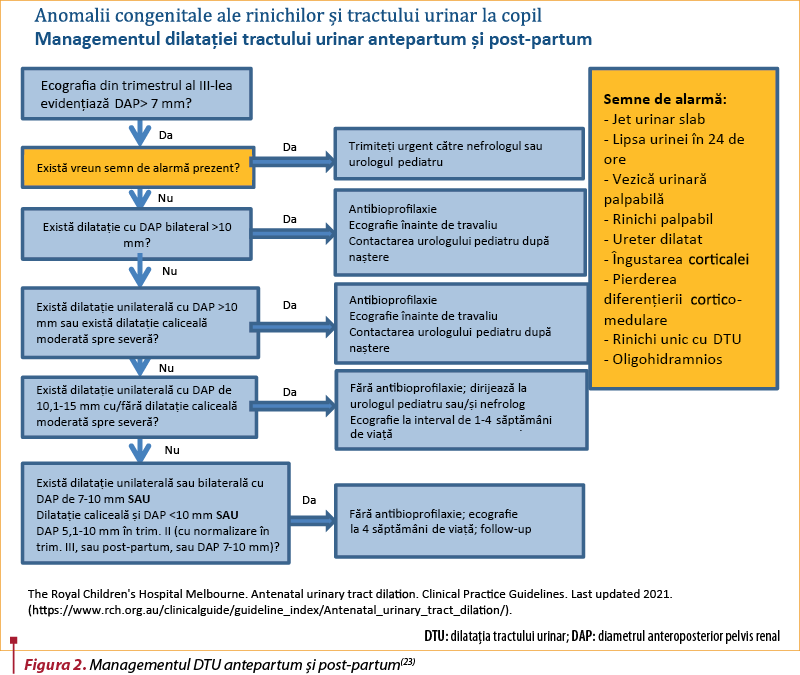
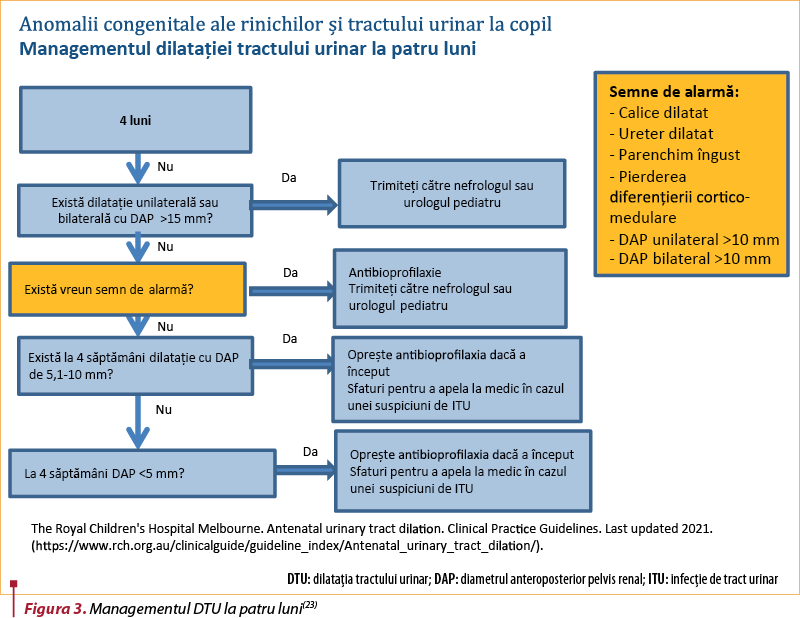
Un algoritm propus pentru managementul dilataţiei tractului urinar atât în îngrijirile prenatale, cât şi post-partum şi care include recomandări pentru antibioprofilaxie este prezentat de către Royal Children’s Hospital Melbourne(23).
Intervenţii antepartum
Deşi majoritatea acestor anomalii nu necesită intervenţie nici înainte, nici postnatal, există un subgrup de pacienţi a căror boală este atât de gravă, încât poate justifica intervenţia înainte de naştere pentru a preveni morbiditatea şi mortalitatea(25):
-
Prezenţa unei obstrucţii moderate a tractului urinar inferior (LTUO) la care vezicocenteza, şuntarea sau cistoscopia sunt opţiuni.
-
Anhidramnios renal din sarcina timpurie (EPRA – early pregnancy renal anhydramnios), la care terapia cu amnioinfuzie poate fi o opţiune. Principalele cauze ale EPRA sunt:
-
agenezia renală bilaterală congenitală (CoBRA)
-
boala chistică renală (CKD)
-
obstrucţie severă a tractului urinar inferior.
-
Netratată, EPRA este universal fatală secundar hipoplaziei pulmonare induse de anhidramnios. Dovezile cu privire la terapia pentru LTUO sunt limitate, iar studiul PLTUO (privind şuntarea percutanată în obstrucţia tractului urinar inferior), oprit timpuriu, nu a putut oferi răspunsuri definitive cu privire la selecţia pacienţilor. Dovezile pentru terapia EPRA sunt, de asemenea, puţine. Amnioinfuziile în serie s-au arătat promiţătoare în cazurile de EPRA datorate CoBRA sau insuficienţei renale, iar această modalitate de tratament formează baza studiului RAFT (Renal Anhidramnios Fetal Therapy), în curs de desfăşurare, finanţat de NIH. În prezent, există un consens că tratamentul pentru EPRA ar trebui să aibă loc numai în cadrul unui studiu clinic(25).
Anhidramniosul renal din sarcina timpurie sau EPRA este o afecţiune în care o femeie însărcinată nu are lichid amniotic în jurul fătului, din cauza unei afecţiuni la nivelul rinchiului fetal. Se crede că această afecţiune este fatală odată ce fătul se naşte, din cauza creşterii pulmonare inadecvate. Trialul privind terapia anhidramniosului renal fetal (RAFT) oferă femeilor însărcinate eligibile cu un diagnostic de EPRA o terapie experimentală de „amnioinfuzii” repetate sau în serie de lichid în uter. O amnioinfuzie presupune introducerea unui mic ac prin pielea gravidei în uter, lângă făt. Lichidul steril cald cu electroliţi echilibraţi şi antibiotice este apoi infuzat lent în spaţiul amniotic din interiorul uterului. Scopul este de a ajuta plămânii fătului să crească suficient pentru a putea supravieţui după naştere. Aceste amnioinfuzii vor fi efectuate de un expert în intervenţii fetale la un centru RAFT. Există un risc semnificativ de ruptură precoce a membranelor şi de naştere precoce la subiecţii care primesc amnioinfuzii şi toţi potenţialii participanţi la studiu vor fi consiliaţi cu privire la aceste riscuri înainte de a decide dacă se alătură studiului. Orice pacientă eligibilă care, după consiliere, alege să întrerupă sarcina nu va fi eligibilă pentru a participa la studiu. Toţi pacienţii eligibili care aleg să se alăture studiului RAFT vor putea să-şi aleagă repartizarea într-una dintre cele două componente ale studiului: (1) să primească amnioinfuzii seriate; (2) să nu primească amnioinfuzii, dar să primească monitorizare pentru restul sarcinii la centrul RAFT. Astfel, repartizarea pacienţilor în loturile de studiu nu va fi aleatorie, ci va fi decisă de participant. Fetuşii care supravieţuiesc după naştere vor necesita un tratament medical intensiv pentru insuficienţa renală, inclusiv plasarea unui cateter de dializă şi terapie de dializă, cu eventuala necesitate a unui transplant de rinichi. De asemenea, poate fi necesar tratamentul pentru boala pulmonară secundară dezvoltării anormale a plămânilor. Studiul va urmări bebeluşii şi familiile acestora până la nonsupravieţuire sau transplant(26).
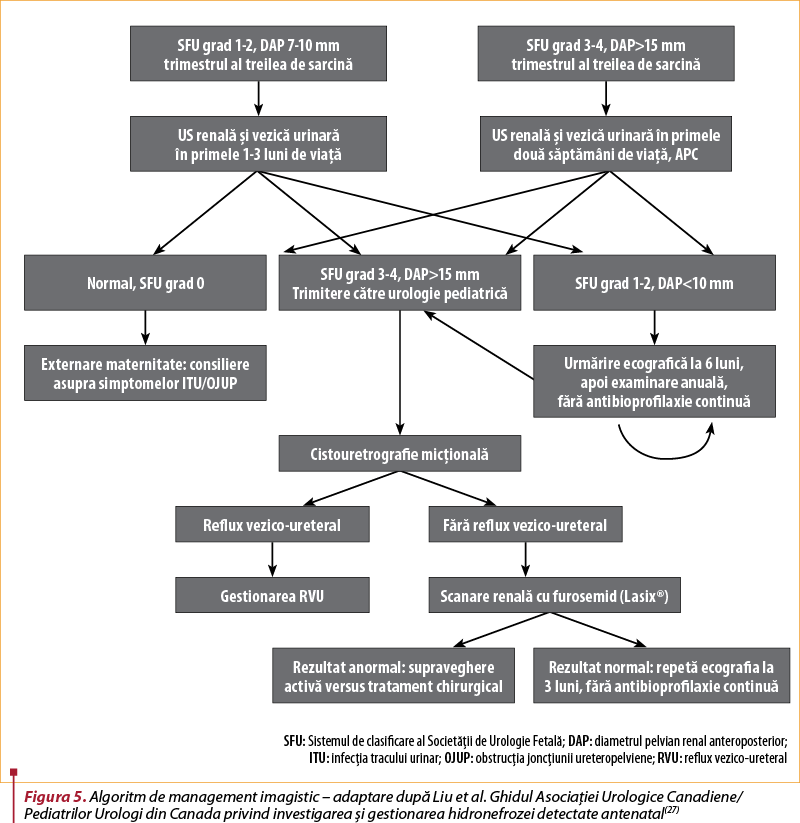
Un algoritm de management imagistic a fost propus de Liu et al. în Ghidul Asociaţiei Urologice Canadiene/Pediatrilor Urologi din Canada privind investigarea şi gestionarea hidronefrozei detectate antenatal(27).
Dilataţia vezicii urinare fetale, sau megacystis, a fost definită pe baza formulei: lungimea vezicii urinare în secţiune sagitală în mm = vârsta gestaţională în săptămâni + 2.
Lee şi colab. au demonstrat că DAP prenatal >15 mm în al treilea trimestru prezice o probabilitate de 88% de patologie postnatală(27).
Educaţia părinţilor(23)
-
Discutaţi şi furnizaţi părinţilor informaţii scrise despre simptomele infecţiei tractului urinar la nou-născut:
-
febră, vărsături, scăderea producţiei de urină şi iritabilitate – necesită screening ITU.
-
-
Luaţi în considerare consultarea cu echipa locală de pediatrie când:
-
orice sarcină în care există DTU prenatală ar trebui să fie evaluată de echipa locală de pediatrie.
-
-
Discutaţi cu nefrologul/urologul pediatru dacă există:
-
flux urinar slab
-
vezică urinară palpabilă
-
rinichi palpabil
-
ureter dilatat
-
corticală subţiată la examenul ecografic
-
diferenţiere corticomedulară anormală la examenul ecografic
-
rinichi solitar, cu dilatarea tractului urinar
-
oligohidramnios, cu dilatarea tractului urinar (indiferent de cauză).
-
Evoluţie şi prognostic
Un studiu de cohortă care a inclus 822 de pacienţi depistaţi antenatal cu ACRTU şi urmăriţi pentru un timp mediu de 43 de luni a avut ca scop identificarea factorilor predictivi asociaţi cu BRC în ACRTU, propunând, de asemenea, şi un scor de risc pentru BRC. Boala renală cronică a apărut la 49 din 822 de copii cu ACRTU detectat prenatal (6%). Cel mai precis model a inclus hidronefroza bilaterală, oligohidramnios, rata de filtrare glomerulară estimată şi diagnosticul postnatal. Precizia scorului a fost de 0,95 [interval de încredere (IC) 95%; 0,89-0,99] şi 0,92 (95% CI; 0,86-0,95) după o urmărire de doi, respectiv 10 ani. Pe baza curbelor de supravieţuire, s-a estimat că; la 10 ani de vârstă, probabilitatea de supravieţuire fără BRC stadiul III a fost de aproximativ 98% şi 58% pentru pacienţii repartizaţi în grupul cu risc scăzut şi, respectiv, cu risc ridicat (p<0,001). Concluziile modelului studiului predictiv pentru BRC pot contribui la o identificare precoce a unui subgrup de pacienţi cu risc crescut pentru insuficienţă renală. Boala renală bilaterală cu oligohidramnios indică o disfuncţie renală fetală globală semnificativă şi este, de asemenea, un factor de risc pentru dezvoltarea hipoplaziei pulmonare(9).
Autor pentru corespondenţă: Iuliana Picioreanu E-mail: ipicioreanu@gmail.com
CONFLICT DE INTERESE: niciunul declarat.
SUPORT FINANCIAR: niciunul declarat.
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
-
Murugapoopathy V, Gupta IR. A Primer on Congenital Anomalies of the Kidneys and Urinary Tracts (CAKUT). Clin J Am Soc Nephrol. 2020;15:723–31.
-
Isert S, Müller D, Thumfart J. Factors Associated With the Development of Chronic Kidney Disease in Children With Congenital Anomalies of the Kidney and Urinary Tract. Front Pediatr. 2020;8:298.
-
Nguyen HT, Benson CB, Bromley B, et al. Multidisciplinary consensus on the classification of prenatal and postnatal urinary tract dilation (UTD classification system). J Pediatr Urol. 2014;10:982–98.
-
Bessa J de, Rodrigues CM, Chammas MC, et al. Diagnostic accuracy of Onen’s Alternative Grading System combined with Doppler evaluation of ureteral jets as an alternative in the diagnosis of obstructive hydronephrosis in children. PeerJ. 2018;6:e4791.
-
Yalçınkaya F, Özçakar ZB. Management of antenatal hydronephrosis. Pediatr Nephrol. 2020;35:2231-9.
-
Melo BF, Aguiar MB, Bouzada MCF, et al. Early risk factors for neonatal mortality in CAKUT, Analysis of 524 affected newborns. Pediatr Nephrol. 2012;27:965–72.
-
Simões E Silva AC, Oliveira EA, Mak RH. Urinary tract infection in pediatrics, An overview. J Pediatr. (Rio J). 2020;96 Suppl 1:65–79.
-
Balighian E, Burke M. Urinary Tract Infections in Children. Pediatr Rev. 2018;39:3–12.
-
Quirino IG, Dias CS, Vasconcelos MA, et al. A predictive model of chronic kidney disease in patients with congenital anomalies of the kidney and urinary tract. Pediatr Nephrol. 2014;29:2357–64.
-
Leung AKC, Wong AHC, Leung AAM, Hon KL. Urinary Tract Infection in Children. Recent Pat Inflamm Allergy Drug Discov. 2019;13:2–18.
-
Visuri S, Jahnukainen T, Taskinen S. Incidence of urinary tract infections in infants with antenatally diagnosed hydronephrosis - A retrospective single center study. J Pediatr Surg. 2017;52:1503–6.
-
Faiz S, Zaveri MP, Perry JC, Schuetz TM, Cancarevic I. Role of Antibiotic Prophylaxis in the Management of Antenatal Hydronephrosis, Vesicoureteral Reflux, and Ureterocele in Infants. Cureus. 2020;12:e9064.
-
Austin PF, Bauer SB, Bower W, et al. The standardization of terminology of lower urinary tract function in children and adolescents, Update report from the Standardization Committee of the International Children’s Continence Society. J Urol. 2014;191:1863-1865.e13.
-
National Institute for Health and Care Excellence. Urinary tract infection in under 16s: diagnosis and management. Clinical guideline. Last updated: 2018. (https://www.nice.org.uk/guidance/cg54/chapter/Recommendations#diagnosis).
-
Roberts KB. Urinary tract infection. Clinical practice guideline for the diagnosis and management of the initial UTI in febrile infants and children 2 to 24 months. Pediatrics. 2011;128:595–610.
-
Gabriele MM, Koch Nogueira PC. Management of Hypertension in CAKUT, Protective Factor for CKD. Front Pediatr. 2019;7:222.
-
Flynn JT, Kaelber DC, Baker-Smith CM, et al. Clinical Practice Guideline for Screening and Management of High Blood Pressure in Children and Adolescents. Pediatrics. 2017;140.
-
Oliveira EA, Oliveira MCL, Mak RH. Evaluation and management of hydronephrosis in the neonate. Curr Opin Pediatr. 2016;28:195–201.
-
Duong HP, Piepsz A, Khelif K, et al. Transverse comparisons between ultrasound and radionuclide parameters in children with presumed antenatally detected pelvi-ureteric junction obstruction. Eur J Nucl Med Mol Imaging. 2015;42:940–6.
-
Varda BK, Finkelstein JB, Wang H-H, Logvinenko T, Nelson CP. The association between continuous antibiotic prophylaxis and UTI from birth until initial postnatal imaging evaluation among newborns with antenatal hydronephrosis. J Pediatr Urol. 2018;14:539.e1-539.e6.
-
Braga LH, Farrokhyar F, D’Cruz J, Pemberton J, Lorenzo AJ. Risk factors for febrile urinary tract infection in children with prenatal hydronephrosis. A prospective study. J Urol. 2015;193:1766–71.
-
Herz D, Merguerian P, McQuiston L. Continuous antibiotic prophylaxis reduces the risk of febrile UTI in children with asymptomatic antenatal hydronephrosis with either ureteral dilation, high-grade vesicoureteral reflux, or ureterovesical junction obstruction. J Pediatr Urol. 2014;10:650–4.
-
The Royal Children’s Hospital Melbourne. Antenatal urinary tract dilation, Clinical Practice Guidelines. Last updated, 2021. (https://www.rch.org.au/clinicalguide/guideline_index/Antenatal_urinary_tract_dilation/).
-
Onen A. Grading of Hydronephrosis, An Ongoing Challenge. Front Pediatr. 2020;8:458.
-
Irfan A, O’Hare E, Jelin E. Fetal interventions for congenital renal anomalies. Transl Pediatr. 2021;10:1506–17.
-
NIH. Renal Anhydramnios Fetal Therapy (RAFT). ClinicalTrials (https://clinicaltrials.gov/ct2/show/NCT03101891).
-
Capolicchio J-P, Braga LH, Szymanski KM. Canadian Urological Association/Pediatric Urologists of Canada guideline on the investigation and management of antenatally detected hydronephrosis. Can Urol Assoc J. 2018;12:85–92.
Articole din ediţiile anterioare
Noutăţi în managementul valvulopatiilor, conform Ghidului ESC 2021
Valvulopatiile sunt afectări tot mai des întâlnite în practica noastră profesională. În ultimii ani există o preocupare deosebită pentru ac...
Infecţia cu SARS-CoV-2 în populaţia pediatrică
Datele de la Centrele pentru Controlul şi Prevenirea Bolilor (CDC) demonstrează o incidenţă mai mică a infecţiei cu SARS-CoV-2 şi a bolilor...
De la ghiduri la practica clinică: recomandări actuale pentru abordarea pacientului cardiac cu patologie chirurgicală noncardiacă
Intervenţiile chirurgicale noncardiace (ICNC) reprezintă aproape 85% din totalul de 300 de milioane de intervenţii chirurgicale care sunt efectuat...
Hemangiomul infantil
Hemangioamele sunt cele mai frecvente tumori vasculare benigne întâlnite la vârsta pediatrică, incidenţa estimată fiind între 1% și 3% la nou-născu...