Polycystic ovary syndrome (PCOS) is a complex disorder that affects both reproductive and metabolic functions. Insulin resistance (IR) and compensatory hyperinsulinemia (HI) are considered major factors in the pathophysiology of PCOS and are involved in the development of hyperandrogenism and reproductive dysfunction. Excess androgens are a distinctive sign of PCOS, which determines many of the phenotypic features. Chronic low-grade inflammation is associated with PCOS characteristics, including insulin resistance and cardiovascular risk factors. Adipose tissue can be considered a proinflammatory organ, involved in the PCOS pathogenesis. Mediators released from immune cells and adipocytes have been identified as being involved in the development of IR. In conclusion, PCOS is a complex disorder with multiple contributing factors, including insulin resistance, hyperinsulinism, hyperandrogenism, and chronic inflammation. Understanding these mechanisms is essential for the development of more effective diagnostic and therapeutic approaches to this multifactorial condition.
Sindromul ovarelor polichistice (SOPC) – rolul inflamaţiei cronice în exprimarea fenotipului dismetabolic
Polycystic ovary syndrome (PCOS) – role of chronic inflammation in the expression of dysmetabolic phenotype
First published: 24 martie 2023
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Med.151.1.2023.7837
Abstract
Rezumat
Sindromul ovarelor polichistice (SOPC) este o tulburare complexă ce afectează atât funcţiile de reproducere, cât şi cele metabolice. Rezistenţa la insulină (IR) şi hiperinsulinemia compensatorie (HI) sunt considerate factori majori în patofiziologia SOPC şi sunt implicate în dezvoltarea hiperandrogenismului şi a disfuncţiei de reproducere. Excesul de androgeni este un semn distinctiv al SOPC, care determină multe dintre caracteristicile fenotipice. Inflamaţia cronică de grad scăzut este asociată cu caracteristicile SOPC, inclusiv rezistenţa la insulină şi factorii de risc cardiovascular. Ţesutul adipos poate fi considerat un organ proinflamator, cu rol important în patogeneza SOPC. Mediatorii eliberaţi din celulele imune şi adipocite au fost identificaţi ca fiind implicaţi în dezvoltarea IR. În concluzie, SOPC este o tulburare complexă cu factori multipli contribuitori, incluzând rezistenţa la insulină, hiperinsulinismul, hiperandrogenismul şi inflamaţia cronică. Înţelegerea acestor mecanisme este esenţială pentru dezvoltarea unor abordări diagnostice şi terapeutice mai eficiente pentru această condiţie multifactorială.
Introducere
Sindromul ovarelor polichistice (SOPC) este o afecţiune ale cărei definiţie şi diagnostic au evoluat de-a lungul timpului, de când Stein şi Leventhal (1935) au făcut descrierea iniţială a triadei: amenoree, ovare polichistice şi hiperandrogenism(1,2,3). SOPC este în prezent recunoscut ca fiind cea mai frecventă tulburare endocrină la femeile de vârstă reproductivă, cu o prevalenţă la nivel mondial variind de la 5% la 20%, în funcţie de criteriile de diagnostic(1,2,3,4,5,6). SOPC reprezintă o patologie eterogenă, caracterizată prin hiperandrogenism, disfuncţie ovulatorie şi modificări ale morfologiei ovarului (prezenţa de chisturi ovariene), însoţite de anomalii metabolice, reprezentate de rezistenţa la insulină (IR) şi obezitate. Până în prezent, patogeneza sindromului ovarelor polichistice nu este încă bine elucidată. Studii recente au arătat că genetica(7), modificările epigenetice(8), factorii de mediu(9), stresul oxidativ(6), inflamaţia cronică de grad scăzut(10), disfuncţia mitocondrială(11) şi tulburările metabolice(12,13) sunt implicate în etiologia SOPC.
Clasic, există patru fenotipuri comune recunoscute de SOPC (figura 1)(14,15): tip A – ovar polichistic (PCO), oligoanovulaţie cronică (OA) şi hiperandrogenism (HA); tip B – OA şi HA; tip C – PCO şi HA; şi tip D – PCO şi OA. Pacientele cu fenotip Rotterdam hiperandrogenic sunt considerate cu risc înalt pentru obezitatea viscerală, insulinorezistenţă şi complicaţii cardiometabolice secundare, comparativ cu alte fenotipuri de SOPC(16). La pacientele cu SOPC şi normoandrogenemie, profilul metabolic este asemănător cu cel al persoanelor sănătoase(16). Clasificarea fenotipurilor SOPC bazată pe criteriile Rotterdam exprimă bine diferenţele dintre pacientele cu SOPC în ceea ce priveşte disfuncţia ovulatorie şi secreţia de androgeni, dar nu face diferenţa între femeile obeze cu alterări metabolice şi pacientele nonobeze cu profil metabolic normal(17).
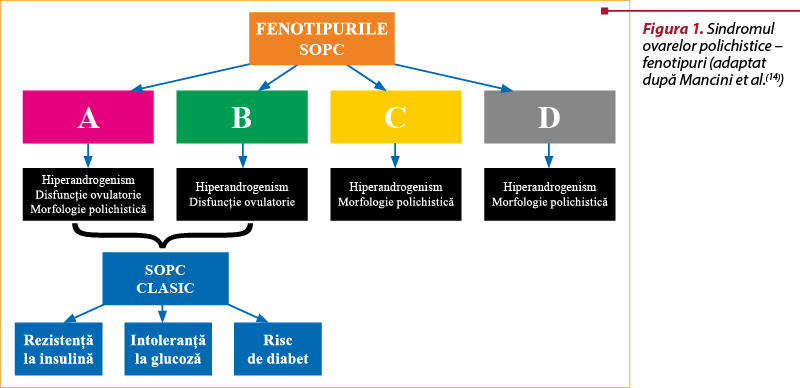
Sindromul ovarelor polichistice este o tulburare predominant endocrină, caracterizată prin tulburări de reproducere şi metabolice. Studii recente au evidenţiat căi metabolice alterate ca mecanism biologic de bază în SOPC(18,19,20). Aceste descoperiri se adaugă la înţelegerea interacţiunii complexe dintre homeostazia metabolică şi funcţia de reproducere umană. Insulinorezistenţa (IR) este prezentă în toate fenotipurile, iar sensibilitatea la insulină variază în funcţie de fenotipul SOPC(14,15,18,19, 20,21). IR este prezentă la 80% din femeile încadrate în fenotipurile cu hiperandrogenemie A şi B, în proporţie de 65% la cele cu fenotip ovulator de tip C şi 38% la femeile cu SOPC nonhiperandrogenemic (tip D)(21,22). Insulinorezistenţa şi hiperinsulinemia (HI) sunt considerate factori majori ai fiziopatologiei SOPC şi sunt implicate în dezvoltarea hiperandrogenemiei şi a disfuncţiei reproductive prin diferite mecanisme(6,14). Excesul de androgeni este un semn distinctiv al SOPC, ce determină multe dintre caracteristicile fenotipice(1,6,17).
Se consideră că, din punct de vedere genetic, sindromul ovarelor polichistice poate fi clasificat în două subtipuri distincte: reproductiv şi dismetabolic. Grupul reproductiv endocrin se caracterizează prin niveluri mai ridicate de hormon luteinizant (LH) şi proteină plasmatică ce leagă hormonii sexuali androgeni şi estradiolul (sex hormon binding protein; SHBG), indice de masă corporală (IMC) şi insulinemie relativ scăzute, în timp ce grupul dismetabolic se caracterizează prin valori crescute ale IMC-ului, glicemiei şi insulinemiei, alături de niveluri serice mai scăzute ale SHBG şi LH(21,22,23).
Insulinorezistenţa şi hiperinsulinemia compensatorie sunt prezente la 65-95% dintre femeile cu SOPC, incluzând marea majoritate a femeilor supraponderale sau obeze şi mai mult de jumătate dintre femeile cu greutate normală(6,21,22,23). În sindromul ovarelor polichistice, IR este independentă şi exacerbată de obezitate(21,22,23). De asemenea, la femeile cu SOPC, IR este mai frecventă la pacientele cu cicluri anovulatorii comparativ cu cele cu cicluri ovulatorii(24).
Pe lângă riscul crescut pentru boli cronice, cum ar fi diabetul zaharat de tip 2, bolile cardiovasculare şi sindromul metabolic(6,25), femeile cu SOPC şi IR au un risc semnificativ crescut de a dezvolta complicaţii pe parcursul sarcinii(26,27). Mai mult, diagnosticul matern de SOPC şi/sau creşterea testosteronului fetal au fost legate de dizabilităţi de dezvoltare, tulburări din spectru autist (ASD) şi tulburare de deficit de atenţie/hiperactivitate (ADHD)(26). De asemenea, s-a arătat că rezistenţa la insulină este un factor de risc independent pentru avortul spontan precoce şi macrosomie la pacientele cu SOPC supuse procedurii de fertilizare in vitro(27).
Relaţia SOPC – inflamaţie cronică insulinorezistentă
Cauza principală a IR în SOPC este în mare măsură necunoscută, iar mecanismul de bază rămâne încă neelucidat(6,16,18). În timp ce etiologia SOPC este un mister, apar dovezi în sprijinul prezenţei inflamaţiei cronice de grad scăzut la femeile diagnosticate cu acest sindrom(6,23,28,29). De asemenea, inflamaţia cronică este asociată cu caracteristici ale SOPC, inclusiv rezistenţa la insulină şi factorii de risc pentru bolile cardiovasculare(28,29) (figura 2).
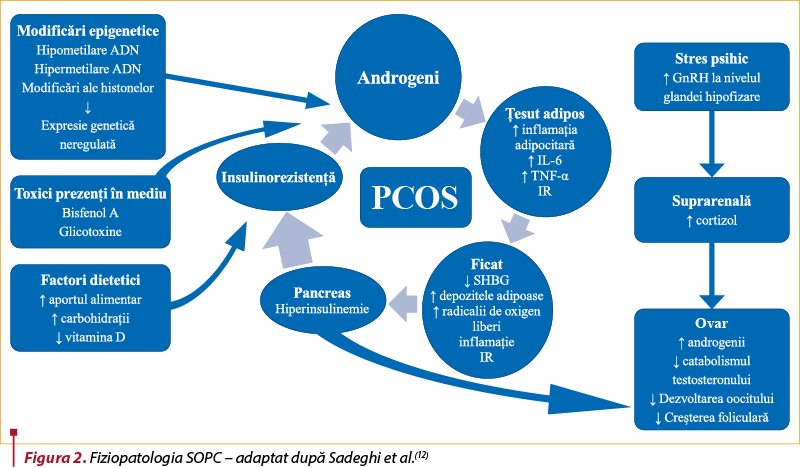
SOPC a fost asociat cu o inflamaţie persistentă de grad scăzut, caracterizată printr-o creştere a numărului de globule albe şi a proteinei C reactive (CRP), niveluri crescute de interleukină 18 (IL-18), interleukină 6 (IL-6), proteină inflamatorie a macrofagelor-1 (MIP-1) şi proteină chemoatractantă a monocitelor-1 (MCP-1)(10). Disfuncţiile metabolice precum hiperinsulinemia, hiperandrogenismul şi obezitatea joacă un rol important în inducerea inflamaţiei(10).
Ţesutul adipos este asimilat cu un organ cu rol proinflamator implicat în patogeneza SOPC(10,30). S-a demonstrat că IR este asociată cu o stare de inflamaţie cronică de grad scăzut. O serie de mediatori eliberaţi din diferite tipuri de celule (inclusiv celule imune şi adipocite) au fost identificaţi ca fiind implicaţi în dezvoltarea IR(31,32,33,34,35). Printre aceştia se numără câteva citokine proinflamatorii, cum ar fi factorul de necroză tumorală alfa (TNF-alfa), IL-1, IL-6 şi diverse adipocitokine(36). Mai mult, factori de transcripţie şi kinaze, cum ar fi kinaza c-Jun N-terminală (JNK) şi inhibitorul kappa B kinazei-beta (IKKbeta), o kinază situată în apropierea factorului nuclear-kappaB (NF-kappaB), participă la acest proces(31,32,33,35).
Citokinele, molecule solubile care sunt implicate în semnalizarea intercelulară, produse de o mare varietate de celule, inclusiv adipocite, sunt implicate în procese biologice ce promovează recrutarea macrofagelor, proliferarea şi migrarea celulelor musculare netede vasculare(35,36). Ele joacă astfel un rol bine cunoscut în dezvoltarea aterosclerozei, a bolii coronariene şi a diabetului zaharat(34,37). SOPC este asociat cu creşterea IL-18, a MCP-1 şi a MIP-1a(38,39). Il-18 este o citokină proinflamatoare ce aparţine superfamiliei IL-1 şi este strâns asociată cu rezistenţa la insulină şi sindromul metabolic, fiind un predictor important al mortalităţii cardiovasculare pe termen lung(38). Concentraţia sa este crescută la pacienţii cu SOPC, indiferent de prezenţa rezistenţei la insulină şi a obezităţii, dar femeile obeze cu hiperinsulinemie au concentraţii evident mai mari de IL-18(38,39). De asemenea, s-a arătat că femeile cu SOPC au o concentraţie crescută de MCP-1(39), factor cu rol major în dezvoltarea aterosclerozei(34). SOPC este, de asemenea, asociat cu o concentraţie crescută a proteinei inflamatorii a macrofagelor 1-a (MIP-1a/CCL3)(24), citokină implicată în recrutarea şi activarea leucocitară(40).
Producţia crescută de factor de necroză tumorală (TNF-a), interleukină 6 proinflamatoare (IL-6) şi de proteină chemoatractantă monocitară-1 (MCP-1), ca răspuns la hiperinsulinemie, poate agrava disfuncţia hormonală în SOPC(41). De asemenea, la persoanele care suferă de SOPC s-a arătat că produşii finali de glicozilare avansată (AGE), cunoscuţi şi sub numele de glicotoxine (implicate în stresul oxidativ şi inflamaţie), se găsesc în concentraţii ridicate(42). Creşterea raportului aldosteron/renină la bolnavii de SOPC induce o stare inflamatorie cronică, având consecinţe la nivel cardiovascular(10,36,41). Mai departe, creşterea concentraţiei aldosteronului induce creşterea inhibitorului activatorului de plasminogen-1 (PAI-1), urmată de scăderea activităţii fibrinolitice şi de creşterea riscului de tromboză(36,41).
Ţesutul adipos conţine adipocite, fibroblaste, macrofage, monocite şi celule stromale(41). Androgenii stimulează diferenţierea preadipocitelor în adipocite şi promovează hipertrofia adipocitară, facilitând dezvoltarea obezităţii de tip visceral(36,39,41). Hipertrofia adipocitelor determină compresia vasului stromal, ducând la hipoperfuzie şi, în final, la hipoxie(36,39,43). Starea de hipoxie stimulează producerea şi eliberarea de factori proinflamatori, cum ar fi: TNF-a, IL1b, IL6, IL10, IL18, factorul de creştere şi transformare b-1 şi interferon gama(41,43.44). Aceştia fac ca macrofagele să migreze în ţesutul adipos, menţinând inflamaţia, împiedicând funcţiile normale ale celulei adipoase şi conducând la necroză celulară(43). Hiperandrogenismul determină activarea celulelor mononucleare şi creşte sensibilitatea acestora la ingestia de glucoză, ducând astfel la persistenţa inflamaţiei(41,44).
La femeile cu SOPC, producţia crescută de androgeni în ţesutul adipos şi acumularea ulterioară de lipide şi ţesut adipos pot duce la IR sistemică şi la afectare organică(45). La nivelul ţesutului adipos apare hiperplazia adipocitelor albe, alături de infiltrarea cu macrofage. Secreţia de adipokine, citokine şi proteine chimioatractante este crescută într-o manieră proinflamatoare, ceea ce duce la o sensibilitate redusă la insulină prin modificarea proteinelor transportatoare de glucoză şi, prin urmare, la scăderea absorbţiei de glucoză. Cinetica acizilor graşi neesterificaţi (sau acizilor graşi liberi) este, de asemenea, modificată, ducând la lipotoxicitate(29). Hiperinsulinismul exacerbează şi mai mult hiperandrogenemia, rezultând un cerc vicios care exacerbează alterările metabolice(10,45). În plus, testosteronul liber observat în SOPC este invers proporţional cu nivelul seric al adiponectinei, o citokină cu greutate moleculară mare, cu structură asemănătoare colagenului, sintetizată de adipocit, cu efecte antiinflamatoare şi de sensibilizare la insulină şi a cărei concentraţie scade odată cu creşterea volumului ţesutului adipos(6,46). Nivelurile scăzute de adiponectină au ca rezultat scăderea activităţii protein-kinazei C (PKC) şi a semnalizării insulinei(46). Adiponectina stimulează, de asemenea, secreţia globulinei hepatice care leagă hormonii sexuali (SHBG), sugerând că efectul androgenilor asupra insulinorezistenţei la nivelul ţesutului adipos poate fi influenţat de SHBG prin nivelurile serice de testosteron liber(39,46). Mai mult, în SOPC, nivelurile de adiponectină sunt scăzute atât la pacientele obeze, cât şi la cele neobeze(24).
Modificări ale altor adipokine, cum ar fi apelina, vaspina, resistina şi chemerina, sunt, de asemenea, observate la femeile cu SOPC(47,48,49). Apelina este o adipokină exprimată în adipocite şi celule ovariene, iar expresia sa este stimulată de insulină. Creşte secreţia de progesteron şi estradiol în celulele granuloasei ca răspuns la stimularea de către factorul de creştere insulin-like 1 (IGF-1)(47). Vaspina, o adipokină exprimată în principal în ţesutul adipos visceral şi în ovar, îmbunătăţeşte steroidogeneza şi proliferarea celulelor granuloasei(47). Rezistina poate fi implicată în patogeneza IR din SOPC, deoarece expresia rezistinei este suprareglată de androgeni. Prin urmare, există o asociere pozitivă între hiperandrogenism şi niveluri ridicate de rezistină la femeile cu SOPC(48). Chemerina este exprimată în celulele ovariene şi joacă un rol important în inflamaţia ţesutului adipos, iar nivelul circulant al acesteia este mult mai mare la pacientele cu sindromul ovarelor polichistice(49). Semnificativ este faptul ca eliberarea markerilor inflamatori este asociată cu complicaţii metabolice pe termen lung şi cu un risc cardiovascular ridicat(32,34).
Hiperandrogenismul duce la funcţii aberante ale ţesutului adipos în SOPC(31,50). Disfuncţia simpatică şi hiperandrogenismul sunt asociate semnificativ cu SOPC(51). Inflamaţia cronică de grad scăzut mediază efectul disfuncţiei simpatice asupra hiperandrogenismului şi rezistenţei la insulină(31,51). În patogenia SOPC, rezistenţa la insulină, hiperandrogenismul, inflamaţia cronică de grad scăzut şi hipertrofia şi disfuncţia ţesutului adipos pot acţiona împreună într-un cerc vicios(31,50,51). Aceste observaţii au nevoie de confirmare în studii mai mari, care evaluează direct prezenţa inflamaţiei în ţesutul adipos al femeilor cu SOPC(31).
Relaţia dintre sindromul ovarelor polichistice şi sindromul metabolic
Sindromul ovarelor polichistice (SOPC) este cea mai frecventă endocrinopatie la femeile de vârstă reproductivă, care afectează diferite funcţii, inclusiv reproducerea şi metabolismul(1,6). Aspectul dismetabolic al SOPC a dobândit recent multă atenţie. Mai multe alterări metabolice, în special IR şi hiperinsulinemia, au fost observate la majoritatea femeilor cu SOPC(52). De asemenea, sindromul ovarelor polichistice este asociat cu o prevalenţă crescută a bolilor cardiovasculare subclinice, precum şi a cancerului endometrial şi ovarian(52). Sindromul metabolic (SM) cuprinde un cluster de disfuncţii endocrino-metabolice, incluzând IR, supraponderalitatea/obezitatea centrală, dislipidemia şi hipertensiunea arterială, cu risc crescut de afectare cardiovasculară(34). Studiile confirmă că SM este mai frecvent în rândul femeilor cu SOPC din cauza prevalenţei mai mari a IR şi a hipertrofiei ţesutului adipos visceral(53,54,55). Prezenţa sindromului metabolic la femeile cu SOPC agravează starea proinflamatorie prezentă, având ca efect creşterea riscului de complicaţii cardiometabolice. Creşterea markerilor inflamatori poate fi un indicator precoce al riscului de a dezvolta rezistenţă la insulină şi ateroscleroză şi poate deveni un instrument de prognostic şi terapeutic util pentru monitorizarea pacientelor cu SOPC(56). Evaluarea concentraţiilor markerilor inflamatori poate deveni un test foarte util în evaluarea riscului de apariţie a aterosclerozei şi a bolilor cardiovasculare cu mult înainte de manifestarea clinică a acestora, pemiţând astfel implementarea unor măsuri profilactice adecvate(34,56).
Sindromul ovarelor polichistice este eterogen, iar factorii responsabili pentru dezvoltarea unui anumit fenotip nu sunt încă bine precizaţi. Cercetările actuale au arătat că interacţiunea variantelor genomice susceptibile şi protectoare sub influenţa factorilor de mediu poate modifica prezentarea clinică prin modificări epigenetice(52).
Concluzii
1. S-au înregistrat progrese semnificative în elucidarea patogeniei sindromului ovarelor polichistice, cu recunoaşterea influenţei puternice a IR asupra apariţiei şi dezvoltării SOPC.
2. Evaluarea sensibilităţii la insulină în stadiile incipiente ale SOPC şi intervenţia eficientă asupra insulinorezistenţei sunt esenţiale pentru a reduce riscul de complicaţii pe termen lung.
3. Schimbarea stilului de viaţă este de elecţie pentru toate femeile cu SOPC.
4. Recentele grupe de medicamente ce cresc sensibilitatea la insulină sunt o alegere promiţătoare şi pentru SOPC.
Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat

Bibliografie
-
Islam H, Masud J, Islam YN, Haque FKM. An update on polycystic ovary syndrome: A review of the current state of knowledge in diagnosis, genetic etiology, and emerging treatment options. Womens Health (Lond). 2022;18:17455057221117966.
-
Lua ACY, How CH, King TFJ. Managing polycystic ovary syndrome in primary care. Singapore Med J. 2018;59(11):567-71.
-
Azziz R. How polycystic ovary syndrome came into its own. F S Sci. 2021;2(1):2-10.
-
Bozdag G, Mumusoglu S, Zengin D, Karabulut E, Yildiz B. The prevalence and phenotypic features of polycystic ovary syndrome: a systematic review and meta-analysis. Hum Reprod (Oxford, England). 2016;31(12):2841-55.
-
Dapas M, Lin F, Nadkarni G, Sisk R, Legro R, Urbanek M, et al. Distinct subtypes of polycystic ovary syndrome with novel genetic associations: an unsupervised, phenotypic clustering analysis. PLoS Med. 2020;17(6): e1003132.
-
Zhao H, Zhang J, Cheng X, Nie X, He B. Insulin resistance in polycystic ovary syndrome across various tissues: an updated review of pathogenesis, evaluation, and treatment. J Ovarian Res. 2023;16(1):9.
-
Yilmaz B, Vellanki P, Ata B, Yildiz B. Diabetes mellitus and insulin resistance in mothers, fathers, sisters, and brothers of women with polycystic ovary syndrome: a systematic review and meta-analysis. Fertil Steril. 2018;110(3):523-33.e14.
-
Liu Y, Qin Y, Wu B, Peng H, Li M, Luo H, et al. DNA methylation in polycystic ovary syndrome: emerging evidence and challenges. Reprod Toxicol (Elmsford, NY). 2022;111:11–9.
-
Merlo E, Silva I, Cardoso R, Graceli J. The obesogen tributyltin induces features of polycystic ovary syndrome (PCOS): a review. J Toxicol Environ Health Part B. 2018;21(3):181–206.
-
Armanini D, Boscaro M, Bordin L, Sabbadin C. Controversies in the Pathogenesis, Diagnosis and Treatment of PCOS: Focus on Insulin Resistance, Inflammation, and Hyperandrogenism. Int J Mol Sci. 2022 Apr 8;23(8):4110.
-
Malamouli M, Levinger I, McAinch A, Trewin A, Rodgers R, Moreno-Asso A. The mitochondrial profile in women with polycystic ovary syndrome: impact of exercise. J Mol Endocrinol. 2022;68(3):R11–23.
-
Sadeghi H, Adeli I, Calina D, Docea A, Mousavi T, Daniali M, et al. Polycystic ovary syndrome: a comprehensive review of pathogenesis, management, and drug repurposing. Int J Mol Sci. 2022;23(2):583.
-
Liu Q, Xie Y, Qu L, Zhang M, Mo Z. Dyslipidemia involvement in the development of polycystic ovary syndrome. Taiwan J Obstet Gynecol. 2019;58(4):447–53.
-
Mancini A, Bruno C, Vergani E, d’Abate C, Giacchi E, Silvestrini A. Oxidative Stress and Low-Grade Inflammation in Polycystic Ovary Syndrome: Controversies and New Insights. International Journal of Molecular Sciences. 2021;22(4):1667.
-
Hoeger KM, Dokras A, Piltonen T. Update on PCOS: Consequences, Challenges, and Guiding Treatment. J Clin Endocrinol Metab. 2021 Mar 8;106(3):e1071-e1083.
-
Krentowska A, Kowalska I. Metabolic syndrome and its components in different phenotypes of polycystic ovary syndrome. Diabetes Metab Res Rev. 2022;38(1):e3464.
-
Carmina E, Lobo RA. Comparing Lean and Obese SOP in Different SOP Phenotypes: Evidence That the Body Weight Is More Important than the Rotterdam Phenotype in Influencing the Metabolic Status. Diagnostics. 2022;12(10):2313.
-
Visser JA. The importance of metabolic dysfunction in polycystic ovary syndrome. Nat Rev Endocrinol. 2021;17(2):77-78.
-
Hiam D, Moreno-Asso A, Teede HJ, Laven JSE, Stepto NK, Moran LJ, Gibson-Helm M. The Genetics of Polycystic Ovary Syndrome: An Overview of Candidate Gene Systematic Reviews and Genome-Wide Association Studies. Journal of Clinical Medicine. 2019;8(10):1606. https://doi.org/10.3390/jcm8101606.
-
Dumesic DA, Padmanabhan V, Chazenbalk GD, Abbott DH. Polycystic ovary syndrome as a plausible evolutionary outcome of metabolic adaptation. Reprod Biol Endocrinol. 2022 Jan 10;20(1):12.
-
Moghetti P, Tosi F, Bonin C, Di Sarra D, Fiers T, Kaufman JM, Giagulli VA, Signori C, Zambotti F, Dall’Alda M, Spiazzi G, Zanolin ME, Bonora E. Divergences in insulin resistance between the different phenotypes of the polycystic ovary syndrome. J Clin Endocrinol Metab. 2013 Apr;98(4):E628-37.
-
Cassar S, Misso M, Hopkins W, Shaw C, Teede H, Stepto N. Insulin resistance in polycystic ovary syndrome: a systematic review and meta-analysis of euglycaemic-hyperinsulinaemic clamp studies. Hum Reprod (Oxford, England). 2016;31(11):2619-31.
-
González F. Inflammation in Polycystic Ovary Syndrome: underpinning of insulin resistance and ovarian dysfunction. Steroids. 2012 Mar 10;77(4):300-5.
-
Bednarz K, Kowalczyk K, Cwynar M, Czapla D, Czarkowski W, Kmita D, Nowak A, Madej P. The Role of Glp-1 Receptor Agonists in Insulin Resistance with Concomitant Obesity Treatment in Polycystic Ovary Syndrome. Int J Mol Sci. 2022 Apr 14;23(8):4334.
-
Coman A, Petrovanu R. Sindromul metabolic în practica de ambulator. Iaşi, România: Editura Pim, 2009.
-
Bell GA, Sundaram R, Mumford SL, Park H, Mills J, Bell EM, Broadney M, Yeung EH. Maternal polycystic ovarian syndrome and early offspring development. Hum Reprod. 2018 Jul 1;33(7):1307-1315.
-
Chen Y, Guo J, Zhang Q, Zhang C. Insulin Resistance is a Risk Factor for Early Miscarriage and Macrosomia in Patients With Polycystic Ovary Syndrome From the First Embryo Transfer Cycle: A Retrospective Cohort Study. Front Endocrinol (Lausanne). 2022 Apr 14;13:853473.
-
Duleba AJ, Dokras A. Is SOPC an inflammatory process? Fertil Steril. 2012 Jan;97(1):7-12.
-
Lemaitre M, Christin-Maitre S, Kerlan V. Polycystic ovary syndrome and adipose tissue. Ann Endocrinol (Paris). 2023:S0003-4266(23)00002-1.
-
Makki K, Froguel P, Wolowczuk I. Adipose tissue in obesity-related inflammation and insulin resistance: cells, cytokines, and chemokines. ISRN Inflamm. 2013;2013:139239.
-
Aboeldalyl S, James C, Seyam E, Ibrahim EM, Shawki HE, Amer S. The Role of Chronic Inflammation in Polycystic Ovarian Syndrome - A Systematic Review and Meta-Analysis. Int J Mol Sci. 2021 Mar 8;22(5):2734.
-
Rudnicka E, Suchta K, Grymowicz M, Calik-Ksepka A, Smolarczyk K, Duszewska AM, Smolarczyk R, Meczekalski B. Chronic Low Grade Inflammation in Pathogenesis of SOPC. Int J Mol Sci. 2021;22(7):378.
-
Zatterale F, Longo M, Naderi J, Raciti GA, Desiderio A, Miele C, Beguinot F. Chronic Adipose Tissue Inflammation Linking Obesity to Insulin Resistance and Type 2 Diabetes. Front Physiol. 2020 Jan 29;10:1607.
-
Popa E, Zugun-Eloae F, Zlei M, Jitaru D, Pintilie O, Coman A, Traian M, Ungureanu D, Carasevici E. Flow Cytometry Analysis of Pparα Receptors in Metabolic Syndrome/Studiul Receptorilor Pparα prin Metoda Citometriei în Flux în Sindromul Metabolic. Revista Română de Medicină de Laborator. 2014;22(4): 427-38.
-
Szukiewicz D, Trojanowski S, Kociszewska A, Szewczyk G. Modulation of the Inflammatory Response in Polycystic Ovary Syndrome (PCOS) - Searching for Epigenetic Factors. International Journal of Molecular Sciences. 2022;23(23):1466.
-
Cao H. Adipocytokines in obesity and metabolic disease. J Endocrinol. 2014 Jan 8;220(2):T47-59.
-
Andreadi A, Muscoli S, Tajmir R, Meloni M, Muscoli C, Ilari S, Mollace V, Della Morte D, Bellia A, Di Daniele N, Tesauro M, Lauro D. Recent Pharmacological Options in Type 2 Diabetes and Synergic Mechanism in Cardiovascular Disease. Int J Mol Sci. 2023 Jan 13;24(2):1646.
-
Rostamtabar M, Esmaeilzadeh S, Tourani M, Rahmani A, Baee M, Shirafkan F, Saleki K, Mirzababayi SS, Ebrahimpour S, Nouri HR. Pathophysiological roles of chronic low-grade inflammation mediators in polycystic ovary syndrome. J Cell Physiol. 2021 Feb;236(2):824-838.
-
Rudnicka E, Kunicki M, Suchta K, Machura P, Grymowicz M, Smolarczyk R. Inflammatory Markers in Women with Polycystic Ovary Syndrome. Biomed Res Int. 2020 Mar 4;2020:4092470.
-
Bhavsar I, Miller CS, Al-Sabbagh M. Macrophage Inflammatory Protein-1 Alpha (MIP-1 alpha)/CCL3: As a Biomarker. General Methods in Biomarker Research and their Applications. 2015 Jun 1:223-49.
-
Chaudhuri A. Polycystic ovary syndrome: Causes, symptoms, pathophysiology and remedies. Obesity Medicine. 2023;39:100240.
-
Garg D, Merhi Z. Relationship between Advanced Glycation End Products and Steroidogenesis in SOPC. Reprod Biol Endocrinol. 2016 Oct 21;14(1):71.
-
Spritzer PM, Lecke SB, Satler F, Morsch DM. Adipose tissue dysfunction, adipokines, and low-grade chronic inflammation in polycystic ovary syndrome. Reproduction. 2015 May;149(5):R219-2.
-
Duan L, An X, Zhang Y, Jin D, Zhao S, Zhou R, Duan Y, Zhang Y, Liu X, Lian F. Gut microbiota as the critical correlation of polycystic ovary syndrome and type 2 diabetes mellitus. Biomed Pharmacother. 2021;142:112094.
-
Paulukinas RD, Mesaros CA, Penning TM. Conversion of Classical and 11-Oxygenated Androgens by Insulin-Induced AKR1C3 in a Model of Human SOPC Adipocytes. Endocrinology. 2022 Jul 1;163(7):bqac068.
-
Brochu-Gaudreau K, Rehfeldt C, Blouin R, Bordignon V, Murphy BD, Palin MF. Adiponectin action from head to toe. Endocrine. 2010 Feb;37(1):11-32.
-
Chen P, Jia R, Liu Y, Cao M, Zhou L, Zhao Z. Progress of Adipokines in the Female Reproductive System: A Focus on Polycystic Ovary Syndrome. Front Endocrinol (Lausanne). 2022 May 26;13:881684.
-
Raeisi T, Rezaie H, Darand M, Taheri A, Garousi N, Razi B, Roever L, Mohseni R, Hussien Mohammed S, Alizadeh S. Circulating resistin and follistatin levels in obese and non-obese women with polycystic ovary syndrome: A systematic review and meta-analysis. PLoS One. 2021;16(3):e0246200.
-
Gao Y, Xin C, Fan H, Sun X, Wang H. Circulating apelin and chemerin levels in patients with polycystic ovary syndrome: A meta-analysis. Front Endocrinol (Lausanne). 2023 Jan 11;13:1076951.
-
Tilg H, Moschen AR. Inflammatory mechanisms in the regulation of insulin resistance. Mol Med. 2008 Mar-Apr;14(3-4):222-3.
-
Shorakae S, Ranasinha S, Abell S, Lambert G, Lambert E, de Courten B, Teede H. Inter-related effects of insulin resistance, hyperandrogenism, sympathetic dysfunction and chronic inflammation in SOPC. Clin Endocrinol (Oxf). 2018 Nov;89(5):628-633.
-
Ilie IR, Georgescu CE. Polycystic Ovary Syndrome - Epigenetic Mechanisms and Aberrant MicroRNA. Adv Clin Chem. 2015;71:25-45.
-
Kassi E, Pervanidou P, Kaltsas G, Chrousos G. Metabolic syndrome: definitions and controversies. BMC Med. 2011 May 5;9:48.
-
Huang PL. A comprehensive definition for metabolic syndrome. Dis Model Mech. 2009 May-Jun;2(5-6):231-7.
-
Moran LJ, Misso ML, Wild RA, Norman RJ. Impaired glucose tolerance, type 2 diabetes and metabolic syndrome in polycystic ovary syndrome: a systematic review and meta-analysis. Hum Reprod Update. 2010 Jul-Aug;16(4):347-63.
-
Marciniak A, Nawrocka Rutkowska J, Brodowska A, Wiśniewska B, Starczewski A. Cardiovascular system diseases in patients with polycystic ovary syndrome – the role of inflammation process in this pathology and possibility of early diagnosis and prevention. Ann Agric Environ Med. 2016;23(4):537-541.
Articole din ediţiile anterioare
Sindromul ovarelor polichistice
Sindromul ovarelor polichistice (SOP) este o afecţiune complexă, frecvent întâlnită în rândul femeilor în perioada reproductivă, care însumeaz...
Managementul riscului cardiovascular în sindromul ovarelor polichistice în practica medicului de familie
Sindromul ovarului polichistic (SOPC) este una dintre cele mai frecvente tulburări hormonale ale femeilor în perioada de reproducere. Semnele și s...