Eficacitatea unguentului GGT (gălbenele-ghimbir-turmeric) în papilomatoza bovină
Efficacy of CGT (calendula-ginger-turmeric) ointment in bovine papillomatosis
Abstract
Bovine papillomavirus (BPV) is a global concern due to its wide distribution and the wide range of benign and malignant diseases it can induce. Papillomas appear with high frequency in cattle, being discovered, in this species, 13 types of papillomavirus to date. It affects all age groups, but the highest incidence is in youth. Papillomas can appear on any region of the body, lesions on the nipples leading to impaired milking and reduced milk yield, with significant effects on production and economics.Keywords
papilomavirusbovineointmentRezumat
Papilomavirusul bovin (BPV) este un motiv de îngrijorare globală, dacă luăm în considerare distribuţia şi gamă largă de boli benigne şi maligne pe care le poate induce. Papiloamele apar cu o frecvenţă ridicată la bovine, până în prezent fiind descoperite, la această specie, 13 tipuri de papilomavirus. BPV afectează toate categoriile de vârstă, dar incidenţa cea mai crescută este la tineret. Papiloamele pot apărea pe orice regiune a corpului, leziunile apărute pe mameloane ducând la afectarea mulsului şi scăderea cantităţii de lapte, cu efecte semnificative asupra producţiei şi a economiei.Cuvinte Cheie
papilomavirusbovinunguentIntroducere
Din punct de vedere clinic, papilomatoza bovină a fost clasificată în şase tipuri specifice(6-8), în funcţie de localizarea papiloamelor, după cum urmează.Tipurile 1 şi 2: la nivelul capului, gâtului, spetelor, vaginal şi penianTipul 3: prezenţa papiloamelor persistente pe piele.Tipul 4: prezenţa papiloamelor la nivelul tractului digestiv superiorTipul 5: tipul „bob de orez”, cu localizare pe cele patru sferturi mamareTipul 6: localizarea la nivelul ugerului, sub forma unor papiloame plate.
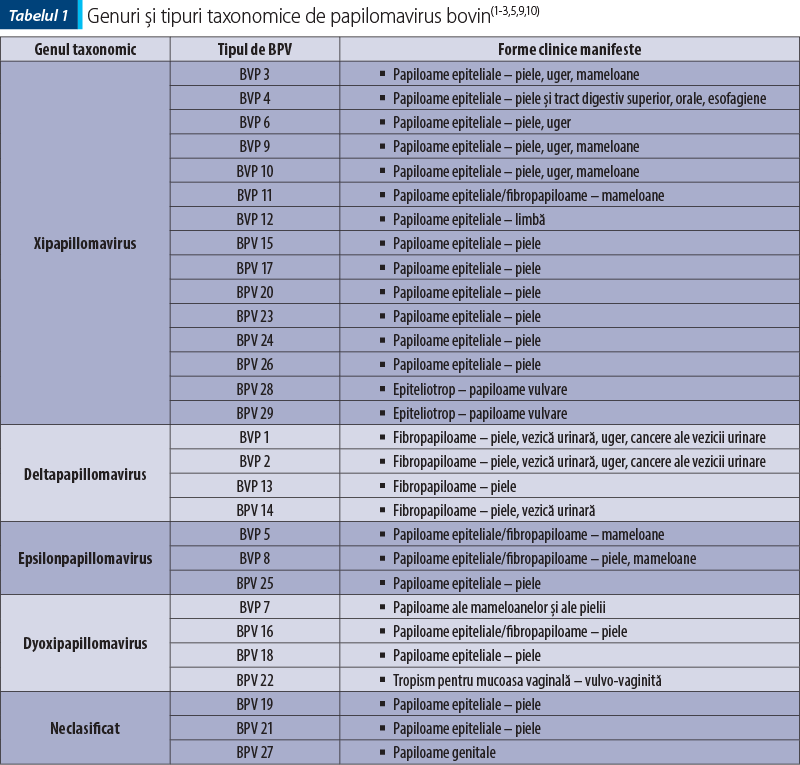
Papiloamele bovinelor au fost reclasificate, fiind încadrate taxonomic în 29 de tipuri de papilomavirus bovin (tabelul 1).
Din punct de vedere clinic, papilomatoza bovină evoluează cronic, cu o dezvoltare lentă, şi se pot deosebi următoarele localizări.
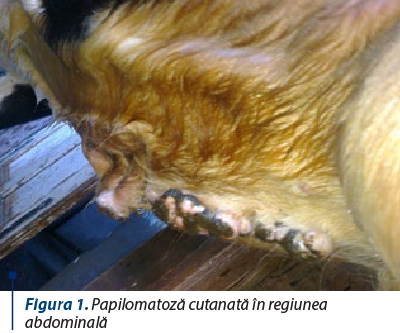
Localizarea cutanată (papilomatoza cutanată), în care papilomatoamele de tip malpighian sunt situate pe toată suprafaţa pielii, dar cel mai frecvent pe cap şi pe gât, apoi în regiunea abdominală, mamară (figura 1), testiculară, pe furou, pe ombilic, pe greabăn şi pe membre.
Tulburările funcţionale sunt dependente de locul apariţiei papiloamelor, de numărul şi de dimensiunile lor. Cele mai importante sunt cele amplasate în zona sferei genitale, deoarece pot da stări de jenă în timpul montei, a ugerului, unde sunt observate dificultăţi în timpul mulsului, şi cele interdigitale, care pot antrena şchiopături de diverse grade.
Localizarea pe mucoase (papilomatoza mucoaselor) se caracterizează prin apariţia unor vegetaţii conopidiforme pe mucoasa faringelui şi a esofagului, şi mai rar pe mucoasa rumenului, foiosului şi pe mucoasa cavităţii bucale.
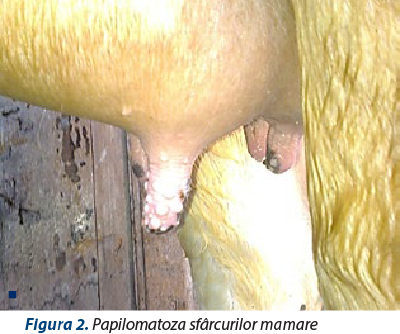
Localizarea mamară (papilomatoza mamară) poate apărea ca atare sau concomitent cu alte localizări şi se caracterizează prin procese neoplazice localizate pe mameloane sau pe pielea intramamelonară, uneori chiar pe canalul galactofor (figura 2). Traumatizarea lor prin muls poate determina o accelerare a evoluţiei sau sângerare.
Localizarea genitală (papilomatoza genitală) la masculi se caracterizează prin prezenţa papiloamelor ca formaţiuni unice sau grupate la extremitatea glandului sau la baza penisului. Se manifestă sub formă de papiloame multinodulare pe glandul penisului taurilor tineri, ca urmare a infecţiei virale a abraziunilor epiteliului prepuţial şi penian, datorate montei. La femele, procesul se localizează mai frecvent pe mucoasa vaginală şi vulvară, sub forma unor proeminenţe conopidiforme(6,11-13).
Leziuni mai puţin întâlnite date de papilomavirus sunt cele ale vezicii urinare. Aceste leziuni nu determină semne clinice, dar pot predispune animalele la apariţia hematuriei(7,14).
Existenţa în România a unui număr tot mai mare de bovine cu diferite forme de papilomatoză, precum şi existenţa relativ limitată a modalităţilor terapeutice (autovaccin, produsele Theranekron®, Nekro Veyxym®
, Biotur). Deşi se crede că majoritatea papiloamelor epiteliale la bovine dispar spontan (RichterP harma) în trei până la şase luni, acest lucru nu este întotdeauna adevărat în cazul papiloamelor de pe mameloane, care pot persista ani întregi. Utilizarea ustensilelor comune în timpul spălării şi uscării ugerului trebuie evitată; ugerele trebuie spălate şi uscate cu prosoape individuale de hârtie înainte de muls, ceea ce nu se întâmplă în majoritatea gospodăriilor, fapt care facilitează răspândirea papilomatozei de la o vacă la alta.
Transmiterea se realizează prin contact direct cu animalele infectate sau indirect, prin diverşi vectori care au luat contact cu animalele bolnave. S-a constat că boala este mult mai frecventă la animalele în stabulaţie decât la cele crescute în sistem extensiv (păşune)(3,10,15).
Papilomatoza bovină are, în general, o evoluţie benignă. Formaţiunile papilomatoase se localizează pe piele şi/sau mucoase. Papiloamele cutanate induse de BPV sunt benigne din punct de vedere histologic şi în general suferă regresie spontană.
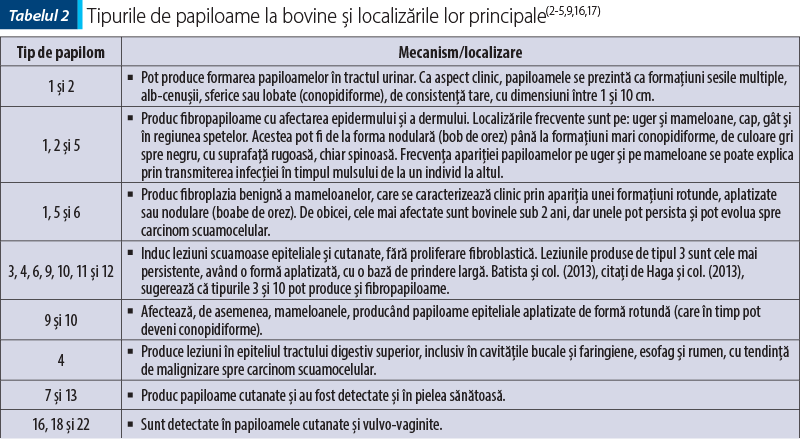
Aşa cum se cunoaşte, la bovine, infecţia produce leziuni distincte în diverse localizări anatomice, care au fost clasificate pe tipuri, prezentate în tabelul 2.
După infecţia şi pătrunderea papilomavirusului în celulele epiteliale, se produc hiperplazia, degenerarea şi hipercheratinizarea celulelor. Modificările apar după 4-6 săptămâni de la infecţie şi persistă între 1 şi 6 luni, după care majoritatea se resorb în mod spontan, datorită unei regresii imunomediate, în 1-14 luni(3,15,18).
BPV, clasificat în genul Deltapapillomavirus, are o caracteristică unică, având capacitatea de a infecta alte specii de animale din familiile Bovidae, Cervidae, Equidae, Felidae şi Girafiidae.
Aceştia sunt capabili să provoace sarcoizi şi la gazde înrudite îndepărtate, cum ar fi caii, catârii, leii africani, pisicile domestice, zebrele de munte, girafele şi antilopele negre. Aceşti sarcoizi sunt de fapt tumori cutanate cu celule fusiforme invazive local, caracterizate histologic prin hiperplazie epidermică şi proliferare subepidermică a celulelor, care sunt similare cu fibroblastele(5).
În acest sens, scopul studiului a fost de a evalua eficacitatea clinică a unguentului cu gălbenele-ghimbir-turmeric, pentru tratamentul papilomatozei bovine cu localizare mamară. Obiectivele punctuale ale studiului au fost: crearea unui mijloc terapeutic uşor de administrat de proprietari şi urmărirea periodică a efectelor acestuia asupra papiloamelor şi asupra pielii adiacente; urmărirea periodică a eventualelor efecte secundare şi urmărirea recurenţei papiloamelor tratate, precum şi urmărirea duratei medii a tratamentelor.
Materiale şi metodă
Unguentul de gălbenele-ghimbir-turmeric (GGT)
Prepararea unguentului s-a realizat în Laboratorul de Farmacie al FMV Timişoara. Ca bază s-a ales un unguent de gălbenelele (Transvital Cosmetics SRL), având în compoziţie petroleatum, extract de C. officinalis flos, linalool, limonen şi betacaroten, de la farmacia naturistă, datorită proprietăţilor sale emoliente. Pentru realizarea unguentului cu gălbenele-ghimbir-turmeric s-a folosit ca bază 250 ml de unguent de gălbenele Transvital, care a fost topit pe baia de apă. După topire s-au încorporat treptat câte 20 ml de extract alcoolic de ghimbir 10%, respectiv turmeric 10%. După omogenizare, unguentul obţinut s-a transferat în recipiente sterile, cu capacitatea de 50 ml, până la utilizare.
Animalele
Studiul clinic a fost efectuat pe 15 din judeţele Timiş şi Arad. Vacile au prezentat forme de papilomatoză cu localizare mamară. Din papiloamele identificate s-au ales 15 formaţiuni, de la 10 vaci, pe care s-a aplicat tratament, şi cinci formaţiuni pentru control de la cinci vaci care nu au fost tratate. Papiloamele au fost măsurate înainte de aplicarea unguentului şi prin palpare s-au determinat consistenţa şi sensibilitatea locală (T0).
După terminarea tratamentului, parametrii urmăriţi au fost: dimensiunea papiloamelor, care a fost evaluată prin intermediul măsurării, consistenţa acestora şi sensibilitatea vacilor la muls. Unguentul a fost aplicat direct pe papiloame de două ori pe zi: prima aplicare dimineaţa la ora 7:00 după muls, iar a doua aplicare, seara la ora 19:00, după muls, timp de 28 de zile.
Lotul experimental a fost format din 10 vaci. Regiunile cu papiloame au interesat mameloanele, rezultând astfel 15 zone în care a fost aplicat unguentul.
Lotul-martor a fost format din cinci vaci care nu au primit tratament, dar papiloamele acestora au fost măsurate conform lotului experimental. Evoluţia dimensiunilor papiloamelor din lotul experimental şi lotul-martor este prezentată în figura 3.

Măsurătorile au fost efectuate cu ajutorul unei rigle, apoi s-a calculat suprafaţa în milimetri pătraţi, T0 fiind prima măsurare înainte de aplicarea unguentului. Următoarele măsurări s-au realizat o dată pe săptămână, dimineaţa. În total s-au realizat patru măsurători, fără T0 (28 de zile de la prima aplicare).
Rezultate şi discuţie
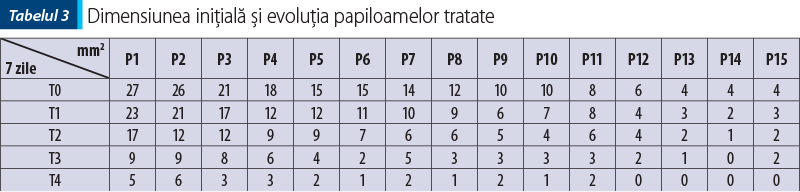
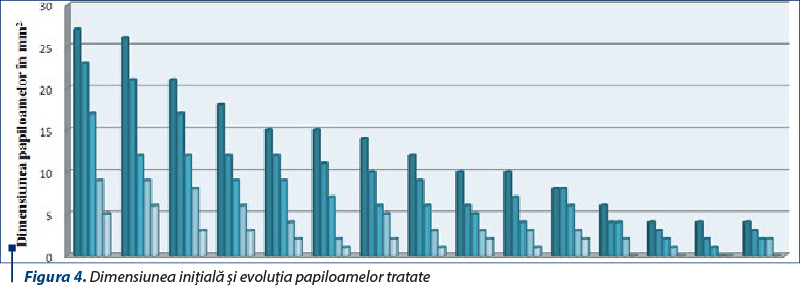
Consistenţa şi sensibilitatea papiloamelor au fost evaluate prin palpare, la fiecare măsurătoare, precum şi din relatările proprietarilor. Evoluţia dimensiunilor papiloamelor din lotul experimental este prezentată în tabelul 3 şi în figura 4.
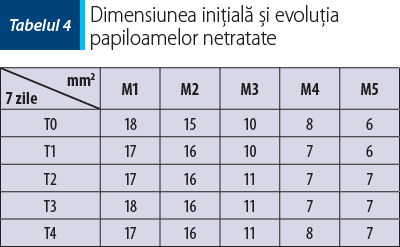
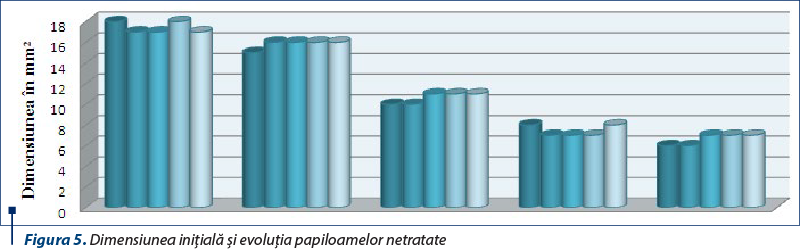
Evoluţia lotului-martor este prezentată în tabelul 4 şi în figura 5.
În tabelul 5 şi în figura 6 sunt prezentate rezultatele analizei statistice asupra evoluţiei papiloamelor tratate.
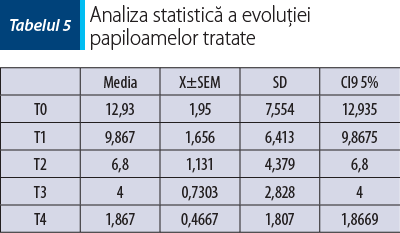
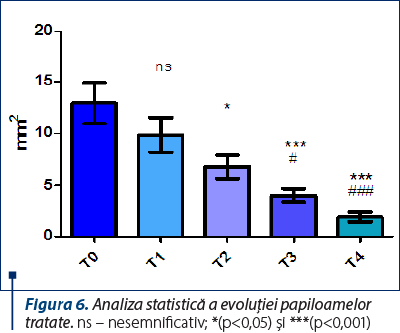
Analizând rezultatele, se observă că nu s-au constatat diferenţe statistice semnificative între T0/T1, T1/T2, T2/T3, T2/T4 şi T3/T4. S-au constatat diferenţe statistice semnificative *(p<0,05) între T0/T2, T1/ T3 şi puternic semnificative ***(p<0,001) între T0/ T3, T0/T4, T1/T4.
Referitor la evoluţia dimensiunii papiloamelor, se poate spune că după şapte zile de tratament nu se observă diferenţe semnificative faţă de dimensiunea iniţială sau faţă de dimensiunea măsurătorilor succesive. Se observă diferenţe semnificative între cele patru măsurători.
Figura 6. Analiza statistică a evoluţiei papiloamelor tratate. ns – nesemnificativ; *(p<0,05) şi ***(p<0,001)
La începutul studiului, consistenţa papiloamelor a fost dură, vacile prezentau sensibilitate la muls, fiind necesară contenţia acestora.
După şapte zile de tratament, consistenţa papiloamelor s-a schimbat foarte puţin, dar vacile au fost mai puţin sensibile.
După 14 zile de aplicare a început să se simtă modificarea consistenţei, ea devenind elastică, iar din relatările proprietarilor, şase dintre cele 15 animale au stat la muls fără a mai fi nevoie să fie legate.
După 21 de zile de aplicare a tratamentului, papiloamele au avut consistenţă elastică şi niciuna dintre vacile luate în studiu nu a mai necesitat contenţie.
La sfârşitul studiului clinic, consistenţa papiloamelor a fost elastică, patru din cele 15 papiloame au dispărut, trei aveau dimensiuni foarte mici şi restul erau în fază de regresie. Animalele nu au mai prezentat sensibilitate la atingere. În cazul celor patru vaci cu regresie totală, nu s-au observat cicatrice sau hiper-/hipopigmentări la locul papilomului. Pe durata tratamentului nu s-au constatat efecte secundare pe suprafaţa de aplicare şi nici pe zonele adiacente.
Prevenirea şi tratarea papiloamelor sunt dificile, deoarece boala este de cele mai multe ori autolimitantă. Pentru tratarea acestora s-au utilizat, dar nu pe scară largă, interferon α bovin şi terapie fotodinamică(3,7,18).
Un mijloc terapeutic des utilizat şi care a înregistrat o oarecare eficienţă a fost autovaccinul din papiloamele triturate şi tratate cu formol, asociat cu stimularea imunităţii cu diverse produse comerciale(13).
De asemenea, vaccinurile cu proteine obţinute din capsida virală au avut potenţial efect doar în cazul când au conţinut mai multe tipuri virale, deoarece nu apare imunitatea încrucişată. Răspunsul la autovaccin al papiloamelor plate este foarte slab. Reducerea chirurgicală a dimensiunilor unui papilom poate stimula regresia generală a papiloamelor, dar poate fi, de asemenea, ineficace dacă se realizează în timpul fazei de creştere a papilomului(3,7,18).
Nehru şi col. în 2017(19) au tratat un caz de papilomatoză mamelonară cu ajutorul autohemoterapiei, prin recoltarea a 20 ml de sânge venos şi readministrarea acestuia în doze de 10 ml subcutanat pe latura gâtului şi 10 ml intramuscular în muşchii glutei.
Administrările s-au făcut o dată pe săptămână, timp de patru săptămâni. Autorii au constatat că după a treia săptămână papiloamele au început să regreseze, iar după şase săptămâni au dispărut de tot, în locul lor rămânând o cicatrice hiperpigmentată(19).
Kale şi col. în 2018(20) au tratat papilomatoza mamelonară cu ajutorul unguentului cu podofilină. Podofilina s-a aplicat o dată la trei zile, timp de 27 de zile. La opt ore după aplicarea medicaţiei, mamelonul a fost spălat cu apă sterilă. Autorii au constatat că papiloamele au început să regreseze şi să se usuce după 27 de zile. Aceluiaşi animal i s-a administrat şi vaccin autolog în ziua 28. Mameloanele s-au recuperat în totalitate(20).
Mathi şi col. în 2016(21) au luat în studiu 66 de vaci cu papilomatoză cu localizare şi tipologie diverse. Lotul experimental a fost format din 60 de vaci, iar cel martor, din şase vaci. Vacile din lotul experimental au fost tratate cu picături de Thuja 200C, 1 ml, administrat sublingual, de două ori pe zi, timp de şapte zile, după care s-a administrat 1 ml o dată pe zi, timp de 23 de zile.
Concomitent s-a utilizat unguentul cu Thuja, administrat local pe papiloame, de două ori pe zi. Alt tip de tratament sau medicaţie nu s-a administrat. Papiloamele au fost reduse în totalitate după 30 de zile şi nu s-a constatat recurenţă pe durata a trei ani de observaţie. În cazul animalelor din lotul-martor nu s-a observat nicio modificare(21).
Archana şi col. în 2019(10) au studiat efectele extractului homeopatic de Thuja (Thuja-30), al litiu‑tiomalatului de stibiu (anthiomaline) şi al autovaccinului asupra papilomatozei la vacile de lapte. Autorii au format trei loturi experimentale şi un lot-martor netratat.
Lotul 1 a fost tratat cu Thuja-30, 10 picături administrate oral de două ori pe zi şi aplicarea topică pe papiloame a aceluiaşi extract, timp de patru săptămâni.
Lotul 2 a fost tratat cu 15 ml de Anthiomaline, administrat intramuscular profund la 48 de ore, în decurs de patru săptămâni; 1 ml de anthiomaline conţine 60 mg litiu‑tiomalat de stibiu.
Lotului 3 i s-a administrat autovaccin 5 ml subcutanat, cu rapel la şapte zile, pe durata a patru săptămâni.
Lotul 1 a avut rezultate bune după finalizarea celor patru săptămâni, în cazul lotului 2 papiloamele s-au redus în proporţie de 75%, iar în cazul lotului 3 nu s-a observat nicio modificare. Diagnosticul se poate pune pe baza examenului clinic, formaţiunile observate fiind caracteristice, rareori fiind necesar diagnosticul de laborator(3,15,18).
Acţiunea combinată a BPV 2 sau BPV 4 cu ingerarea ferigii de câmp se pare că favorizează apariţia tumorilor la nivelul tractului digestiv superior(6). S-a observat că vacile care au consumat ferigă de câmp sunt imunosupresate, fapt care duce la persistenţa şi multiplicarea papilomavirusurilor, iar mutagenii conţinuţi în feriga de câmp pot provoca transformarea neoplazică a papiloamelor în carcinoame de tip scuamos.
Acest potenţial carcinogen a fost atribuit compuşilor glicozidici de iludan din ferigă, care au proprietăţi imunosupresoare şi mutagene, cum ar fi ptaquilozida(5,7,23).
După pătrunderea în organism prin intermediul leziunilor cutanate, virusul infectează cheratinocitele bazale, replicându-şi genomul în straturile granulare şi spinale, rezultând hiperplazia caracteristică papilomatozei(6,7).
Acidul nucleic este integrat în genomul celular, inducând proliferarea de tip tumoral a celulelor epiteliale şi conjunctive. Proliferarea de tip fibroblastic nu va demara imediat după integrarea genomului viral în genomul celulei-gazdă, ci se va declanşa după o perioadă de acalmie, fiind adesea însoţită de cheratinizarea proceselor tumorale.
Printre principalele gene ale BPV, gena E2 are o funcţie importantă în neoplasmele asociate cu BPV, atât la animale, cât şi la oameni, deoarece întreruperea E2 are ca rezultat expresia necontrolată a E6 şi E7, care promovează transformarea celulelor. Prezenţa genelor E1, E2, E3, E4, E5, E6, E7 şi E8 variază în funcţie de gen.
Proteina E1 este considerată proteina primară de replicare virală, în timp ce E2 acţionează ca un transactivator sau amplificator. Proteina E3 nu are încă o funcţie cunoscută. Proteina E4 este responsabilă de maturarea virală şi este asociată cu perturbarea structurii citoscheletului.
Proteina E5 este o proteină importantă în transformarea produsă de BPV, promovează proliferarea celulelor infectate prin activarea receptorului beta al factorului de creştere derivat din trombocite (PDGFRβ), promovând în acelaşi timp „ocolirea” sistemului imunitar prin reglarea în jos a expresiei proteinelor de tip I ale complexului major de histocompatibilitate de pe suprafaţa celulară.
BPV E5 interferează, de asemenea, cu homeostazia celulară prin împiedicarea funcţiilor organitelor citozolice; de exemplu, prin interferarea cu acidificarea complexului Golgi, interferează cu proteostaza şi autofagia.
Proteina E6 promovează perturbarea citoscheletului de actină, crescând motilitatea celulară, induce ruperea ADN-ului şi reglarea descendentă a p53, permiţând proliferarea necontrolată în prezenţa instabilităţii genomice şi a contribuit la dereglarea metabolică, ducând la stres oxidativ.
Proteina E7 promovează transformarea celulelor prin scăderea proteinei retinoblastomului (pRb), dereglarea ciclului celular şi inducerea mitozei.
Gena E8 codifică o mică polipeptidă hidrofobă care contribuie la transformarea celulelor prin asigurarea unei creşteri independente de ancorare(5,25,26).
Papiloamele sunt rezultatul hiperplaziei celulelor bazale fără producţie de antigen viral, iar fibropapiloamele sunt leziuni frecvent întâlnite la vaci, oi şi la rumegătoarele sălbatice(6).
Tumorile conţin în structura lor ţesut epitelial şi ţesut conjunctiv şi pot fi papiloame sau fibropapiloame (diferenţierea se va face pe baza cantităţii de ţesut epitelial şi conjunctiv prezent). Astfel, papiloamele vor conţine puţin ţesut conjunctiv, iar fibropapiloamele sunt în principal alcătuite din ţesut fibros cu foarte puţin ţesut epitelial(6).
Concluzii
În urma aplicării unguentului de gălbenele-ghimbir-turmeric asupra papiloamelor la vaci, putem concluziona următoarele:
După 21 de zile de tratament, consistenţa papiloamelor a fost modificată din dură în elastică, iar sensibilitatea la atingere a dispărut în totalitate.
După 28 de zile de tratament, papiloamele de dimensiuni mici (5 mm) pot dispărea în totalitate. Pe toată durata tratamentului nu s-au observat efecte secundare la locul aplicării şi nici cicatrice sau modificări de culoare după regresia papiloamelor.
Eficacitatea terapeutică a unguentului asupra papiloamelor mamare la bovine a fost demonstrată statistic prin valori semnificative (p<0,05) între T0/T2, T1/T3 şi puternic semnificative (p<0,001) între T0/T3, T0/T4 şi T1/T4.
Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
-
Grindatto A, Ferraro G, Varello K, Crescio MI, Miceli I, Bozzetta E, Goria M, Nappi R. Molecular and histological characterization of bovine papillomavirus in North West Italy. Vet Microbiol. 2015 Oct 22;180(1-2):113-7.
-
Haga T, Dong J, Zhu W, Burk RD. The many unknown aspects of bovine papillomavirus diversity, infection and pathogenesis. Vet J. 2013 Aug;197(2):122-3.
-
Maclachlan JN, Dubori EJ. Fenner`s Veterinary Virology. Fourth Edition, Academic Press, London, UK. 2011.
-
Maeda Y, Shibahara T, Wada Y, Kadota K, Kanno T, Uchida I, Hatama S. An outbreak of teat papillomatosis in cattle caused by bovine papilloma virus (BPV) type 6 and unclassified BPVs. Vet Microbiol. 2007 Apr 15;121(3-4):242-8.
-
Medeiros-Fonseca B, Abreu-Silva AL, Medeiros R, Oliveira PA, Gil da Costa RM. Pteridium spp. and Bovine Papillomavirus: Partners in Cancer. Front Vet Sci. 2021 Nov 2;8:75872.
-
Perianu T. Tratat de boli infecţioase ale animalelor: Viroze şi boli prionice. Vol. II. Universitas. Iaşi. 2012. pp. 574-583.
-
Radostis OM, Gay CC, Hincliff KW, Constable PD. A Textbook of the Diseases of Cattle, Horses, Sheep, Pigs and Goats – 10th Edition. Saunders. UK. 2007. pp. 1421-1423.
-
Tîrziu E, Cumpănăşoiu C, Trif R. Elemente de Virusologie. Editura Waldpress, Timişoara. 2012.
-
Hatama S, Nishida T, Kadota K, Uchida I, Kanno T. Bovine papillomavirus type 9 induces epithelial papillomas on the teat skin of heifers. Vet Microbiol. 2009 May 12;136(3-4):347-51.
-
Rector A, Van Ranst M. Animal papillomaviruses. Virology. 2013 Oct;445(1-2):213-23.
-
Blowey RW, Weaver AD. Color Atlas of Disease and Disorders of Cattle. Third Edition, Mosby, UK. 2011.
-
Monke DR. Rebhun’s Diseases of Dairy Cattle, Diseases Specific to or Common in Dairy Bulls. Elsevier. 2018:508–525. doi:10.1016/B978-0-323-39055-2.00010-3.
-
Moroni P. Rebhun’s Diseases of Dairy Cattle, Diseases of the Teats and Udder. Elsevier. 2018:389–465. doi:10.1016/B978-0-323-39055-2.00008-5.
-
Bolte S, Manolescu N. Oncologie Veterinară. Editura Ceres. Bucureşti. 1991.
-
Jelínek F, Tachezy R. Cutaneous papillomatosis in cattle. J Comp Pathol. 2005 Jan;132(1):70-81.
-
Batista MV, Silva MA, Pontes NE, Reis MC, Corteggio A, Castro RS, Borzacchiello G, Balbino VQ, Freitas AC. Molecular epidemiology of bovine papillomatosis and the identification of a putative new virus type in Brazilian cattle. Vet J. 2013 Aug;197(2):368-73.
-
Kim CH, Kim JE, Song YJ. Antiviral Activities of Quercetin and Isoquercitrin Against Human Herpesviruses. Molecules. 2020 May 20;25(10):2379.
-
Turk N, Zupancic Z, Staresina V, Kovac S, Babic T, Kreszinger M, Curic S, Barbic L, Milas Z. Severe Bovine Papillomatosis: Detection of Bovine Papillomavirus In Tumour Tissue and Efficacy of Treatment Using Autogenous Vaccine and Paraimmunity Inducer. Vet Arhiv. 2005;75(5):391-397.
-
Nehru PA, Sunandhadevi S, Rama T, Muniyappan N. Efficacy Of Auto-Hemotherapy In Bovine Teat Papillomatosis: A Case Report. Adv Anim Vet Sci. 2017;5(8):350-351.
-
Kale M, Saltik HS, Hasircioglu S, Yildirim Y, Yavru S, Mamak N, Atli K. Treatment of Bovine Papillomavirus-Induced Teat Warts In a Cow by Using Podophyllin Magistral Formula and Autologous Vaccine Applications Together. Ind J Anim Res. 2018;53(6):832-836.
-
Mathi PM, Saranya K, Umadevi U, Umakanthan T. An Effective Treatment Regimen for Warts in Cattle. J Vet Sci Anim Husband. 2016;4(2):202.
-
Archana SN, Prasad A, Davis J, Seena TX. Bovine Papillomatosis And its Treatment Under Farm Condition. Int J Curr Microbiol Appl Sci. 2019;8(4):2880-2884
-
Carter GR, Wise DJ. A Concise Review Of Veterinary Virology – www.Ivis.Org (Accesed in 27.11.2021).
-
Llambi F, Green DR. Apoptosis and oncogenesis: give and take in the BCL-2 family. Curr Opin Genet Dev. 2011 Feb;21(1):12-20Lunardi M, Alcindo A, Alejandro R, Fernandes A. Bovine Papillomaviruses — Taxonomy and Genetic Features [Internet]. Current Issues in Molecular Virology - Viral Genetics and Biotechnological Applications. InTech; 2013. http://dx.doi.org/10.5772/56195..


