Genetic testing represents a major asset for discriminating between normal antigenic stimulation of B or T cells and malignant, pathological findings. The main difference between those two situations is the heterogenicity of lymphocyte populations as a result of diverse antigenic stimulation for the first situation, compared to single and identical population (clones) for the second situation. The present paper describes one of the many genetic assays capable of discriminating between normal and malignant, characterized by low time-to-result interval, accuracy, simplicity, and low cost comparing to other tests.
Implementarea unui protocol de tip Real-Time PCR cuplat cu analiza curbei de topire pentru evaluarea clonalităţii populaţiei de limfocite la câine
Implementation of a Real Time PCR protocol coupled with melting curve analysis for evaluating the clonality of the lymphocyte population in dogs
First published: 30 septembrie 2023
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/PV.41.3.2023.8676
Abstract
Rezumat
Testele genetice reprezintă un mijloc important în discriminarea dintre situaţiile fiziologice de stimulare antigenică a populaţiilor de limfocite B sau T şi cele patologice de proliferare malignă. Diferenţa fundamentală între cele două situaţii o reprezintă eterogenitatea populaţiei ca răspuns la stimularea antigenică diversă în prima situaţie, comparativ cu existenţa unei populaţii numeroase şi totodată identice (sub formă de clone) în cea de-a doua. Lucrarea de faţă prezintă una dintre metodele genetice pentru stabilirea acestui aspect, caracterizată prin rapiditate în obţinerea rezultatelor, acurateţe, simplitate şi un cost redus comparativ cu alte abordări.
Introducere
Limfomul canin reprezintă un grup eterogen de cancere, fiind totodată printre cele mai frecvent diagnosticate, cu o prevalenţă în intervalul 7-14%. Există peste 30 de tipuri descrise de limfom canin, cu un comportament extrem de divers, unele beneficiind de o evoluţie rapidă, sub formă acută şi de cele mai multe ori incompatibile cu supravieţuirea, în timp ce altele evoluează lent, cronic(10). Din punctul de vedere al diagnosticului, detecţia unui număr mare de celule tumorale este posibilă utilizând metodele de diagnostic curente, inclusiv examenul citologic şi/sau flowcitometria(6,7,8,11), totuşi caracterizarea unui număr redus de celule implică utilizarea unor tehnici genetice ce prezintă avantajul sensibilităţii net superioare în identificarea reasortării receptorilor pentru antigen(2,8). Testul PARR (PCR for Antigen Receptor Rearrangements) este termenul uzual folosit pentru astfel de tehnici în medicina veterinară, cu menţiunea că nu există o astfel de terminologie în medicina umană(1,2).
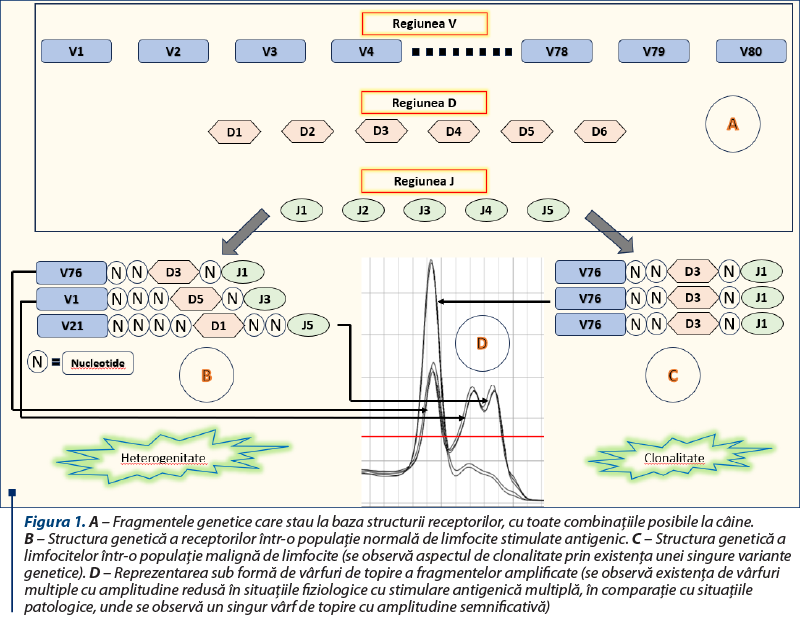
Mecanismul genetic al reasortării receptorilor a fost elucidat în anul 1987 de către cercetătorul japonez Susumu Tonegawa, ulterior recompensat cu Premiul Nobel, şi are la bază fenomene de modelare a receptorilor de pe suprafaţa limfocitelor T sau a imunoglobulinelor produse subsecvent de limfocitele B (plasmocite), astfel încât fiecare receptor să recunoască în mod specific un anumit antigen. Regiunile genetice care codifică situsul de legare antigenică variază la nivelul populaţiei de limfocite mature, atât ca lungime, cât şi ca secvenţă nucleotidică, şi sunt consecinţa recombinării a trei segmente genetic distincte: V, D şi, respectiv, J. Secvenţa genetică pentru fiecare receptor este compusă din una dintre variantele segmentului V (aproximativ 80 de astfel de variante au fost descrise la câine), una dintre variantele segmentului D (în total, şase la câine) şi una dintre variantele segmentului J (cinci pentru câine), între care sunt adăugate un număr variabil de nucleotide suplimentare (figura 1A)(1). Aşadar, unicitatea fiecărui receptor este dată de una dintre combinaţiile posibile dintre cele trei segmente, la care se adaugă un număr variabil de nucleotide, fapt ce face ca fragmentul final să aibă dimensiuni extrem de variabile şi semnificative.
Într-o populaţie normală de limfocite stimulate antigenic, o şuşă de limfocite stimulate pentru acelaşi antigen va avea o structură unică şi total diferită faţă de celelalte (atât ca lungime, cât şi ca secvenţă) (figura 1B), în timp ce, în cazul limfomului, fiind vorba de o singură şuşă, întreaga populaţie de limfocite va avea acelaşi tipar genetic (figura 1C). Aşadar, în cazul amplificării prin tehnica PCR a acestui segment, fragmentele amplificate pentru o situaţie fiziologică vor fi numeroase şi cu dimensiuni diferite, în timp ce, pentru limfom, vom avea un singur fragment amplificat de aceeaşi lungime (figura 1D).
În ceea ce priveşte primerii, cel mai frecvent utilizaţi sunt cei pentru amplificarea lanţului greu imunoglobulinic (IgH) pentru limfocitele B, respectiv receptorii gama ai limfocitelor T (TCRy)(2,3,4,5,9,12,13,14).
Extracţia ADN-ului genomic a fost realizată având ca sursă de material biologic raclatul de pe lamele utilizate pentru examenul citologic, prin aplicarea unui protocol customizat (date disponibile la cerere) şi utilizarea tehnologiei QIAamp (Qiagen, Hilden, Germania), cu eluţia ADN-ului într-un volum final de 150µ l. Toate probele au fost examinate anterior (citologie), confirmând sau infirmând suspiciunea de limfom.
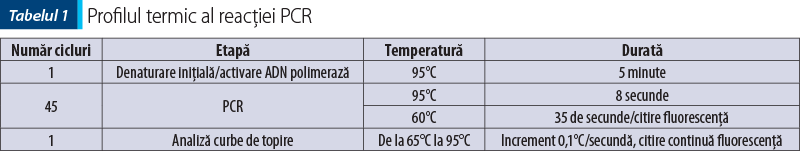
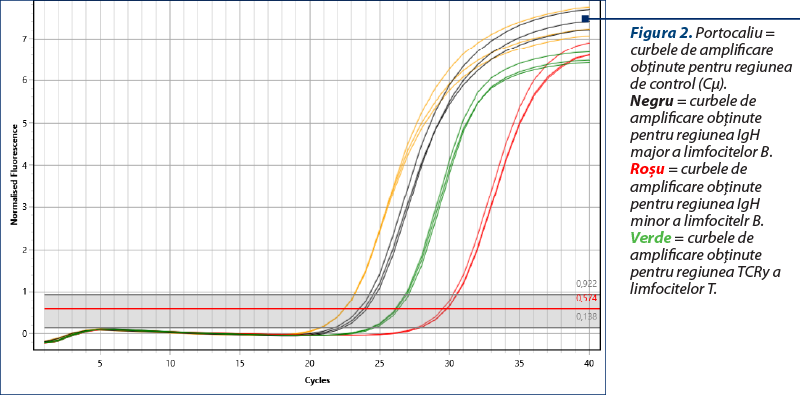
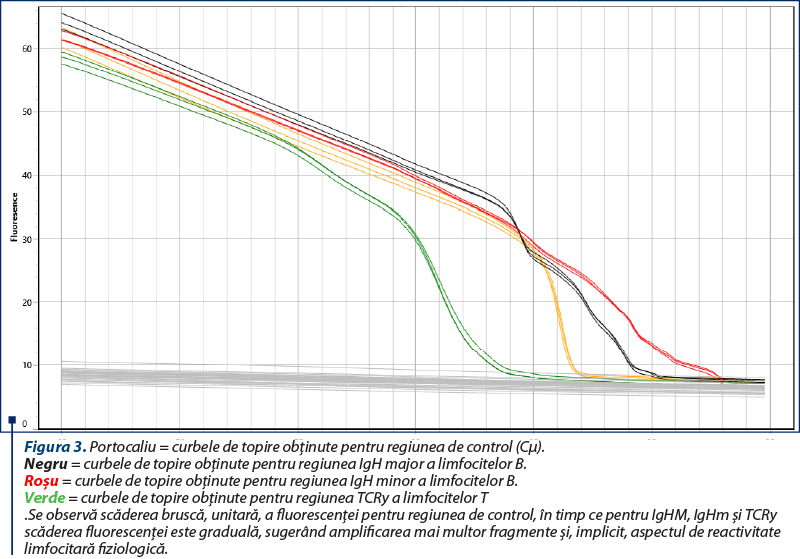
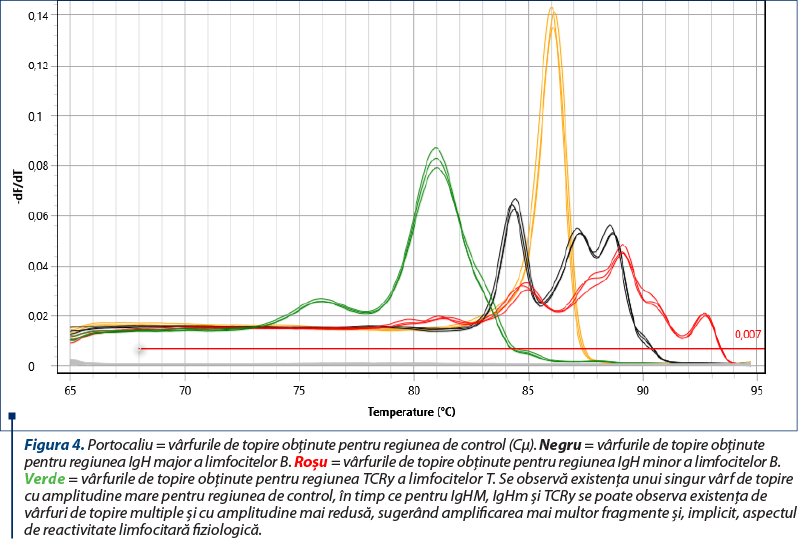
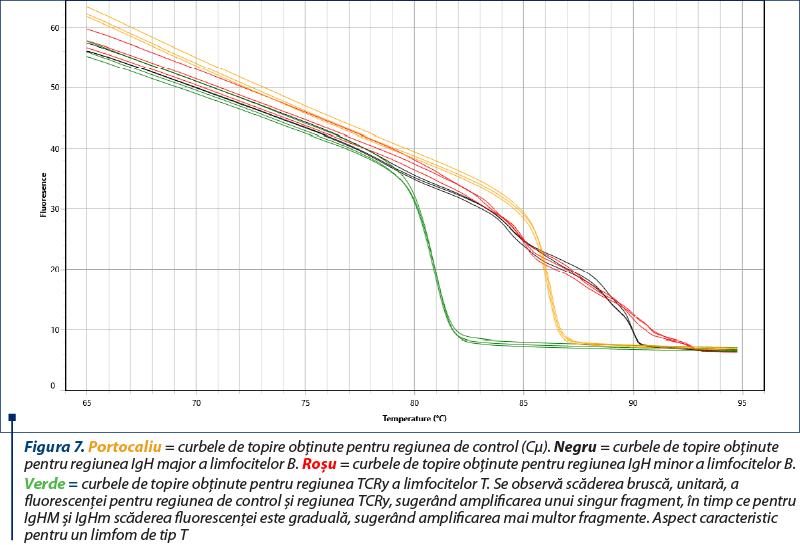
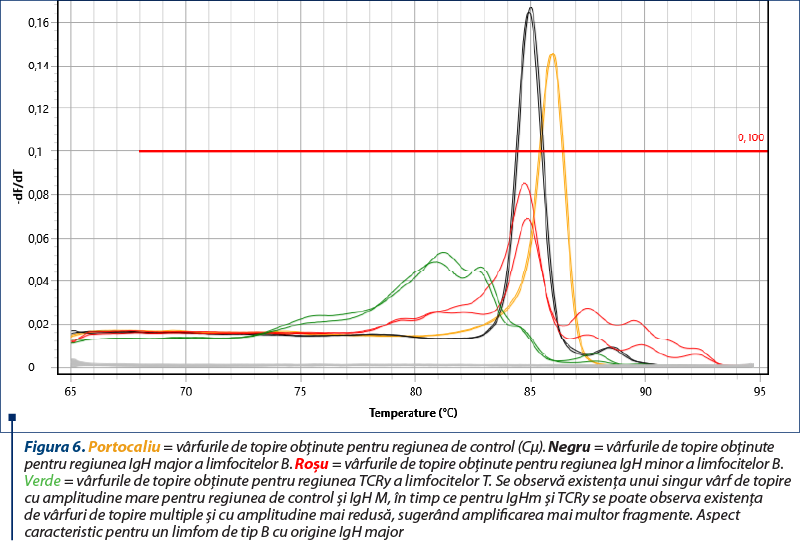
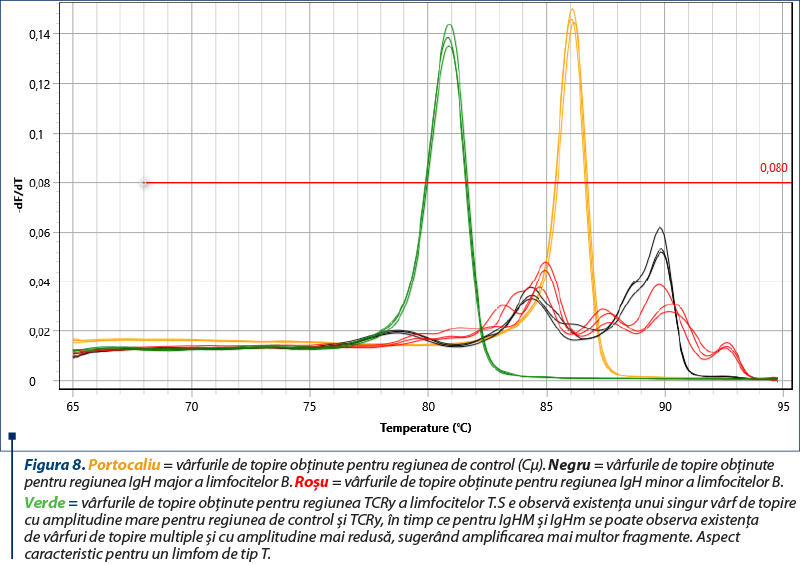
Amplificarea (reacţia PCR) a fost realizată utilizând două seturi de primeri pentru regiunile genetice IgH ale limfocitelor B, un set de primeri pentru regiunea TCRy a limfocitelor T şi o regiune de control (Cµ)(8), cu amplificarea în mai multe replicate pentru a contracara eventualele artefacte (două sau trei replicate pentru fiecare regiune amplificată). Kitul utilizat a fost QuantiFast SYBR PCR Kit (Qiagen, Hilden, Germania), iar ca aparat s-a folosit Q-instrument (QuantaBio, SUA). Profilul termic este prezentat în tabelul 1. Monitorizarea eficienţei şi cineticii reacţiei PCR s-a realizat prin analiza curbelor de amplificare (figura 2). Ulterior, evaluarea clonalităţii a fost realizată prin etapa de topire, cu obţinerea curbelor de topire specifice (figurile 3, 5, 7), respectiv a vârfurilor de topire (figurile 4, 6, 8).

Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
- Anne C. Avery. Molecular Diagnostics of Hematologic Malignancies in Small Animals. Vet Clin Small Anim. 2012;42:97–110.
- Burnett RC, Vernau W, Modiano JF, Olver CS, Moore PF, Avery AC: Diagnosis of canine lymphoid neoplasia using clonal rearrangements of antigen receptor genes. Vet Pathol. 2003;40:32–41.
- Chaubert P, Baur Chaubert AS, Sattler U, Forster U, Bornand V, Suter M, Welle M. Improved polymerase chain reaction-based method to detect early-stage epitheliotropic T-cell lymphoma (mycosis fungoides) in formalin-fixed, paraffin-embedded skin biopsy specimens of the dog. J Vet Diagn Invest. 2010;22:20–29.
- Waugh EM, Gallagher A, Haining H, Johnston PEJ, Marchesi F, Jarrett RF, Morris JS. Optimisation and validation of a PCR for antigen receptor rearrangement (PARR) assay to detect clonality in canine lymphoid malignancies. Vet Immunol Immunopathol. 2016 Dec;182:115–124.
- Gentilini F, Calzolari C, Turba ME, Bettini G, Famigli-Bergamini P. GeneScanning analysis of Ig/TCR gene rearrangements to detect clonality in canine lymphomas. Vet Immunol Immunopathol. 2009;127:47–56.
- Gibson D, Aubert I, Woods JP, Abrams-Ogg A, Kruth S, Wood RD, Bienzle D. Flow cytometric immunophenotype of canine lymph node aspirates. J Vet Intern Med. 2004;18:710–717.
- Greenlee PG, Filippa DA, Quimby FW, Patnaik AK, Calvano SE, Matus RE, Kimmel M, Hurvitz AI, Lieberman PH: Lymphomas in dogs. A morphologic, immunologic, and clinical study. Cancer. 1990;66:480–490.
- Langner FAK, Joetzke EA, Nerschbach V, Eberle N, Schuberth H-J, Koy M, Nolte I, Betz D. Detection of clonal antigen receptor gene rearrangement in dogs with lymphoma by real-time polymerase chain reaction and melting curve analysis. BMC Veterinary Research. 201;10(1):1..
- Keller SM, Moore PF. A novel clonality assay for the assessment of canine T cell proliferations. Vet Immunol Immunopathol. 2012;145:410–419.
- Purdue University, Cancer Research Department, SUA. https://vet.purdue.edu/wcorc/cancer-research/canine-lymphoma-research.php
- Sözmen M, Tasca S, Carli E, De Lorenzi D, Furlanello T, Caldin M. Use of fine needle aspirates and flow cytometry for the diagnosis, classification, and immunophenotyping of canine lymphomas. J Vet Diagn Invest. 2005;17:323–330.
- Tamura K, Yagihara H, Isotani M, Ono K, Washizu T, Bonkobara M. Development of the polymerase chain reaction assay based on the canine genome database for detection of monoclonality in B cell lymphoma. Vet Immunol Immunopathol. 2006;110:163–167.
- Vernau W, Moore PF. An immunophenotypic study of canine leukemias and preliminary assessment of clonality by polymerase chain reaction. Vet Immunol Immunopathol. 1999;69:145–164.
- Yagihara H, Tamura K, Isotani M, Ono K, Washizu T, Bonkobara M. Genomic organization of the T-cell receptor gamma gene and PCR detection of its clonal rearrangement in canine T-cell lymphoma/leukemia. Vet Immunol Immunopathol. 2007;115:375–382.
Articole din ediţiile anterioare
Asocierea BVD cu sindromul PDD la psitacine
Dintre sindroamele diagnosticate la speciile de psitacine PDD (proventricular dilatation disease sau proventricular dilatation syndrome), entitatea...
Performanţele testelor de biologie moleculară în diagnosticul parvovirozei canine
Testele de biologie moleculară reprezintă cronologic cele mai noi și mai moderne tehnici de investigare, inclusiv pentru identificarea și caracteri...
Implementarea unui protocol de tip Real‑Time PCR HRM pentru diagnosticul mielopatiei degenerative la câine
Maladiile cu etiologie genetică la animalele de companie reprezintă un domeniu destul de bine investigat, fiind descrise numeroase afecţiuni cu det...