Chronic spontaneous urticaria (CSU) is the most common form of chronic urticaria, frequently evaluated in allergology and dermatology services, with an increasing incidence, with an evolution usually of several years and often incompletely controlled by treatment, strongly impacting the patient's quality of life. The current therapeutic algorithm recommended by the international urticaria guideline, although useful, is not perfect, given the fact that it is based on a one-size-fits-all approach for all CSU patients: initially, second-generation antihistamines are administered up to the maximum dose, and in the case of insufficient control, omalizumab is added and, in the last step of treatment, ciclosporin. Ideally, the treatment of patients should be individualized based on predictors of response for each type of treatment, to avoid less effective therapeutic options. In recent years, potential clinical and laboratory parameters have been described that could predict treatment response for all three guideline-recommended therapeutic lines in the management of CSU. Low level of total IgE correlated with nonresponse to treatment has the best evidence for the treatment with omalizumab. Further prospective randomized studies are needed to confirm and/or identify other predictors of treatment response.
Actualităţi privind potenţiali markeri de răspuns la tratamentul cu omalizumab în urticaria cronică spontană
Update on prospective markers of treatment response with omalizumab in chronic spontaneous urticaria
First published: 31 mai 2023
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.7.2.2023.8194
Abstract
Rezumat
Urticaria cronică spontană (UCS) este cea mai întâlnită formă de urticarie cronică, frecvent evaluată în serviciile de alergologie şi dermatologie, cu o incidenţă în creştere, cu o evoluţie de obicei de câţiva ani şi adesea incomplet controlată de tratament, afectând puternic calitatea vieţii pacientului. Algoritmul terapeutic actual recomandat de ghidul internaţional de urticarie, deşi util, nu este perfect, dat fiind faptul că se bazează pe o abordare unică pentru toţi pacienţii cu UCS: iniţial se administrează antihistaminice de generaţia a doua până la doza maximală, iar în cazul controlului insuficient se adaugă omalizumab şi, în ultima treaptă de tratament, ciclosporina. În mod ideal, tratamentul pacienţilor ar trebui individualizat pe baza unor predictori de răspuns pentru fiecare tip de tratament, pentru a evita variante terapeutice mai puţin eficiente. În ultimii ani au fost descrişi potenţiali parametri clinici şi de laborator care ar putea prezice răspunsul la tratament pentru toate cele trei linii terapeutice recomandate de ghid în managementul UCS. Cele mai bune evidenţe, pentru tratamentul cu omalizumab, le deţine nivelul scăzut al IgE total corelat cu nonrăspunsul la tratament. Sunt necesare studii suplimentare prospective randomizate pentru a confirma şi/sau pentru a identifica alţi predictori de răspuns la tratament.
Date generale actuale despre urticaria cronică spontană
Urticaria este definită de apariţia papulelor urticariene, a angioedemului sau a ambelor timp de mai mult de şase săptămâni în urticaria cronică sau de cel mult şase săptămâni în urticaria acută(1).
Urticaria cronică (UC) este una dintre afecţiunile cutanate cel mai frecvent evaluate în serviciile de alergologie, cu o incidenţă în creştere. Atât copiii, cât şi adulţii pot suferi de UC, până la 1% din populaţia generală fiind afectată. Durata de evoluţie a bolii este de obicei de câţiva ani (peste un an la 25-75% dintre pacienţi şi peste cinci ani la 10% dintre pacienţi) şi durează adesea mai mult de un an până să fie implementat un management eficient(2). Date recente privind prevalenţa UC arată valori similare în rândul copiilor şi adulţilor şi o variabilitate mare în funcţie de zona geografică. Femeile sunt mai frecvent afectate comparativ cu bărbaţii, dar în rândul populaţiei sub 15 ani nu există o diferenţă de gen(3). Este nevoie de date suplimentare specifice pentru copii şi adolescenţi şi, de asemenea, pentru subtipurile de urticarie cronică.
UC poate fi spontană (UCS) sau inductibilă (UCInd) – urticarie dermografică, urticarie presională întârziată, urticarie la rece, urticarie solară, urticarie la cald, angioedem vibrator, urticarie colinergică, urticarie acvagenică, urticarie de contact. UCS este cea mai frecventă formă de urticarie cronică, dar uneori poate asocia şi o formă inductibilă(1). Recent, mai multe rapoarte au ajutat la caracterizarea mai bună a UCS, sub forma a două endotipuri: UCS autoimună de tip I şi UCS autoimună de tip IIb(3). Astfel, mastocitul, care este celula cu rol central în declanşarea manifestărilor cutanate la pacienţii cu UCS, se pare că poate fi activat şi se poate degranula printr-un mecanism de hipersensibilitate de tip I (IgE împotriva unor autoalergene; de exemplu, tiroidperoxidaza, tiroglobulina, factorul tisular, ADNdc, IL-24 etc.) şi unul de tip IIb (IgG împotriva receptorilor FcεRI şi IgE)(5,6).
Se pare că pacienţii cu UCS autoimună de tip I şi autoimună de tip IIb au caracteristici diferite în ceea ce priveşte evoluţia bolii, markerii de laborator şi răspunsul la tratament(7).
UCS autoimună de tip I a fost asociată cu un titru crescut sau normal al IgE totale, IgE la autoalergene, cu posibilitatea asocierii unor afecţiuni alergice concomitente şi cu o rată de răspuns mare şi rapidă la omalizumab(3).
UCS autoimună de tip IIb ar fi asociată cu un titru scăzut de IgE totale, o activitate mai mare a bolii, posibilă asociere cu alte afecţiuni autoimune, bazopenie, eozinopenie, PCR crescută, ANA pozitiv, cu o rată mai mică de răspuns la antihistaminicele H1 de generaţie 2, o rată de răspuns scăzută la omalizumab, iar terapia cu ciclosporină poate fi eficientă. Pentru diagnosticul UCS autoimune de tip IIb, standardul de aur este reprezentat de tripla pozitivitate a BAT (test de activare a bazofilelor)/BHRA (test de eliberare a histaminei din bazofil), ASST (test cutanat la ser autolog) şi Ac IgG anti-FcεRI/Ac IgG anti-IgE(3,5).
Cu toate acestea, un biomarker de diagnostic pentru UCS încă lipseşte, deoarece majoritatea celor descrişi până acum nu par să aibă suficientă specificitate pentru această afecţiune, iar anumite explorări sunt dificil de efectuat (de exemplu, BAT sau BHRA), fiind rezervate doar centrelor de excelenţă pentru studiul urticariei(1).
Astfel, cel mai recent ghid internaţional de urticarie EAACI/GA²LEN/EuroGuiDerm/APAAACI recomandă ca pacienţilor cu UCS să le fie efectuate ca investigaţii de rutină hemogramă, PCR, VSH, IgE totale şi IgG anti-TPO, iar diagnosticul UCS trebuie să atingă şapte obiective majore: să confirme diagnosticul şi să excludă diagnosticele diferenţiale; să investigheze posibile cauze; să identifice posibili factori de agravare; să verifice posibile comorbidităţi; să identifice consecinţele UCS; să evalueze predictorii privind evoluţia bolii şi răspunsul la tratament; să monitorizeze activitatea, impactul şi controlul bolii(1,8). Însă, în ceea ce priveşte UCInd, nu sunt date suficiente legate de markerii de laborator, un raport recent arătând că atât nivelul IgE totale, cât şi exprimarea receptorilor FcεRI pe bazofile sunt independente de subtipul de UCInd, iar parcursul bolii şi răspunsul la tratament merg pe modelul similar UCS(9).
O încadrare diagnostică corectă şi completă a diferitelor subtipuri de UC este de dorit a fi făcută de la început, pentru a evita investigaţii extensive, tratamente care să nu aducă beneficiu clinic, costuri importante şi, implicit, o calitate a vieţii intens perturbată. UC poate avea un impact puternic asupra calităţii vieţii în ceea ce priveşte sănătatea, în special când UCS este asociată cu angioedem şi/sau UCInd (Indexul calităţii vieţii dermatologice >10 la 30% dintre pacienţi). Pruritul sever şi apariţia imprevizibilă a episoadelor de urticarie şi a angioedemului sunt responsabile pentru tulburările de somn, pentru limitarea activităţilor de zi cu zi la serviciu, a sportului, a vieţii în familie şi în societate, dar şi pentru afectarea performanţelor şcolare şi la locul de muncă (6% absenteism)(2).
Comorbidităţile, cum ar fi anxietatea şi depresia, sunt prezente la mai mult de 30% dintre pacienţii cu UCS(10).
În plus, UC este asociată cu un consum mare de resurse medicale, costuri ridicate de tratament plus alte costuri directe şi indirecte pentru societate. Costurile de tratament au valori anuale cuprinse între 900 şi 2400 USD, dar asocierea cu consumul de resurse medicale şi alte costuri indirecte poate duce costurile totale până la 15550 USD(2,11).
Management terapeutic în UCS
Algoritmul terapeutic actual recomandat pentru urticaria cronică spontană, aprobat de ghidul internaţional de urticarie, presupune creşterea nivelului de tratament cu antihistaminice H1 (AH1) de a doua generaţie, urmată de adăugarea omalizumabului şi apoi a ciclosporinei pentru obţinerea unui răspuns complet la tratament (figura 1).
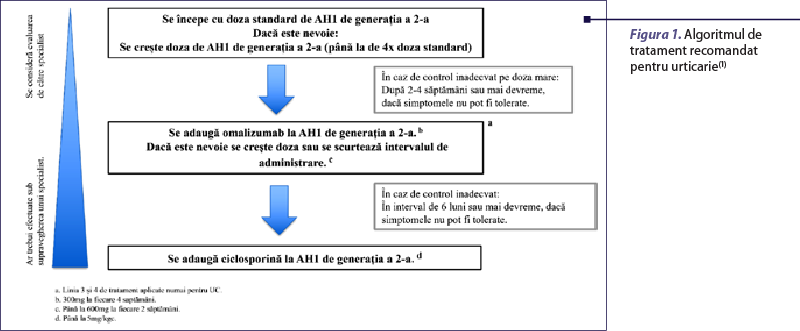
Totuşi, antihistaminicele H1 de a doua generaţie în doză standard, terapia de primă linie conform ghidului pentru managementul urticariei, sunt eficiente la mai puţin de 50% dintre pacienţii cu UCS. Creşterea dozei de AH1 îmbunătăţeşte răspunsul la tratament. Cu toate acestea, fiecare al treilea până la al patrulea pacient va rămâne simptomatic(1,12).
Terapia de linia a doua, reprezentată de omalizumab, anticorp monoclonal anti-IgE, este mai eficientă, având o rată de răspuns complet care variază de la 26% la 83%, aşa cum a fost demonstrat în mai multe studii de referinţă, inclusiv XCUISITE şi ASTERIA(13,14). Pacienţii care nu răspund la omalizumab pot beneficia de următoarea linie de tratament, reprezentată de ciclosporină(15).
Algoritmul actual de tratament recomandat de ghid, deşi util, nu este perfect, dat fiind că se bazează pe o abordare unică pentru toţi pacienţii cu UCS – de încercare – şi în cazul unui eşec terapeutic se trece la următoarea linie. În mod ideal, tratamentul pacienţilor ar trebui să fie individualizat şi să ia în considerare probabilitatea ca pacienţii să răspundă la terapie, pe baza unor biomarkeri predictori de răspuns.
În mod clar, răspunsul la tratament variază între subgrupurile de pacienţi cu UCS. Chiar şi în aceste subgrupuri de CSU, răspunsurile diferă între indivizi.
Astfel, prin alegerea unei opţiuni de tratament adaptate caracteristicilor clinice sau biochimice ale pacientului, ar putea fi evitate tratamentele care ar fi probabil mai puţin eficiente. Utilizarea unor predictori de răspuns la tratament, în practica clinică, va îmbunătăţi gestionarea UCS, economisind atât timp, cât şi costuri.
Potenţiali biomarkeri privind răspunsul/nonrăspunsul la tratamentul cu omalizumab în UCS
În ultimii ani au fost descrişi markeri specifici, incluzând parametri clinici şi de laborator pentru UCS, care ar putea prezice răspunsul/nonrăspunsul la tratament pentru toate cele trei linii terapeutice recomandate de ghid în managementul UCS(12).
Pentru tratamentul cu omalizumab, se pare că cele mai multe date pentru care există evidenţe sunt legate de nonrăspunsul terapeutic. Numeroase studii susţin că nivelul scăzut de IgE totale ar fi un predictor al nonrăspunsului sau al răspunsului slab la omalizumab. Într-un studiu realizat de Straesser şi colab., nivelurile serice de IgE ale pacienţilor cu UCS au fost analizate şi s-a constatat că un nivel al IgE totale de peste 168 UI/ml a fost corelat cu un răspuns bun la omalizumab, iar nivelul IgE totale sub 15,2 UI/ml a fost corelat cu un răspuns slab la omalizumab(16). Un alt studiu a constatat că nivelurile iniţiale scăzute de IgE totale sunt asociate cu nonrăspunsul la omalizumab, iar nivelul-limită pentru nonresponderi a fost stabilit la 42 kUA/L(17). Rezultate similare au fost observate şi în alte studii, care au demonstrat că nivelurile de IgE au fost semnificativ mai scăzute la grupul nonresponderilor comparativ cu responderii parţial sau complet(18,19). În plus, creşterile nivelurilor de IgE totale de două ori sau mai mult, în primele patru săptămâni de tratament cu omalizumab, sporesc probabilitatea de răspuns terapeutic. Nivelurile iniţiale de IgE totale peste 43 UI/ml şi nivelurile de IgE totale crescute de două ori sau mai mult în săptămâna 4 de tratament au fost corelate cu îmbunătăţirea UCS în săptămâna 12 de tratament, răspuns evaluat pe baza UAS(18). Weller şi colab. a constatat că nivelurile crescute ale IgE totale au fost frecvente la responderii complet (77,5%) şi rar detectate la nonresponderi (20%) la omalizumab(20). Mai recent, Asero a confirmat că majoritatea responderilor timpurii la omalizumab au IgE totale de bază crescute (>100 UI/ ml)(12,21).
Omalizumab este un anticorp monoclonal anti-IgE care inhibă legarea IgE de receptorul FcεRI de pe suprafaţa mastocitelor şi a bazofilelor, ducând la o reducere a receptorilor FcεRI de pe bazofile la pacienţii cu UCS. Prin urmare, se poate postula că densitatea receptorului FcεRI poate fi un parametru pentru reactivitatea bazofilelor. Două studii au furnizat dovezi că pacienţii care au demonstrat o îmbunătăţire clinică după omalizumab au avut o reducere semnificativă a densităţii receptorilor FcεRI pe bazofile(12).
Mai multe studii au demonstrat că tratamentul imunosupresor anterior ar putea fi un predictor al nonrăspunsului sau al răspunsului slab la omalizumab, aşa cum este ilustrat de Ghazanfar şi colab. în 2018, azatioprina, ciclosporina şi metotrexatul fiind medicamentele imunosupresoare administrate anterior tratamentului cu omalizumab(22). Această observaţie a fost reluată într-un alt studiu, cu o dimensiune mai mare a eşantionului de pacienţi, care a relevat că un rezultat slab al tratamentului a fost observat în grupul care a primit anterior ciclosporină(23). Totuşi, în prezent, dovezile nu sunt concludente, deoarece rezultate similare nu au fost demonstrate în alte studii(24,25).
Datele pentru alţi markeri – de exemplu, ASST, BHRA şi ANA – şi legătura lor cu răspunsul la tratamentul cu omalizumab nu sunt consistente(26,27). Sunt necesare studii suplimentare la scară largă, prospective, pentru a aduce mai multe date cu privire la aceşti markeri ai autoimunităţii IgG, dacă sunt într-adevăr predictori de nonrăspuns sau de răspuns slab la tratamentul cu omalizumab(12).
D-dimerii şi IL-31 sunt markeri promiţători pentru răspunsul la tratamentul cu omalizumab în UCS, dar dovezile sunt limitate. Într-un studiu, toţi pacienţii care au răspuns la omalizumab au arătat o scădere dramatică a nivelurilor de D-dimeri după prima administrare de omalizumab, în comparaţie cu cei care nu au răspuns la omalizumab şi care nu au prezentat o reducere a nivelurilor de D-dimeri(29). Într-un alt studiu, tratamentul cu succes cu omalizumab la pacienţii cu UCS a fost asociat cu scăderea nivelurilor serice de IL-31(30).
Dovezile pentru potenţiali predictori ai unui răspuns favorabil la omalizumab sunt inconsistente, totuşi EAACI a emis o recomandare condiţională pentru valoarea crescută a IgE totale ca potenţial indicator de răspuns la tratamentul cu omalizumab şi recădere rapidă după întreruperea tratamentului la pacienţii de peste 12 ani(31).
În ceea ce priveşte existenţa unor markeri de predicţie pentru timpul de răspuns la tratamentul cu omalizumab în UCS, există dovezi slabe în sprijinul faptului că pozitivitatea ASST este un marker al răspunsului lent. Gericke şi colab. au raportat că pacienţii cu răspuns la omalizumab, cu BHRA pozitiv şi ASST pozitiv, au de 4,5 şi 5,5 ori mai multe şanse de a avea un răspuns lent la tratament în comparaţie cu pacienţii cu răspuns la omalizumab, dar cu BHRA negativ şi ASST negativ(32). Într-un alt studiu, pozitivitatea ASST a fost, de asemenea, legată de debutul lent al răspunsului la omalizumab(12,23).
Reapariţia simptomelor după tratamentul cu omalizumab a fost independentă de durata UCS, a angioedemului, a tratamentelor anterioare primite sau a dermografismului. Mai degrabă este sugerat că UAS7 iniţial ridicat şi scăderea lentă a simptomelor indică o probabilitate mai mare de reapariţie rapidă a simptomelor(33). În studiile ASTERIA I şi II şi GLACIAL, pacienţii cu UAS7 iniţial mai scăzut şi răspuns rapid la tratament au avut o probabilitate mai mică de recădere rapidă a simptomelor, iar pacienţii cu UAS7 iniţial ridicat şi răspuns iniţial mai lent la tratament au avut o probabilitate mai mare de recădere rapidă după întreruperea tratamentului. Nivelurile crescute de IgE totale au fost legate de recăderea mai rapidă la pacienţii cu UCS după întreruperea omalizumabului(34).
Concluzii
Nivelul scăzut de IgE totale are cele mai bune evidenţe ca potenţial predictor al nonrăspunsului la omalizumab. Sunt necesare studii suplimentare prospective randomizate pentru a confirma şi/sau pentru a identifica alţi predictori de răspuns la tratament. Utilizarea unor predictori de răspuns la tratament poate ajuta în alegerea unei terapii ţintite şi la prioritizarea pacienţilor la risc de nonrăspuns, pentru a accesa terapii mai eficiente şi, nu în ultimul rând, pentru consilierea pacienţilor în legătură cu rezultatele posibile ale fiecărui tip de tratament.
Conflict de interese: niciunul declarat
Suport financiar: niciunul declarat
Acest articol este accesibil online, fără taxă, fiind publicat sub licenţa CC-BY.

Bibliografie
-
Zuberbier T, Abdul Latiff AH, Abuzakouk M, Aquilina S, Asero R, Baker D, Ballmer-Weber B, Bangert C, Ben-Shoshan M, Bernstein JA, Bindslev-Jensen C, Brockow K, Brzoza Z, Chong Neto HJ, Church MK, Criado PR, Danilycheva IV, Dressler C, Ensina LF, Fonacier L, Gaskins M, Gáspár K, Gelincik A, Giménez-Arnau A, Godse K, Gonçalo M, Grattan C, Grosber M, Hamelmann E, Hébert J, Hide M, Kaplan A, Kapp A, Kessel A, Kocatürk E, Kulthanan K, Larenas-Linnemann D, Lauerma A, Leslie TA, Magerl M, Makris M, Meshkova RY, Metz M, Micallef D, Mortz CG, Nast A, Oude-Elberink H, Pawankar R, Pigatto PD, Ratti Sisa H, Rojo Gutiérrez MI, Saini SS, Schmid-Grendelmeier P, Sekerel BE, Siebenhaar F, Siiskonen H, Soria A, Staubach-Renz P, Stingeni L, Sussman G, Szegedi A, Thomsen SF, Vadasz Z, Vestergaard C, Wedi B, Zhao Z, Maurer M. The international EAACI/GA²LEN/EuroGuiDerm/APAAACI guideline for the definition, classification, diagnosis, and management of urticaria. Allergy. 2022 Mar;77(3):734-766.
-
Gonçalo M, Gimenéz-Arnau A, Al-Ahmad M, Ben-Shoshan M, Bernstein JA, Ensina LF, Fomina D, Galvàn CA, Godse K, Grattan C, Hide M, Katelaris CH, Khoshkhui M, Kocatürk E, Kulthanan K, Medina I, Nasr I, Peter J, Staubach P, Wang L, Weller K, Maurer M. The global burden of chronic urticaria for the patient and society. Br J Dermatol. 2021 Feb;184(2):226-236.
-
Fricke J, Ávila G, Keller T, Weller K, Lau S, Maurer M, Zuberbier T, Keil T. Prevalence of chronic urticaria in children and adults across the globe: Systematic review with meta-analysis. Allergy. 2020 Feb;75(2):423-432. doi: 10.1111/all.14037.
-
Maurer M, Eyerich K, Eyerich S, Ferrer M, Gutermuth J, Hartmann K, Jakob T, Kapp A, Kolkhir P, Larenas-Linnemann D, Park HS, Pejler G, Sánchez-Borges M, Schäkel K, Simon D, Simon HU, Weller K, Zuberbier T, Metz M. Urticaria: Collegium Internationale Allergologicum (CIA) Update 2020. Int Arch Allergy Immunol. 2020;181(5):321-333.
-
Kolkhir P, Church MK, Weller K, Metz M, Schmetzer O, Maurer M. Autoimmune chronic spontaneous urticaria: what we know and what we do not know. J Allergy Clin Immunol. 2017 Jun;139(6):1772–81.e1.
-
Altrichter S, Zampeli V, Ellrich A, Zhang K, Church MK, Maurer M. IgM and IgA in addition to IgG autoantibodies against FcɛRIα are frequent and associated with disease markers of chronic spontaneous urticaria. Allergy. 2020 Dec;75(12):3208-3215.
-
Schoepke N, Asero R, Ellrich A, Ferrer M, Gimenez-Arnau A, E H Grattan C, Jakob T, Konstantinou GN, Raap U, Skov PS, Staubach P, Kromminga A, Zhang K, Bindslev-Jensen C, Daschner A, Kinaciyan T, Knol EF, Makris M, Marrouche N, Schmid-Grendelmeier P, Sussman G, Toubi E, Church MK, Maurer M. Biomarkers and clinical characteristics of autoimmune chronic spontaneous urticaria: Results of the PURIST Study. Allergy. 2019 Dec;74(12):2427-2436.
-
Metz M, Altrichter S, Buttgereit T, Fluhr JW, Fok JS, Hawro T, Jiao Q, Kolkhir P, Krause K, Magerl M, Pyatilova P, Siebenhaar F, Su H, Terhorst-Molawi D, Weller K, Xiang YK, Maurer M. The Diagnostic Workup in Chronic Spontaneous Urticaria-What to Test and Why. J Allergy Clin Immunol Pract. 2021 Jun;9(6):2274-2283.
-
Giménez-Arnau AM, Ribas-Llauradó C, Mohammad-Porras N, Deza G, Pujol RM, Gimeno R. IgE and high-affinity IgE receptor in chronic inducible urticaria, pathogenic, and management relevance. Clin Transl Allergy. 2022 Feb 1;12(2):e12117.
-
Konstantinou GN, Konstantinou GN. Psychiatric comorbidity in chronic urticaria patients: a systematic review and meta-analysis. Clin Transl Allergy. 2019 Aug 23;9:42.
-
Altrichter S, Fok JS, Jiao Q, Kolkhir P, Pyatilova P, Romero SM, Scheffel J, Siebenhaar F, Steinert C, Terhorst-Molawi D, Xiang YK, Church MK, Maurer M. Total IgE as a Marker for Chronic Spontaneous Urticaria. Allergy Asthma Immunol Res. 2021 Mar;13(2):206-218.
-
Fok JS, Kolkhir P, Church MK, Maurer M. Predictors of treatment response in chronic spontaneous urticaria. Allergy. 2021 Oct;76(10):2965-2981.
-
Maurer M, Altrichter S, Bieber T, Biedermann T, Bräutigam M, Seyfried S, Brehler R, Grabbe J, Hunzelmann N, Jakob T, Jung A, Kleine-Tebbe J, Mempel M, Meurer M, Reich K, Ruëff F, Schäkel K, Sengupta K, Sieder C, Simon JC, Wedi B, Zuberbier T, Mahler V, Staubach P. Efficacy and safety of omalizumab in patients with chronic urticaria who exhibit IgE against thyroperoxidase. J Allergy Clin Immunol. 2011 Jul;128(1):202-209.e5.
-
Maurer M, Rosén K, Hsieh HJ, Saini S, Grattan C, Gimenéz-Arnau A, Agarwal S, Doyle R, Canvin J, Kaplan A, Casale T. Omalizumab for the treatment of chronic idiopathic or spontaneous urticaria. N Engl J Med. 2013 Mar 7;368(10):924-35.
-
Kessel A, Toubi E. Cyclosporine-A in severe chronic urticaria: the option for long-term therapy. Allergy. 2010 Nov;65(11):1478-82.
-
Straesser MD, Oliver E, Palacios T, Kyin T, Patrie J, Borish L, Saini SS, Lawrence MG. Serum IgE as an immunological marker to predict response to omalizumab treatment in symptomatic chronic urticaria. J Allergy Clin Immunol Pract. 2018 Jul-Aug;6(4):1386-1388.e1.
-
Marzano AV, Genovese G, Casazza G, Fierro MT, Dapavo P, Crimi N, Ferrucci S, Pepe P, Liberati S, Pigatto PD, Offidani A, Martina E, Girolomoni G, Rovaris M, Foti C, Stingeni L, Cristaudo A, Canonica GW, Nettis E, Asero R. Predictors of response to omalizumab and relapse in chronic spontaneous urticaria: a study of 470 patients. J Eur Acad Dermatol Venereol. 2019 May;33(5):918-924.
-
Ertas R, Ozyurt K, Atasoy M, Hawro T, Maurer M. The clinical response to omalizumab in chronic spontaneous urticaria patients is linked to and predicted by IgE levels and their change. Allergy. 2018 Mar;73(3):705-712.
-
Magen E, Chikovani T, Waitman DA, Kahan NR. Factors related to omalizumab resistance in chronic spontaneous urticaria. Allergy Asthma Proc. 2019;40(4):273-278.
-
Weller K, Ohanyan T, Hawro T, Ellrich A, Sussman G, Koplowitz J, Gimenez-Arnau AM, Peveling-Oberhag A, Staubach P, Metz M, Maurer M. Total IgE levels are linked to the response of chronic spontaneous urticaria patients to omalizumab. Allergy. 2018 Dec;73(12):2406-2408.
-
Asero R. Chronic spontaneous urticaria treated with omalizumab: what differentiates early from late responders? Eur Ann Allergy Clin Immunol. 2021;53(1):47-48..
-
Ghazanfar MN, Holm JG, Thomsen SF. Effectiveness of omalizumab in chronic spontaneous urticaria assessed with patient-reported outcomes: a prospective study. J Eur Acad Dermatol Venereol. 2018;32(10):1761-1767.
-
Nettis E, Cegolon L, Di Leo E, Lodi Rizzini F, Detoraki A, Canonica GW. Omalizumab chronic spontaneous urticaria: efficacy, safety, predictors of treatment outcome, and time to response. Ann Allergy Asthma Immunol. 2018;121(4):474-478.
-
Cubiro X, Spertino J, Rozas-Munoz E, Serra-Baldrich E, Puig L. The effectiveness of omalizumab treatment in real-life is lower in patients with chronic urticaria longer than 18 months’ evolution and prior immunosuppressive treatment. Actas Dermo-sifiliograficas. 2019;110(4):289-296.
-
Ghazanfar MN, Sand C, Thomsen SF. Effectiveness and safety of omalizumab in chronic spontaneous or inducible urticaria: evaluation of 154 patients. Br J Dermatol. 2016;175(2):404-406.
-
Ertaş R, Hawro T, Altrichter S, Özyurt K, Erol K, Ketenci Ertaş Ş, Maurer M. Antinuclear antibodies are common and linked to poor response to omalizumab treatment in patients with CSU. Allergy. 2020 Feb;75(2):468-470.
-
Magen E, Waitman D-A, Dickstein Y, Davidovich V, Kahan NR. Clinical-laboratory characteristics of ANA-positive chronic idiopathic urticaria. Allergy Asthma Proc. 2015;36(2):138-144.
-
Viswanathan RK, Moss MH, Mathur SK. Retrospective analysis of the efficacy of omalizumab in chronic refractory urticaria. Allergy and Asthma Proceedings. 2013;34(5):446-452.
-
Asero R, Marzano AV, Ferrucci S, Cugno M. D-dimer plasma levels parallel the clinical response to omalizumab in patients with severe chronic spontaneous urticaria. Int Arch Allergy Immunol. 2017;172(1):40-44.
-
Altrichter S, Hawro T, Hänel K, Czaja K, Lüscher B, Maurer M, Church MK, Baron JM. Successful omalizumab treatment in chronic spontaneous urticaria is associated with lowering of serum IL-31 levels. J Eur Acad Dermatol Venereol. 2016 Mar;30(3):454-5.
-
Agache I, Akdis CA, Akdis M, Brockow K, Chivato T, Del Giacco S, Eiwegger T, Eyerich K, Giménez-Arnau A, Gutermuth J, Guttman-Yassky E, Maurer M, Ogg G, Ong PY, O'Mahony L, Schwarze J, Warner A, Werfel T, Palomares O, Jutel M. EAACI Biologicals Guidelines-Omalizumab for the treatment of chronic spontaneous urticaria in adults and in the paediatric population 12-17 years old. Allergy. 2022 Jan;77(1):17-38.
-
Gericke J, Metz M, Ohanyan T, Weller K, Altrichter S, Skov PS, Falkencrone S, Brand J, Kromminga A, Hawro T, Church MK, Maurer M. Serum autoreactivity predicts time to response to omalizumab therapy in chronic spontaneous urticaria. J Allergy Clin Immunol. 2017 Mar;139(3):1059-1061.e1.
-
Ferrer M, Giménez-Arnau A, Saldana D, Janssens N, Balp MM, Khalil S, Risson V. Predicting Chronic Spontaneous Urticaria Symptom Return After Omalizumab Treatment Discontinuation: Exploratory Analysis. J Allergy Clin Immunol Pract. 2018 Jul-Aug;6(4):1191-1197.e5.
-
Ertas R, Ozyurt K, Ozlu E, Ulas Y, Avci A, Atasoy M, Hawro T, Maurer M. Increased IgE levels are linked to faster relapse in patients with omalizumab-discontinued chronic spontaneous urticaria. J Allergy Clin Immunol. 2017 Dec;140(6):1749-1751.
Articole din ediţiile anterioare
Aspecte practice ale tratamentului cu omalizumab în urticaria spontană cronică în perioada campaniei de vaccinare împotriva COVID-19
Omalizumab este primul anticorp monoclonal aprobat pentru utilizare la pacienţii cu urticarie cronică spontană care rămân simptomatici în ciuda tra...
Terapiile biologice în astmul sever – o perspectivă moleculară
Astmul este o boală heterogenă definită printr‑un istoric de simptome respiratorii care variază în timp şi în intensitate, precum şi prin limitarea...
Urticaria cronică spontană – utilitatea instrumentelor de evaluare în practica clinică conform ghidului EAACI/GA²LEN/EuroGuiDerm/APAAACI 2021
Urticaria cronică spontană (UCS) este o boală cutanată frecventă şi debilitantă, care afectează calitatea vieţii şi performanţa la locul de muncă ş...
Rolul diagnosticului molecular în anafilaxie
Anafilaxia reprezintă o reacţie alergică severă, cu potenţial letal, caracterizată prin debutul acut al simptomelor şi care necesită intervenţie me...