Egg allergy is common among the pediatric population, manifested by various clinical phenotypes. The present review aims to present recent data on the topic for a deeper understanding of accurate diagnosis and individualized therapeutic approaches, considering that these are very useful in clinical practice.
Alergia alimentară la oul de găină. Actualizări în diagnosticul şi abordarea terapeutică
Hen’s egg food allergy – updates in diagnosis and therapeutic approach
First published: 27 aprilie 2021
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.5.2.2021.4910
Abstract
Rezumat
Alergia alimentară la ou este frecventă în rândul populaţiei pediatrice, manifestându-se prin diferite fenotipuri clinice. Lucrarea de faţă are ca scop expunerea datelor recente asupra temei, pentru o înţelegere mai aprofundată cu privire la diagnosticul precis, precum şi asupra abordării terapeutice individualizate, considerând că acestea sunt de mare folos în practica clinică.
Introducere
Alergia alimentară la ou este o reacţie adversă, reproductibilă, care rezultă dintr-un răspuns imun specific faţă de proteinele din oul de găină. Este a doua alergie alimentară ca prevalenţă, după cea la proteinele laptelui de vacă, în rândul sugarilor şi copiiilor mici(1). Prevalenţa confirmată prin test de provocare orală variază între 0,5% şi 2,5% la populaţia pediatrică fiind de 0,2% la populaţia adultă(1,2,3). Deşi se cunoaşte că alergia alimentară la ou este tranzitorie, în 70% dintre cazuri toleranţa apare la vârste tot mai mari (între 10 şi 16 ani)(4). În studiul HEAP (Hen’s Egg Allergy Prevention), dermatita atopică şi naşterea prin cezariană au fost cei mai puternici factori de risc pentru dezvoltarea sensibilizării la oul de găină. Date recent publicate din cohorta EuroPrevall indică factorii de risc asociaţi independent cu dezvoltarea alergiei la ou ca fiind: dermatita atopică, antibioterapia în prima săptămână de viaţă şi rinita alergică(5). Alergia la ou, la rândul ei, reprezintă un factor de risc pentru sensibilizarea la aeroalergeni, cu apariţia în timp a astmului bronşic(1,6).
Alergenii majori din ou
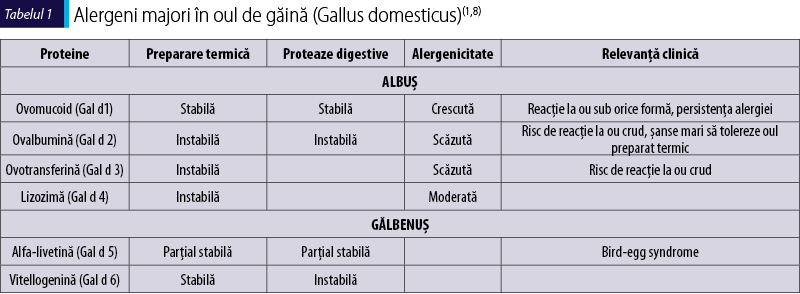
Alergenii majori din oul de găină (tabelul 1) se împart în funcţie de provenienţa lor din albuş sau gălbenuş. De asemenea, sunt clasificaţi în funcţie de caracteristicile lor fizice şi chimice. În principiu, cu cât proteina este mai stabilă la prepararea termică şi la digestia enzimatică la nivel digestiv, alergenicitatea acesteia este mai crescută, cum observăm că este în cazul ovomucoidului (Gal d 1). Pacienţii cu IgE specifică peste nivelul cutoff faţă de ovomucoid sunt la risc crescut pentru reacţie la ou sub orice formă şi pentru persistenţa acestei alergii alimentare. Dezvoltarea toleranţei la ou se asociază cu scăderea IgE specifice faţă de ovomucoid(9). Când avem doar IgE specifică faţă de ovoalbumină (Gal d 2), riscul este de reacţie la ou crud sau puţin preparat termic, fiind şanse mari de toleranţă faţă de oul preparat termic. Restul alergenilor sunt mai puţin utilizaţi în practica clinică actuală, dar pot fi importanţi în cazuri selectate care nu urmează fenotipul tipic.
Manifestările clinice
Răspunsul imunologic faţă de proteinele din ou poate determina manifestări clinice variate în funcţie de mecanismul de bază, majoritatea fiind reacţii de hipersensibilitate de tip I (IgE mediate) şi în mai mică măsură manifestări non-IgE mediate sau mixte.
Reacţiile IgE mediate sunt cu debut rapid, începând de la câteva minute după expunere până la două ore. În cazul alergiei la ou, manifestările cele mai frecvente sunt limitate la nivelul tegumentului şi mucoaselor (urticarie şi angioedem), urmate de manifestări respiratorii (tuse, constricţie toracică, wheezing, obstrucţie nazală, strănut şi rinoree) până la anafilaxie, reacţie ameninţătoare de viaţă cu implicare multiorganică(1). Expunerea la ou reprezintă cauza a 7% dintre reacţiile anafilactice constatate la sugari.
Alte entităţi care cad sub umbrela reacţiilor IgE-mediate la ou, raportate în special la adulţi, sunt: astmul ocupaţional în rândul brutarilor expuşi la praful de ou aerosolizat, sindromul pasăre-ou (bird-egg syndrome) la indivizi iniţial sensibilizaţi la alergene inhalatorii (pene şi dejecţiile păsărilor), urmate de manifestări respiratorii şi digestive la consumul de ou prin cross-reactivitatea acestora şi anafilaxia indusă de efort dependentă de alimente.
Manifestările non-IgE mediate sunt reprezentate de sindromul enterocolitei induse de proteine alimentare şi de proctocolita sugarului indusă de proteine alimentare.
Manifestările mixte (IgE şi non-IgE mediate) includ dermatita atopică, care are la bază un mecanism de hipersensibilitate de tip IV, mediat celular, la care se poate adăuga şi mecanismul IgE mediat prin sensibilizări la aeroalergeni şi alimente. Dermatita atopică la copiii cu alergie alimentară la ou are un debut timpuriu, în formă moderat-severă şi un risc foarte crescut de până la 80% pentru a dezvolta astm bronşic ulterior(6). S-a emis ipoteza că sensibilizarea la alimente are loc prin expunerea cutanată la începutul vieţii, facilitată de permeabilitatea crescută a pielii în dermatita atopică, aceasta precedând alergia la ou cu aproximativ 3 luni şi jumătate(5). Esofagita eosinofiliză este de asemenea o entitate mixtă, mai rar întâlnită, dar de reţinut că oul reprezintă al doilea alergen ca frecvenţă implicat în declanşarea simptomelor(1).
Diagnostic
Pentru un diagnostic cert de alergie alimentară la ou, pe lângă datele anamnestice şi istoricul pacientului, avem la dispoziţie investigaţii in vivo pe care le alegem în funcţie de manifestările clinice. Pentru reacţii IgE mediate, se începem cu testarea cutanată prick. Testul cutanat prick cu alergen standardizat (ou mix) poate prezice diagnosticul cu valoare predictiv pozitivă de 95%, dacă avem o papulă cu diametru de peste 7 mm la copiii peste 2 ani, sau peste 4 mm, la cei sub 2 ani. În caz de prick-to-prick, diametrul papulei considerat relevant este de peste 11 mm(1,5).
În cazul unei dermatite atopice care se exacerbează la consumul de ou, putem folosi testul patch la ou, pentru a evidenţia o reacţie mediată celular.
Pentru diagnosticul in vitro al unei alergii alimentare putem apela la determinarea IgE specifice, precum şi la testul de activare a bazofilelor (BAT). IgE specifică la albuş cu valoare predictiv pozitivă de 95% are cutoff de 7 kU/L la copiii de peste 2 ani sau 2 kU/L la cei sub 2 ani1,2,7. Totuşi nu putem exclude alergia la ou doar pe baza serologiei negative, având în vedere că 10% până la 30% dintre testele de provocare orală la ou pozitive sunt la indivizi cu IgE specifice negative. Utilizarea componentelor moleculare ale albuşului sunt de ajutor pentru un diagnostic mai precis şi o stratificare a riscurilor clinice(2,8). Până recent, nivelul cutoff cu valoare predictivă pozitivă de peste 95% pentru IgE specifice faţă de ovomucoid (Gal d 1) era de peste 11 kU/L, indicând risc crescut de reacţie la ou sub orice formă, şi Gal d 1 sub 1 kU/L reprezentând risc scăzut pentru oul preparat termic(1,7). Într-un articol apărut în Journal of Allergy and Clinical Immunology în ianuarie 2021, Foong şi colaboratorii(2) au propus noi valori cutoff pentru Gal d 1, stratificând mai mult fenotipurile clinice: Gal d 1 > 5,21 kU/L pentru diagnosticul alergiei la ou crud, Gal d 1 > 26,6 kU/L pentru alergia la ou fiert şi Gad d 1 > 50 kU/L pentru alergia la ou copt.
Testul de activare a bazofilelor este un test bazat pe citometrie de flux, în care expresia markerilor de activare (CD203c şi CD63) este măsurată la suprafaţa bazofilelor în urma stimulării cu alergen(9). Potrivit lui Foong et al.(2), testul de activare a bazofilelor are specificitate crescută şi reflectă severitatea, precum şi pragul reacţiilor alergice, deosebindu-se între fenotipurile clinice. Pacienţii cu reacţii la ou sub orice formă prezintă o proporţie mai mare de bazofile activate în urma stimulării cu ou. Valori cutoff pentru BAT la ou publicate până în prezent sunt: >5% CD63+, >1,6 CD203c pentru alergia la ou crud şi >1,7 CD203c pentru alergia la ou preparat termic(9).
Standardul de aur pentru diagnosticul alergiei alimentare la ou a rămas testul de provocare orală dublu‑orb placebo‑controlat, care se efectuează dacă istoricul este incert, testele cutanate şi in vitro fiind sub valorile considerate relevante(10).
Abordarea terapeutică
Managementul alergiei la ou cuprinde diferite abordări, în funcţie de fenotipul clinic. Cea mai importantă măsură pentru toţi pacienţii este educaţia asupra evitării oului, un aliment ubicuitar în cultura noastră. Citirea etichetelor alimentare este importantă pentru evitarea expunerii accidentale la proteinele din ou, fiind un ingredient de bază în multe produse de pe piaţă. Pe lângă termenul de ou, albuş sau gălbenuş, mai putem găsi denumiri precum: albumină, globulină, livetin, lizozimă, cuvinte care încep cu „ovo” (de exemplu, ovoalbumină şi ovomucoid) şi surimi, care indică faptul că alimentul respectiv conţine ou. Atenţie la sursele ascunse de ou în alimente (budincă, glazură, bezele, frişcă, paste, dressing pentru salate, produse de patiserie, supe, băuturi), precum şi în produse de îngrijire personală (creme de corp, gel de duş, şampoane, alte cosmetice). Posibilele contaminări cu ou în restaurante şi în produse de panificaţie sunt problematice pentru pacienţi, limitând sursele sigure la alimente preparate la domiciliu. Reactivitatea încrucişată cu ouă de la alte păsări (curcan, prepeliţă, gâscă, raţă, pescăruş) sau cu carnea de pui este scăzută, dar se recomandă precauţie la utilizarea acestora.
Unele vaccinuri conţin ingrediente derivate din ou (cel mai frecvent, ovalbumina) şi pot declanşa o reacţie alergică la cei sensibilizaţi. Conform documentului de poziţie EAACI Vaccination and Allergy(11), vaccinurile din schema naţională, inclusiv vaccinul împotriva rujeolei, oreionului şi rubeolei (ROR), se pot administra fără precauţii la copiii cu alergie la ou. Vaccinul antigripal inactivat conţine <0,12 mcg/ml ovalbumină şi este considerat sigur inclusiv pentru cei cu reacţii severe la ou în antecedente, cu menţiunea să se facă sub supraveghere medicală şi cu monitorizare timp de 2 ore postadministrare. Datele legate de siguranţa vaccinului antigripal viu atenuat nu sunt concludente, acesta având cantităţi variabile de ovalbumină. Vaccinul pentru febra galbenă conţine cantităţi relativ mari de proteine din ou (de la 0,61 mcg/ml până la 4, 43 mcg/ml), acesta fiind contraindicat la pacienţii cu alergie la ou.
Tratamentul episoadelor acute postexpunere constă în trusa de urgenţă (antihistaminice, corticosteroizi şi adrenalină) inclusă în planul de acţiune în caz de reacţie alergică primit la stabilirea diagnosticului. Severitatea simptomelor poate varia de la o reacţie la alta, iar gravitatea reacţiei iniţiale nu poate prezice severitatea reacţiilor ulterioare(1).
Monitorizarea rezoluţiei alergiei la ou prin testare prick, IgE specifice faţă de albuş, ovomucoid şi ovoalbumină, istoricul asupra reacţiilor în urma expunerilor accidentale şi test de provocare la ou este importantă, având în vedere că majoritatea copiilor dezvoltă toleranţă în timp. Studiile indică faptul că un consum regulat de ou preparat termic de către cei fără sensibilizare sau cu nivel <1 kU/L la ovomucoid (Gal d 1) şi în urma unui test de provocare accelerează dezvoltarea toleranţei(12,16). Astfel, nu doar se îmbunătăţeşte calitatea vieţii, dar se şi promovează evoluţia favorabilă a bolii, observându-se modificări imunologice similare cu cele observate în imunoterapia orală(17). Mecanismul toleranţei la oul copt este considerat a fi rezultatul alterării epitopilor conformaţionali, modificând configuraţia tridimensională a proteinei, scăzând astfel capacitatea specifică de a lega IgE(17).
Formele de ou preparat termic standardizate sunt: oul copt într-o matrice de grâu sub forma unei brioşe coapte la 180 ºC cel puţin 30 de minute sau oul fiert 15 minute(13). Datele publicate nu indică un cutoff absolut al diametrului papulei la testarea cutanată sau nivelul IgE specifice la albuş înainte de testul de provocare la ou preparat termic, dar sunt în general acceptate valori IgE specifice la albuş <2 kU/L şi papulă <3 mm la testarea cutanată, indicând şanse de succes la peste 80% dintre cazuri(1,12,17). Unele centre oferă test de provocare la ou preparat termic la valori mai mari, până în 10 kU/L şi 11 mm diametrul papulei, sub premisa succesului testului de provocare în aproximativ 50% dintre cazurile care prezintă aceste valori(1,14). Testul de provocare la ou copt se face cu creşterea dozelor la 15-30 de minute în 4 sau 6 paşi, până la atingerea dozei totale de 2 g proteine de ou într-o brioşă după reţeta standard(17). După introducerea consumului regulat de ou preparat termic (produse coapte cu conţinut <1/3 de ou, produse cumpărate care conţin ou de la al treilea ingredient în jos)(17), pacienţii sunt monitorizaţi la 6 luni, evaluându-se expunerea clinică, precum şi statusul imunologic (IgE specifică şi, când va fi disponibil, IgG4 la albuş, ovomucoid, ovalbumină), pentru posibilitatea introducerii preparatelor din ou mai puţin preparate termic, cum ar fi omleta(14,16). Atenţie la copiii a căror manifestare clinică este doar exacerbarea dermatitei atopice la consumul de ou. Acest grup este la risc crescut pentru dezvoltarea reacţiilor sistemice la reintroducerea oului după o perioadă de eliminare, astfel încât se recomandă dozarea IgE specifice ale componentelor moleculare, precum şi testare cutanată înainte de reintroducere, sub supraveghere medicală(15).
Imunoterapia orală la ou este o variantă terapeutică recentă, care are ca scop inducerea toleranţei imunologice faţă de ou cu doze repetate crescânde. Pentru pacienţii care nu tolerează oul copt, Bird şi colaboratorii(16) au publicat date încurajatoare asupra imunoterapiei orale cu ou copt, ca mijloc de inducere a toleranţei atât pentru oul copt, cât şi, ulterior, pentru oul mai puţin preparat termic. După primul an, fiind pe o doză de menţinere de 2,5 g proteine de ou/zi, 87,5% au trecut testul de provocare la ou copt cu o doză totală de 3,8 g. Participanţii respectivi au continuat cu doză de menţinere de 3,8 g/zi, iar la un an, 83% au tolerat 6 g de ou uşor preparat termic (omletă), fiind demonstrate şi modificările imunomodulatoare aşteptate(16). Date recente din studiul multicentric publicat de Kim şi colaboratorii(18) indică faptul că inducerea toleranţei şi a răspunsului susţinut la copiii care tolerează oul copt prin imunoterapie orală cu praf de albuş de ou crud pasteurizat (doză de menţinere 2 g/zi) este mai eficientă în comparaţie cu inducerea toleranţei prin expunerea regulată la 2 g de proteine în formă de ou copt (42% versus 11%). Deşi există numeroase beneficii asupra calităţii vieţii consumului de ou copt la cei care îl tolerează, un considerent important în decizia abordării terapeutice individualizate îl reprezintă pericolul de reacţii alergice la expuneri accidentale la ou crud. Acest lucru ridică întrebarea dacă imunoterapia orală cu ou crud, care desensibilizează pacienţii la toate formele de ou, ar trebui să fie luată în considerare nu doar la pacienţii reactivi la toate formele de ou, ci, de asemenea, şi la pacienţii care tolerează oul copt.
Prevenţia primară a fraţilor mai mici ai pacienţilor cu alergie la ou se face prin evitarea factorilor de risc menţionaţi anterior şi prin introducerea oului în alimentaţia sugarului între 4 şi 6 luni, conform ghidurilor comitetului de experţi internaţionali în alergii alimentare(19,20).
În concluzie, alergia alimentară la ou reprezintă o entitate tot mai des întâlnită în practica clinică, persistând până în anii adolescenţei, sub diferite fenotipuri clinice. Un diagnostic precis şi urmărirea evoluţiei statusului imunologic conform ghidurilor publicate sunt importante în monitorizarea pacientului. Pe lângă abordarea clasică de evitare a expunerii la proteinele din ou, mai recent s-au publicat date încurajatoare cu privire la terapia cu ou copt, precum şi la imunoterapia cu ou copt sau ou crud la pacienţii selecţionaţi în urma evaluării de către medicul curant.
Bibliografie
- Wang J. UpToDate: Egg allergy. Last update October 16, 2020.
- Foong RX, et al. Improving Diagnostic Accuracy in Food Allergy. J Allergy Clin Immunol Pract. 2021 Jan;9(1):71-80.
- Rona RJ, et al. The prevalence of food allergy: a meta-analysis. J Allergy Clin Immunol. 2007;120(3):638–46.
- Johns Hopkins Medicine. (2007, December 17). Milk And Egg Allergies Harder To Outgrow. ScienceDaily. Retrieved: November 22, 2020.
- Grimshaw KEC, et al. Risk Factors for Hen’s Egg Allergy in Europe: EuroPrevall Birth Cohort. J Allergy Clin Immunol Pract. 2020;8(4):1341-1348.
- Tariq SM, Matthews SM, Hakim EA, Arshad SH. Egg allergy in infancy predicts respiratory allergic disease by 4 years of age. Pediatr Allergy Immunol. 2000 Aug;11(3):162-7.
- Sampson H, Aceves S, Bock A. Food Allergy: a practice parameter update-2014. J Allergy Clin Immunol. 2014 Nov;134(5):1016-25.e43.
- Matricardi PM, et al. EAACI Molecular Allergology User’s Guide. Pediatric allergy and immunology: official publication of the European Society of Pediatric Allergy and Immunology. 2016 May;27 Suppl 23:1-250.
- Santos AA. Clinical applications of BAT in food allergy – oral presentation. FAAM 2020.
- Caubet JC, Wang J. Current understanding of egg allergy. Pediatric Clinics of North America. 2011;58(2):427–xi.
- Nilsson L, et al. Vaccination and allergy: EAACI position paper, practical aspects. Pediatr Allergy Immunol. 2017 Nov;28(7):628-640.
- Lambert R, et al. Evidence that eating baked egg or milk influences egg or milk allergy resolution: a systematic review. Clinical and Experimental Allergy : journal of the British Society for Allergy and Clinical Immunology. 2017;47(6):829-837.
- Miceli Sopo S, Greco M, Cuomo B, et al. Matrix effect on baked egg tolerance in children with IgE-mediated hen’s egg allergy. Pediatr Allergy Immunol. 2016;27:465.
- Tan JW, Campbell DE, Turner PJ, et al. Baked egg food challenges – clinical utility of skin test to baked egg and ovomucoid in children with egg allergy. Clin Exp Allergy. 2013 Oct;43(10):1189-95.
- Chang A, Robison R, Cai M, Singh AM. Natural History of Food-Triggered Atopic Dermatitis and Development of Immediate Reactions in Children. J Allergy Clin Immunol Pract. Mar-Apr 2016;4(2):229-36.e1.
- Bird JA, et al. Baked egg oral immunotherapy desensitizes baked egg allergic children to lightly cooked egg. J Alergy Clin Immunol Pract. 2019 Feb;7(2):667-669.
- Bird JA, et al. Conducting an Oral Food Challenge: An update to the 2009 Adverse Reactions to Food Committee Work Group Report. J Allergy Clin Immunol Pract. 2020;8(1):75-90.
- Kim EH, et al. Induction of sustained unresponsiveness after egg oral immunotherapy compared to baked egg therapy in children with egg allergy. J Allergy Clin Immunol. 2020;146(4):851-862.
- Greer FR, et al. The Effects of Early Nutritional Interventions on the Development of Atopic Disease in Infants and Children: The Role of Maternal Dietary Restriction, Breastfeeding, Hydrolyzed Formulas, and Timing of Introduction of Allergenic Complementary Foods. Pediatrics. 2019 Apr;143(4):e20190281.
- Grimshaw KE, et al. Infant feeding and allergy prevention: a review of current knowledge and recommendations. A EuroPrevall state of the art paper. Allergy. 2009 Oct;64(10):1407-16.
Articole din ediţiile anterioare
Alergia alimentară – patogenie
Alergia alimentară este o afecţiune cu impact socioeconomic semnificativ şi reprezintă un subiect de interes pentru clinicieni şi pacienţi deopotri...
Forme gastrointestinale ale alergiilor alimentare non-IgE-mediate
Reacţiile de hipersensibilitate la alimente au impact negativ major asupra calităţii vieţii pacientului, dar nu numai asupra lui, ci şi asupra fami...
Antiinflamatoarele nesteroidiene – cofactor în reacţiile alergice la alimente
Antiinflamatoarele nesteroidiene (AINS) sunt utilizate frecvent pentru proprietăţile lor analgezice, antipiretice şi antiinflamatoare, la toate gru...
Alergia alimentară la mazăre şi corelaţiile acesteia cu procesarea termică
Alergiile produse de leguminoase ocupă unul dintre primele cinci locuri în topul alergiilor alimentare, deoarece leguminoasele reprezintă principal...