It is known that allergen immunotherapy is the only treatment that can modify the evolution of allergic disease and induce immunological tolerance. The molecular characterization of allergens has made important progress, thereby making possible to develop specific immunotherapy vaccines that target certain immune mechanisms.
Recent changes in immunotherapy preparations that use recombinant allergens obtained through molecular engineering techniques have increased vaccine efficacy and safety profile. Thus, an attempt is made to establish a treatment scheme that can be performed in a shorter period of time, with the intention of increasing the patients’ adherence to therapy.
The favorable evolution following the therapy shows the need to carry out complementary studies in order to improve the quality of the vaccine preparations, also leading to the development of an immunoprophylaxis.
Noi direcţii în imunoterapia alergenică
Novel directions in allergen immunotherapy
First published: 10 iunie 2020
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Aler.4.2.2020.3540
Abstract
Rezumat
Este cunoscut faptul că imunoterapia alergenică (AIT) este singurul tratament care poate modifica evoluţia bolii alergice şi poate conferi toleranţă imunologică. Caracterizarea moleculară a alergenelor a înregistrat progrese importante, făcând posibilă dezvoltarea de produse specifice de imunoterapie care să ţintească anumite mecanisme imunologice.
Modificările recente din domeniul imunoterapiei care utilizează alergene recombinate obţinute prin tehnici de inginerie moleculară au dus la creşterea eficacităţii şi siguranţei preparatului vaccinal. Astfel, se fac eforturi pentru realizarea unei scheme de tratament care să poată fi efectuată într-un interval de timp mai scurt, având ca deziderat sporirea aderenţei pacienţilor la terapie.
Evoluţia favorabilă în urma AIT prefigurează necesitatea efectuării unor studii complementare, cu scopul de a îmbunătăţi calitatea vaccinurilor, ducând totodată şi la dezvoltarea unei imunoprofilaxii.
Introducere
Afecţiunile alergice cu manifestări respiratorii şi cutanate sunt tulburări cu importanţă şi prevalenţă semnificative la nivel mondial, reprezentând principala patologie cronică în rândul adolescenţilor şi adulţilor tineri(1).
În funcţie de locul de apariţie a reacţiei inflamatorii, există mai multe tipuri de manifestări alergice: rinită (RA), astm, conjunctivită, dermatită atopică, urticarie, iar în unele cazuri poate apărea angioedemul sau şocul anafilactic(2,3). Printre principalele semne şi simptome întâlnim: pruritul nazal, strănutul, obstrucţia nazală, tusea, dispneea, lăcrimarea excesivă, pruritul ocular, edemul, eritemul sau erupţiile cutanate(3,4).
Tratamentul acestui cumul de manifestări ar trebui să restabilească viaţa socială normală, olfacţia, simţul gustativ şi somnul odihnitor, dar şi statutul comorbidităţilor. O strategie benefică pentru controlul evoluţiei patologiilor alergice cuprinde eliminarea alergenului din mediul înconjurător al pacientului sau limitarea expunerii la acesta(2). Singura modalitate de tratament care modifică evoluţia naturală a bolii, inducând rezultate eficiente de lungă durată, este imunoterapia alergenică (allergen immunotherapy; AIT). AIT induce toleranţă specifică pentru diverse alergene, conducând la rezoluţia inflamaţiei şi a simptomelor asociate(2,3,5). Această terapie a fost recent introdusă şi în ghidurile internaţionale de management al bolilor alergice.
Din punctul de vedere al indicaţiilor, ghidul ARIA (Allergic Rhinitis and its Impact on Asthma) 2016 recomandă imunoterapia alergenică pentru formele moderat-severe ale rinitei alergice persistente sau intermitente care nu răspund eficient la tratamentul medicamentos(2,6).
În ceea ce priveşte astmul alergic, prevenirea apariţiei lui ar putea fi realizată cu ajutorul câtorva măsuri profilactice. În acest scop se pot identifica persoanele cu risc crescut de a dezvolta boala timpuriu, iar adoptarea diferitelor atitudini, precum evaluarea obstrucţiei bronşice, evidenţierea eozinofiliei într-o hemoleucogramă, diagnosticul alergologic in vivo (folosind testul cutanat prick) sau in vitro (prin determinarea anticorpilor IgE alergen-specifici), pot dezvălui debutul afecţiunii şi astfel conduc la iniţierea promptă a tratamentului, ceea ce are numeroase beneficii(6,7,8).
Ghidul GINA (Global Initiative for Asthma) 2018 indică AIT, administrată fie pe cale subcutanată (subcutaneous immunotherapy; SCIT), fie sublingual (sublingual immunotherapy; SLIT), în formele de astm alergic la care se asociază şi rinoconjunctivită alergică, dacă volumul expirator maxim pe secundă este peste 70%. Terapia este recomandată ca metodă terapeutică alături de evitarea contactului cu alergenul şi tratamentul farmacologic(9,10).
De la alergie la dezvoltarea toleranţei imunologice
Prin expunerea la alergene, acestea ajung la nivelul mucoasei tractului respirator, unde există o concentraţie mare a celulelor de apărare ale sistemului imunitar înnăscut. Aici are loc contactul alergenului cu limfocitele B (LB) şi cu celulele prezentatoare de antigen (de exemplu, celula dendritică)(11). Consecutiv maturizării prin expunere la antigen, celulele dendritice iniţiază răspunsul imunitar adaptativ, prin prezentarea peptidelor alergenice limfocitului T (LT), prin intermediul moleculelor complexului major de histocompatibilitate (MHC)(4,12).
Ca răspuns la contactul sensibilizant, LT se diferenţiază preferenţial înspre un fenotip de limfocite Th2 capabile să determine LB să producă anticorpi, să stimuleze dezvoltarea de limfocite T de memorie şi să secrete citokine (în principiu, cele de tip Th2: IL-3, IL-4, IL-5, IL-6, IL-9, IL-10, IL-13). Aceste citokine conferă un impuls important pentru chemotactismul, maturarea şi activarea celulelor inflamatorii(4,5).
Pentru stimularea celulelor T naive, LB necesită două semnale (cu unele excepţii) pentru a deveni active. Astfel, limfocitele B sunt capabile să răspundă în mod direct la antigenele solubile sau sub formă de particule prin intermediul imunoglobulinelor M (IgM) legate de membrană, care funcţionează ca unităţi de recunoaştere. Cealaltă formă de costimulare solicitată de LB are loc după întâlnirea iniţială cu antigenul şi este furnizată de LT sub forma unui ligand CD40 asociat membranei, care se leagă de CD40 de pe membrana limfocitului B. Chiar dacă nu este necesară pentru activarea iniţială, este foarte importantă pentru comutarea clasei de imunoglobuline secretate. În acest mod se realizează comutarea izotipică înspre generarea de IgE de către plasmocit(3,4,7).
Mastocitele fiind sensibilizate consecutiv legării încrucişate a receptorilor, expunerea ulterioară la alergen va duce la reacţia imediată urmată de degranularea şi eliberarea aminelor (principală fiind histamina) şi citokinelor vasoactive preformate şi sinteza unei varietăţi de mediatori inflamatori derivaţi din acidul arahidonic (leucotrienele B4, C4 şi D4, prostaglandina D2, tromboxani), provocând simptomele imediate ale alergiei(4).
Reacţiile întârziate şi cronice sunt datorate prezentării alergenelor către limfocitele T după o prealabilă sensibilizare, ducând la eliberarea de citokine proinflamatorii, cum ar fi IL-4, IL-5 şi IL-13. Citokinele Th2, precum IL-5, realizează chemotactism pentru eozinofile, care se vor concentra la nivelul ţesutului, unde se eliberează mediatori inflamatori. Totodată, chemokinele eliberate de mastocite şi de alte tipuri de celule recrutează în mod direct celule inflamatorii care contribuie la reacţia întârziată, caracterizată printr-un influx de eozinofile şi limfocite Th2. Eozinofilele eliberează o gamă de mediatori proinflamatori, incluzând leucotriene şi proteine bazice, şi ar putea fi o sursă importantă de IL-3, IL-5 (cu rol major în reglarea formării, recrutării, activării şi supravieţuirii eozinofilelor), IL-13 şi GM-CSF(2,4).
Pentru contracararea efectelor procesului alergic, administrarea imunoterapiei va duce la creşterea pragului de toleranţă a organismului pentru un tip de alergen, desensibilizarea la pacienţii monosensibilizaţi soldându-se adesea cu succesul terapeutic(4).
La momentul actual, desensibilizarea alergică prin imunoterapie reprezintă singura abordare specifică în terapia rinoconjunctivitei alergice, influenţând pe termen lung evoluţia. Aceasta are ca efect restaurarea imunităţii normale pentru un anumit tip de alergen. AIT determină activarea unei succesiuni de mecanisme care conferă toleranţă imunologică şi eliminarea inflamaţiei, suprimând astfel simptomatologia clinică. Astfel, induce o modificare în grupul de limfocite T helper 2, secretoare de IL-4, înspre formarea de populaţii T reglatoare (LTreg), IL-10-secretoare, specifice pentru acelaşi epitop alergenic(4,14). Consecutiv, s-a observat o bună concordanţă între un număr crescut de Treg şi ameliorarea simptomatologiei. Totodată, se produce o proliferare a limfocitelor B reglatoare (LBreg) care produc IgG4 în defavoarea IgE, ducând la memoria toleranţei imunologice. LTreg sunt capabile să influenţeze mastocitele şi bazofilele pentru a reduce inflamaţia, dar şi să producă o scădere a numărului de eozinofile la nivelul mucoaselor (figurile 1şi 2)(15).
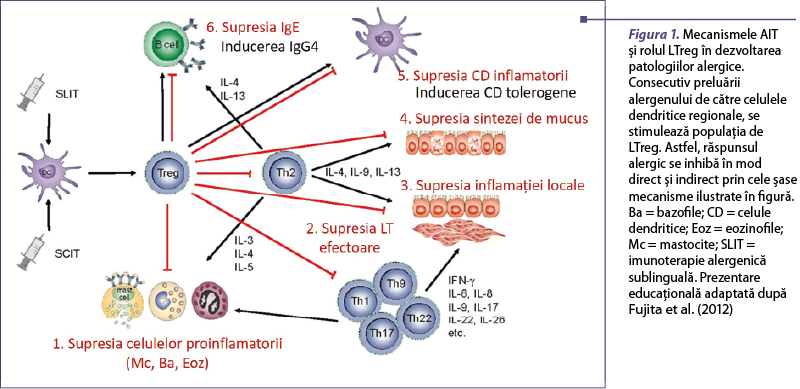
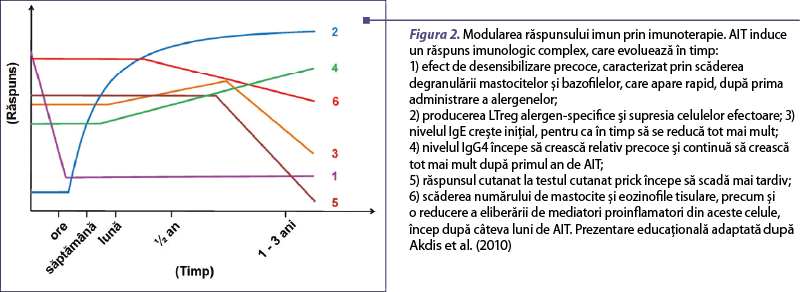
Noi aspecte în abordarea formelor moleculare de vaccin
Caracterizarea moleculară a alergenelor a condus la progrese importante în dezvoltarea şi producerea de forme specifice de imunoterapie, ultimele studii axându-se asupra vaccinării profilactice bazate pe tehnologii ce utilizează ADN‑ul recombinat şi peptide sintetice obţinute prin metode chimice(16,17).
Progresul în dezvoltarea unui tip de vaccin în care triada siguranţă–aderenţă–eficacitate este îndeplinită la un nivel cât mai înalt se realizează cu ajutorul noilor tehnologii de biologie moleculară, inginerie genetică şi bioinformatică(16,18).
Clasificând tipurile de imunoterapie în funcţie de bazele moleculare utilizate, la ora actuală există în studiu vaccinuri care conţin(16,19):
-
peptide care includ epitopi ai limfocitelor t (t cell epitope-containing peptides)
-
vaccinuri bazate pe epitopul limfocitului b (b cell epitope-containing vaccins)
-
hipoalergene recombinate (recombinant hypoallergens)
-
vaccinuri care au la bază acizi nucleici (nucleic acid-based vaccines)
-
alergene cpg-conjugate (cpg-conjugated allergens)
-
alergene de tip sălbatic recombinate (recombinant wild-type allergens)
-
peptide transportoare recombinate (recombinant peptide carrier-based ait).
Principiul imunoterapiei alergenice constă din administrarea repetată, în doze crescânde, a alergenului, cu scopul de a modifica răspunsul imunologic alergen-specific al pacientului şi de a induce toleranţă faţă de acesta. Iniţial se utilizau pentru AIT extracte alergenice şi proteine purificate din sursele naturale de alergen, uneori cu efecte adverse greu de tolerat, ceea ce a dus la dezvoltarea unor metode de modificare chimică a extractelor alergenice, cu activitate alergenică scăzută(20). Un pas important pentru AIT l-a reprezentat elucidarea secvenţei de aminoacizi şi a structurii alergenelor prin tehnici de clonare moleculară, precum şi producerea de alergene recombinate(21). Astfel a devenit posibilă şi producerea unor peptide sintetice cu epitopi pentru limfocitele T sau B şi a unor derivaţi hipoalergenici, aceste molecule fiind apoi testate în studii clinice(22).
Cartarea epitopilor alergenici pentru limfocitele B (deci pentru IgE) şi T este deosebit de utilă pentru producerea unor peptide care pot fi utilizate cu efecte adverse minime în imunoterapia alergenică.
Epitopii alergenici pentru limfocitele T sunt secvenţe liniare din alergene care se leagă de receptorii alergen-specifici ai limfocitelor T şi care nu prezintă reactivitate IgE. Astfel, capacitatea lor de a lega încrucişat IgE alergen-specifice este mult redusă, ceea ce are drept rezultat o scădere a efectelor adverse IgE-mediate. Aceşti epitopi de dimensiune redusă de obicei nu induc producţie de imunoglobuline G specifice care să blocheze alergenul, astfel încât efectul lor terapeutic se bazează doar pe inducerea imunotoleranţei prin limfocite T producătoare de IL-10(24).
Imunoglobulinele E recunosc în principal epitopi conformaţionali (discontinui), care de obicei se găsesc la nivelul suprafeţei expuse a alergenului. Epitopii conformaţionali se formează prin alăturarea unor porţiuni ale alergenelor care vin în proximitate spaţială în molecula pliată şi care vor fi recunoscute ca atare de către IgE(25). Dacă structura cuaternară a moleculei alergenice se pierde (de exemplu, când alergenul este fragmentat), epitopii IgE conformaţionali vor fi distruşi, rezultând molecule hipoalergenice, cu reactivitate IgE scăzută sau absentă.
Moleculele hipoalergenice pot fi exprimate ca molecule recombinate prin utilizarea unor organisme precum Escherichia coli. Reactivitatea IgE se poate reduce semnificativ prin diferite tehnici de biologie moleculară, precum introducerea unor mutaţii în secvenţa peptidică, reasamblarea sau deleţia unor secvenţe ori oligomerizarea moleculelor(26). Majoritatea epitopilor pentru limfocitele T sunt păstraţi în moleculele hipoalergenice. Aceste molecule pot fi grefate pe proteine transportoare nonalergenice, pentru a se obţine peptide legate de transportor fără reactivitate IgE, dar care pot fi utilizate pentru inducerea de răspunsuri IgG alergen-specifice după imunizare. IgG astfel induse se leagă de peptidele alergenului pliat şi ocupă aminoacizi din cadrul epitopilor IgE conformaţionali, blocând legarea IgE de alergen (figurile 3 şi 4)(27).
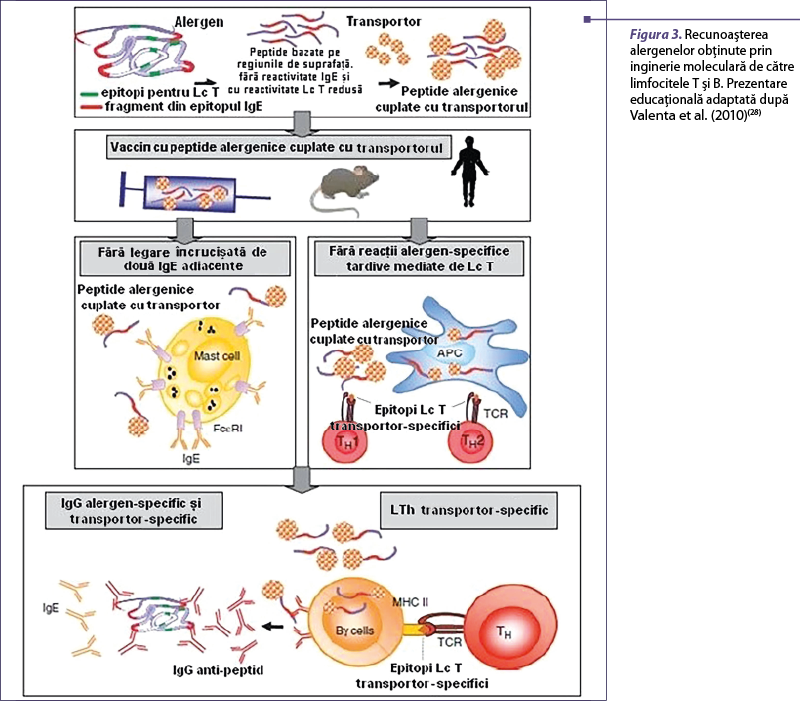
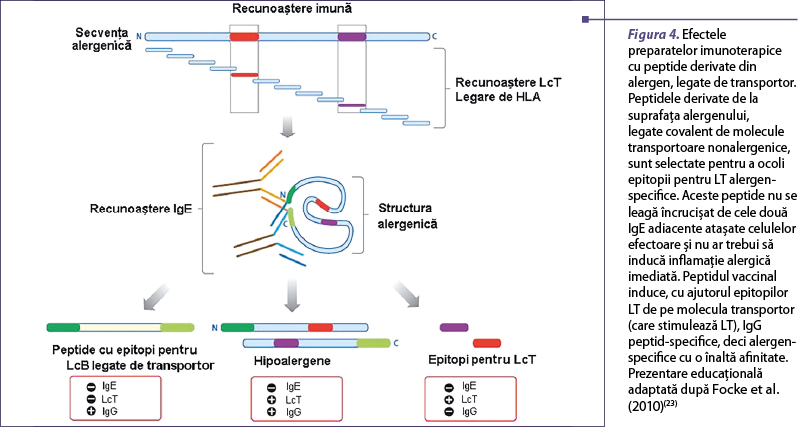
Strategii de administrare a imunoterapiei
La momentul actual se utilizează mai multe tipuri de imunoterapie, cele mai comune fiind administrate pe cale subcutanată (SCIT) şi sublinguală (SLIT), iar cel mai nou dezvoltate fiind pe calea inhalatorie, intranazală, epicutanată sau intralimfatică(16,29).
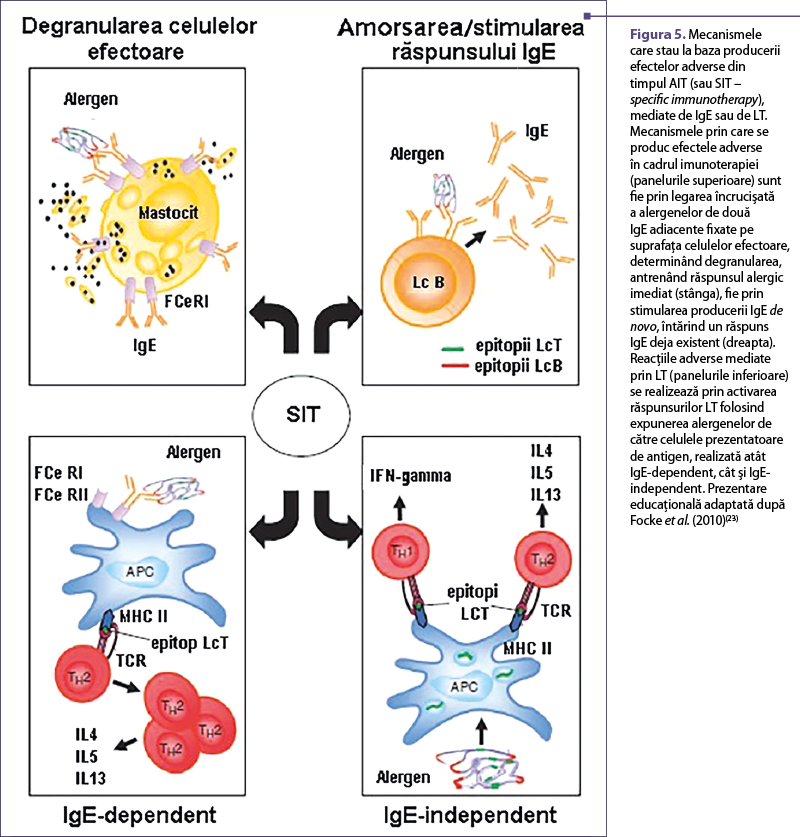
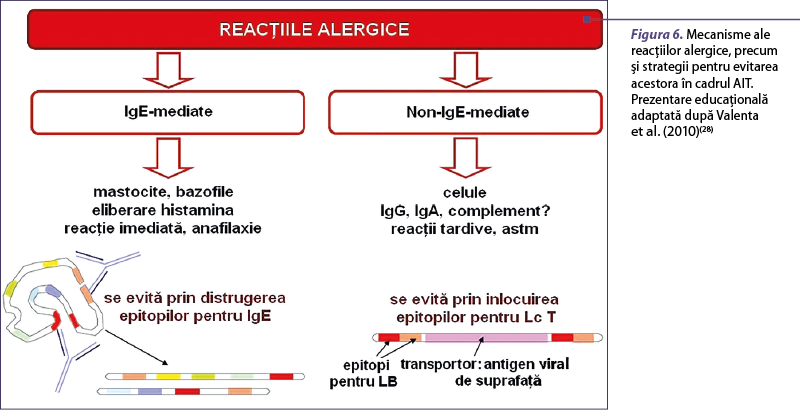
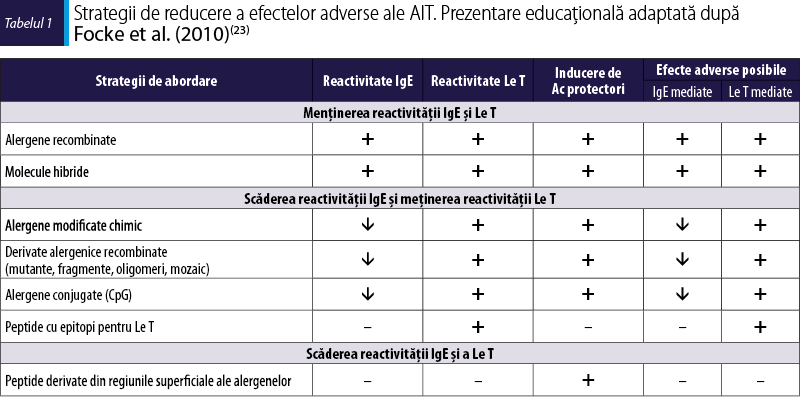
Preparatele care s-au folosit în trecut pentru AIT aveau marele dezavantaj că produceau adesea reacţii adverse (figura 5). În consecinţă, a fost necesară reducerea reacţiilor adverse. Acest deziderat ar putea fi obţinut prin folosirea unor adjuvanţi, cum ar fi hidroxidul de aluminiu, care stabilizează extractul alergenic(16). Un alt mod de a diminua efectele secundare este prin reducerea reactivităţii IgE a extractelor alergenice şi reţinerea epitopilor limfocitelor T, prin inginerie genetică a derivaţilor alergenelor hipoalergenice recombinate sau denaturarea chimică a alergenelor recombinate(16,29). Au fost abordate mai multe tehnici, precum producţia de fragmente de alergene recombinante, alergene mutante şi produse de tip mozaic. Astfel de substanţe modificate care prezintă reactivitate IgE redusă sunt denumite alergoizi(16). În prezent este posibilă studierea contribuţiei efectelor IgE-mediate, respectiv non-IgE-mediate, la dezvoltarea inflamaţiei alergice, prin compararea peptidelor cu epitopi pentru limfocitele T (non-IgE-reactive) şi a derivaţilor hipoalergenici cu alergenul sălbatic corespunzător (IgE-reactiv). Inflamaţia alergică IgE-mediată este în mod clasic indusă de degranularea mastocitelor şi bazofilelor, care este mecanismul-cheie pentru reacţia alergică imediată. Cu toate acestea, activarea non-IgE-mediată a limfocitelor T, răspunsurile IgA şi IgG alergen-specifice şi activarea complementului pot contribui în diferite proporţii la dezvoltarea inflamaţiei alergice, dar mecanismele acestor fenomene nu sunt în totalitate cunoscute. Aceste mecanisme, precum şi posibilele modalităţi de contracarare în cadrul AIT sunt prezentate în figura 6 şi în tabelul 1.
La momentul actual, imunoterapia se realizează cu ajutorul a două tipuri de preparate care conţin ca elemente de bază alergoizi şi derivaţi ai acestora, respectiv extracte alergenice. Avantajul revine produselor care conţin alergoizi, datorită faptului că acestea sunt dezvoltate prin inginerie moleculară şi astfel vor avea o alergenicitate mai scăzută, menţinându-şi în acelaşi timp imunogenicitatea crescută(30).
Administrarea AIT se recomandă a fi continuă, cu o perioadă de iniţiere şi una de menţinere. Se începe cu doze progresiv crescânde de preparat alergenic până la atingerea dozei de menţinere, pentru aproximativ 3-6 luni (perioada de iniţiere). Ulterior acestei etape urmează perioada de menţinere, care constă în administrarea de rapeluri vaccinale la intervale de 4-8 săptămâni(3).
Durata medie a terapiei este între 3 şi 5 ani. Pe parcursul acestui timp îndelungat în care pacientul primeşte preparatele imunoterapice, organismul reuşeşte să antagonizeze răspunsul alergic, conferindu-se toleranţă imunologică şi asigurându-se astfel un management superior al afecţiunilor alergice induse de alergene(31).
AIT are ca indicaţii tratamentul formelor moderat-severe de alergie, cel mai frecvent implicate fiind rinita, conjunctivita şi astmul alergic(9). Avantajul major al AIT în gestionarea pacienţilor cu RA este rerezentat de prevenţia apariţiei astmului şi reducerea noilor sensibilizări(10).
Momentan sunt disponibile diverse preparate care conţin polenuri de graminee, arbori şi buruieni (ambrozia şi pelinariţă), acarieni, mai multe specii de mucegaiuri şi epitelii de animale(3). Conform metaanalizei realizate de Kakourou în 2017, există dovezi clare ale beneficiilor imunoterapiei alergenice cu acarieni din praful de casă, polen de graminee, păr de câine/pisică, beneficii sugerate dar neconfirmate ale celei cu polen de arbori şi nu s-au observat beneficii ale imunoterapiei cu mucegaiuri(32).
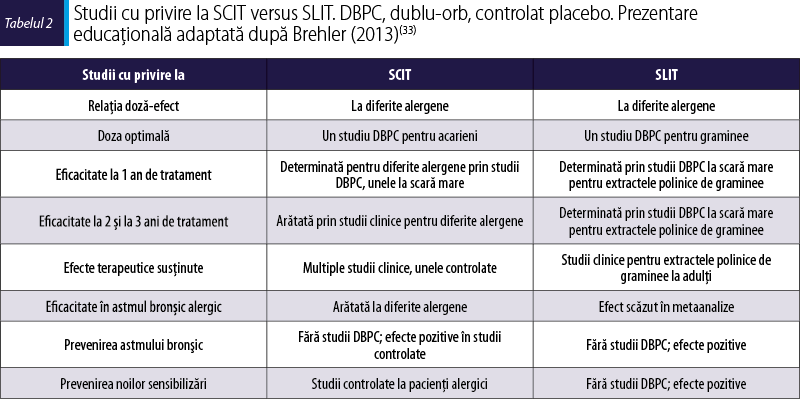
În ceea ce priveşte căile uzuale de administrare a imunoterapiei alergenice, respectiv cea subcutanată şi cea sublinguală, studiile clinice arată că ambele sunt benefice (tabelul 2), cu menţiunea că există puţine studii care să le compare direct.
Perspectivele intervenţiei terapeutice eficiente
În cele din urmă, a devenit evident faptul că unul dintre marile avantaje ale AIT este capacitatea acesteia de a preveni progresia formelor uşoare către cele severe de alergie(16). S-a demonstrat că AIT poate preîntâmpina dezvoltarea astmului la cei cu rinită, când este administrată de la vârste timpurii, în perioada copilăriei. În consecinţă, s-ar putea lua în considerare aplicarea AIT la copii deja sensibilizaţi, dar care încă nu sunt simptomatici, aceasta reuşind să împiedice dezvoltarea manifestărilor alergice. Treptat, apar tot mai multe studii care explorează imunoterapia profilactică(34). Cu toate acestea, va fi necesar să implementăm tehnologii inovatoare în AIT, care să inducă în mod selectiv un răspuns susţinut de protecţie prin IgG, fără stimularea producţiei de IgE(35).
După Valenta R. et al., există trei categorii de intervenţii terapeutice propuse pentru tratamentul patologiei alergice(16).
Primul demers presupune prevenirea sensibilizării IgE în prima copilărie, fie prin vaccinarea timpurie a copiilor, fie prin vaccinarea mamelor care încă nu au fost sensibilizate, astfel încât să transfere anticorpi de protecţie urmaşilor (figura 7). În acest mod se realizează blocarea răspunsul imun şi, consecutiv, prevenirea dezvoltării seriei clonale de limfocite Th2 care reacţionează la contactul cu alergenele(34,36).
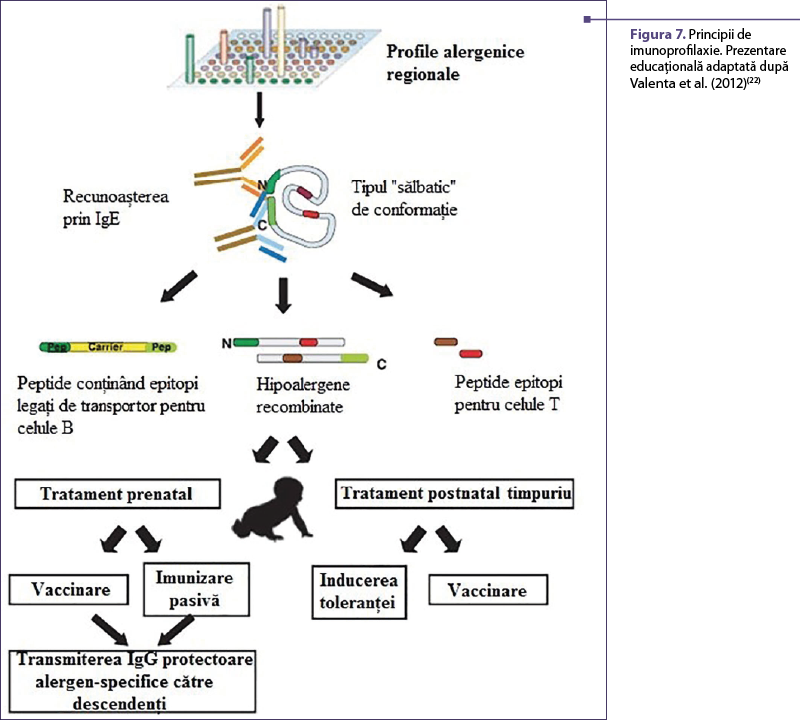
Cea de-a doua variantă presupune utilizarea tratamentului antiinflamator (glucocorticoizi) sau a imunoterapiei. Profilaxia secundară se realizează prin împiedicarea progresiei de la sensibilizarea IgE clinic silenţioasă înspre alergie simptomatică sau prin stoparea progresiei de la forme uşoare până la cele severe (de exemplu, rinită-astm). Aceasta va duce la blocarea activării limfocitelor Th2 alergen specifice, fie direct fie indirect prin efectele medicaţiei asupra celulelor prezentatoare de antigen(9,16).
A treia posibilitate este de a bloca moleculele efectoare care provoacă simptomele clinice ale bolii alergice: de exemplu, prin tratamentul cu antihistaminice, cu antagonişti ai leucotrienelor, cu anticorpi neutralizanţi specifici pentru citokine Th2 sau cu anticorpi specifici pentru IgE(1,16).
Concluzii
Patologia alergică are un impact semnificativ asupra calităţii vieţii pacienţilor prin prisma simptomatologiei diversificate şi persistente dobândite în urma sensibilizării. Formele moderate sau severe de boală tind să fie mai dificil de controlat cu ajutorul medicaţiei simptomatice şi, prin urmare, necesită un alt tip de terapie, care să ducă la îmbunătăţirea prognosticului. AIT este astfel recomandată acelora la care terapia farmacologică nu are efectul scontat sau nu este tolerată.
Imunoterapia alergenică este singura terapie care modifică evoluţia bolii, schimbând răspunsul alergic al pacienţilor într-unul care conferă toleranţă imunologică. În consecinţă, aceasta va favoriza regresia fenomenelor alergice şi va duce la scăderea susceptibilităţii pentru neosensibilizări ulterioare, pentru o perioadă mai lungă ulterior întreruperii AIT(3).
Din cauza creşterii exponenţiale a frecvenţei alergiilor în populaţia generală, se amplifică nevoia de a avea un tratament cauzal al acestora. Eficienţa demonstrată a preparatelor de imunoterapie arată necesitatea dezvoltării prin inginerie moleculară a unor noi tipuri de vaccinuri în care triada siguranţă–aderenţă–eficacitate să prezinte îmbunătăţiri semnificative, astfel încât acestea să fie utile atât pentru tratament, cât şi pentru profilaxie.
În completarea anamnezei şi a testelor prick cutanate, profilul imunologic al pacientului realizat prin tehnici singleplex sau multiplex este un adjuvant eficace pentru stabilirea indicaţiei de imunoterapie, asigurându-se în acest mod un tratament ţintit(31).
Dezvoltările recente susţin indicaţia preparatelor de tip alergoid, create prin recombinare moleculară, în defavoarea extractelor alergenice, datorită profilului lor sporit de siguranţă şi faptului că şi-au dovedit eficienţa ca tratament imunomodulator. Pentru durata optimă de 3 ani de administrare, SCIT are în prezent cele mai multe studii care îl recomandă ca tratament. Cu toate acestea, SLIT este tot mai promovat, în mod special pentru alergia la graminee(16,37,38).
Imunoprofilaxia alergenică este destinată a-i ajuta pe copiii alergici asimptomatici, dar şi pe mamele alergice la vârsta fertilă, cu scopul de a reduce atopia şi predispoziţia pentru alergii în viitor, fapt intens studiat în ultimul deceniu(34).
Studiile farmacoeconomice au demonstrat avantajul net al AIT în comparaţie cu terapiile farmacologice. Dar, chiar dacă pe termen lung raportul cost-beneficiu este în favoarea AIT şi acest tratament a fost inclus în ultimii ani în ghidurile internaţionale ARIA şi GINA, costurile iniţiale sunt destul de ridicate, iar aderenţa pacienţilor la terapie este uneori insuficientă, principala cauză fiind durata lungă a curei terapeutice. Aşadar, AIT este încă insuficient utilizată(9,10).
Acest articol a fost elaborat în cadrul proiectului INSPIRED (Strategii inovative pentru prevenţia, diagnosticul şi terapia afecţiunilor respiratorii induse de polenul de ambrozia), cod SMIS 103662.
Bibliografie
- Long A, Borro M, Sampath V, Chinthrajah RS. New Developments in Non-allergen-specific Therapy for the Treatment of Food Allergy. Current Allergy and Asthma Reports. 2020. 20:3 https://doi.org/10.1007/s11882-020-0897-8.
- Bousquet JJ, Schünemann HJ, Togias A, Erhola M, Hellings PW, Zuberbier T, Agache I et al. Next-generation ARIA care pathways for rhinitis and asthma: a model for multimorbid chronic diseases. Bousquet et al. Clin Transl Allergy. 2019; 9:44 https://doi.org/10.1186/s13601-019-0279-2.
- Chen KW, Marusciac L, Tamas PT, et al. Ragweed Pollen Allergy: Burden, Characteristics, and Management of an Imported Allergen Source in Europe. Int Arch Allergy Immunol. 2018;176:163–180; DOI: 10.1159/000487997.
- Akdis CA, Akdis M. Mechanisms of allergen-specific immunotherapy and immune tolerance to allergens. Akdis and Akdis World Allergy Organization Journal. 2015; 8:17 DOI 10.1186/s40413-015-0063-2.
- Fujita H, Soyka MB, Akdis M, Akdis CA. Mechanisms of allergen-specific immunotherapy. Clinical and Translational Allergy. 2012; 2:2 http://www.ctajournal.com/content/2/1/2.
- Moote W, Kim H. Allergen-specific immunotherapy. Asthma & Clinical Immunology. 2011; 7(Suppl 1):S5.
- Globinska A, Boonpiyathad T, Satitsuksanoa P, et al. Mechanisms of allergen-specific immunotherapy. Diverse mechanisms of immune tolerance to allergens. Ann Allergy Asthma Immunol. 2018; 121: 306-312.
- Tankersley M, Han JK, Nolte H, Clinical Aspects of Sublingual Immunotherapy Tablets and Drops, Annals of Allergy, Asthma and Immunology. 2020; doi: https://doi.org/10.1016/ j.anai.2019.12.025.
- Pfaar O, Agache I, Blay F, et al. Perspectives in allergen immunotherapy: 2019 and beyond. Allergy. 2019; 74(Suppl. 108):3–25. DOI: 10.1111/all.14077.
- Brożek JL, Bousquet J, Agache I, et al. Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines–2016 revision. J. Allergy Clin. Immunol. 2017; 140, 950–958.
- Eckl-Dorna J, Villazala-Merino S, Campion NJ, Byazrova M, Filatov A, Kudlay D, Karsonova A, Riabova K, Khaitov M, Karaulov A, Niederberger-Leppin V, Valenta R. Tracing IgE-Producing Cells in Allergic Patients. Cells. 2019; 8, 994; doi:10.3390/cells8090994.
- Steveling-Klein EH. Allergen-Specific Immunotherapy. EMJ. 2016;1[4]:78-87.
- Shamji MH, Kappen JH, Akdis M, Jensen-Jarolim E, Knol EF, Kleine-Tebbe J, Bohle B, Chaker AM, Till SJ, Valenta R, Poulsen LK, Calderon MA, Demoly P, Pfaar O, Jacobsen L, Durham SR, Schmidt-Weber CB. Biomarkers for monitoring clinical efficacy of allergen immunotherapy for allergic rhinoconjunctivitis and allergic asthma: an EAACI position paper. Allergy. 2017; 72: 1156–1173.
- Rauber MM, Möbs C, Campana R, Henning R, Schulze‐Dasbeck M, Greene B, Focke‐Tejkl M, Weber M, Valenta R, Pfützner W. Allergen immunotherapy with the hypoallergenic B-cell epitope-based vaccine BM32 modifies IL-10- and IL-5-secreting T cells. Allergy. 2019; DOI: 10.1111/all.13996.
- Akdis CA, Akdis M. Mechanisms of allergen-specific immunotherapy. J Allergy Clin Immunol. 2011; doi:10.1016/j.jaci.2010.11.030.
- Valenta R, Campana R, Focke-Tejkl M, Niederberger V. Vaccine development for allergen-specific immunotherapy based on recombinant allergens and synthetic allergen peptides: Lessons from the past and novel mechanisms of action for the future. J Allergy Clin Immunol. 2016 February; 137(2): 351–357. doi:10.1016/j.jaci.2015.12.1299.
- Curin M, Khaitov M, Karaulov A, Namazova-Baranova L, Campana R, Garib V, Valenta R. Next-Generation of Allergen-Specific Immunotherapies: Molecular Approaches. Current Allergy and Asthma Reports (2018) 18: 39 https://doi.org/10.1007/s11882-018-0790-x.
- Zhernov Y, Curin M, Khaitov M, Karaulov A, Valenta R. Recombinant allergens for immunotherapy: state of the art. Curr Opin Allergy Clin Immunol. 2019 August; 19:402–414 DOI:10.1097/ACI.0000000000000536.
- Valenta R, Campana R, Niederberger V. Recombinant allergy vaccines based on allergen-derived B cell epitopes. Immunol Lett. 2017 September; 189: 19–26. doi:10.1016/j.imlet.2017.04.015.
- Lee WY, Sehon AH. Abrogation of reaginic antibodies with modified allergens. Nature. 1977 Jun16; 267(5612):618-9.
- Valenta R, Ferreira F, Focke-Tejkl M, Linhart B, Niederberger V, Swoboda I, Vrtala S. From allergen genes to allergy vaccines. Annual review of immunology. 2009 Apr 23; 28:211-41.
- Valenta R, Campana R, Marth K et al. Allergen‐specific immunotherapy: from therapeutic vaccines to prophylactic approaches. Journal of Internal Medicine. 2012 Aug; 272(2):144-57.
- Focke M, Swoboda I, Marth K, Valenta R. Developments in allergen-specific immunotherapy: from allergen extracts to allergy vaccines bypassing allergen-specific immunoglobulin E and T cell reactivity. Clinical & Experimental Allergy, 2010; 40, 385–397; doi: 10.1111/j.1365-2222.2009.03443.x.
- Larché M. T cell epitope-based allergy vaccines. In Vaccines against Allergies. 2011; (pp. 107-119). Springer, Berlin, Heidelberg.
- Greene WK, Cyster JG, Chua KY, O’brien RM, Thomas WR. IgE and IgG binding of peptides expressed from fragments of cDNA encoding the major house dust mite allergen Der p I. The Journal of Immunology. 1991 Dec 1; 147(11):3768-73.
- Valenta R, Linhart B, Swoboda I, Niederberger V. Recombinant allergens for allergen‐specific immunotherapy: 10 years anniversary of immunotherapy with recombinant allergens. Allergy. 2011 Jun; 66(6):775-83.
- Van Milligen FJ, van’t Hof W, van den Berg M, Aalberse RC. IgE epitopes on the cat (Felis domesticus) major allergen Fel d I: a study with overlapping synthetic peptides. Journal of allergy and clinical immunology. 1994 Jan 1; 93(1):34-43.
- Valenta R, Ferreira F, Focke-Tejkl M, Linhart B, Niederberger V, Swoboda I, Susanne Vrtala S. From Allergen Genes to Allergy Vaccines. Annu. Rev. Immunol. 2010; 28:211–4; doi: 10.1146/annurev-immunol-030409-101218.
- Nelson HS. Allergy immunotherapy for inhalant allergens: Strategies to improve efficacy. Allergy Asthma Proc 41:26–37, 2020; doi: 10.2500/aap.2020.41.190013.
- Lupinek C, Wollmann E, Valenta R. Monitoring Allergen Immunotherapy Effects by Microarray. Curr Treat Options Allergy. 2016; 3:189–203 DOI 10.1007/s40521-016-0084-2.
- Valenta R, Karaulov K, Niederberger V, Zhernov Y, Elisyutina O, Campana R, Focke-Tejkl M, Curin M, Namazova-Baranova L, Wang JY, Pawankar R, Khaitov M. Allergen Extracts for In Vivo Diagnosis and Treatment of Allergy: Is There a Future? J Allergy Clin Immunol Pract. 2018; 6(6): 1845–1855.e2. doi:10.1016/j.jaip.2018.08.032.
- Dhami S, Kakourou A, Asamoah F, Agache I, Lau S, Jutel M, Muraro A, Roberts G, Akdis CA, Bonini M, Cavkaytar O. Allergen immunotherapy for allergic asthma: a systematic review and meta‐analysis. Allergy. 2017 Dec; 72(12):1825-48.
- Brehler R, Klimek L, Kopp MV, Virchow JC. Specific immunotherapy—Indications and mode of action. Deutsches Ärzteblatt International. 2013 Mar; 110(9):148.
- Eckl-Dorna J, Villazala-Merino S, Linhart B, Karaulov AV, Zhernov Y, Khaitov M, Niederberger-Leppin V, Valenta R. Allergen-Specific Antibodies Regulate Secondary Allergen-Specific Immune Responses. Front. Immunol. 2019; 9:3131. doi: 10.3389/fimmu.2018.03131.
- Zidarn M, Robič M, Krivec A, Šilar M, Resch-Marat Y, Vrtala S, Kopač P, Bajrović N, Valenta R, Korošec P. Clinical and immunological differences between asymptomatic HDM-sensitized and HDM-allergic rhinitis patients. Clin Exp Allergy . 2019 February 7; 49(6): 808–818. doi:10.1111/cea.13361.
- Lupinek C, Hochwallner H, Johansson C, Mie A, Rigler E, Scheynius A, Alm J, Valenta R. Maternal allergen-specific IgG might protect the child against allergic sensitization. J Allergy Clin Immunol . 2019 January 25; 144(2): 536–548. doi:10.1016/j.jaci.2018.11.051.
- Frølund L, Durham SR, Calderon M, Emminger W, Andersen JS, Rask P, et al. Sustained effect of SQ-standardized grass allergy immunotherapy tablet on rhinoconjunctivitis quality of life. Allergy. 2010; 65:753–757.
- Durham SR, et al. SQ-standardized sublingual grass immunotherapy: Confirmation of disease modification 2 years after 3 years of treatment in a randomized trial. Journal of Allergy and Clinical Immunology. 2011; Volume 129, Issue 3, 717 - 725.e5. https://doi.org/10.1016/j.jaci.2011.12.973.
Articole din ediţiile anterioare
Diagnosticul molecular în alergiile alimentare
Diagnosticul molecular al alergiilor (component-resolved diagnosis; CRD) s-a îmbunătăţit în ultimii ani datorită producţiei de materiale de testare...
Cartoful alb – o cauză rară de anafilaxie la copii
În literatura de specialitate au fost descrise sporadic reacţii alergice atât la cartoful crud, cât şi la cartoful gătit(1). Se estimează că 5% din...
Alergia alimentară la oul de găină. Actualizări în diagnosticul şi abordarea terapeutică
Alergia alimentară la ou este frecventă în rândul populaţiei pediatrice, manifestându-se prin diferite fenotipuri clinice. Lucrarea de faţă are ca ...
Ce ştim despre sindromul Frey?
Sindromul Lucja Frey, descris de medicul neurolog cu acelaşi nume, este o afecţiune rar întâlnită, care se caracterizează prin eritem şi disconfort...