Cough is a common symptom which makes the patient to address for medical attention when it no longer improves and becomes annoying. Cough lasting more than 8 weeks is evaluated as chronic, refractory, idiopathic or unexplained, that does not respond to classic antitussive preparations and requires a differentiated and thorough approach. Cough and non-cough stimuli, including subtreshold, through a series of biological peptides, mediators of inflammation and immune processes, can generate a series of nonspecific mechanisms. In these cases, new strategies are needed based on the elucidation of peripheral and central mechanisms of hypersensitivity to cough. Research on centrally acting neuromodulators – GABA agonists (baclofen), antidepressants (amitriptyline), antiepileptics (gabepentin, pregabalin), potential transient receptor channel antagonists, new tachykin antagonists, P2X3 purinergic receptor blockers (gefapixant), H1-antihistamines and opioids – opens new perspectives in the pharmacotherapy of chronic refractory cough.
Abordări farmacoterapeutice ale tusei cronice
Pharmacotherapeutic approaches to chronic cough
First published: 30 noiembrie 2021
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Farm.203.6.2021.5748
Abstract
Rezumat
Tusea constituie un simptom frecvent, care face pacientul să solicite asistenţă medicală când aceasta nu se mai ameliorează şi devine supărătoare. Tusea cu o durată mai mare de opt săptămâni care a beneficiat de tratament se consideră ca fiind cronică, refractară, idiopatică sau inexplicabilă, care nu răspunde la preparatele antitusive clasice şi necesită o abordare diferenţiată şi minuţioasă. Stimulii tusivi şi nontusivi, inclusiv cei subpragali, prin intermediul unui şir de peptide biologice, mediatori ai inflamaţiei şi procesele imune, pot genera o serie de mecanisme nespecifice. În aceste cazuri sunt necesare strategii noi în baza elucidării mecanismelor periferice şi centrale ale hipersensibilităţii la tuse. Cercetarea neuromodulatorilor cu acţiune centrală – agoniştii GABA (baclofen), antidepresivele (amitriptilina), antiepilepticele (gabepentina, pregabalina), antagoniştii canalelor potenţiale receptor tranzitoriu, antagoniştii tahikininelor, blocantele receptorilor purinergici P2X3 (gefapixant), H1-antihistaminicele şi opioidele – deschide noi perspective în farmacoterapia tusei cronice refractare.
Tusea este o problemă medicală frecventă, iar povara socioeconomică este substanţială. Tusea constituie un simptom frecvent (locul al cincilea după incidenţa de adresare la medic), iar tusea cronică poate fi prezentă la 4-20% din populaţie. Un sondaj internaţional recent, realizat pe 10 032 de pacienţi adulţi din clinici specializate pe tuse, a demonstrat că două treimi dintre ei sunt femei şi cea mai frecventă vârstă de prezentare a fost cea de 60 de ani. Se presupune că modelul demografic distinct este legat de diferenţele de sex în procesarea centrală a senzaţiei de tuse. Cele mai frecvente afecţiuni asociate tusei sunt sindromul colonului iritabil, obezitatea şi o varietate de sindroame neuropatice. Tusea cronică iatrogenă după tratamentele medicamentoase este adesea nerecunoscută(5,8,9,10,12).
La pacienţii care suferă de mai multe maladii, tusea poate deveni hiperactivă, neproductivă sau supărătoare, fiind unul dintre cele mai frecvente motive pentru care oamenii solicită sfatul medicului. Deşi tusea poate fi adesea gestionată prin tratarea bolii asociate, la o parte dintre pacienţi se dovedeşte a fi un simptom supărător care este refractar la terapii. Se estimează că la între 20% şi 46% dintre pacienţii care se prezintă la clinicile specializate de tuse, în pofida evaluărilor clinice minuţioase, cauza rămâne necunoscută şi tusea este refractară la terapiile destinate tratamentului bolii. Un sondaj desfăşurat în 29 de ţări europene a demonstrat că o bună parte dintre indivizii (până la 70%) cu tuse problematică raportează că medicul lor nu a „tratat în detaliu tusea” sau că medicamentele au fost cu spectru îngust (57%) sau ineficiente (36%) şi doar 7% dintre respondenţi au raportat că medicamentele sunt eficiente. Încercările timpurii de a diagnostica şi de a trata în mod adecvat tusea (protocolul anatomo-diagnostic) a părut iniţial eficace la mulţi pacienţi cu tuse cronică, dar alţii au raportat că astfel de abordări ar putea să nu identifice cauza tusei în 40% dintre cazuri(7).
Din punct de vedere clinic, tusea, în funcţie de durată, este definită ca: acută (până la trei săptămâni cel mai frecvent asociată unei infecţii virale a tractului respirator superior); subacută (între trei şi opt săptămâni şi se datorează probabil unei tuse postvirale care se rezolvă lent); cronică (peste opt săptămâni şi poate apărea ca o problemă clinică izolată sau asociată cu afecţiuni respiratorii şi nonrespiratorii). Este evident că tusea se asociază cel mai frecvent cu patologia căilor respiratorii, dar ea poate fi cauzată şi de afecţiunile otolaringologice (rinosinuzitele cronice), ale tubului digestiv (boala de reflux gastroesofagian), cardiopulmonare, reumatologice, metabolice sau de utilizare a medicamentelor (inhibitori ai enzimei de conversie a angiotensinei, beta-adrenoblocante, preparate antiretrovirale, alfa-interferon etc.). Recunoaşterea tusei cronice ca o problemă clinică importantă a necesitat elaborarea şi perfectarea unor strategii de diagnostic diferenţial şi tratament. Uneori, în pofida investigaţiilor ample şi a studiilor de terapie empirică, cauza tusei rămâne inexplicabilă şi în astfel de cazuri vorbim despre tuse cronică idiopatică sau inexplicabilă(1,5,8,9,10,12,15).
Tusea cronică este o afecţiune clinică dificil de tratat, care atrage o atenţie din ce în ce mai mare în ultimii ani. Prevalenţa sa mai mare în rândul vârstnicilor sugerează că povara tusei cronice poate continua să crească. Deşi nu are legătură directă cu mortalitatea, tusea cronică are un impact asupra activităţilor zilnice, provocând o afectare semnificativă a calităţii vieţii şi determină frecvent izolarea socială a persoanelor afectate. Simptomele adverse asociate cu tusea cronică pot fi destul de variate. Cele mai frecvente motive pentru care pacienţii cu tuse cronică solicită asistenţă medicală includ îngrijorarea cu privire la o boală subiacentă gravă, vomă, epuizare, tulburări de somn, jenă socială, dificultăţi de a vorbi la telefon, incontinenţă urinară şi stare de nervozitate faţă de familie, prieteni şi colegi. Impactul tusei cronice asupra calităţii vieţii este determinat de incontinenţa urinară de efort, interferenţa cu vorbirea şi depresia, precum şi de unele consecinţe mai grave, ca sincopa(2,8,12,13).
Tusea este o caracteristică pentru circa 100 de diverse maladii. O trăsătură comună a pacienţilor cu tuse cronică este sensibilitatea exagerată la stimuli tusivi şi nontusivi, care se dezvoltă prin mecanisme multiple care contribuie la sensibilizarea neuronală, inclusiv sensibilitatea crescută şi expresia nociceptorilor specifici pe neuroni, expresia de novo a nociceptorilor de către neuroni non‑nociceptori, densitatea crescută a nervilor epiteliali şi eliberarea crescută de substanţe endogene care declanşează tusea în căile respiratorii. O varietate de mediatori inflamatori (leucotriene, bradikinină, neurokinine, prostanoizi, mediatori lipidici şi adenozin trifosfat), care se eliberează la expunerea la alergeni, infecţii virale, fumul de ţigară, ozon etc., contribuie la sensibilizarea nervilor şi la declanşarea tusei. Sensibilizarea neuronală este o parte a spectrului de remodelare a căilor respiratorii în tusea cronică, care include afectarea epitelială a căilor respiratorii, îngroşarea membranei bazale şi un aflux de celule inflamatorii (mastocite, eozinofile). Din aceste considerente, în funcţie de patogeneza maladiilor şi de rolul mediatorilor inflamaţiei, răspunsul la preparatele antitusive va fi variat la pacienţi diferiţi. S-a demonstrat că pacienţii cu bronhopneumopatie obstructivă cronică (BPOC) şi tuse cronică idiopatică au avut o sensibilitate similară la tuse după inhalarea capsaicinei, dar diferă substanţial sensibilitatea acestora după inhalarea prostaglandinei E2(3).
Reflexul tusei implică anumite structuri, precum: receptorii tusei, nervii aferenţi, centrul tusei, nervii eferenţi, musculatura implicată în respiraţie. Receptorii responsabili de tuse sunt situaţi între celulele epiteliale, preponderent în peretele posterior al faringelui, în laringe, în trahee şi în bifurcarea bronhiilor. Se evidenţiază două tipuri de receptori: de tip iritativ intra- şi extrapulmonari (situaţi proximal, care sunt excitaţi de factorii externi – mecanici, chimici, termici) şi fibrele C şi A intra- şi extrapulmonare (situate distal, care sunt excitate de substanţele endogene – mediatorii inflamaţiei etc.). Nervii aferenţi sunt reprezentaţi de terminaţiile sensibile ale nervilor vagus, trigeminus, glossapharingeus şi phrenicus. Centrul de tuse este situat în bulbul rahidian (medulla oblongata, Pons). Nervii eferenţi sunt reprezentaţi prin vagus, phrenicus, intercostalis, lumbalis, trigiminus, facialis şi hipoglossus. Muşchii respiratori sunt reprezentaţi prin diafragm, muşchii laringelui, traheii, bronhiilor, intercostali, abdominali şi respiratori auxiliari. Tusea poate surveni nu numai în urma excitării receptorilor căilor respiratorii, ci şi a altor mecanisme: reflexul Arnold (afectarea şi neuropatia nervului vagus – 5%, ca urmare a infecţiei virale precedente sau acute, cu dereglări ale fibrelor senzitive şi motorii care determină tusea sau spasmul laringelui); reflexului laringian (fluxul mucusului pe peretele posterior al laringelui în rinita şi sinuzita cronică, cu excitarea receptorilor fibrelor aferente ale vagusului); iritarea esofagului (existenţa receptorilor necunoscuţi). Toate cele descrise confirmă cele trei faze ale reflexului de tuse: inspiratorie, de compresie şi expiratorie(5,9,13).
Tusea cronică persistentă se defineşte ca tuse idiopatică sau neelucidată, tuse cronică refractară şi/sau sindrom de hipersensibilitate al tusei (SHT). Tusea idiopatică se consideră când, după o examinare minuţioasă în clinicile specializate, cauzele nu au fost elucidate. Tusea idiopatică include pacienţii de sex feminin, vârsta medie în perioada menopauzală, frecvent după infecţiile virale, iar circa 30% dintre acestea prezintă tiroidită autoimună cu inflamaţie limfocitară în căile respiratorii şi creşterea nivelului mediatorilor tusei în sputa indusă (histamina, prostaglandinele D2 şi E2). Experţii Societăţii Respiratorii Europene au propus termenul de „sindrom de hipersensibilitate al tusei”, definit ca un „sindrom clinic caracterizat de tusea problematică declanşată de niveluri scăzute de expunere termică, mecanică sau chimică”. Conceptul de bază este că reflexul tusei protectoare se transformă într-o stare exagerată, declanşată de un nivel scăzut de stimuli, care nu ar cauza de obicei tuse. Această stare reflectă exact caracteristicile clinice raportate de pacienţii cu sindromul de hipersensibilitate al tusei provocate de modificările temperaturii mediului ambiant, respiraţia profundă sau vorbirea, expunerea la aerosoli sau consumul de alimente uscate sfărâmicioase. Mecanismele responsabile de această stare clinică nu au fost încă determinate, dar pot fi asociate cu alte concepte ale bolii, cum ar fi durerea neuropatică. Urmând această linie de gândire, tusea declanşată de stimuli inofensivi ar putea fi similară cu alodinia şi tusea excesivă, ca răspuns la o expunere nocivă (hipertusie), care ar putea fi considerată echivalentă cu hiperalgezia. Elucidarea mecanismelor acestor manifestări poate determina dezvoltarea unor strategii terapeutice eficiente în combaterea tusei cronice(5,8,9,10,12,15).
Modificările funcţionale sau fenotipice ale neuronilor senzoriali periferici pot fi răspunsurile adaptive ale gazdei de prim nivel în ceea ce priveşte dezvoltarea hipersensibilităţii reflexe a tusei. Factorii declanşatori externi şi interni, precum infecţia virală, alergenii, eozinofilele, poluanţii aerului sau inflamaţia ulterioară a căilor respiratorii, pot induce o stare de hipersensibilitate funcţională în reflexul tusei, însoţită de modificări funcţionale sau fenotipice ale neuronilor (figura 1). Din punct de vedere clinic, infecţia virală respiratorie este o cauză frecventă a tusei şi poate creşte sensibilitatea la tuse, iar mecanic, infecţia virală sau sechelele inflamatorii pot induce modificări funcţionale în neuronii senzoriali. Studiile experimentale in vitro şi in vivo au demonstrat că virusul infectează celulele neuronale şi reglează rapid expresia canalului potenţial al receptorului tranzitoriu vaniloid-1 (TRPV1) şi ankyrin-1 (TRPA1), implicat în tusea indusă de iritanţii chimici şi fizici, la creşterea expresiei genice a TRPV1 în ganglionii vagali. Modificări funcţionale şi fenotipice similare în neuronii senzoriali ai căilor respiratorii au fost observate în modelele experimentale de inflamaţie alergică prin sensibilizarea cu ovalbumină, care a indus expresia de novo a genei TRPV1 în neuronii ganglionari ai traheii. Eozinofilele pot induce direct hipersensibilitate la tuse, probabil prin proteinele lor cationice şi, de asemenea, pot creşte direct sensibilitatea chimică şi mecanică a fibrelor C aferente pulmonare. În studiile clinice, la astmatici, numărul de eozinofile ale căilor respiratorii şi din sânge s‑a corelat cu lungimea nervilor căilor respiratorii şi cu numărul de puncte ale ramurilor nervoase. Concomitent, într-un alt studiu la astmaticii alergici la inhalarea diferitor alergeni (capsaicina, fumul de tutun etc.) au crescut semnificativ răspunsurile la tuse, cu modificări similare în sistemul nervos al căilor respiratorii(12).
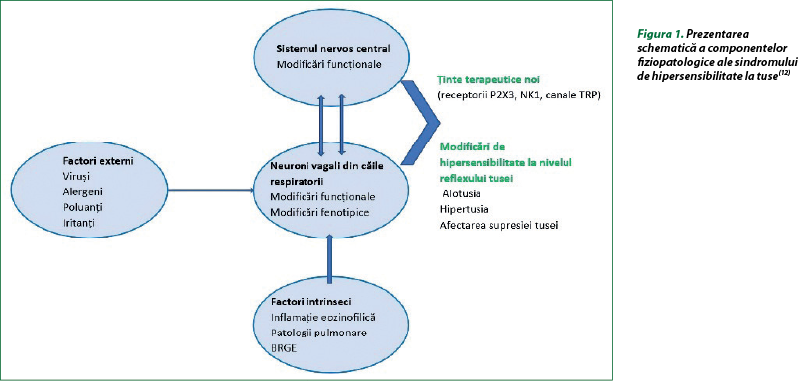
Fenotipurile tusei cronice
Tuse astmatică/bronşită eozinofilă
Pentru a face diferenţierea între diagnosticul clinic de astm bronşic şi tusea astmatică este necesară utilizarea unor biomarkeri, precum infiltrarea eozinofilică, oxidul nitric etc. Inflamarea eozinofilă poate fi un biomarker util al tusei astmatice şi poate avea utilitate în direcţionarea terapiei. Eozinofilia sputei este poate cel mai precis indicator, dar nu este disponibilă în mod obişnuit, necesită timp şi o interpretare de specialitate. Eozinofilia sangvină este o măsură simplă şi disponibilă, dar se caracterizează prin variabilitate diurnă şi sezonieră. Un număr de eozinofile de peste 0,3 celule·µL-1 poate indica inflamaţia eozinofilă a căilor respiratorii. Oxidul nitric expirat poate fi folosit ca marker surogat al inflamaţiei eozinofilice a căilor respiratorii şi al răspunsului la steroizi în astmul clasic, dar rolul său în astm şi în tusea cronică este pus sub semnul întrebării. O metaanaliză a studiilor observaţionale a arătat că oxidul de azot expirat are o specificitate relativ mare, de 0,85, în prezicerea astmului la pacienţii adulţi cu tuse cronică, dar încă nu există un consens cu privire la nivelul‑limită pentru diagnostic. Au fost recunoscute trei subgrupe de tuse astmatică: astmul clasic, care se caracterizează prin variabilitatea fluxului de aer şi hiperreactivitate bronşică (confirmată prin spirometrie); astmul şi tusea ca singurele simptome (tratamentul cu bronhodilatatoare a îmbunătăţit starea pacienţilor cu tuse); bronşita eozinofilă fără bronhoconstricţie sau hiperreactivitate (afecţiune separată – bronşita eozinofilică nonastmatică). Importanţa vitală a stabilirii sau infirmării diagnosticului de tuse astmatică constă în terapie. Ca parte a unui spectru astmatic, tusea cronică poate fi ameliorată dacă toate cele trei subgrupuri pot răspunde la terapia antiinflamatoare a astmului(6).
Tusea de reflux
Rolul refluxului, al dismotilităţii esofagiene şi al aspiraţiei în tusea cronică este controversat. O revizuire nu a găsit beneficii semnificative faţă de placebo ale inhibitorilor pompei de protoni la pacienţii fără reflux acid şi doar beneficii modeste la pacienţii cu reflux acid. S-a sugerat că refluxul nonacid, atât lichid, cât şi gazos, poate fi un factor etiologic. Multe dintre semnele şi simptomele asociate tusei cronice (schimbarea vocii, simptomele nazale, disgeuziile) sunt explicabile prin reflux şi aspiraţie. Aspiraţia conţinutului din tractul gastrointestinal determină un răspuns inflamator prin neutrofile sau eozinofile, cu generarea tusei astmatice şi hipersecreţie de mucus (Morice AH, 2020).
Sindromul tusei căilor respiratorii superioare sau sindromul de drenare postnazală
Sindromul de tuse a căilor respiratorii superioare (rinosinuzită, rinită, drenarea postnazală) ar putea fi acceptat ca etiologie a tusei cronice la unii pacienţi, acţionând ca un declanşator al hipersensibilităţii la tuse. Totuşi, deoarece simptomele şi semnele sunt nespecifice, diagnosticul acestui sindrom nu poate fi făcut numai din istoricul medical şi examenul fizic. Descongestantele şi H1-antihistaminicele au fost recomandate ca tratament. Recomandările pentru tratamentul empiric pot fi utile clinic, dar ele nu confirmă diagnosticul etiologic de tuse, deoarece efectele farmacologice ale H1-antihistaminicelor de primă generaţie nu sunt limitate la căile aeriene superioare, ci includ şi sistemul nervos. Este discutabilă şi relaţia cauzală dintre bolile nazale şi tusea cronică. Senzaţia de drenare postnazală este un fenomen comun, dar doar o mică parte dintre aceşti subiecţi se plâng de tuse. Mucoasa nazală este inervată în primul rând de nervul trigemen, iar stimularea directă a aferenţelor nazale cu histamină sau un iritant la cobai provoacă un reflex de strănut, dar nu induce un răspuns de tuse. Eficacitatea H1-antihistaminicelor de primă generaţie se consideră a fi determinată şi de acţiunea colinoblocantă centrală(4,6).
Tusea iatrogenă
Tusea cronică poate surveni la utilizarea unor medicamente, precum inhibitorii enzimei de conversie (ca urmare a creşterii nivelului bradichininei), bifosfonaţii sau antagoniştii canalelor de calciu (pot agrava boala de reflux preexistentă) sau analogii prostaglandinelor (latanoprost, drenarea prin canalul lacrimal, cu iritarea faringelui). Întreruperea acestor medicamente poate rezolva tusea cronică şi confirma rolul lor etiologic(8).
Tusea cronică se caracterizează prin sensibilitatea crescută a căilor neuronale periferice şi centrale, iar elucidarea mecanismelor responsabile de dezvoltarea tusei va permite elaborarea şi dezvoltarea de noi strategii de tratament şi medicamente eficiente. Neuronii senzoriali ai căilor respiratorii exprimă o varietate de receptori şi canale ionice.
Mecanisme periferice ale tusei cronice refractare
La nivel periferic, nervul vag este stimulat de terminaţiile nervoase aferente din căile respiratorii prin calea exogenă şi endogenă (figura 2a). Calea exogenă este declanşată predominant de stimulii fizici şi chimici (particule din aer, fragmente de alimente aspirate, aer rece, acizi) proveniţi din plămâni, cu implicarea receptorilor TRPV1, TRPA1 şi TRPM8, dar probabil nu şi a P2X3. Calea endogenă este declanşată de ATP, posibil ca răspuns la inflamaţie, sau de alte cauze ale stresului tisular, care interacţionează cu P2X3 şi cu alţi receptori purinergici. La inhalarea agenţilor tusigeni experimentali, tusea se dezvoltă predominant pe calea exogenă, în timp ce ATP declanşează direct calea endogenă. Gefapixantul, antagonist al P2X3, reduce răspunsurile tusive la ATP inhalat, dar nu şi la acid citric sau capsaicină inhalată, în timp ce antagonistul TRPV1 reduce răspunsul tusiv la capsaicina inhalată. În tusea cronică refractară, calea endogenă are probabil un rol mai important, astfel încât gefapixantul, dar nu şi antagoniştii TRPV1 sau TRPA1, va reduce frecvenţa tusei. Poate exista o suprapunere între cele două căi cu soluţii hipoosmolare, când ambele căi stimulează direct nervii periferici şi eliberarea de ATP. În calea endogenă pot fi implicaţi şi alţi mediatori periferici decât ATP. Căile centrale de tuse sunt determinate de sinapsele dintre nervul vag şi neuronii din „centrul tusei” medular din nucleul tractus solitarius (figura 2b). Aceasta, la rândul său, declanşează tusea prin intermediul eferenţelor motorii către laringe, diafragmă şi muşchii intercostali. Centrul tusei este stimulat excesiv în tusea cronică refractară de către centrii superiori (nucleul cuneiform şi gri periacueductal al mezencefalului). Simultan, influenţele inhibitorii corticale normale (de exemplu, din interiorul cortexului prefrontal şi cortexului midcingulat anterior) sunt diminuate. Aceste căi sunt posibil responsabile pentru hipersensibilitatea la tuse. Căile corticale implică, de asemenea, necesitatea de a tuşi şi senzaţii conştiente de tuse(13).
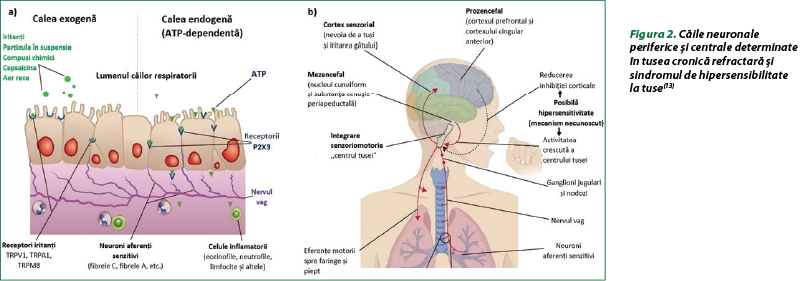
Tusea excesivă şi sindromul de hipersensibilitate la tuse (SHT) se manifestă la mulţi pacienţi ca urmare a proceselor patologice periferice care afectează activitatea şi/sau sensibilitatea fibrelor nervoase aferente primare vagale de la nivelul căilor respiratorii şi plămânilor, precum şi de patologiile inflamatorii ale esofagului, nasului şi din cadrul altor localizări extrapulmonare. În aceste cazuri, efectul procesului patologic asupra funcţiei nervoase senzoriale ar putea fi determinat de aspiraţie, edem, bronhoconstricţie sau exces de secreţie de mucus, cu activarea neuronilor senzoriali vagali sensibili mecanic, independent de inflamaţie, iar tusea la unii pacienţi poate fi ameliorată fără a trata inflamaţia (inhibitori ai pompei de protoni, bronhodilatatoare). Înţelegerea modului în care inflamaţia contribuie la declanşarea tusei şi modifică activitatea neuronilor senzoriali vagali şi sensibilitatea poate deschide noi orizonturi în dezvoltarea noilor strategii terapeutice pentru tusea cronică refractară. Mecanismele specifice care provoacă tusea excesivă şi dezvoltarea SHT pot fi complexe şi eterogene între pacienţi şi patologii, iar elucidarea rolului diferiţilor mediatori inflamatori poate fi definitivă în selectarea adecvată a tratamentului (figura 3)(7).
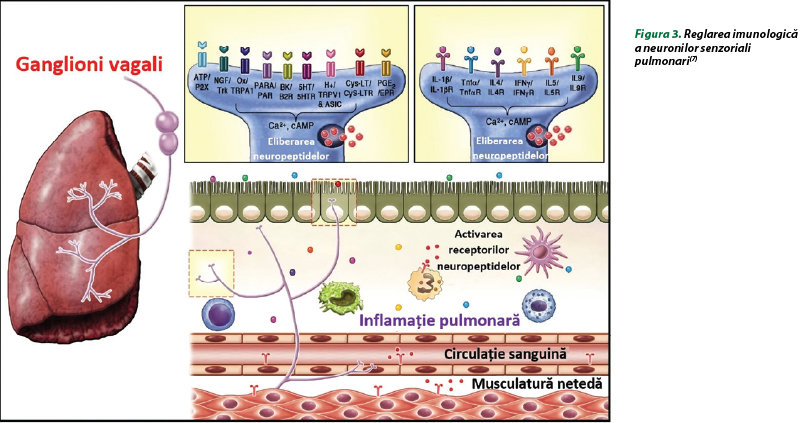
Imaginea pulmonilor arată inervaţia neuronală senzorială vagală din doi ganglioni vagali extrinseci. În peretele căilor respiratorii (panoul inferior), neuronii senzoriali vagali sunt numeroşi în epiteliu, în submucoasă şi în straturile musculare, unde sunt potenţial expuşi la o gamă de mediatori inflamatori (punctele colorate), inclusiv molecule asociate leziunilor din epiteliul căilor respiratorii şi citokine din celulele inflamatorii infiltrante şi rezidente. Imaginea din figura 3 demonstrează terminaţiile nervoase senzoriale, subliniind faptul că receptorii înrudiţi pentru o mare varietate de molecule inflamatorii sunt exprimaţi pe neuronii senzoriali pulmonari. Astfel, inflamaţia pulmonară poate iniţia potenţiale de acţiune în neuronii senzoriali şi poate declanşa, de asemenea, un influx de Ca2+ care duce la eliberarea de neuropeptide (substanţa P), peptida legată de gena calcitoninei (CGRP) şi polipeptida intestinală vasoactivă (VIP) din vezicule. Multe celule inflamatorii exprimă receptori neuropeptidici, iar acesta reprezintă un mecanism prin care neuronii senzoriali contribuie reciproc la reglarea inflamaţiei.
La pacienţii cu patologii însoţite de tuse problematică, mediatorii inflamatori sunt eliberaţi de celule rezidente sau infiltrate în ţesuturile inflamate sau lezate, precum epiteliul căilor respiratorii, fibroblastele rezidente, endoteliul vascular, celulele musculaturii netede, trombocitele, limfocitele, macrofagele, mastocitele şi chiar neuronii înşişi şi celulele gliale asociate acestora. Inflamaţia tisulară induce creşterea activităţii neuronilor senzoriali şi creşterea sensibilităţii acestora, astfel încât stimulii nocivi produc activitate neuronală mai mare decât de obicei, iar stimulii inofensivi pot fi sesizaţi ca nocivi. Astfel, IFN-gama, prostaglandina D2 şi factorul de necroză tumorală alfa (TNF-α) declanşează depolarizarea membranei şi potenţialele de acţiune în neuronii senzoriali vagali, care determină o sensibilitate exagerată la reflexul tusei(7).
O mare varietate de receptori pentru mediatorii imuni sunt exprimaţi pe terminaţiile neuronilor senzoriali vagali, care, când sunt activate, depolarizează membrana terminală nervoasă, producând un „potenţial generator”, care va atinge pragul necesar pentru a declanşa direct potenţialele de acţiune, în timp ce altele vor lăsa terminalul nervos mai receptiv la stimuli secundari inofensivi (figura 4). Nu toţi neuronii senzoriali care provoacă tusea exprimă aceeaşi gamă de receptori imunitari. Astfel, ATP, eliberat din celulele epiteliale ale căilor respiratorii lezate sau afectate la mulţi pacienţi cu boli pulmonare, ar putea fi un mediator proeminent care conduce la tuse. Studiile clinice cu un inhibitor al subtipului receptorului purinergic specific neuronului senzorial P2X3 au demonstrat eficacitate la pacienţii cu tuse cronică refractară. Studiile au relevat că numai neuronii senzoriali vagali derivaţi din ganglionii nodozi sunt sensibili la ATP, ceea ce ridică întrebări importante despre modul în care receptorii P2X3 sunt implicaţi în tusea excesivă şi dacă antagoniştii P2X3 vor fi eficienţi în diferite endotipuri de tuse. Concomitent cu modificările acute induse de mediatorii inflamaţiei în activitatea neuronilor senzoriali, pot fi induse dereglări neuroplastice de durată în fenotipul şi structura neuronului senzorial. În acest caz pot fi implicaţi o serie de factori neurotrofici, precum factorul de creştere a nervilor şi factorul neurotrofic derivat din creier, care sunt produşi şi eliberaţi de multe celule inflamatorii. Factorii neurotrofici induc semnalizarea retrogradă în neuronii senzoriali, precum şi reglarea transcripţională a proteinelor exprimate în mod normal (receptori şi neurotransmiţători). Inducerea de proteine noi care nu sunt exprimate în mod normal şi promovarea multiplicării neuronale determină o creştere a densităţii nervoase şi procesează inervaţia ţesuturilor-ţintă (figura 4)(7).
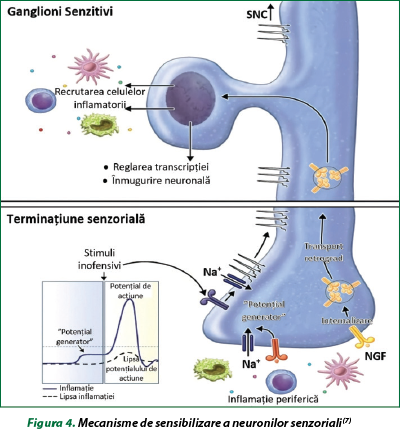
În panoul inferior, moleculele inflamatorii se leagă de receptorii înrudiţi de pe terminalele neuronilor senzoriali care inervează căile respiratorii şi plămânii, ceea ce duce la un aflux localizat de Na+ şi la producerea unei depolarizări subpragale (TP) sau „potenţial generator”. Graficul arată excitabilitatea electrică a neuronului în timpul inflamaţiei (linii continue) în comparaţie cu absenţa inflamaţiei (linii întrerupte). Potenţialul generator determină neuronul mai aproape de pragul necesar pentru iniţierea potenţialului de acţiune, care face terminalul nervos mai sensibil. În mod normal, stimulii inofensivi sunt acum capabili să inducă formarea potenţialului de acţiune (vârful curbei pe grafic) care se propagă de-a lungul axonului şi aflux crescut spre sistemul nervos central (SNC). În plus faţă de moleculele inflamatorii tradiţionale, neurotrofinele – factorul de creştere a nervilor (NGF) – eliberate de celulele inflamatorii pot semnala retrograd către corpul celular al neuronilor senzoriali din ganglionii vagali (panoul superior) şi pot promova modificările transcripţionale şi creşterea neuronală (neuroplasticitate). Activarea celulelor inflamatorii are loc şi în ganglionii senzoriali, iar aceasta exagerează efectele inflamaţiei periferice.
Neuroplasticitatea ar putea fi o caracteristică importantă a tusei cronice şi este asemănătoare cu evenimentele neuropatice din neuronii senzoriali somatici responsabili de dezvoltarea durerii cronice. Tusea care însoţeşte infecţiile virale pulmonare poate persista câteva luni după ce infecţia şi inflamaţia ţesuturilor au dispărut (tusea postvirală), care probabil reflectă dezvoltarea neuropatiei senzoriale vagale. Infecţiile virale induc răspunsuri inflamatorii complexe în sistemul respirator, inclusiv producţia şi eliberarea de citokine proinflamatorii, chemokine şi mediatori antivirali, care sunt necesari pentru a ajuta la combaterea virusului, dar care, de multe ori, pot afecta funcţia neuronilor senzoriali. Unele virusuri ale tractului respirator ar putea invada direct sistemul nervos senzorial vagal şi mulţi neuroni senzoriali, inclusiv neuronii senzoriali vagali, cu exprimarea receptorilor de recunoaştere, capabili să genereze răspunsuri imune înnăscute asemănătoare în sistemul nervos. Rolul acestor receptori de recunoaştere este important la pacienţii cu tulburări senzoriale care însoţesc neuropatiile. Studiile în domeniul durerii au demonstrat că macrofagele, celulele T şi alte celule imunitare contribuie în mod activ la inflamaţia ganglionară, componentă importantă a plasticităţii şi leziunii în cadrul nervilor senzoriali (figura 4). Dacă mecanismele similare sunt implicate la pacienţii cu tuse cronică şi SHT, farmacoterapia acestora ar trebui să ia în considerare strategiile care vizează atât patologia pulmonară, cât şi ţintele extrinseci ale neuroinflamaţiei(7).
Mecanismele neuroimune centrale în tuse
Sistemul nervos central joacă un rol important în reglarea tusei. Plasticitatea în procesarea neuronală centrală, denumită şi sensibilizare centrală, are probabil o contribuţie importantă la dezvoltarea sau menţinerea tusei cronice şi a SHT la unii pacienţi. Mecanismele de sensibilizare centrală sunt bine descrise pentru hipersensibilităţi senzoriale şi implică o interacţiune reglată între afluxurile senzoriale periferice, procesarea sinaptică la diferite niveluri din SNC şi răspunsurile imunologice ale celulelor gliale (figura 5). Aceste procese amplifică afluxurile neuronilor senzoriali, astfel încât răspunsurile la tuse sunt exagerate la stimuli de tuse (hipertusie) sau induse de stimuli, de obicei consideraţi subpragali (alotusia). Structurile neuronale centrale controlează tusea reflexă, procesarea senzorială respiratorie şi controlul voluntar al tusei. Neuronii senzitivi bronhopulmonari stabilesc conexiunea cu neuronii de ordinul doi din nucleii trunchiului cerebral (nucleul tractului solitar, nucleul paratrigemenului), care proiectează la circuitele respiratorii ale trunchiului cerebral implicate în generarea tusei reflexe sau la reţelele neuronale subcorticale şi corticale necesare discriminării senzoriale, inclusiv generarea dorinţei de a tuşi şi reglarea comportamentală a tusei (inducerea şi suprimarea tusei voluntare)(7).
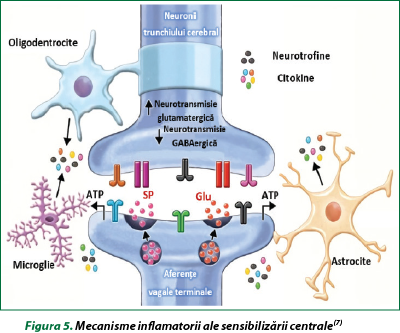
Studiile clinice de imagistică funcţională a creierului au demonstrat că pacienţii cu tuse cronică refractară prezintă o activitate neuronală semnificativ sporită în regiunile mezencefalului implicate în procesarea senzorială a tusei, similar sensibilizării centrale raportate anterior la pacienţii cu durere cronică. Aceşti pacienţi prezintă, de asemenea, o activitate neuronală redusă în structurile centrale ale creierului necesare pentru suprimarea voluntară a tusei, sugerând că tusea cronică implică o procesare senzorială activată şi mecanisme diminuate de suprimare a tusei în creier. S-a sugerat că mecanismele care reglează plasticitatea centrală în circuitele neuronale ale tusei au similarităţi remarcabile în prezentarea clinică a hipersensibilităţii la tuse, durere şi prurit, ceea ce sugerează mecanisme centrale comparabile care guvernează dezvoltarea lor (McGovern AE, 2018).
La pacienţii cu sindroame dureroase, sensibilizarea periferică a neuronilor senzoriali după inflamaţia sau leziunea ţesuturilor induce sensibilizarea centrală, prin creşterea neurotransmisiei glutamatergice excitatoare spinale şi scăderea neurotransmisiei inhibitoare GABA-ergice (figura 4). Aceste modificări ale eficacităţii sinaptice coincid cu recrutarea şi/sau activarea microgliei, astrocitelor şi oligodendrocitelor în coarnele posterioare ale măduvei spinării şi în alte segmente în calea de propagare a durerii şi eliberarea numeroşilor mediatori inflamatori, inclusiv ATP, chemokina CXCL12, IL-1β, TNF-α, factor neurotrofic derivat din creier şi factor de creştere a nervilor. Aceşti mediatori pot creşte şi mai mult excitabilitatea neuronilor centrali, care la rândul lor pot escalada activarea glială şi neuroinflamaţia(7).
Conform studiilor preclinice referitoare la tuse, care se concentrează pe procesarea neuronilor senzoriali în nucleul trunchiului cerebral al tractului solitar, se confirmă că stimulii inflamatori periferici din arborele respirator pot induce modificări în neuroni şi celule gliale în regiunile creierului, care controlează respiraţia şi procesarea autonomă. S-a relatat că expunerea la praful de casă şi la fumul de ţigară provoacă o excitabilitate crescută a nucleului neuronilor tractului solitar la afluxurile din neuronii senzoriali.
Inflamaţia laringiană, indusă de lipopolizaharide, creşte expresia markerilor de activare neuronală într-o varietate de nuclee ale trunchiului cerebral legate de respiraţie.
Inhalarea de ozon creşte acoperirea astrocitară a sinapselor glutamatergice în nucleul tractului solitar, în timp ce sensibilizarea cu ovalbumină măreşte activitatea nucleului neuronilor tractului solitar, promovează semnalizarea endocanabinoidelor şi activează celulele microgliale. Inflamaţia la nivelul nasului, o comorbiditate clinică frecvent asociată cu tusea cronică, ar putea afecta porţiunile centrale prin bulbii olfactivi. S-a estimat că semnalele inflamatorii sau imunitare din ţesuturile periferice din căile respiratorii ale pacienţilor cu tuse cronică, concomitent cu traducerea în locurile centrale ale procesării senzorimotorii ale tusei prin ameliorarea neurotransmiterii senzoriale, pot ajunge direct în creier (nucleul tractului solitar) pe calea sangvină, deoarece această regiune a creierului nu are intactă o barieră între sânge şi creier. Se consideră că prezenţa inflamaţiei pulmonare nu este probabil suficientă pentru a determina sensibilizarea centrală a tusei la toţi pacienţii. Vârsta şi sexul pacientului (feminin, decada 5-6), factorii suplimentari de mediu şi genetica creează condiţii care susţin dezvoltarea hipersensibilităţii centrale(7).
Sensibilizarea centrală reprezintă un proces al SNC care amplifică afluxurile senzoriale periferice. În timpul inflamaţiei pulmonare, activităţile nervoase senzoriale intensificate sunt transmise la trunchiul cerebral şi determină mai mult decât activitatea sinaptică normală. În timp, acest lucru are ca rezultat recrutarea şi/sau activarea celulelor neurogliale, inclusiv a astrocitelor, a microglielor şi a oligodendrocitelor. Celulele neurogliale activate eliberează o varietate de citokine şi neurotrofine care modifică eficacitatea transmiterii sinaptice. Efectul acestei neuroinflamaţii este o neurotransmisie stimulatoare crescută (glutamat) şi inhibitorie scăzută (GABA), făcând circuitele neuronale centrale mai receptive la inputurile nervoase senzoriale. În aceste condiţii, abolirea afluxurilor senzoriale crescute nu ar putea să normalizeze sensibilitatea sistemului şi, din punct de vedere clinic, pacienţii cu sensibilizare centrală prezintă alotusie sau tuse ca răspuns la stimuli care sunt mult sub pragul nociv.
Dezvoltarea unor terapii eficiente pentru tuse necesită o înţelegere mai complexă a mecanismelor fiziopatologice. S-au constatat progrese în înţelegerea mecanismelor neuroreglării tusei în trei direcţii: proprietăţile nervilor senzoriali, în special receptorii şi canalele membranare; plasticitatea căilor; mecanismele nervoase centrale ale tusei. Reflexul tusei este mediat de stimularea nervului aferent vagal distribuit de-a lungul arborelui traheobronşic, precum şi în zonele extrapulmonare (laringe, trahee, bronhiile stem principale). Tusea cronică refractară are factori în comun cu sindroamele de hipersensibilitate laringiană şi cu sindroamele dureroase cronice, iar mecanismele fiziopatologice includ sensibilitatea reflexă la tuse, sensibilizarea centrală, sensibilizarea periferică şi mişcarea paradoxală a corzilor vocale. Din aceste considerente, în ultimele decenii studiile s-au axat pe cercetarea neuromodulatorilor cu acţiune centrală, precum baclofen, gabapentină, pregabalină, amitriptilină etc.(16)
Antagoniştii receptorilor purinergici
Reflexul tusei este transmis prin fibrele Aδ şi C aferente ale vagusului, sensibile la stimularea mecanică şi chimică. Receptorii purinergici P2X3 sunt canale ionice dependente de adenozin trifosfat (ATP) care se găsesc în neuronii aferenţi ascendenţi din ganglionii cranieni şi coarnele posterioare. Dovezile preclinice sugerează că receptorii P2X3 sunt localizaţi în fibre C vagale care inervează căile respiratorii, iar stimularea lor prin ATP şi histamină contribuie la dezvoltarea reflexului tusei(1,6).
Receptorul purinergic P2X3 este activat de ATP, substanţă endogenă eliberată de celulele structurale şi inflamatorii în perioadele de stres celular şi declanşează tuse la oameni şi la animale. Pacienţii cu tuse cronică prezintă o sensibilitate crescută la ATP inhalat, ceea ce sugerează că pot apărea sensibilizarea receptorului şi/sau modificări ale expresiei. Creşterea ATP extracelular a fost raportată şi în bolile pulmonare care sunt asociate cu hipersensibilitatea la tuse, inclusiv astmul şi BPOC, sugerând că activarea crescută a P2X3 contribuie la tusea excesivă. Interesul clinic pentru P2X3 ca ţintă terapeutică a crescut recent datorită studiilor care au arătat că antagonistul P2X3 gefapixant a redus semnificativ frecvenţa tusei spontane la pacienţii cu tuse cronică refractară sau inexplicabilă. Deoarece nu toţi pacienţii au răspuns la gefapixant, s-a sugerat că este necesară o neurofenotipizare pentru a identifica subgrupurile de pacienţi care să răspundă la tratament sau să se asocieze cu alte substanţe care să potenţeze acţiunea(3).
Receptorii purinergici P2X şi P2Y sunt canale ionice de suprafaţă a celulei stimulaţi de ATP extracelular. Afectarea celulară determinată de leziuni sau infecţii declanşează eliberarea de concentraţii mari de ATP, inducând hipersensibilizarea nervilor şi provocând simptome cronice sau debilitante, precum tusea cronică. Receptorii P2X3, P2X2/3, P2X4 şi P2X7 au atras atenţia ca ţinte potenţiale pentru a trata o varietate de afecţiuni care includ durerea cronică şi artrita. În studiile preclinice de tuse s-a constatat că antagonistul P2X3 nu a avut vreo influenţă asupra tusei induse de capsaicină, ceea ce a demonstrat că ATP şi capsaicina au mecanisme independente de acţiune(11,13).
Gefapixantul, un antagonist al receptorului purinergic P2X3, a demonstrat recent eficacitate în tratamentul tusei cronice prin controlul sensibilităţii aferente a căilor respiratorii superioare şi inferioare. Preparatul a demonstrat o diminuare a frecvenţei şi severităţii tusei şi a ameliorat calitatea vieţii. Concomitent, gefapixantul a determinat unele efecte adverse (disgeuzie, hipogeuzie, ageuzie, greaţă şi infecţia tractului respirator superior) care s‑au corelat cu doza, dar dozele crescute au fost asociate în mod substanţial cu evenimente adverse grave. În prezent sunt în curs de desfăşurare studii globale, la scară largă şi de fază III, pentru a investiga efectul gefapixantului (15 mg şi 45 mg/2 ori/zi) la peste 2000 de pacienţi cu tuse cronică. Alţi antagonişti ai P2X3 extrem de selectivi (BLU-5937, BAY1817080 şi S-600918) sunt în curs de investigare din punctul de vedere al farmacocineticii, farmacodinamicii, siguranţei şi eficacităţii în studiile clinice de fază incipientă(1,6).
Tusea cronică refractară este descrisă ca o tuse persistentă, care continuă mai mult de opt săptămâni, în ciuda evaluării şi tratamentului conform celor mai moderne ghiduri. Hipersensibilitatea reflexă la tuse este o manifestare distinctă a tusei cronice refractare, care implică şi sensibilizarea periferică a reflexului de tuse. Din punct de vedere mecanic, la pacienţii cu tuse cronică, inflamaţia de lungă durată care are loc în esofag şi în plămâni creşte excitaţia nervoasă aferentă, având ca rezultat o percepţie a disconfortului în gât, precum şi o scădere a pragului de tuse. Scăderea pragului de tuse în tusea cronică refractară este corelată cu o expresie a receptorilor TRPV1 pe nervii căilor respiratorii. Se presupune că expresia receptorilor TRPA1, TRPV1 şi P2X3 şi dezvoltarea sensibilizării reflexului central şi periferic al tusei transformă tusea într-un sindrom de hipersensibilitate la tuse(1).
S-au analizat mai multe medicamente cu acţiune centrală şi periferică utilizate în tratamentul tusei cronice. S-a raportat despre efectele antitusive ale unor neuromodulatori, precum opioidele, amitriptilina, gabapentina şi pregabalina. Aceste studii ale neuromodulatoarelor au fost efectuate ca urmare a asemănării dintre mecanismul funcţional al tusei şi durerea neuropată. Medicamentele cu acţiune periferică, în special antagoniştii receptorilor purinergici P2X3, au prezentat cel mai încurajator impact antitusiv asupra tusei cronice(1).
Antagoniştii tahikininelor
Tahikininele sunt o familie mare de neuropeptide excitatoare, inclusiv substanţa P (SP), neurokinina A (NKA) şi neurokinina B (NKB), care, printre alte funcţii, acţionează ca neurotransmiţători. Tahikininele sunt larg distribuite în sistemul nervos central şi periferic. S-au evidenţiat trei tipuri de receptori: receptorul neurokininei 1 (NK-1), activat preponderent de SP; receptorul neurokininei 2 (NK-2), activat preferenţial de NKA; receptorul neurokininei 3 (NK-3), activat de NKB. În ţesuturile periferice, activarea fibrelor C senzoriale eliberează neuropeptide printr-un reflex axon. În studii experimentale s-a demonstrat că SP, NKA şi peptida legată de gena calcitoninei sunt eliberate în căile respiratorii şi induc contracţia muşchilor netezi, extravazarea plasmei, hipersecreţia de mucus şi infiltrarea celulelor inflamatorii, cu dezvoltarea aşa-numitei „inflamaţii neurogene”, care joacă un rol important în patofiziologia astmului. În cercetările experimentale s-a dovedit că SP şi receptorul NK-1 în sistemul nervos central joacă un rol important în neurotransmisie, inclusiv în reglarea vomei. Receptorul neurokininei 1 (NK1) este un receptor cuplat cu proteina G, activat de ligandul substanţă P (SP). Receptorii NK1 sunt prezenţi în sistemul nervos central şi periferic, precum şi în alte ţesuturi, cu funcţii fiziologice variate. S-a remarcat posibila implicare a SP în tulburările senzoriale, vezica hiperactivă şi în pruritul cronic. S-a estimat un rol important al NK1 în tuse. Fibrele C aferente vagale din căile respiratorii par să producă SP, iar antagonismul selectiv NK1 blochează în mod specific tusea dependentă de fibra C(14).
Dovezile preclinice sugerează că tahikininele sunt produse în principal de fibrele C vagale şi pot fi eliberate de terminalele fibrei C periferice în căile respiratorii, dar şi central, în trunchiul cerebral. Microinjecţia de SP în această regiune creşte răspunsurile la tuse, care pot fi blocate de antagoniştii NK1. Există dovezi că expunerea la fumul de ţigară şi alergenii cresc nivelul ARNm, care codifică SP în nervii aferenţi, cu declanşarea tusei. Antagonistul NK1, în aceste situaţii, precum şi în tusea indusă de acidul citric, blochează transmisia sinaptică, care a dus la concluzia că SP poate fi un mediator important al răspunsurilor la tuse, iar receptorii NK1, o ţintă‑cheie terapeutică(2).
Antagoniştii receptorilor NK1 cu acţiune centrală foarte selectivi, aprepitant şi rolapitant, sunt în prezent autorizaţi pentru prevenirea greţei şi vomei induse de chimioterapie. Totodată, s-au sugerat efecte benefice ale unor antagonişti NK1 în tratarea anxietăţii, depresiei şi a durerii neuropate. Aprepitant, antagonistul NK1, care penetrează mai bine în sistemul nervos central, este autorizat şi în Marea Britanie ca antiemetic la pacienţii cărora li se administrează terapie antitumorală sistemică. Astfel, pacienţii cu cancer pulmonar reprezintă un grup ideal, în care să exploreze potenţialele efecte antitusive. Într-un studiu clinic a fost inclus un grup eterogen de pacienţi cu cancer pulmonar periferic sau central în stadiile 3-4 (fumători, administrarea de medicamente ce influenţau tusea – opioide, gabapentină şi inhibitorii enzimei de conversie a angiotensinei, boli pulmonare şi alte afecţiuni patologice coexistente relevante), cărora li se administra aprepitant timp de trei zile (doza antiemetică de 125 mg şi apoi 80 mg/zi), urmat de placebo timp de încă trei zile, sau invers, s-a constatat o reducere cu 22% a frecvenţei medii a tusei, precum şi ameliorarea semnificativă clinic a tusei(14).
Substanţa peptidică P şi receptorul său de tahikinină, neurokinina 1 (NK1), au fost cercetate pentru rolul şi efectele produse în diverse maladii, atât centrale, cât şi periferice. Studiile preclinice au arătat că antagoniştii receptorilor NK1 blochează răspunsul inflamator neurogen produs de administrarea de capsaicină şi stimularea electrică a ganglionului trigemen. S-a descoperit că antagonistul NK1 inhibă tusea indusă de capsaicină la cobai la administrarea subcutanată şi în ventriculii creierului, sugerând că acest compus îşi exercită efectele atât central, cât şi periferic(11).
Agoniştii GABA B receptorilor
Baclofenul, agonist GABA, stimulează receptorii presinaptici GABA B, cu inhibarea eliberării presinaptice de glutamat. S-a dovedit că baclofenul inhibă activitatea fibrelor nervoase aferente senzoriale periferice (fibrele C pulmonare) şi, de asemenea, acţionează în sistemul nervos central. S-a demonstrat că agoniştii receptorilor GABA B prezintă efecte antitusive la pacienţi umani şi la animale. La cobai, agoniştii GABA inhibă diferite răspunsuri la nivelul căilor respiratorii, inclusiv contracţia muşchilor netezi mediată de sistemul colinergic şi de tahikinină, permeabilitatea vasculară, bronhospasmul anafilactic şi tusea. Utilizarea baclofenului pentru a suprima tusea indusă de inhibitorii enzimelor de conversie şi tusea reflexă a fost asociată cu un risc crescut de a dezvolta pneumonie de aspiraţie la pacienţii cu accident cerebrovascular şi la vârstnici. Baclofenul poate produce sedare, hipotonie şi tulburări gastrice. S-a demonstrat că doza adecvată de baclofen la voluntari sănătoşi este de 20 mg/zi pe o durată de 14 zile(6,16).
Antidepresivele
Amitriptilina, un antidepresiv triciclic, inhibă recaptarea 5-hidroxitriptaminei (5-HT), un neurotransmiţător distribuit în principal în glanda pineală şi hipotalamus, iar diminuarea acestuia este responsabilă de dezvoltarea depresiei şi a durerii cronice neuropatice. Efectul analgezic al antidepresivelor triciclice este independent şi se poate instala mai devreme decât efectele lor antidepresive. Interacţiunea subtipurilor de nervi aferenţi vagali şi a funcţiei căilor respiratorii şi convergenţa lor la segmentele-cheie de integrare în trunchiul cerebral pot duce la o sensibilizare centrală similară cu cea descrisă în căile somatice care reglează senzaţia de durere(6,16).
Amitriptilina, utilizată pentru tratamentul tusei cronice neuropatice vagale postvirale, a demonstrat un răspuns complet faţă de combinaţia codeină şi guaifenesină. Preparatul, în doză de 10 mg timp de 21 de zile, a redus cu 40% simptomele în tusea cronică. În studiile la pacienţii cu simptome neuropatice senzitive recurente ale nervului laringian s-a constatat ameliorarea simptomelor neuropatice în cazul tratamentului cu amitriptilină timp de două luni(11,15).
Antiepilepticele. Gabapentina şi pregabalina
Gabapentina şi pregabalina acţionează asupra receptorilor alfa-2 şi delta ai canalelor de calciu, inhibând eliberarea de neurotransmiţători, precum substanţa P, un agent tusigenic, şi posibil inhibând receptorii N-metil-D-aspartat (NMDA). Preparatul este cunoscut a fi eficient în tratamentul durerii neuropatice cu sensibilizare centrală, iar tusea refractară este determinată de un mecanism central de sensibilizare similar cu durerea neuropatică. Tusea refractară se caracterizează prin senzaţii anormale în gât (parestezie laringiană), sensibilitate crescută la tusigeni (hiperdipsie) şi tusea declanşată de stimuli nontusivi (răceala sau vorbirea). S-a raportat despre eficienţa gabapentinei în neuropatia laringiană senzorială şi despre simptomele afecţiunilor de origine neuronală. Utilizarea gabapentinei a dus la ameliorarea semnificativă a calităţii vieţii pacienţilor care sufereau de simptome specifice tusei (severitatea tusei şi sensibilitatea reflexului tusei).
Totuşi, gabapentina trebuie utilizată cu prudenţă, deoarece are o absorbţie dependentă de doză, cu concentraţii maxime peste două-trei ore şi cu efecte secundare precum ameţeli, oboseală, cefalee şi confuzie. Administrarea pregabalinei scade eliberarea neurotransmiţătorilor, precum glutamatul, noradrenalina şi substanţa P. Pregabalina prescrisă pentru ameliorarea nevralgiei postherpetice a ameliorat şi tusea cronică a pacientului, fără evenimente adverse grave raportate după doi ani de supraveghere. S-a demonstrat eficacitatea preparatului asupra neuropatiei senzoriale laringiene, iar riscul/beneficiul pregabalinei fată de al gabapentinei pentru tratamentul tusei cronice a demonstrat că efectele adverse au fost mai frecvente la pregabalină. Aceasta are un potenţial de abuz mai mare decât gabapentina, probabil datorită absorbţiei şi acţiunii mai rapide. Preparatul este o opţiune de tratament recomandată de ghidurile actuale(6,11,15,16).
Opioidele
Analgezicele opioide suprimă tusea prin inhibarea centrului tusei. Ele modulează sensibilizarea neuronală, componenta-cheie a tusei cronice. Codeina, folosită în mod tradiţional ca antitusiv, nu deţine dovezi suficiente de eficacitate în tusea cronică, dar cu raportări privind o serie de efecte secundare. Deşi codeina nu este eficientă în tusea cronică refractară şi nu este recomandată de ghiduri, poate fi utilă în tusea prelungită care persistă după infecţii respiratorii acute, inclusiv COVID-19. Morfina este eficientă la unii pacienţi, dar sunt disponibile date limitate din studii prospective. Într-un studiu dublu-orb, morfina cu eliberare lentă (5 mg de 2 ori/zi) timp de 4 săptămâni a îmbunătăţit scorurile zilnice de severitate a tusei, deşi nu a alterat reflexul tusei. Morfina este recomandată de ghiduri, deşi somnolenţa şi constipaţia sunt reacţii adverse frecvente. Tramadolul la pacienţii cu tuse neurogenă a demonstrat proprietăţi antitusive. Cu toate acestea, tramadolul nu este nici recomandat, nici descurajat de ghiduri(6,11,15).
Canale cu potenţial receptor tranzitoriu (TRP)
Canalele TRP sunt canale ionice permeabile la calciu care declanşează activarea nervilor senzoriali şi sunt considerate receptori canonici de tuse datorită capacităţii lor de a declanşa tusea ca răspuns la multipli stimuli tusivi. Primii dintre aceşti receptori sunt TRPV1, care au ca liganzi capsaicina şi acidul citric, TRPA1, care răspunde la compuşi nocivi precum cinamaldehida, acroleina şi formolul, şi TRPV4, care este activat de acidul arahidonic şi soluţiile hipotone. Modificările în expresia şi activitatea TRP au fost documentate în tusea cronică. În studiile experimentale s-a demonstrat că expresia TRPV1 este crescută în biopsiile bronşice la pacienţii cu tuse cronică, în timp ce expresia TRPV1 de novo apare la mecanoreceptorii cu prag scăzut după expunerea la alergeni sau infecţia cu virus. Fumătorii, pacienţii cu astm bronşic şi cei cu BPOC au o reacţie crescută la agoniştii TRPV1, acidul citric şi capsaicină, care susţin rolul canalelor TRP în hipersensibilitatea la tuse. Au fost elaboraţi câţiva antagonişti ai canalului TRP pentru tratamentul tusei cronice şi s-au dovedit destul de eficienţi în blocarea tusei la agenţi tusivi specifici în condiţii experimentale, dar nu au reuşit să îmbunătăţească frecvenţa tusei spontane sau să inhibe tusea cronică în studiile clinice. Aceste rezultate discordante sugerează că modificările specifice receptorilor TRP nu explică pe deplin mecanismele neuronale care stau la baza hipersensibilităţii la tuse(3).
Canalele TRP sunt exprimate în majoritatea tipurilor de ţesut şi celulă şi joacă un rol important în reglarea diferitelor funcţii celulare. Ele sunt capabile să simtă temperatura, stimulii nocivi, durerea, întinderea şi osmolaritatea şi sunt implicate în diferite boli printr-un nivel crescut de expresie a canalului. Canalele ionice TRP sunt prezente în căile respiratorii, neuronii senzoriali primari ai căilor respiratorii, muşchii netezi şi celulele epiteliale. Inflamaţia în plămâni sau în esofag creşte excitaţia nervoasă aferentă, care duce la o senzaţie de iritaţie în gât şi la un prag de tuse redus. Pragul tusiv redus în tusea cronică refractară este asociat cu o expresie crescută a receptorilor TRPV1 pe nervii căilor respiratorii. Antagoniştii TRPV1 selectivi au fost studiaţi pentru tratamentul durerii, iar recent au fost testaţi şi în tratamentul tusei cronice refractare(6,11).
H1-antihistaminicele
Utilizarea H1-antihistaminicelor de primă generaţie are atât efecte periferice, cât şi centrale, care sunt asociate cu efecte adverse precum oboseala, dereglările oculare şi afectarea funcţiei cognitive. Din aceste considerente, tot mai multe ghiduri recomandă administrarea H1-antihistaminicelor nonsedative de generaţiile a doua şi a treia. Efectele H1-antihistaminicelor nonsedative sunt probabil minime dacă sunt administrate la pacienţi neselectaţi cu tuse cronică. Studiile la pacienţii nonastmatici cu rinită alergică sezonieră sau tuse atopică sugerează că pacienţii cu astfel de fenotipuri alergice specifice de tuse cronică ar putea răspunde la tratamentul cu aceste preparate. Doza standard a îmbunătăţit scorurile de tuse, care au fost deja semnificative din prima săptămână şi au progresat la patru săptămâni. Aceste constatări ar putea servi drept ghid pentru practica clinică la pacienţii cu aceste fenotipuri alergice, îndeosebi la adulţii cu tuse cronică de vârstă mijlocie sau în vârstă(4).
Receptorii N-metil-D-aspartat sunt implicaţi în reflexele determinate de acid, cum ar fi reflexul tusei. Ketamina, utilizată în durerea acută, sindroamele dureroase neuropate cronice, simptomele de alodinie şi în hiperalgezie, s-a presupus a fi eficientă şi ca preparat antitusiv datorită caracteristicilor clinice asemănătoare ale alotusiei şi hipertusiei din tusea cronică refractară. Într-un studiu experimental a fost demonstrat rolul predominant pentru activarea receptorului NMDA în timpul tusei, alături de un rol modulator pentru receptorii non-NMDA. S-a observat o inhibare sinergică a tusei când s-au administrat simultan atât antagoniştii receptorilor NMDA, cât şi non-NMDA(11).
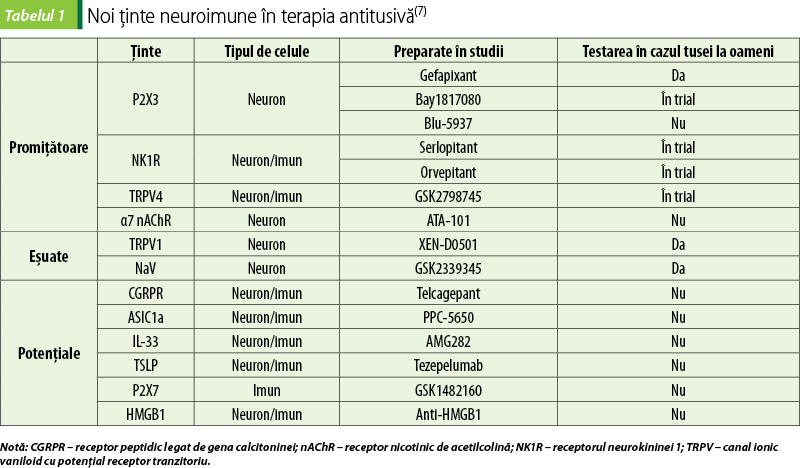
Unele preparate eficiente în atenuarea durerii (anestezice locale, opioide, agenţi neuromodulatori – gabapentina, pregabalina, amitriptilina) sunt utilizate ca antitusive în clinică în cazurile în care terapiile specifice bolii nu ameliorează tusea. Cu toate acestea, sunt necesare medicamente antitusive mai selective şi mai eficiente, în special în cazurile de tuse refractară. Ţinte terapeutice noi şi emergente pentru tusea supărătoare sunt în cercetare de mulţi ani, iar conceptele importante şi opţiunile terapeutice potenţiale pentru tuse se bazează pe înţelegerea biologiei neuroimune (tabelul 1)(7).
Concluzii
În baza analizei efectuate, se poate concluziona: tusea cronică inexplicabilă, refractară sau idiopatică reprezintă un simptom frecvent asociat unor maladii pulmonare şi extrapulmonare, care nu răspunde la preparatele antitusive clasice, iar mecanismele periferice şi centrale ale tusei refractare necesită o abordare diferenţiată a strategiilor de tratament. Elucidarea minuţioasă a anamnezei, interpretarea în ansamblu a rezultatelor investigaţiilor, inclusiv direcţionate, pot facilita înţelegerea patogenezei sindromului de hipersensibilitate al tusei, cu selectarea adecvată a metodelor de tratament. Actuale şi de perspectivă pot fi considerate preparatele care influenţează simultan verigile periferice şi centrale ale tusei.
Bibliografie
- Abu-Zaid A, Aljaili AK, Althaqib A, et al. Safety and efficacy of gefapixant, a novel drug for the treatment of chronic cough: A systematic review and meta-analysis of randomized controlled trials. Ann Thorac Med. 2021 Apr-Jun;16(2):127-140. doi: 10.4103/atm.ATM_417_20.
- Badri H, Smith JA. Emerging targets for cough therapies; NK1 receptor antagonists. Pulm Pharmacol Ther. 2019 Dec; 59:101853. doi: 10.1016/j.pupt.2019.101853.
- Drake MG, Cook M, Fryer AD, et al. Airway Sensory Nerve Plasticity in Asthma and Chronic Cough. Front Physiol. 2021 Sep 7; 12:720538. doi.org/10.3389/fphys.2021.720538.
- Lee JH, Lee JW, An J, et al. Efficacy of non-sedating H1-receptor antihistamines in adults and adolescents with chronic cough: A systematic review. World Allergy Organ J. 2021 Jul 21;14(8):100568. doi: 10.1016/j.waojou.2021.100568.
- Makarevich AE. Chronic cough in clinical practice. Pulmonologia. 2020;1(9):13-24.
- Mazzone SB, McGarvey L. Mechanisms and Rationale for Targeted Therapies in Refractory and Unexplained Chronic Cough. Clin Pharmacol Ther. 2021 Mar;109(3):619-636. doi: 10.1002/cpt.2003.
- McGovern AE, Short KR, Moe AAK, Mazzone SB. Translational review: Neuroimmune mechanisms in cough and emerging therapeutic targets. J Allergy Clin Immunol. 2018;142:1392-402. doi.org/10.1016/j.jaci.2018.09.004.
- Morice AH, Millqvist E, Bieksiene K, et al. ERS guidelines on the diagnosis and treatment of chronic cough in adults and children. European Respiratory Journal. 2020;55:1901136. doi: 10.1183/13993003.01136-2019.
- Pashkova TL, Averyanov AV. Diagnosis and course of chronic cough. Pulmonologia. 2006;4:89-93. doi.org/10.18093/0869-0189-2006-4-89-93.
- Roe NA, Lundy FT, Litherland GJ, McGarvey LPA. Therapeutic Targets for the Treatment of Chronic Cough. Current Otorhinolaryngology Reports. 2019;7:116–128. doi.org/10.1007/s40136-019-00239-9.
- Ryan NM, Vertigan AE, Birring SS. An update and systematic review on drug therapies for the treatment of refractory chronic cough. Expert Opinion on Pharmacotherapy. 2018;19:7 687-711. doi: 10.1080/14656566.2018.1462795.
- Song WJ, An J, McGarvey L. Recent progress in the management of chronic cough. Korean J Intern Med. 2020 Jul;35(4):811-822. doi: 10.3904/kjim.2020.013.
- Turner RD, Birring SS. Chronic cough: ATP, afferent pathways and hypersensitivity. European Respiratory Journal 2019; 54:1900889. doi: 10.1183/13993003.00889-2019.
- Turner RD, Birring SS. Neurokinin-1 Receptor Inhibition and Cough. American Journal of Respiratory and Critical Care Medicine. 2021 March 15;6 (203). doi: 10.1164/rccm.202010-3783ED.
- Visca D, Beghè B, Fabbri LM, Papi A, Spanevello A. Management of chronic refractory cough in adults. Eur J Intern Med. 2020 Nov; 81:15-21. doi: 10.1016/j.ejim.2020.09.008.
- Wei W, Liu R, ZhangTong Y, Qiu Z. The efficacy of specific neuromodulators on human refractory chronic cough: a systematic review and meta-analysis. J Thorac Dis. 2016;8(10):2942-2951.
Articole din ediţiile anterioare
Medicamente folosite în tulburări de dispoziţie
Incidenţa anuală în populaţia adultă a tulburărilor de dispoziţie este de 10%. Organizaţia Mondială a Sănătăţii (OMS) estima în 2015 că 4,4% din po...