Metformina, diabetul zaharat de tip 2 şi COVID-19
Metformin, type 2 diabetes and COVID-19
Abstract
Metformin, in conjunction with its antihyperglycemic effect, which in itself reduces the susceptibility to various infections and the severity of the disease, may provide protection to patients with COVID-19 through its antiviral, anti-inflammatory, immunomodulatory, cardio- and vasoprotective effects. The mechanisms of beneficial action of metformin in patients with diabetes and SARS-CoV-2 infection may be determined by: decreased body weight, especially in the elderly; impairment of AMPK expression of angiotensin converting enzyme 2 receptor (ACE2); reduced insulin resistance; improving the stability of ACE2; balancing the renin-angiotensin-aldosterone system (RAAS); ACE2 receptor modulation; glucose level control; inhibition of the cytokine storm (IL-6, IL-1β, TNF-α); increasing the level of anti-inflammatory IL-10; modulation of the composition of the gut microbiota; reducing the number of neutrophils and improving the ratio between neutrophils and lymphocytes; protection of diabetic patients from infection (inhibition of the PI3K/AKT/mTOR pathway; prevention of thrombus formation; prevention of lung damage and fibrosis; decreased acidity of endosomes and lysosomes).Keywords
diabetes mellitus hyperglycemiaCOVID-19SARS-CoV-2metforminRezumat
Metformina, concomitent cu efectul antihiperglicemic, prin care reduce susceptibilitatea la diferite infecţii şi severitatea bolii, poate oferi protecţie pacienţilor cu COVID-19 prin efectele antivirale, antiinflamatoare, imunomodulatoare, cardio- şi vasoprotectoare. Mecanismele acţiunii benefice a metforminei la pacienţii cu diabet zaharat (DZ) şi infecţie cu SARS-CoV-2 pot fi determinate de: micşorarea masei corporale, în special la vârstnici; afectarea prin calea AMPK-azei a expresiei receptorului enzimei de conversie a angiotensinei 2 (ECA2); reducerea rezistenţei la insulină; îmbunătăţirea stabilităţii ECA2; echilibrarea sistemului renină-angiotensină-aldosteron (SRAA); modularea receptorului ECA2; controlul nivelului glucozei; inhibarea furtunii citokinice (IL-6, IL-1β, TNF-α); creşterea nivelului IL-10 antiinflamatoare; modularea compoziţiei microbiotei intestinale; reducerea numărului de neutrofile şi ameliorarea raportului dintre neutrofile şi limfocite; protejarea pacienţilor diabetici de infecţie (inhibarea căii PI3K/AKT/mTOR; preîntâmpinarea formării trombilor; prevenirea leziunilor pulmonare şi a fibrozei; scăderea acidităţii endozomilor şi lizozomilor).Cuvinte Cheie
diabet zaharathiperglicemieCOVID-19SARS-CoV-2metforminăIntroducere
Infecţia cu SARS-CoV-2, sau boala coronavirus 2019 (COVID-19), declarată pandemie de Organizaţia Mondială a Sănătăţii (OMS) la 11 martie 2020, la pacienţii diabetici prezintă un risc crescut de complicaţii, internări în secţiile de terapie intensivă şi mortalitate. Studii multiple au identificat diabetul zaharat (DZ) drept un factor de risc independent asociat cu o rată a mortalităţii mai mare la pacienţii diabetici cu COVID-19. S-a demonstrat că un control insuficient al glicemiei la pacienţii cu COVID-19 şi DZ este responsabil de o durată mai lungă de spitalizare, mai multe complicaţii sau de deces. Menţinerea nivelului adecvat de glucoză prin preparatele insulinei şi antidiabeticelor orale (biguanide, sulfonilureice, incretinomimetice, tiazolidindione, tetrazaharide, inhibitorii cotransportorului sodiu-glucoză-2 etc.) s-a dovedit a fi determinantă în evoluţia benefică a COVID-19 la bolnavii cu DZ. Mai multe studii au raportat rezultatele benefice ale metforminei la pacienţii cu DZ de tip 2 şi COVID-19, altele nu au găsit niciun beneficiu la utilizatorii de metformină în comparaţie cu nonutilizatorii în ceea ce priveşte severitatea şi mortalitatea, iar unele studii au raportat chiar şi o creştere a severităţii la utilizatorii de metformină. Studiile la începutul pandemiei au sugerat interzicerea metforminei la pacienţii cu DZ şi COVID-19, din cauza cetoacidozei diabetice anticipate în contextul dereglării poliorganice, în timp ce studiile ulterioare au constatat că tratamentul cu metformină nu este dăunător şi ar putea fi benefic(3,5,6,15,18,19,22,23).
Mai multe studii retrospective şi metaanalize au raportat o reducere semnificativă a mortalităţii legate de COVID-19 în rândul pacienţilor cu DZ care urmau tratament cu metformină pentru a-şi gestiona nivelul glicemiei. Capacitatea metforminei de a reduce rata mortalităţii a fost observată după corectarea altor factori de risc, cum ar fi vârsta, sexul, rasa, obezitatea, hipertensiunea, bolile renale cronice şi insuficienţa cardiacă, factori care reduc supravieţuirea la pacienţii cu COVID-19. La pacienţii diabetici cu COVID-19, administrarea insulinei, considerată preparat de elecţie, a fost asociată cu oscilaţii ale glicemiei şi efecte adverse, iar tratamentul cu metformină a fost corelat cu o reducere semnificativă a severităţii bolii şi a ratelor de mortalitate în rândul persoanelor afectate. Potenţialele legături patogenetice dintre COVID-19 şi DZ includ inflamaţia, efectele asupra homeostaziei glucozei, dezoxigenarea hemoglobinei, modificarea stării imune şi activarea sistemului renină-angiotensină-aldosteron (SRAA). Metformina normalizează nivelul glicemiei prin: creşterea absorbţiei glucozei de către muşchi, ţesutul adipos; reducerea glicogenolizei şi gluconeogenezei; scăderea absorbţiei glucozei din intestin; reducerea producţiei glucozei de către ficat. Aceste efecte ale metforminei sunt realizate prin intermediul căilor independente şi dependente de protein-kinaza activată de AMP (AMPK-aza), iar activarea acesteia îmbunătăţeşte căile catabolice care generează ATP. Cercetările recente s-au concentrat asupra efectelor benefice suplimentare ale metforminei prin mecanismele moleculare implicate în controlul inflamaţiei, metabolismului glucozei, funcţiei musculaturii netede vasculare şi patogeneza virală. Metformina este studiată pentru efectele sale antioxidante, antiinflamatoare, imunomodulatoare, antivirale, cardio- şi vasoprotectoare responsabile de protecţia pacienţilor cu COVID-19(3,5,6,10,11,15,18,21,22).
Vârsta înaintată, DZ, hipertensiunea arterială şi obezitatea marcantă (IMC ≥ 40 kg/m2) cresc morbiditatea şi mortalitatea la pacienţii cu COVID-19. Prevalenţa ridicată a bolilor cardiovasculare şi a obezităţii la pacienţii cu DZ pot creşte şi mai mult acest risc, dar hiperglicemia şi DZ sunt predictori independenţi pentru morbiditate şi mortalitate la pacienţii cu SARS-CoV-2. Mecanismele potenţiale care pot creşte sensibilitatea la COVID-19 la pacienţii cu DZ includ: ataşarea cu o afinitate mai mare la celule şi intrarea mai uşoară a virusului; scăderea clearance-ului viral; diminuarea funcţiei celulelor T; susceptibilitatea crescută la inflamaţie şi furtună citokinică; prezenţa maladiilor cardiovasculare. La animalele cu DZ experimental s-a constatat o expresie majoră a enzimei de conversie a angiotensinei 2 (ECA2) în alveolocitele pulmonare de tip 2, miocard, rinichi şi pancreas, care poate favoriza o legare celulară mai intensă a SARS-CoV-2. La pacienţii cu DZ s-au constatat niveluri circulante mari de furină, o protează celulară implicată în facilitarea intrării virale prin scindarea domeniului S1 şi S2 al proteinei spike. Studiile recente susţin ipoteza că pacienţii cu DZ sunt mai sensibili la infecţia cu SARS-CoV-2, precum şi că eliminarea SARS-CoV-2 a fost întârziată. Diabetul zaharat inhibă chimiotaxia neutrofilelor, fagocitoza şi inactivarea intracelulară a microbilor. La pacienţii cu DZ s-au observat dereglări ale imunităţii adaptive caracterizate printr-o întârziere iniţială în activarea imunităţii mediată de celule Th1 şi un răspuns hiperinflamator tardiv. La pacienţii cu COVID-19 este scăzut numărul de celule T CD4+ şi CD8+, dar cu o proporţie mai mare de celule T Th17 CD4+ extrem de proinflamatorii, precum şi cu niveluri crescute de citokine. Astfel, este probabil ca pacienţii cu DZ să aibă răspunsuri antivirale reduse ale interferonilor, iar activarea întârziată a Th1/Th17 poate contribui la răspunsuri inflamatorii accentuate(14,20).
Pacienţii cu DZ au o predispoziţie crescută la infecţii virale şi bacteriene, inclusiv ale tractului respirator, ca urmare a sindromului leucocitar „leneş”, caracterizat prin afectarea funcţiei fagocitare a leucocitelor. Microangiopatia diabetică afectează complianţa pulmonară cu dereglarea schimbului de gaze, care poate determina proliferarea unor agenţi patogeni respiratori, inclusiv SARS-CoV-2. La pacienţii diabetici s-au constatat modificări respiratorii care afectează volumul pulmonar şi capacitatea de difuzie pulmonară. Variabilitatea glicemică este un factor de prognostic la pacienţii diabetici cu COVID-19. Hiperglicemia agravează evoluţia prin furtună citokinică, disfuncţie endotelială şi leziuni multiple ale organelor. Hiperglicemia în pulmoni determină o deteriorare rapidă a funcţiilor spirometrice, în special scăderea volumului expirator forţat în o secundă şi capacitatea vitală forţată. S-a arătat că în stările hiperglicemiante există o concentraţie crescută de glucoză în epiteliul respirator, care poate afecta capacitatea sa imună înnăscută. Hipoglicemia, de asemenea, creşte mortalitatea cardiovasculară prin activarea monocitelor, ce determină efecte proinflamatorii şi de agregare plachetară(20).
S-a constatat că dezechilibrul în SRAA are implicaţii considerabile în evoluţia şi prognosticul infecţiei cu SARS-CoV-2, îndeosebi la pacienţii cu DZ. La persoanele sănătoase există un echilibru între acţiunea angiotensinei II (Ang II) şi a angiotensinei 1-7 (Ang 1-7), care manifestă efecte opuse, respectiv vasoconstrictor şi protrombotic, vasodilatator şi antitrombotic. S-a sugerat că în infecţia cu SARS-CoV-2 prevalează Ang II, care poate duce la exacerbarea furtunii citokinice (supraproducţia IL-6, TNF-α) şi poate provoca sindromul de detresă respiratorie acută (SDRA) şi disfuncţii poliorganice. Infecţia cu SARS-CoV-2 poate provoca hiperglicemie la persoanele fără diabet preexistent, ca urmare a expresiei ECA2 în celulele pancreatice endocrine. Deteriorarea celulelor beta-pancreatice, creşterea rezistenţei la insulină şi afectarea metabolismului glucozei, cauzate de COVID-19, pot determina apariţia diabetului în viitor. Concomitent, hiperglicemia poate induce glicozilarea aberantă a ECA2, care favorizează legarea SARS-CoV-2 la receptorul său(3,15).
Enzima de conversie a angiotensinei 2, exprimată în ţesuturile metabolice critice (celulele beta-pancreatice, ţesutul adipos, ficat, intestinul subţire, rinichi), este receptorul pentru SARS-CoV-2 şi, astfel, poate provoca modificări pleiotrope în metabolismul glucozei, cu complicarea fiziopatologiei DZ preexistent sau crearea de mecanisme noi ale bolii. Infecţia cu SARS-CoV-2 perturbă metabolismul celular de la fosforilarea oxidativă la glicoliză, cu reducerea producerii de energie – ATP. Dezechilibrul metabolic şi sistemul imunitar afectat cresc susceptibilitatea pacienţilor cu DZ la infecţia cu SARS-CoV-2, iar modificările metabolice induse în celulele imune pot determina hiperinflamaţie şi furtună citokinică. Disfuncţia metabolică poate afecta acţiunea preparatelor utilizate în infecţia cu SARS-CoV-2. Controlul eficient al complicaţiilor metabolice ar putea deveni o ţintă terapeutică utilă pentru combaterea COVID-19, inclusiv pentru anihilarea consecinţelor pe termen lung la pacienţii cu DZ care au supravieţuit COVID-19. Astfel, cunoaşterea mai profundă a fiziopatologiei COVID-19, inclusiv prin identificarea mecanismelor metabolice care contribuie la progresia sa şi a DZ, este esenţială pentru a oferi modalităţi specifice de prevenire şi îmbunătăţire a consecinţelor infecţiei cu SARS-CoV-2(13,15).
Expresia ECA2 în diferite ţesuturi este proporţională cu diferite simptome ale COVID-19, respiratorii, cardiovasculare, renale, gastrointestinale, hepatice şi leziuni beta-celulare. Înţelegerea mecanismelor de interacţiune dintre sistemul renină-angiotensină (SRA) şi SARS-CoV-2 poate oferi o terapie adecvată pacienţilor cu risc crescut de COVID-19. Enzima de conversie a angiotensinei 2, un membru al SRAA, scindează angiotensina I (Ang I) şi angiotensina II (Ang II), peptide cu acţiune vasoconstrictoare şi inflamatoare, în Ang 1-9 şi Ang 1-7, cu efecte vasodilatatoare şi antiinflamatoare. Endocitoza SARS-CoV-2 are ca rezultat o reducere a activităţii ECA2 şi o trecere de la Ang 1-7 la Ang II, care poate conduce la leziuni pulmonare, fapt constatat în infecţia cu SARS-CoV. O scădere a Ang 1-7 şi o creştere a Ang II ar putea duce la modificarea metabolismului glucozei în celulele-ţintă ale virusului. Astfel, ECA2 joacă roluri diferite în COVID-19 – pe de o parte, este locul de legare pentru SARS-CoV-2, iar pe de altă parte, exprimarea redusă a acestuia de către virus poate implica leziuni pulmonare severe(13,14).
La pacienţii diabetici stabili cu COVID-19 s-a determinat agravarea bruscă a controlului glicemic care necesită utilizarea unei doze mai mari de insulină, fapt ce a sugerat posibilitatea invaziei pancreatice de către SARS-CoV-2. Această constatare a fost susţinută de nivelurile ridicate de ECA2 în celulele beta ale insulelor pancreatice, care pot provoca leziuni ale celulelor şi pot afecta secreţia de insulină. După intrarea virusului în celulele beta, s-a dezvoltat o reglare descendentă a ECA2 care a determinat creşterea nivelului de angiotensină, ceea ce afectează şi secreţia de insulină. Mecanismele posibile ale leziunii pancreatice includ: efectul citopatic direct al replicării SARS-CoV-2; răspunsul sistemic la insuficienţa respiratorie; răspunsul imun nociv indus de infecţia cu SARS-CoV-2(20).
Conform unui studiu, DZ de tip 2 a fost asociat cu expresia crescută a ECA2 în plămâni, care poate influenţa riscul de îmbolnăvire de COVID-19 şi poate exacerba complicaţiile sale. Rezultatele studiului au sugerat că pacienţii de vârstă înaintată, bărbaţii şi cei cu boli asociate (hipertensiune arterială, DZ) cu o expresie ridicată a ECA2 pot avea un risc crescut pentru eliminarea întârziată a virusului. Posibil, impactul DZ asupra expresiei ECA2 depinde de stadiul bolii. Conform studiilor experimentale, expresia ECA2 creşte în boala timpurie şi scade în perioada ulterioară. Concomitent, s-a arătat că raportul de activitate ECA2/ECA pulmonară a scăzut semnificativ în stadiul târziu al DZ. S-a remarcat că nivelul ECA2 solubile are asociaţii semnificative cu toate componentele sindromului metabolic, inclusiv rezistenţă la insulină, obezitate, hiperlipidemie şi hipertensiune. Creşterea ECA2 şi a glicării acesteia în hiperglicemia necontrolată poate afecta legarea proteinei spike de ECA2, determinând o afinitate mai mare a SARS-CoV-2 şi o evoluţie mai severă a COVID-19. S-a remarcat că hiperglicemia acută creşte expresia ECA2, cu facilitarea intrării virusului în celule, iar hiperglicemia cronică contribuie la diminuarea expresiei ECA2, cu predispunerea celulelor la efectele inflamatorii ale virusului. Astfel, hiperglicemia acută şi cea cronică pot avea efecte dăunătoare. SARS-CoV-2 poate exercita efecte directe asupra celulelor beta prin ECA2, cu exacerbarea DZ. Intrarea virusului în aceste celule poate provoca o disfuncţie acută care ar putea duce la hiperglicemie necontrolată. S-a constatat că nivelul ARN mesager al ECA2 este mai mare în pancreas comparativ cu plămânul, demonstrând că pancreasul este o ţintă esenţială a SARS-CoV-2. La pacienţii cu COVID-19 sever s-au raportat niveluri crescute de amilază şi lipază, mărirea focală a pancreasului sau dilatarea canalului pancreatic. Afectarea directă a celulelor beta ca urmare a infecţiei cu SARS-CoV-2 ar putea provoca deficienţa insulinei şi pancreatită cronică autoimună(13).
Metabolismul celular al glucozei este deturnat în celulele infectate cu SARS-CoV-2. Citokinele proinflamatoare activează celulele imune, macrofagele şi celulele dendritice, pentru a le schimba metabolismul şi a produce cantităţi mari de citokine. Această reprogramare metabolică determină aceste celule să genereze ATP prin trecerea de la fosforilarea oxidativă mitocondrială la glicoliza citozolică. Glicoliza permite celulelor imune activate să genereze cantităţi crescute de citokine proinflamatorii, inclusiv IL-1β, IL-2, IL-6, IL-8, interferoni (IFN‑1α şi IFN-1β) şi TNF- α, precum şi chemokine. Aceşti agenţi pot induce cantităţi excesive de specii reactive de oxigen şi azot, cu dezvoltarea stresului nitro-oxidativ, cu implicaţii fiziopatologice respiratorii. Melatonina forţează celulele imune activate să abandoneze glicoliza în favoarea fosforilării oxidative mitocondriale(13).
Materiale şi metodă
S-a efectuat o căutare în literatură în baza PubMed prin utilizarea combinaţilor ale următoarelor cuvinte-cheie: diabet, COVID-19, SARS-CoV-2 şi metformină, în perioada martie 2020 – august 2021. Au fost analizate circa 37 de publicaţii, dintre care au fost selectate 24, care reflectau scopul şi obiectivele cercetării.
Rezultate şi discuţii
Mecanismele patogenetice ale DZ şi COVID-19 includ: efectele asupra homeostaziei glucozei, inflamaţia, dezoxigenarea hemoglobinei, modificarea statusului imunitar şi activarea SRAA. S-a constatat că hiperglicemia sau complicaţiile DZ cresc severitatea şi mortalitatea din COVID-19 prin dereglarea sistemului imunitar umoral şi înnăscut, potenţarea replicării virale, disfuncţia endotelială, insulinorezistenţa şi afectarea poliorganică. Hiperglicemia poate afecta fagocitoza şi activitatea bactericidă, chimiotaxia neutrofilelor, fixarea complementului şi opsonizarea microorganismelor şi modificarea producţiei de chemokine. Concentraţiile crescute de glucoză şi glicoliza susţin replicarea SARS-CoV-2 în monocitele umane prin activarea factorului 1α inductibil de hipoxie (HIF-1α) şi prin producerea de mitocondrii a speciilor reactive de oxigen (SRO). Lezarea endoteliului prin inflamaţie, glucotoxicitate, stres oxidativ şi producerea de citokine determină un risc crescut de complicaţii tromboembolice şi de deteriorare a organelor vitale la pacienţii cu DZ. Inflamaţia indusă de virus poate afecta funcţiile ficatului şi ale musculaturii striate, responsabile de absorbţia glucozei mediată de insulină, care determină creşterea rapidă a necesităţii şi rezistenţa la insulină, precum şi dezvoltarea cetoacidozei diabetice. Concomitent, unele studii au demonstrat că nivelul crescut de glucoză ar putea fi benefic pentru unele citokine antiinflamatorii şi pentru procesul de eliminare a virusului(3).
Hemoglobina glicozilată, o formă dezoxigenată a hemoglobinei, are un nivel mai mare la pacienţii diabetici decât la persoanele fără hiperglicemie. Deoxihemoglobina poate fi mai uşor atacată de proteinele de suprafaţă ale SARS-CoV-2, care se leagă de lanţul 1-β al hemului din hemoglobina eritrocitelor, cu dereglarea transportului de oxigen şi dioxid de carbon, cu un risc crescut de infecţie cu SARS-CoV-2 şi cu simptom de detresă respiratorie la pacienţii cu DZ(3).
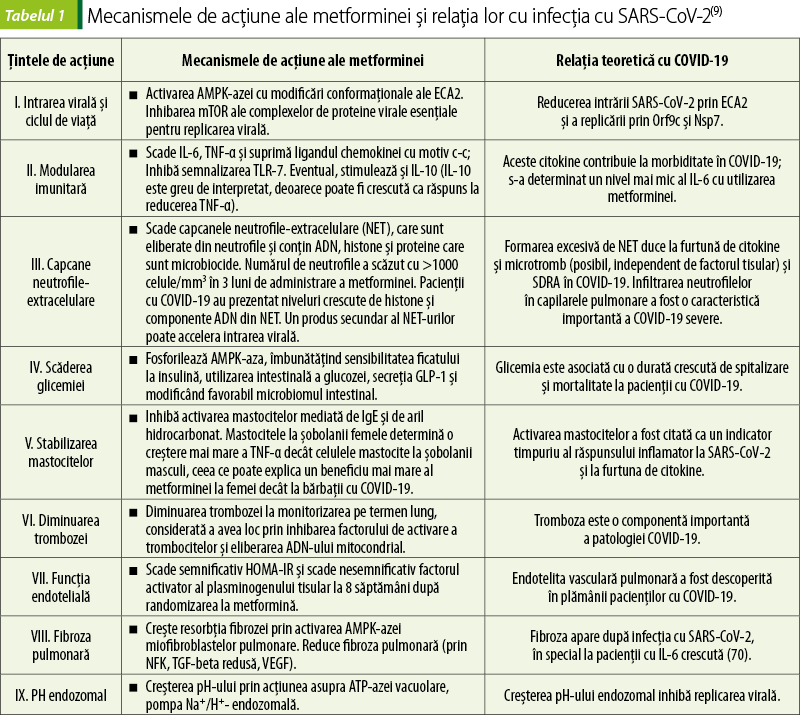
Unele asemănări metabolice între infecţia cu SARS-CoV-2 şi DZ de tip 2, precum hiperglicemia, stresul oxidativ şi citokinele proinflamatoare, pot argumenta eficacitatea posibilă a metforminei în reducerea complicaţiilor COVID-19 la pacienţii cu DZ. Mecanismele acţiunii benefice ale metforminei la pacienţii cu DZ şi infecţia cu SARS-CoV-2 pot fi determinate de: micşorarea masei corporale; controlul nivelului glucozei; afectarea prin calea AMPK-azei a expresiei receptorului enzimei de conversie a angiotensinei 2 (ECA2); reducerea rezistenţei la insulină; îmbunătăţirea stabilităţii ECA2; echilibrarea SRAA; modularea receptorului ECA2; inhibarea furtunii citokinice (IL-6, IL-1β, TNF-α); majorarea nivelului IL-10 antiinflamatoare; inducerea formării macrofagelor şi celulelor T CD8+ cu memorie; modularea compoziţiei microbiomului intestinal; reducerea numărului de neutrofile şi ameliorarea raportului dintre neutrofile şi limfocite; protejarea pacienţilor diabetici la infecţie (inhibarea căii PI3K/AKT/mTOR; preîntâmpinarea formării trombilor; prevenirea leziunilor pulmonare şi a fibrozei; scăderea acidităţii endozomilor şi lizozomilor)(10,24).
S-a arătat că ţesutul adipos visceral abdominal este un indicator al rezultatelor clinice mai severe la pacienţii cu COVID-19. Excesul de ţesut adipos visceral (ŢAV) este principalul secretor de citokine, inclusiv IL-6. Această capacitate a ŢAV ar putea fi unul dintre motivele nivelului mai ridicat de proteină C reactivă (PCR) la obezi, parametru diagnostic utilizat pentru evaluarea nivelului inflamaţiei. Metformina are un efect benefic asupra masei corporale, cu o reducere semnificativă a masei ŢAV. Tratamentul de durată cu metformină la pacienţii cu obezitate abdominală, în asociere cu o dietă hipocalorică, a determinat o reducere mai mare a masei corporale, a ŢAV şi a circumferinţei abdominale. Aceste date susţin continuarea tratamentului la pacienţii obezi sau supraponderali pentru prevenirea COVID-19. Concomitent, prin influenţarea ŢAV, metformina ameliorează rezistenţa la insulină şi funcţia celulelor beta ale pancreasului. Metformina normalizează glicemia fără hipoglicemie, deoarece nu stimulează secreţia de insulină, şi restabileşte producţia normală de insulină prin reducerea insulinei bazale, dacă este în exces. Astfel, reducerea hiperinsulinemiei diminuează inflamaţia. Indicaţia pentru introducerea utilizării continue a metforminei (1,5 g/zi) la pacienţii cu risc mai mare de COVID-19 se referă la persoanele de peste 60 de ani care sunt obeze sau supraponderale (indicele masei corporale – IMC – mai mare de 23,9 pentru femei şi de peste 25 pentru bărbaţi). Persoanele cărora li se va administra metformina vor beneficia şi de proprietăţile pleiotrope, precum efectul anticanceros şi cognitiv, cu reducerea obezităţii şi încetinirea îmbătrânirii.(4).
Obezitatea constituie un factor de risc în infecţia cu SARS-CoV-2, iar utilizarea metforminei a fost asociată cu reducerea masei corporale la pacienţii cu şi fără DZ de tip 2. Metformina provoacă scăderea aportului de alimente şi pierderea în greutate prin creşterea factorului de creştere/diferenţiere 15. Este necesar de determinat dacă pierderea în greutate în săptămânile, lunile sau anii anteriori unei infecţii cu SARS-CoV-2 ar îmbunătăţi rezultatele în COVID-19(9).
Acţiunea antiinflamatoare şi imunomodulatoare a metforminei
Inflamaţia la pacienţii cu COVID-19 s-a confirmat prin creşterea nivelului de citokine patogene critice implicate în furtuna inflamatorie (IL-6, TNF-α, IFN-γ). S-a arătat o corelaţie între nivelul IL-6 şi al lactat-dehidrogenazei (LDH) ca indicatori ai răspunsului inflamator activ în 24 de ore de la spitalizare şi predictorii independenţi ai severităţii COVID-19. Nivelul IL-6 s-ar putea corela cu un profil procoagulant, de asemenea putând provoca leziuni ale lipidelor, proteinelor şi ADN-ului prin creşterea stresului oxidativ, cu afectarea structurii şi funcţiei organelor şi progresia rapidă a COVID-19 la pacienţii cu DZ. Markerii inflamaţiei, D-dimerii şi feritina ar putea contribui la un risc crescut de complicaţii micro- şi macrovasculare, complicaţii asociate cu un risc crescut de mortalitate la pacienţii cu DZ şi COVID-19. Producţia crescută de IFN-γ în infecţiile virale poate activa celulele natural killer (NK) ca mecanism defensiv şi poate provoca rezistenţă la insulină în ţesutul muscular şi adipos. S-a constatat o corelaţie între activitatea celulelor NK şi deteriorarea glicemică la pacienţii cu metabolismul afectat al glucozei. Activitatea celulelor NK este mai mică la pacienţii cu DZ de tip 2 decât la cei cu prediabet sau cu toleranţă normală la glucoză, fapt ce ar putea explica susceptibilitatea mai mare la COVID-19 şi un prognostic mai slab(3,6).
Inflamaţia joacă un rol-cheie în dezvoltarea şi severitatea infecţiei cu SARS-CoV-2. Proteina C-reactivă (PCR), IL-6, TNF-α şi feritina au fost recunoscute ca predictori puternici ai severităţii şi mortalităţii în COVID-19, iar DZ este considerat un factor de risc semnificativ pentru morbiditatea şi mortalitatea din cadrul COVID-19. O metaanaliză a demonstrat corelaţia între severitatea şi mortalitatea infecţiei cu SARS-CoV-2 cu hiperglicemia, rezistenţa la insulină, nivelul hemoglobinei glicolizate (HbA1c) şi markerii inflamaţiei – PCR, IL-6 şi feritină. Aceste date evidenţiază importanţa realizării euglicemiei la pacienţii cu DZ în epoca COVID-19. Există dovezi experimentale şi clinice referitoare la acţiunea antiinflamatoare a metforminei. S-a demonstrat că metformina suprimă secreţia citokinelor proinflamatoare în hepatocite şi macrofage. Metaanalizele anterioare au raportat că metformina a redus semnificativ nivelul PCR la adulţii de vârstă medie şi în vârstă cu inflamaţie cronică şi la femeile cu sindromul ovarului polichistic. S-a demonstrat că metformina a inhibat expresia IL-6 în celulele mucoasei pacienţilor cu boală inflamatoare intestinală, a suprimat eliberarea IL-6 din macrofagele umane, musculatura netedă vasculară şi celulele endoteliale. Nivelul IL-6 şi al feritinei a fost redus într-o manieră dependentă de durată şi de doză la pacienţii cu DZ de tip 2(10,11).
S-a constatat că acţiunea antiinflamatoare a metforminei este mai evidentă la femei comparativ cu bărbaţii, deoarece determină o reducere mai mare a TNF-α şi IL-6 la femei. S-a sugerat că acest lucru s-ar putea datora: unei secreţii mai mari de TNF-α din mastocite ca răspuns la inflamaţie; hormonii sexuali şi modificările epigenetice ale cromozomului Y pot fi responsabile pentru efectele specifice sexului; creşterii nivelului citokinei antiinflamatoare IL-10 la femei mai mult decât la bărbaţi(5,9,23,24).
Infecţia cu SARS-CoV-2, accidentul vascular cerebral acut (AVCA) şi DZ de tip 2 determină un raport neutrofile/limfocite mai mare comparativ cu cel al persoanelor sănătoase ca urmare a activării neutrofilelor şi limfopeniei. Raportul neutrofile/limfocite majorat la pacienţii cu AVCA determină rezultate neurologice nefavorabile şi risc de hemoragie intracerebrală, iar la pacienţii cu COVID-19 este considerat un factor de risc independent pentru spitalizare şi asociat cu o rată ridicată a mortalităţii. S-a constatat că metformina reduce raportul neutrofile/limfocite la pacienţii cu DZ de tip 2. Neutrofilele joacă un rol fundamental în răspunsurile inflamatorii la leziunile ischemice/reperfuzie prin eliberarea de oxidanţi, proteaze, activarea toll receptorilor (TLR) şi eliberarea de produse inflamatorii. S-a raportat efectul dependent de doză al metforminei în reducerea activării şi recrutării neutrofilelor(1,6).
Procesul inflamator marcant este asociat cu o severitate crescută la pacienţii cu COVID-19, fapt confirmat de eficacitatea preparatelor antiinflamatoare. Cercetările anterioare au indicat faptul că monocitele suferă o reprogramare metabolică şi produc citokine proinflamatoare la stimularea cu SARS-CoV-2. S-a emis ipoteza că legarea de proteina virală spike mediază acest efect şi că medicamentele care reglează imunometabolismul ar putea inhiba răspunsul inflamator în monocite. Monocitele stimulate cu subunitatea 1 a proteinei spike a SARS-CoV-2 recombinantă au arătat o creştere dependentă de doză a metabolismului glicolitic care a fost asociată cu producerea de citokine proinflamatorii, inclusiv IL-6 şi TNF-α. Acest răspuns a fost dependent de factorul-1α inductibil de hipoxie (HIF-1α), deoarece antagoniştii HIF-1α au inhibat glicoliza şi producţia de citokine. Inhibarea metabolismului glicolitic prin 2-deoxiglucoză (2-DG) sau privarea de glucoză a inhibat răspunsul glicolitic, iar 2-DG a suprimat puternic producţia de citokine. Monocitele lipsite de glucoză au redus producţia de citokine prin reglarea în sus a fosforilării oxidative, efect care nu a fost prezent în monocitele tratate cu 2-DG datorită efectului cunoscut al 2-DG asupra suprimării metabolismului mitocondrial. Pretratamentul monocitelor cu metformină a suprimat puternic producţia de citokine mediată de proteine în monocite şi a suprimat metabolismul glicolitic şi mitocondrial. Astfel, proteina spike a SARS-CoV-2 induce un răspuns imunometabolic proinflamator în monocite care poate fi suprimat de metformină. Preparatul a inhibat răspunsurile inflamatorii la SARS-CoV-2 viu, fapt ce denotă implicaţii potenţiale pentru tratamentul hiperinflamaţiei în timpul COVID-19(7).
Fagocitele mononucleare, precum monocitele şi macrofagele, sunt constituenţii-cheie ai sistemului imunitar înnăscut şi produc citokine proinflamatorii în timpul infecţiei virale. Infiltrarea pulmonilor cu monocite şi macrofage a determinat severitatea COVID-19. La persoanele infectate cu SARS-CoV-2, monocitele prezintă modificări fenotipice asociate cu hiperinflamarea, inclusiv expresia redusă a HLA-DR, expresia crescută a CD16 şi hiperproducţia de citokine. Ultimul deceniu a cunoscut un interes ştiinţific în reglarea activării şi funcţiei celulelor imune prin reprogramarea metabolică. În condiţii proinflamatorii, celulele imune, inclusiv celulele mieloide, trec la glicoliză aerobă care asigură un ATP suficient pentru a susţine funcţiile celulare care propagă răspunsurile proinflamatorii şi antipatogene ale gazdei. S-a demonstrat că infecţia cu SARS-CoV-2 produce reprogramarea glicolitică proinflamatorie în monocitele infectate, modificând, de asemenea, şi metabolismul lipidic monocitar pentru a promova formarea de picături lipidice care este asociată cu producerea de citokine proinflamatoare. Prin urmare, SARS-CoV-2 pare să reprogrameze metabolismul în monocite, dar factorii virali care mediază aceste răspunsuri sunt neclari. S-a sugerat că proteina virală spike ar putea media activarea proinflamatorie în macrofage, iar dovezile recente sugerează că proteina spike a SARS-CoV-2 activează şi răspunsurile inflamatorii în macrofage şi monocite in vitro şi in vivo. S-a demonstrat că subunitatea 1 a proteinei spike a SARS-CoV-2 determină activarea glicolizei dependente de HIF-1α şi producerea de citokine inflamatorii în monocite care poate fi suprimată prin tratamentul cu metformină. Datele experimentale detaliază un mecanism prin care SARS-CoV-2 mediază reprogramarea metabolică în monocitele umane şi oferă suplimentar un mecanism potenţial care sugerează că metformina manifestă efecte protectoare la pacienţii cu COVID-19(7).
Caracteristica-cheie în COVID-19 este dereglarea răspunsului imun cu o creştere a eliberării citokinelor asociată cu o atenuare a răspunsului interferonilor, în principal ca urmare a limfodepleţiei celulelor T în paralel cu o hiperactivare a imunităţii înnăscute. Receptorii interferonilor de tip I şi de tip II sunt exprimaţi în celulele imune şi alte celule, iar receptorul interferonului de tip III este exprimat în celulele epiteliale din căile respiratorii superioare şi inferioare. Interferonii de tip I şi II produc un răspuns proinflamator, iar interferonii de tip III reduc replicarea virală, induc stabilitatea barierei epiteliale şi sunt mai puţin inflamatori. Din aceste considerente, un răspuns adecvat la interferon este esenţial pentru combaterea unui virus şi pentru eliminarea unei infecţii virale. La persoanele în vârstă, la cei cu obezitate şi DZ există un răspuns timpuriu afectat al interferonilor antivirali, contribuind la susceptibilitatea la COVID-19 sever la aceşti indivizi. Infecţia cu SARS-CoV-2 potenţează starea inflamatorie cronică existentă, rezultând o boală severă. În paralel cu atenuarea semnalizării interferonului, există o activare clară a neutrofilelor şi monocitelor-macrofage, principalele surse de mediatori ai hiperinflamaţiei. Neutrofilele au un rol-cheie în patogeneza COVID-19, deoarece SARS-CoV-2 induce infiltrarea acestor celule în plămâni, cu declanşarea furtunii citokinice, disfuncţiei endoteliale şi trombozei venoase. În DZ, aceste efecte sunt potenţate, deoarece hiperglicemia activează neutrofilele care contribuie la furtuna citokinică şi sepsis în COVID-19, confirmate prin creşterea markerilor inflamatori serici (VSH, proteina C reactivă, feritină, fibrinogen, D-dimeri, LDH)(17).
Sindromul de detresă respiratorie acută, reacţie inflamatorie pulmonară severă declanşată de SARS-CoV-2, este cauza principală de deces la pacienţii cu COVID-19 spitalizaţi în terapie intensivă. Debutul SDRA depinde de celulele imune înnăscute, monocite, macrofage şi de neutrofile, care propagă inflamaţia necontrolată şi leziunile ţesuturilor prin secreţia IL-1β, IL-18, IL-6 şi a TNF-α. Răspunsul inflamator în SDRA declanşat de bacterii este iniţiat de angajarea receptorului Toll‑like (TLR), iar în cel steril sau viral se crede că este iniţiat de inflamazomul NLRP3, care este extrem de exprimat şi activat în celulele mieloide care au fost bazate pe implicarea TLR de către ARN viral sau proteine, precum proteina spike SARS-CoV. Inflamazomul NLRP3, compus din enzima caspază-1 (Casp1), sensorul NLRP3, kinaza mitotică NEK7 şi proteina de schelă ASC, este activat prin moleculele‑patern asociate de deteriorare (DAMPs), precum microcristale ATP şi acid uric, eliberate de celulele epiteliale lezate sau proteina viroporină 3a care formează pori SARS-CoV‑2. Celulele epiteliale lezate eliberează IL-1α, care iniţiază macrofagele căilor respiratorii prin intermediul TLR, stimulează sinteza ADN-ului mitocondrial mediat de AND-polimerază γ (POLγ), iar microcristalele de ATP, acid uric şi alte DAMP provoacă leziuni mitocondriale şi producerea SRO. Speciile reactive de oxigen mitocondriale reacţionează cu ADN‑ul mitocondrial nou sintetizat pentru a genera ADN oxidat, care se leagă de NLRP3 citoplasmatic şi declanşează asamblarea şi activarea inflamazomului. ADN-ul mitocondrial circulant s-a sugerat a fi un mediator inflamator care provoacă leziuni la distanţă ale organelor şi un indicator timpuriu al bolilor severe şi al mortalităţii în SDRA. Alţi factori care amplifică severitatea şi mortalitatea în SDRA sunt bătrâneţea şi comorbidităţile, precum DZ de tip 2 şi obezitatea. Mai multe medicamente utilizate, inclusiv dexametazona, statinele şi metformina, reduc severitatea şi mortalitatea în COVID-19. Studiile timpurii din China au relevat că utilizarea pe termen lung a metforminei a scăzut mortalitatea spitalicească de patru ori faţă de alte medicamente antidiabetice şi a redus insuficienţa cardiacă şi inflamaţia asociate COVID-19. Utilizarea extinsă a metforminei a ameliorat alte patologii legate de vârstă, a majorat durata de viaţă şi a ameliorat starea sănătăţii, efecte care nu au legătură cu controlul glicemic, dar se pot datora proprietăţilor antiinflamatoare. Utilizarea prelungită a metforminei, dar nu şi a altor medicamente antidiabetice, se corelează cu scăderea demenţei legate de vârstă şi a incidenţei bolii neurodegenerative la pacienţii vârstnici cu DZ de tip 2. Se consideră că metformina inhibă fosforilarea oxidativă şi reduce producţia de ATP prin interacţiunea cu complexul respirator I (ETCCI) sau alte componente ale lanţului mitocondrial de transport al electronilor. Metformina, prin creşterea raportului ADP/ATP, activează AMPK-aza şi inhibă senzorul de nutrienţi mTORC1, reducând producţia hepatică de glucoză şi îmbunătăţind autofagia, un proces homeostatic care limitează deteriorarea celulelor şi a ţesuturilor. Autofagia limitează parţial inflamaţia cu eliminarea mitocondriilor lezate şi limitarea activării inflamazomului NLRP3. Administrarea metforminei reduce activarea inflamazomului NLRP3 a macrofagelor la indivizii diabetici şi în celulele nonmieloide prin intermediul unui mecanism dependent de AMPK-ază. S-a sugerat că AMPK-aza inhibă activarea NF-κB în celulele endoteliale vasculare şi cardiomiocite. S-a demonstrat, de asemenea, că metformina inhibă NF-κB şi inducerea de citokine în glie independent de AMPK-ază şi ameliorează tromboza indusă de poluarea aerului şi producţia de IL-6 prin macrofagele alveolare prin inhibarea ETCCI. Metformina nu a afectat expresia TNF sau a altor citokine şi chemokine, dar a inhibat secreţia IL-6 şi IL-1β(22).
Utilizarea în condiţii de ambulatoriu a metforminei a fost asociată cu o mortalitate mai mică şi cu o tendinţă de scădere a numărului de internări pentru COVID-19. S-a demonstrat că metformina scade IL-6 şi TNF-α, citokine care cresc morbiditatea în COVID-19. Astfel, metformina trebuie evaluată pentru tratamentul ambulatoriu al pacienţilor cu COVID-19 în contextul siguranţei stabilite şi dovezilor crescânde ale reducerii severităţii COVID-19(3,5).
Comunităţile microbiene sunt esenţiale pentru sănătatea umană, iar metformina poate limita inflamaţia sistemică prin îmbunătăţirea microbiomului. Obezitatea, DZ şi alte tulburări metabolice sunt asociate cu comunităţi microbiene dezechilibrate (disbioză microbiană), care poate avea mai multe efecte dăunătoare asupra sănătăţii, inclusiv inflamaţia mucoasei şi cea sistemică, translocaţia microbiană şi deteriorarea barierei epiteliale a intestinului. Mai multe studii au demonstrat că boala COVID-19 este asociată cu disbioză microbiană, care poate fi un mecanism potenţial al inflamaţiei şi dereglărilor imune. Metformina poate limita severitatea COVID-19 prin îmbunătăţirea microbiomului pentru a promova efectele antiinflamatoare. S-a demonstrat că metformina poate exercita o influenţă benefică asupra microbiomului prin: creşterea tulpinilor probiotice de bacterii cu proprietăţi antiinflamatoare (Lactobacillus); creşterea de bacterii Bifidobacteria, Megasphera, Ruminococcus şi Butyrivibrio, care produc acizi graşi cu lanţ scurt, esenţiali pentru funcţia barierei epiteliale, şi reglarea inflamaţiei; multiplicarea bacteriilor Bacteroides spp., care produc acizi biliari, esenţiali în homeostazia colesterolului şi în procesele metabolice; îmbunătăţirea comunităţilor microbiene asociate cu reducerea inflamaţiei sistemice, translocaţiei microbiene şi disfuncţiei barierei; niveluri crescute de bacterii, speciile Akkermansia, care degradează mucinele şi pot preveni formarea de biofilme, care pot promova speciile de bacterii inflamatorii; reducerea bacteriilor Prevotella, cunoscute a fi asociate cu afectarea barierei şi cu inflamaţia(9).
Acţiunea antivirală a metforminei
S-a presupus că metformina poate avea un efect inhibitor direct sau indirect asupra virusurilor, inclusiv SARS-CoV-2. Metformina are efect antiviral potenţial faţă de diferite virusuri prin activarea AMPK-azei. Studiile recente au confirmat efectul antiviral al metforminei împotriva replicării SARS-CoV-2. Activitatea anti-SARS-CoV-2 a metforminei este determinată de diferite mecanisme: a) activarea AMPK-azei, care duce la fosforilarea receptorului ECA2 la Ser-680, unde se produce interacţiunea, stabilizarea şi modificările conformaţionale ale ECA2, cu diminuarea sensibilităţii la legarea SARS-CoV-2; b) reglarea ECA2 pulmonare, care determină efecte antiinflamatoare şi antiapoptotice; c) reglarea ECA2 previne efectul dăunător al nivelului crescut de Ang II în pneumonia indusă de COVID-19; d) atenuarea afecţiunilor în pneumonia indusă de COVID-19 prin inhibarea migrării neutrofilelor şi a chemotaxiei, cu efect de stabilizare a mastocitelor(1,6,13).
Utilizarea metforminei s-a asociat cu beneficii potenţiale în diferite infecţii virale, inclusiv gripa H3N2, hepatita C, hepatita B, Zika, HIV etc. Un studiu observaţional la pacienţii cu DZ de tip 2 a demonstrat că cei menţinuţi în terapia cu biguanide au avut o incidenţă mai mică a infecţiilor cu gripă H3N2 în comparaţie cu pacienţii trataţi cu insulină şi sulfonilureice. Studiile experimentale şi clinice au demonstrat că metformina poate influenţa mecanismele responsabile de consecinţele severe ale COVID-19. Metformina, prin AMPK-ază, determină fosforilarea directă a receptorului ECA2, fapt ce sugerează că această modificare ar putea duce la modificări conformaţionale ale sitului de legare a SARS-CoV-2 la receptorii ECA2 şi, la rândul său, reduce recunoaşterea SARS-CoV-2. La pacienţii cu DZ şi COVID-19 cărora li se administra metformină, în comparaţie cu alte antidiabetice, inclusiv insulină, s-a constatat un nivel mai mic al IL-6 şi TNF-α. S-a demonstrat că utilizarea preparatului reduce nivelul inhibitorului activatorului plasminogen-1 şi factorului VII şi stabilizează trombocitele, cu diminuarea riscului de coagulare. Mai multe studii de cohortă retrospective şi o metaanaliză au raportat o reducere a mortalităţii la pacienţii cu DZ şi COVID-19 care utilizau metformină. S-a concluzionat că metformina, concomitent cu normalizarea nivelului glicemiei, manifestă mai multe mecanisme care pot oferi beneficii în timpul infecţiei cu SARS-CoV-2(2,5,6,9).
Replicarea SARS-CoV-2 are loc în principal în tractul respirator, iar studiile efectuate pe primate neumane relevă că acestea au loc şi în ţesuturile extrapulmonare, precum intestinul subţire, colon, pancreas şi amigdale. S-a remarcat că receptorul ECA2 este exprimat în diferite organe şi ţesuturi, precum creier, inimă, ficat, intestin, pancreas, rinichi, ţesutul adipos şi vase, ceea ce le face posibile ţinte pentru infecţia cu SARS-CoV-2 şi poate explica disfuncţiile poliorganice la pacienţii cu COVID-19. Factorii de risc, precum diabetul şi obezitatea, s-au corelat cu o expresie crescută a ECA2 în diferite ţesuturi, determinând o posibilă creştere a încărcăturii virale în aceste ţesuturi. La persoanele diabetice şi obeze, eliminarea şi redistribuirea ECA2 de pe suprafaţa celulei susţin răspândirea virală în diferite regiuni ale corpului(21).
Analiza studiilor a evidenţiat capacitatea metforminei de a avea influenţă asupra diferitelor etape ale infecţiei virale, de la legarea proteinei spike a SARS-CoV-2 de receptorul ECA2 al gazdei şi până la eliberarea virionilor asamblaţi prin exocitoză (figura 1). Metformina, prin activarea directă a AMPK-azei, poate promova fosforilarea ECA2 şi schimbarea conformaţională cu împiedicarea legării virusului de receptorul ECA2 a gazdei (figura 1-❶). Mai mult decât atât, fosforilarea ECA2 dependentă de AMPK-ază, mediată de metformină, prelungeşte timpul de înjumătăţire al ECA2 şi oferă un potenţial de protecţie pulmonară. Modificările conformaţiei 3D ale domeniului extracelular al ECA2, induse de transformările posttranslaţionale, ar putea diminua recunoaşterea SARS-CoV-2. Se presupune că metformina ar stabiliza expresia ECA2 în căile respiratorii şi ar putea agrava infecţia cu SARS-CoV-2. Cu toate acestea, s-a remarcat faptul că legarea virală de ECA2 scade stabilitatea şi disponibilitatea ECA2, ceea ce duce la un dezechilibru în SRAA şi la manifestarea efectelor biologice nocive (efecte vasoconstrictoare, hipertrofice, fibrotice, proliferative şi proinflamatorii şi inducerea stresului oxidativ) în diferite organe. Metformina, prin activarea AMPK-azei, poate preveni reglarea descendentă a ECA2 mediată de SARS-CoV-2. Creşterea mediată de metformină (1) a nivelurilor de ECA2 şi (2) fosforilarea ECA2 reglează ulterior SRAA, oferind protecţie cardiopulmonară, cu stabilitatea endoteliului pulmonar şi atenuarea hipertensiunii pulmonare. Expresia şi stabilitatea ECA2, asociate tratamentului cu metformină, pot modula pozitiv braţul benefic (ECA2/Ang 1-7) al SRAA şi pot preveni afectarea pancreatică şi debutul unui diabet nou la pacienţii cu COVID-19 prin protejarea şi menţinerea funcţiei normale a pancreasului(9,21).

FOTO: PLOS PATHOGENS DOI: HTTPS://DOI.ORG/10.1371/JOURNAL.PPAT.1009634.G003 (TRANSLATED)
Indicatorii numerici ①–⑩ ilustrează diferitele etape ale unei infecţii virale tipice, cu replicare, transcriere, traducere a proteinelor, asamblare virionică şi eliberare. Infecţia virală începe cu ataşarea proteinei spike [S] a virusului de receptorul‑gazdă ECA2 pentru a forma complexul RBD-PD. Această ataşare este pregătită de o altă proteină, serin-proteaza transmembranară 2 (TMPRSS2) „①a”, iar „①b” indică o altă formă de intrare virală prin fuziunea membranei-gazdă. Intrarea virală prin endocitoză este urmată de decapsidarea „②a” şi eliberarea genomului ARN viral „②b”, care este tradus în proteine de ARN polimerază virală, rezultând formarea de ARN-sub-genomice (-) utilizate apoi ca şablon din sub -ARNm genomic (+). După aceea au loc următoarele procese: replicarea ARN‑ului citoplasmatic viral ④, transcripţia proteinei nucleocapsidei [N] ⑤ şi traducerea ulterioară ⑥ a proteinelor virale structurale [S], membranare [M] şi a învelişului [E] în ER, urmate de asamblarea proteinelor structurale [S], [M] şi [E] cu complexul ARN al genomului viral al proteinei [N] şi ansamblul virion matur ⑧ în ERGIC. Virionii se detaşează din aparatul Golgi ⑨ şi sunt eliberaţi ⑩ prin exocitoză.
Indicatorii numerici ❶–❾ ilustrează potenţialele situri ale acţiunii metforminei asupra ciclului virus-gazdă. ❶ Metformina poate inhiba ataşarea virusului la membrana plasmatică a gazdei prin blocarea legării virusului la receptorul ECA2 a gazdei. Metformina, direct ❷, indirect prin inhibarea Akt ❸ sau prin activarea AMPK-azei ❹, inhibă activitatea mTOR ❺, cu suprimarea interacţiunii virus-gazdă. Inhibarea complexului respirator I de către metformină „❼a” activează AMPK‑aza „❼b” cu inhibarea semnalizării mTOR. Metformina inhibă, de asemenea, generarea mitocondrială de SRO „❼c”, care ulterior previne epuizarea indusă de SRO de calciu ER (Ca2+) şi suprimă activarea canalului CRAC „❼d”, prevenind SOCE şi creşterea Ca2+ intracelular şi eliberarea ulterioară a IL-6 „❼e”, care este adesea asociată cu COVID-19 şi mediază tromboza. Metformina creşte sensibilitatea la insulină ❽ şi inhibă infecţiile virale, modifică pH-ul endozomal şi reduce replicarea şi maturarea virală ❾.
Metformina, utilizată pentru controlul glicemiei la persoanele în vârstă infectate cu SARS-CoV-2, a redus mortalitatea prin inhibarea ţintelor de rapamicină la mamifere (mTOR). Preparatul poate perturba interacţiunea dintre gazdă şi proteinele virale necesare pentru replicarea virală, asamblarea virionului şi patogeneză. Tratamentul cu metformină direct (1), prin inhibarea Akt (2) şi/sau activarea AMPK-azei (3) (figura 1-❷❸❹) inhibă calea de semnalizare mTOR (figura 1 -❺) cu stoparea procesului de translare celulară, necesară pentru sinteza proteinelor virale. Concomitent, două proteine ale gazdei, LARP1 şi FKBP7, reglate de calea de semnalizare mTOR, interacţionează cu proteinele virale N şi Orf8 ale SARS-COV-2 (figura 1-❻). Proteinele virale NSP7, M şi proteina-gazdă NDUF din lanţul de transport al electronilor sunt ţinte ale metforminei(21).
La pacienţii cu COVID-19, legarea SARS-CoV-2 la ECA2 şi scăderea disponibilităţii ECA2 creează un dezechilibru în SRAA, care determină hiperactivarea axei AngII/AT1R şi declanşarea procesului inflamator mediat de activarea NF-κB şi sinteza şi secreţia citokinelor proinflamatorii (TNFα, IL-6, IL-1 şi IL-1β), care explică manifestările severe ale bolii, insuficienţa poliorganică şi mortalitatea mai mare la pacienţii diabetici cu COVID-19. Capacitatea SARS-CoV-2 de a infecta şi de a deteriora celulele endoteliale cauzează disfuncţii endoteliale, ca urmare a prezenţei receptorilor ECA2 în endoteliu. Disfuncţia endotelială (mediată de stresul oxidativ indus de diabet şi de nivelul redus de oxid nitric) şi existenţa unei stări protrombotice sunt semnele distinctive ale diabetului evident şi, posibil, pot exacerba complicaţiile vasculare legate de COVID-19. Activarea în DZ a receptorilor prin produsele finale avansate de glicaţie (PFAG) şi alţi liganzi declanşează transcrierea genelor care codifică molecula proinflamatoare şi de adeziune celulară dependentă de NF-κB şi contribuie la disfuncţia endotelială şi la complicaţii cronice vasculare şi de coagulare susţinute de creşterea permeabilităţii vasculare, creşterea aderenţei leucocitelor şi de extravazare. Inhibarea complexului 1 al lanţului mitocondrial de transport de electroni se consideră a fi mecanismul cel mai bine stabilit al metforminei legat de creşterea raportului AMP/ATP cu activarea AMPK-azei (figura 1-❼b) şi inhibarea ulterioară a mTOR. Inhibarea lanţului mitocondrial de electroni suprimă, de asemenea, stresul oxidativ indus de speciile reactive de oxigen (SRO) (figura 1-❼c) şi atenuează disfuncţia endotelială şi senescenţa. Exacerbarea SRO mediază eliberarea IL-6 prin cumularea Ca2+ intracelular datorită deschiderii canalelor de Ca2+ activate cu eliberarea de Ca2+ (CRAC). Reducerea SRO, mediată de metformină, a prevenit epuizarea şi eliberarea Ca2+ din reticulul endoplasmatic şi a inhibat intrarea Ca2+ prin CRAC (figura 1-❼d şi ❼e)(21).
Efectele imunomodulatoare ale metforminei (inhibarea diferenţierii monocite-macrofage, suprimarea capacităţii proinflamatorii ale macrofagelor activate şi diferenţierea celulelor T în celule T reglatoare şi de memorie) sunt provocate de activarea AMPK-azei, inhibarea ulterioară a mTOR şi de reducerea stresului oxidativ. Metformina, prin inhibarea activării NF-κBm şi reglarea ulterioară a genelor care codifică mai multe citokine proinflamatorii şi molecule de adeziune celulară în celulele endoteliale vasculare, celulele musculaturii netede şi macrofage, reduce răspunsul inflamator şi imun şi conferă astfel protecţie vasculară(21).
Metformina, prin reducerea rezistenţei la insulină, poate determina un rol posibil în inhibarea infecţiei cu virus. Reducerea glicemiei şi creşterea sensibilităţii la insulină reduce semnificativ susceptibilitatea la infecţii virale şi severitatea bolii în rândul persoanelor afectate (figura 1-❽). Metformina, prin activarea AMPK-azei şi translocarea transportorilor de glucoză GLUT1/4 către membrana plasmatică, facilitează absorbţia glucozei de către celule şi reduce glicemia. Reducerea rezistenţei la insulină poate fi cauzată de menţinerea homeostazei pancreatice, creşterea viabilităţii β-celulelor şi promovarea metabolismului glucozei. Insulina are un rol important în stimularea sistemului imunitar şi în lupta împotriva infecţiilor. Celulele imune centrale, precum celulele T, celulele B sau macrofagele, exprimă receptori pentru insulină, iar legarea ligandului declanşează o cascadă de semnalizare transdusă prin calea PI3K/AKT/mTOR. Diminuarea funcţiei celulelor T, asociată cu insuficienţa semnalizării insulinei, se corelează cu un clearance viral scăzut şi cu un răspuns neadecvat la vaccin. ECA2 joacă un rol crucial în menţinerea homeostaziei glucozei prin activarea axei receptorului Ang 1-7/MAS, care creşte supravieţuirea β-celulelor pancreasului şi menţine secreţia de insulină. O funcţie modificată a ECA2 sau a SRAA local favorizează apariţia DZ de tip 2. Rolul protector al ECA2 împotriva rezistenţei la insulină este îmbunătăţit de nivelul de Ang1-7 prin expresia GLUT4 şi factorul de transcripţie al miocitelor 2A. Astfel, ECA2 este o ţintă potenţială pentru intervenţia terapeutică în care metformina poate bloca calea activată de semnalizare AngII/AT1R/insulină şi răspunsul imun asociat(21).
Metformina poate modifica pH-ul endozomal cu întreruperea ciclului viral şi infectarea celulelor. S-a stabilit că pentru SARS-CoV-2 calea endocitară este modul de intrare în celulele epiteliale pulmonare. Acest proces de endocitoză a fost dependent de pH şi de legarea proteinei virale spike cu receptorul ECA2, urmată de internalizarea virusului şi a receptorului ECA2 în endozom şi reciclarea receptorilor înapoi la suprafaţa membranei celulare. Un factor crucial pentru supravieţuirea virusului în celula-gazdă este pH-ul endozomal. Un pH intracelular scăzut (acid) poate favoriza legarea SARS-CoV-2 de celula-gazdă, multiplicarea acestuia şi maturarea virionului endozomal. Prin urmare, medicamentele capabile să modifice pH-ul endozomal pot inhiba maturarea virală, asamblarea şi supravieţuirea în celula-gazdă. Reglatorii primari ai pH-ului endozomal sunt ATP-aza vacuolară (V-ATPaza) şi pompa Na+/H+-endozomală, care se consideră ţinte pentru metformină, ce determină creşterea pH-ului celular şi endozomal şi suprimarea ciclului endocitic şi maturarea virionului (figura 1-❾)(9,21).
Acţiunea antitrombotică a metforminei
Utilizarea metforminei la pacienţii cu DZ de tip 2 este asociată cu un risc redus de tromboză venoasă profundă, aşa cum a fost raportat de un studiu de cohortă nerandomizat. Alte studii sugerează că metformina previne activarea trombocitelor şi eliberarea extracelulară a ADN-ului mitocondrial, prevenind astfel tromboza venoasă şi arterială, fără prelungirea semnificativă a timpului de sângerare. Efectele protectoare ale metforminei asupra endoteliului se explică prin activarea AMPK-azei şi stimularea nitri-oxid-sintazei endoteliale (NOSe). Metformina poate proteja endoteliul prin reducerea stresului oxidativ, inhibarea inflamaţiei endoteliale şi suprimarea aderării leucocitelor la endoteliu, atenuând în acelaşi timp senescenţa şi apoptoza celulelor endoteliale şi păstrând glicocalixul endotelial care protejează împotriva disfuncţiei endoteliale(16).
S-a confirmat că metformina are proprietăţi antitrombotice, afirmaţie susţinută de cercetările în care tratamentul cu metformină la pacienţii cu DZ a fost asociat cu un risc redus de tromboză venoasă profundă sau prin studii care au dovedit capacitatea metforminei de a proteja trombocitele împotriva activării şi de a preveni eliberarea extracelulară a ADN‑ului mitocondrial. Metformina a determinat proprietăţi endoteliu-protectoare prin reducerea stresului oxidativ şi a inflamaţiei(3).
Acţiunea cardio- şi vasoprotectoare a metforminei
Metformina are efecte benefice potenţiale asupra sistemului cardiovascular la pacienţii supraponderali cu DZ şi nu provoacă hipoglicemie. La pacienţii diabetici cu comorbidităţi (obezitate, hipertensiune arterială, maladii cardiovasculare), activarea aberantă a SRAA, creşterea stresului oxidativ şi a inflamaţiei şi activarea sistemului imunitar pot exacerba complicaţiile clinice în timpul infecţiei cu SARS-COV-2 şi pot contribui la mortalitate la pacienţii cu COVID-19. Metformina poate fi recomandată (în absenţa unor afecţiuni renale severe) ca medicament preventiv pentru protejarea pacienţilor cu DZ de tip 2 şi obezitate împotriva dezvoltării formelor severe şi pentru creşterea supravieţuirii la pacienţii cu COVID-19. Efectele protectoare ale metforminei depăşesc efectul său antihiperglicemic şi capacitatea de a creşte sensibilitatea la insulină la pacienţii cu DZ cu comorbidităţi multiple. Studiile sunt justificate pentru a explora efectul antihiperglicemic, antiviral, antiinflamator, imunomodulator şi antitrombotic al metforminei care poate contribui la efectele sale de protecţie la pacienţii diabetici cu COVID-19 în absenţa/prezenţa uneia sau mai multor comorbidităţi(11,16,18).
În cadrul studiului s-a constatat că metformina a ameliorat rezultatele clinice şi de laborator la pacienţii cu DZ de tip 2 şi COVID-19 în comparaţie cu pacienţii cu COVID-19 trataţi fără metformină. Terapia cu metformină la pacienţii cu DZ de tip 2 şi COVID-19 care au dezvoltat accident vascular cerebral acut (AVCA) a fost asociată cu un profil cardiometabolic mai bun şi cu un nivel redus de citokine proinflamatoare comparativ cu pacienţii trataţi fără metformină. S-a constatat că terapia cu metformină este asociată cu o reducere a mortalităţii la pacienţii spitalizaţi cu COVID-19 şi DZ de tip 2 datorită efectului antiinflamator şi antiviral. Efectul antiinflamator al metforminei este determinat de activarea căii AMPK-azei cu suprimarea ulterioară a IL-6 şi TNF-α şi activarea IL-10 antiinflamatoare. Aceste modificări declanşate de metformină sunt capabile să atenueze producţia de citokine în macrofage şi celulele gliale activate în timpul neuroinflamaţiei marcante în COVID-19 şi indusă de AVCA. S-a confirmat că metformina are un efect neuroprotector prin inhibarea apoptozei şi a stresului oxidativ în AVCA şi, prin urmare, poate fi privită ca un agent preventiv promiţător împotriva reperfuziei ischemice în AVCA(1).
Terapia cu metformină, în comparaţie cu pacienţii care nu au administrat preparatul, a determinat un risc mai mic al ictusului ca urmare a efectelor neuroprotectoare. Efectul potenţial neuroprotector al metforminei în AVCA a fost legat de inhibarea dependentă de AMPK a căii NFκB, activarea citokinelor şi de ameliorarea semnificativă a consumului neuronal de glucoză-oxigen. Terapia cu metformină a determinat un grad mai mic de afectare pulmonară, indusă de endotoxemie, la pacienţii cu DZ de tip 2 şi COVID-19, prin restaurarea inhibării pulmonare AMPK dependentă a semnalizării mTOR. Astfel, metformina la pacienţii cu DZ de tip 2, COVID-19 şi AVCA determină efecte de protecţie atât asupra pulmonilor, cât şi asupra creierului(1).
Efectele benefice ale metforminei la pacienţii cu DZ şi infecţie cu SARS-CoV-2 sunt rezumate în tabelul 1.
Restricţiile metforminei
Efectele benefice ale metforminei pentru a reduce durata spitalizării, decesul în spital şi prognosticul slab sunt controversate. Unele studii au sugerat ca metformina să nu se utilizeze în tratamentul pacienţilor cu DZ şi COVID-19 din următoarele considerente: riscul de lactacidoză, îndeosebi la pacienţii cu insuficienţă cardiacă, afecţiuni respiratorii, sepsis, insuficienţă renală; reducerea absorbţiei intestinale a vitaminei B12 cu micşorarea concentraţiei plasmatice (vitamina B12 este importantă în reglarea sistemului imunitar, iar insuficienţa poate afecta negativ răspunsurile imune celulare); acţiuni sinergice cu ale inhibitorilor enzimei de conversie a angiotensinei sau blocantelor receptorilor angiotensinici, care pot duce la creşterea disponibilităţii ECA2 în căile respiratorii(18,24).
Majoritatea studiilor au evidenţiat efectele benefice ale metforminei la pacienţii cu COVID-19, în timp ce unele studii au raportat un risc crescut de acidoză (dar nu mortalitate) şi severitate a bolii la pacienţii cu COVID-19. Din aceste considerente, la utilizarea metforminei trebuie luate în consideraţie contraindicaţiile, precum şi faptul că preparatul nu este o alegere adecvată la pacienţii cu patologie respiratorie severă, insuficienţă renală, insuficienţă cardiacă şi subliniază importanţa acordării atenţiei condiţiilor preexistente şi comorbidităţilor în selectarea medicamentului(16,18,23).
Riscul de lactacidoză cauzat de metformină se asociază cu creşterea ratei de mortalitate la pacienţii cu COVID-19 care dezvoltă hipoperfuzie şi hipoxemie. În formele critice de COVID-19, SDRA, cauza majoră a morbidităţii şi mortalităţii, se datorează în mare parte pneumonitei virale acute care evoluează către insuficienţă respiratorie acută hipoxemică, frecvent asociată cu instabilitate hemodinamică ce ar putea duce la formarea lactatului sub acţiunea metforminei. Incidenţa lactacidozei ar putea creşte ca urmare a insuficienţei cardiace acute decompensate preexistente sau nediagnosticate, leziunii miocardice acute sau a utilizării preparatelor vasoconstrictoare în cazul hipotensiunii arteriale. În aceste cazuri, administrarea de metformină trebuie întreruptă cel puţin temporar la pacienţii spitalizaţi cu COVID-19 care au dezvoltat sau sunt susceptibili să dezvolte decompensare hemodinamică, din cauza unui risc crescut de lactacidoză(8,12).
Concluzii
În baza analizei efectuate, putem constata că majoritatea studiilor şi metaanalizelor susţin efectele benefice ale metforminei la pacienţii cu DZ de tip 2 şi COVID-19:
-
Efectul euglicemiant cu reglarea metabolismului glucozei prin creşterea captării glucozei de muşchi şi ţesutul adipos; reducerea glicogenolizei şi gluconeogenezei în ficat; reglarea secreţiei, sensibilităţii şi rezistenţei la insulină; reprogramarea metabolică a celulelor imune; diminuarea proceselor de glicozilare a hemoglobinei; ameliorarea metabolismului lipidic şi reducerea masei corporale.
-
Acţiunea antiinflamatoare şi imunomodulatoare prin scăderea producerii şi secreţiei citokinelor proinflamatoare (Il-1 beta, IL-6, TNF-alfa etc.); creşterea rolului citokinelor antiinflamatoare (IL-10); modularea imunităţii celulare; reprogramarea metabolismului glicolitic în monocite, macrofage şi celulele T; reducerea glicemiei şi stresului oxidativ; ameliorarea parametrilor inflamaţiei (proteina C reactivă, D-dimeri, feritină).
-
Acţiunea antivirală prin inhibarea interacţiunii virusului cu ECA2 şi a fuziunii virale; creşterea pH-ului endozomal cu dereglarea endocitozei şi eliberării genomului viral; implicarea în activitatea enzimelor şi căilor responsabile de translarea, transcrierea şi replicare virală; dereglarea proceselor care asigură asamblarea şi exocitoza virusului; diminuarea rezistenţei la insulină cu reducerea sensibilităţii la infecţia virală; anihilarea producerii speciilor reactive de oxigen şi a stresului oxidativ.
-
Acţiunea cardio- şi vasoprotectoare prin reechilibrarea sistemului renină-angiotensină-aldosteron şi a efectului vasoconstrictor şi inflamator cu predominanţa celui vasodilatator şi antiinflamator; diminuarea procesului inflamator; reducerea glucotoxicităţii asupra vaselor şi ţesuturilor; diminuarea producerii speciilor reactive de oxigen şi creşterea nivelului monoxidului de azot.
-
Acţiunea antitrombotică prin atenuarea disfuncţiei entodeliale cu reducerea stresului oxidativ; inhibarea inflamaţiei endoteliale şi suprimarea aderării leucocitelor la endoteliu; prevenirea activării trombocitelor; corecţia dezechilibrului sistemului renină-angiotensină-aldosteron; suprimarea producerii citokinelor proinflamatoare.
Utilizarea metforminei necesită o evaluare minuţioasă la pacienţii cu risc de lactacidoză, de dereglări ale absorbţiei vitaminei B12 şi de expunere crescută a enzimei de conversie a angiotensinei la asocierea cu inhibitorii enzimei de conversie a angiotensinei sau cu blocantele receptorilor angiotensinici.
Bibliografie
- Al-Kuraishy HM, Al-Gareeb AI, Alblihed M, et al. COVID-19 and Risk of Acute Ischemic Stroke and Acute Lung Injury in Patients With Type II Diabetes Mellitus: The Anti-inflammatory Role of Metformin. Front Med (Lausanne). 2021 Feb 19;8:644295. doi: 10.3389/fmed.2021.644295.
- Berlie HD, Kale-Pradhan PB, Orzechowski T, Jaber LA. Mechanisms and Potential Roles of Glucose-Lowering Agents in COVID-19: A Review. Ann Pharmacother. 2021 Mar 4:1060028021999473. doi: 10.1177/1060028021999473.
- Bielka W, Przezak A, Pawlik A. Therapy of Type 2 Diabetes in Patients with SARS-CoV-2 Infection. Int J Mol. Sci. 2021, 22, 7605. doi.org/10.3390/ ijms22147605.
- Bracco L. COVID-19: Can Metformin Drastically Reduce the Number of Deaths? J Med - Clin Res & Rev. 2021; 5(1): 1-6.
- Bramante CT, Buse J, Tamaritz L, et al. Outpatient metformin use is associated with reduced severity of COVID-19 disease in adults with overweight or obesity. J Med Virol. 2021 Jul;93(7):4273-4279. doi: 10.1002/jmv.26873.
- Chen X, Guo H, Li Q, et al. Immunomodulatory and Antiviral Activity of Metformin and Its Potential Implications in Treating Coronavirus Disease 2019 and Lung Injury. Front Immunol. 2020; 11: 2056.doi: 10.3389/fimmu.2020.02056.
- Cory TJ, Emmons RS, Yarbro JR, et al. Metformin Suppresses Monocyte Immunometabolic Activation by SARS-CoV-2 and Spike Protein Subunit 1. bioRvix. 2021.05.27.445991. doi.org/10.1101/2021.05.27.445991.
- Hasan SS, Kow CS, Bain A, et al. Pharmacotherapeutic considerations for the management of diabetes mellitus among hospitalized COVID-19 patients. Expert Opin Pharmacother. 2021 Feb;22(2):229-240. doi: 10.1080/14656566.2020.1837114.
- Ibrahim S, Lowe JR, Bramante CT, et al. Metformin and Covid-19: Focused Review of Mechanisms and Current Literature Suggesting Benefit. Front. Endocrinol. 2021; 12:587801. doi: 10.3389/fendo.2021.587801.
- Kaneto H, Kimura T, Obata A, et al. Multifaceted Mechanisms of Action of Metformin Which Have Been Unraveled One after Another in the Long History. Int J Mol Sci. 2021 Mar 5;22(5):2596. doi: 10.3390/ijms22052596.
- Katsiki N, Ferrannini E. Anti-inflammatory properties of antidiabetic drugs: A „promised land” in the COVID-19 era? J Diabetes Complications. 2020 Dec;34(12):107723. doi: 10.1016/j.jdiacomp.2020.107723.
- Liao Y-H, Zheng J-Q, Zheng C-M, et al. Novel Molecular Evidence Related to COVID-19 in Patients with Diabetes Mellitus. J. Clin. Med. 2020, 9, 3962. doi.org/10.3390/jcm9123962.
- Mahrooz A, Muscogiuri G, Buzzetti R, Maddaloni E. The complex combination of COVID-19 and diabetes: pleiotropic changes in glucose metabolism. Endocrine. 2021 Apr 22:1–9. doi: 10.1007/s12020-021-02729-7.
- Muniyappa R, Gubbi S. COVID19‑19 pandemic, coronaviruses, and diabetes mellitus. Am J Physiol Endocrinol Metab. 2020; 318: E736–E741. doi.org/10.1152/ajpendo.00124.2020.
- Poly TN, Islam MM, Li Y-C, et al. Metformin Use Is Associated with Decreased Mortality in COVID-19 Patients with Diabetes: Evidence from Retrospective Studies and Biological Mechanism. J Clin Med. 2021, 10, 3507. doi.org/ 10.3390/jcm10163507.
- Samuel SM, Varghese E., Büsselberg D. Therapeutic Potential of Metformin in COVID-19: Reasoning for Its Protective Role. Trends Microbiol. 2021 Mar 14:S0966-842X(21)00063-9. doi: 10.1016/j.tim.2021.03.004.
- Santos A, Magro DO, Evangelista-Poderoso R, Saad MJA. Diabetes, obesity, and insulin resistance in COVID-19: molecular interrelationship and therapeutic implications. Diabetol Metab Syndr. 2021 Mar 1;13(1):23. doi: 10.1186/s13098-021-00639-2.
- Singh AK, Singh R, Saboo B, Misra A. Non-insulin anti-diabetic agents in patients with type 2 diabetes and COVID-19: A Critical Appraisal of Literature. Diabetes Metab Syndr. 2021 Jan-Feb;15(1):159-167. doi: 10.1016/j.dsx.2020.12.026.
- Sun B, Huang S, Zhou J. Perspectives of Antidiabetic Drugs in Diabetes With Coronavirus Infections. Front Pharmacol. 2021 Jan 29;11:592439. doi: 10.3389/fphar.2020.592439.
- Ugwueze CV, Ezeokpo BC, Nnolim BI, et al. COVID-19 and Diabetes Mellitus: The Link and Clinical Implications. Dubai Diabetes Endocrinol J. 2020; 26: 69–77 doi: 10.1159/000511354.
- Varghese E, Samuel SM, Liskova A, et al. Diabetes and coronavirus (SARS-CoV-2): Molecular mechanism of Metformin intervention and the scientific basis of drug repurposing. PLoS Pathog. 2021 Jun 22;17(6):e1009634. doi: 10.1371/journal.ppat.1009634.
- Xian H, Liu Y, Rundberg Nilsson A, et al. Metformin inhibition of mitochondrial ATP and DNA synthesis abrogates NLRP3 inflammasome activation and pulmonary inflammation. Immunity. 2021 Jul 13;54(7):1463-1477.e11. doi: 10.1016/j.immuni.2021.05.004.
- Yang W, Sun X, Zhang J, Zhang K. The effect of metformin on mortality and severity in COVID-19 patients with diabetes mellitus. Diabetes Res Clin Pract. 2021 Jul 22;178:108977. doi: 10.1016/j.diabres.2021.108977.
- Zangiabadian M, Nejadghaderi SA, Zahmatkesh MM, et al. The Efficacy and Potential Mechanisms of Metformin in the Treatment of COVID-19 in the Diabetics: A Systematic Review. Front Endocrinol (Lausanne). 2021 Mar 19; 12:645194. doi: 10.3389/fendo.2021.645194.





