Chronic hepatitis in children are still in medical focus, through their particular evolution and treatment difficulties. Vertical transmission remains an important way of spreading the infection, especially in hepatitis B, even if all newborns have been vaccinated in Romania for more than 20 years. The particularities of B and C infection in pregnant women, the importance of detecting pregnant women infected with HBV and HCV, and the difficult management of these infections in pediatric age are current concerns.
Transmiterea hepatitelor B și C de la mamă la copil - o problemă actuală
Mother-to-child transmission in hepatitis B and C: a nowadays problem
First published: 03 noiembrie 2017
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Pedi.47.3.2017.1184
Abstract
Rezumat
Hepatitele cronice la copil sunt încă în actualitate, prin evoluția particulară și dificultățile de tratament. Transmiterea verticală rămâne o modalitate importantă de răspândire a infecției, mai ales în cazul hepatitei B, chiar dacă vaccinarea tuturor nou-născuților se realizează în România de peste 20 de ani. Particularitățile infecțiilor B și C la gravide, importanța depistării gravidelor infectate cu VHB și VHC și managementul dificil al acestor infecții la vârsta pediatrică sunt probleme preocupante actuale.
Magnitudinea problemei
În lume, peste 500 de milioane de oameni suferă de hepatită cronică virală (B, C, D). Centrul pentru Prevenirea și Controlul Bolilor din SUA (CDC) estimează că 42% din cazurile cu hepatită cronică B la adult au originea în copilărie. În cazul infecțiilor cronice cu virusul hepatitei C (VHC), cazurile nou diagnosticate la vârstă mică în ultimii ani sunt infecții transmise vertical (mamă-copil).Riscul infecțiilor virale hepatitice B și C pentru hepatocarcinom este de 10 ori mai mare decât cel pentru cancer pulmonar la fumătorii cronici. Nevoia prioritară de transplant hepatic în România este dată de condițiile actuale de apariție a cirozei prin hepatitele B și D. Caracteristicile imunologice și moleculare virale au determinat elucidări patogenice, astfel încât terapia a devenit o veritabilă medicină moleculară.
Răspunsul imun al copilului este diferit de cel al adultului (sistem imunitar imatur). Particularitățile evolutive sunt în funcție de vârsta la care este contractată infecția. Rata mare de diviziune și regenerare a celulelor hepatice la copil, în contrast cu răspunsul imun slab la infecție, favorizează diseminarea infecției la vârsta pediatrică.
Infecția cu VHB la copil: o preocupare permanentă
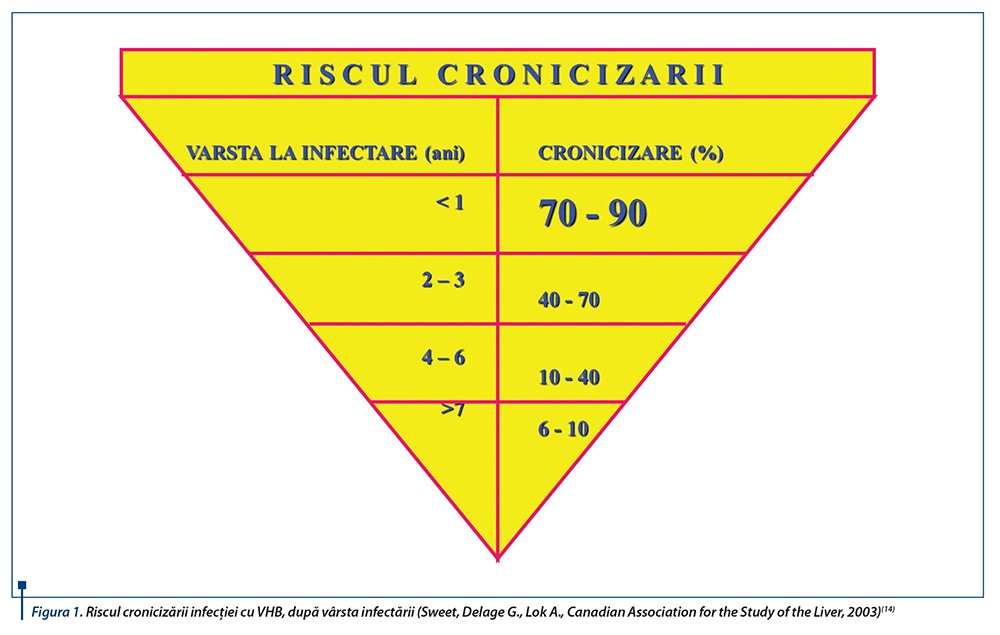
Infecția cronică cu virusul hepatitei B (VHB) are anumite particularități la copil, ca urmare a răspunsurilor imune specifice ale acestuia. Riscul de dezvoltare a hepatitei cronice B după infecția acută crește invers proporțional cu vârsta la impactul primar: dacă doar 5-15% dintre adulți se mențin infectați cronic, peste 90% dintre sugarii mamelor infectate în stadiul viremic dezvoltă infecție cronică.Între 1 și 6 ani, 50% dintre copiii infectați vor avea infecția pentru un interval nedefinit. Abia după 8-10 ani statusul imun al copilului se comportă similar celui de la adult (cronicizare în 10% din cazuri). Studii recente intenționează să stabilească dacă noțiunile clasice de serotipare și cele actuale de genotipare au și alte semnificații decât cele de a trasa evoluția infecțiilor în anumite zone geografice și, în special, să stabilească relația cu un anumit „compartiment” în patologie, răspuns terapeutic sau prognostic.
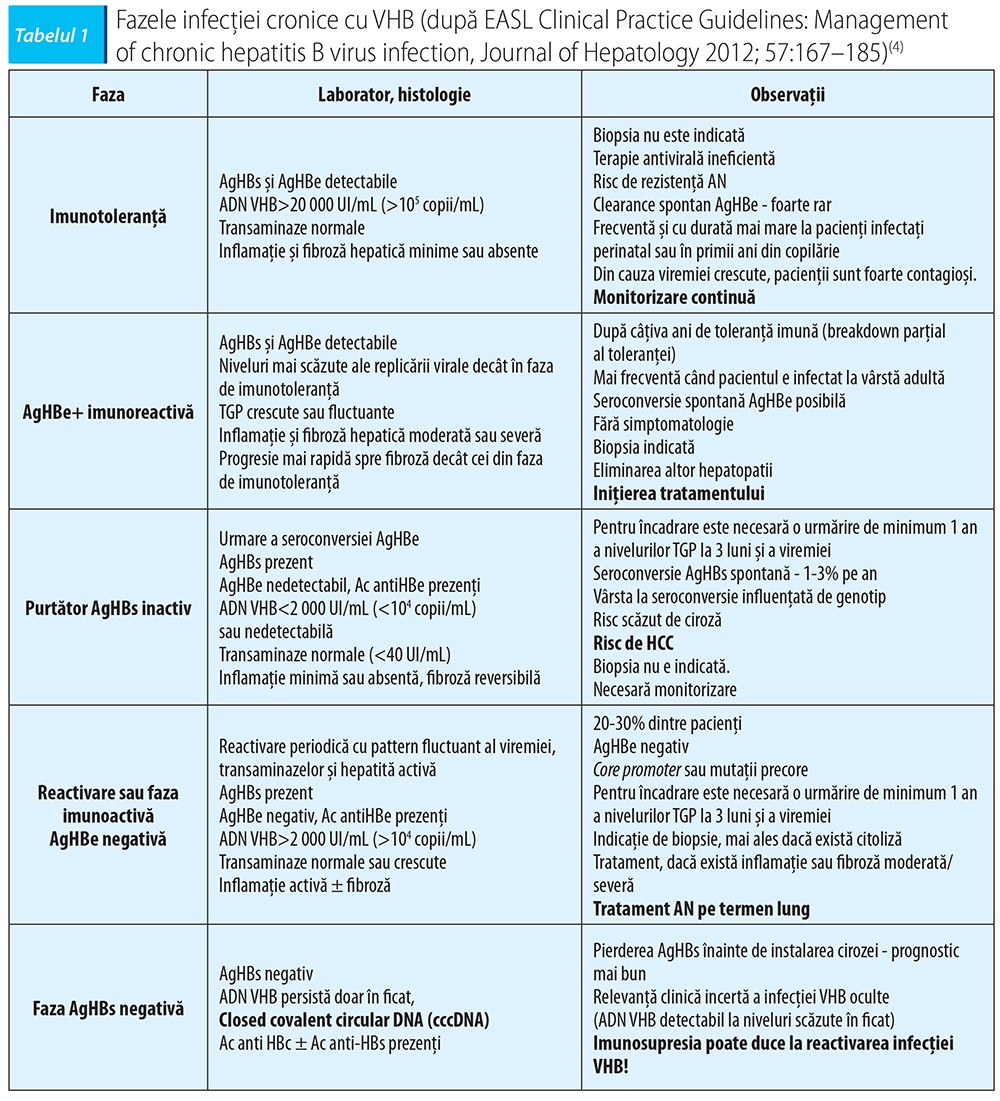
Fazele infecției cronice VHB
În faza de toleranță imună (10-20 de ani), clearance-ul spontan apare extrem de lent (2% în primii 3 ani și numai 15% după 20 de ani de infecție). Astfel, la adolescenții și adulții tineri, nivelul de replicare determină o transmitere materno-fetală ca regulă, în absența măsurilor eficiente complexe. O fetiță infectată în primii 5-7 ani, puternic replicativă, la 15-20 de ani după infecție poate avea neșansa transmiterii VHB la primii copii, mai ales dacă nu a fost depistată.În această etapă, copilul și adolescentul nu dețin suport imun reactiv, chiar în condițiile unui sprijin citokinic exogen. Eficiența terapeutică este mică, integrarea în genomul celulei-gazdă s-a produs, reactivările sunt posibile; se acumulează elemente de risc epidemiologic, dar și de transformare malignă, chiar în absența cirozei.
Faza de clearance imun apare la pacienții cu boli active AgHBe+, niveluri crescute de ADN-VHB, transaminaze mari și necroinflamație moderată/severă. La cei infectați precoce, la naștere sau în copilărie, tranziția între faza de toleranță și cea de clearance viral este tardivă (decada 2-4 de viață). La cei infectați tardiv, se intră direct în această etapă, în care clearance-ul viral determină scăderea ADN-VHB și creșterea transaminazelor (liza celulelor infectate). Clearance-ul eficient determină seroconversie HBe (rată de 5-15% pe an).
De interes major în orice zonă a globului este acum hepatita B ocultă, analizându-se riscul coinfecției sau suprainfecției cu VHD și stabilind corelația cu genotipurile VHB circulante în anumite zone. Fenomenul globalizării generează interesul asupra problemei. Există și hepatită B ocultă, aproape 23% dintre pacienții cu hepatită cronică C au hepatită ocultă cu VHB. Un procent de 15% dintre copiii cu hepatită B ocultă au primit transfuzii cu sânge de la adult fără niciun marker aparent de hepatită B. 7% dintre copiii vaccinați cu Ac anti-HBs pozitivi au niveluri mici de ADN-VHB prin infecție ocultă.
În ciuda faptului că, acum, în lume, infecția cu VHB a scăzut semnificativ datorită introducerii vaccinului specific după 1991, se estimează că există peste 350 milioane de purtători ai infecției cronice. Dintre aceștia, 30-50% au neșansa unor forme evolutive grave (hepatocarcinom, ciroză hepatică, hepatită cronică activă).
Deși cei mai mulți copii cu infecție cronică VHB sunt asimptomatici și nu necesită, în general, tratament, aceștia pot prezenta o formă progresivă de boală și risc major de complicații: fibroză hepatică, evoluție cirogenă, carcinom hepatocelular, înainte de decada a treia de viață. Infecția VHB materno-fetală are cel mai mare risc de apariție a carcinomului hepatocelular.
Cu toate că posibilitatea de clearance viral eficient apare la 90% dintre adulții cu primoinfecție, în cazul infecției precoce, mai ales la nou-născut și sugar, fenomenul de imunotoleranță determină cronicizare în peste 90% dintre cazuri.
În România am trăit etapa dramatică a unor incidențe deosebite ale hepatitei B și am putut urmări efectele lente ale beneficiului introducerii vaccinării pentru hepatită B în octombrie 1995 la toți nou-născuții. Dar o serie de factori particulari de aplicare a profilaxiei generale, neajunsuri materiale și incorectitudini logistice mențin problema hepatitei B în atenție.
Transmiterea verticală
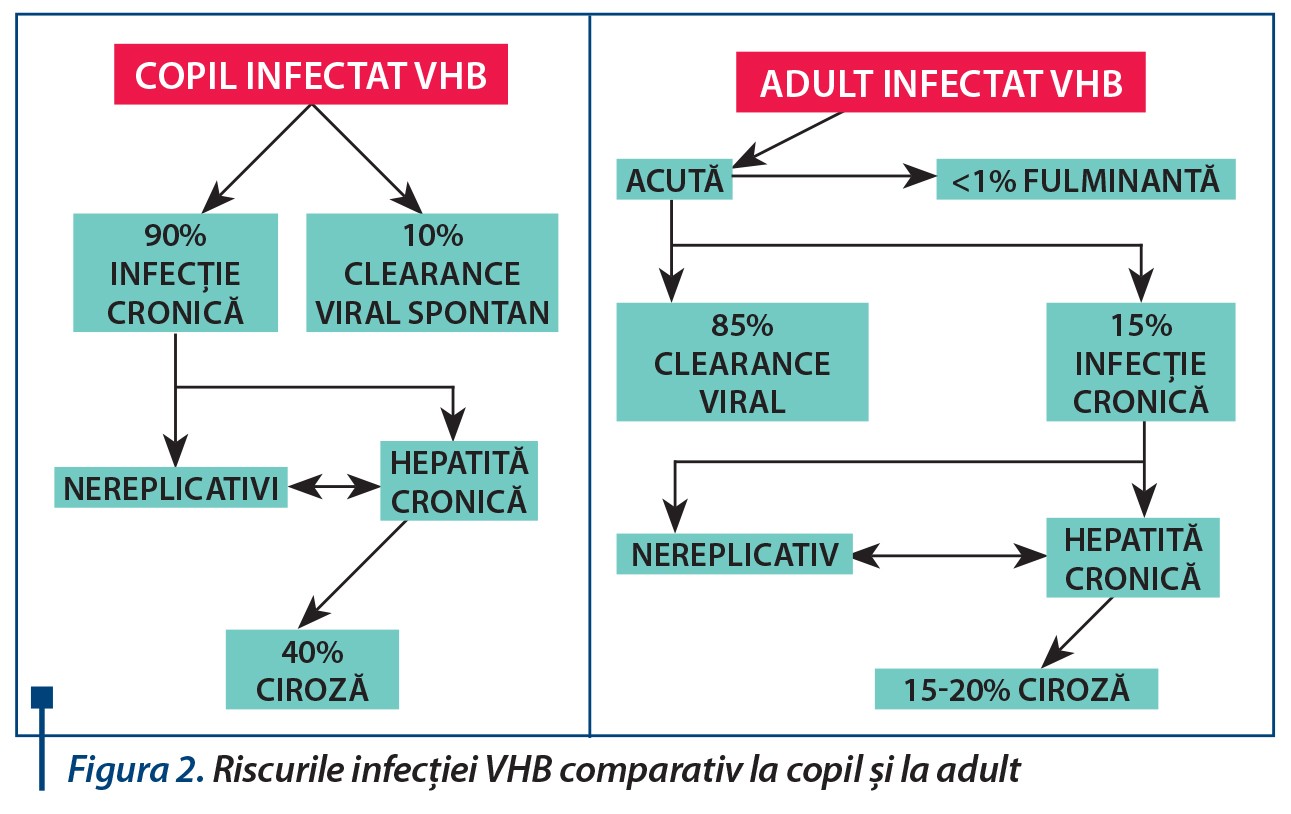
Modalitățile de transmitere perinatală a infecției cu VHB sunt reprezentate de contactul cu secreții și sânge matern infectat în timpul nașterii în 98% dintre cazuri, dar și prin transmitere in utero în aproximativ 2% din cazuri.Transmiterea de la mamă la copil se face de obicei cu ocazia nașterii sau în primele luni de viață. Riscul transmiterii perinatale este mai mare (90%) dacă mama se infectează în timpul sarcinii în special în trimestrele al II-lea și al III-lea sau dacă mama este în fază de replicare virală. În cazul în care mama este AgHBe+ în momentul nașterii, 70-90% dintre nou-născuți sunt infectați dacă nu se face imunoprofilaxie corectă. Dacă mama este AgHBe-negativă, procentul scade la 5-20%. Nivelul viremiei ADN-VHB materne se corelează, de asemenea, cu riscul transmiterii perinatale. Riscul de infectare rămâne în continuare prin coabitare cu persoanele infectate.
Alăptarea și amniocenteza nu cresc riscul transmiterii perinatale a VHB, iar nașterea prin cezariană nu o previne. Deși riscul de transmitere este mai mic la nou-născuții cu mame cu AgHBe negativ, acești copii fac mai frecvent hepatită acută simptomatică sau forme fulminante de boală. O posibilă explicație a rarității formelor simptomatice sau fulminante la copiii din mame AgHBe pozitive o constituie faptul că AgHbe traversează bariera uteroplacentară și poate induce imunotoleranță a limfocitelor T la AgHBe și AgHBc, determinând infecție cronică cu VHB.
Problemele actuale sunt, alături de transmiterea infecției, efectele virusului asupra fătului. Profilaxia ideală ar conferi imunitate protectivă în peste 90% dintre cazuri și implică screeningul gravidelor infectate (AgHBs, AcHBc), consilierea gravidelor HBs pozitive, evaluarea statusului imun, a markerilor replicativi (AgHBe) și a viremiei ADN-VHB. Cezariana nu diminuează semnificativ riscul transmiterii verticale a VHB. În cazul prematurității se impune administrarea diferențiată a măsurilor profilactice (vaccin, tratament sau vaccin și administrare concomitentă de imunoglobuline specifice anti-VHB).
Virusul hepatitei B poate fi transmis de donatorii de sânge și de donatorii de organe care sunt pozitivi pentru anticorpi anti-HBc (core), dar negativi pentru toți ceilalți markeri ai VHB. Același risc însoțește diverse proceduri/intervenții chirurgicale anterioare la mamă, de aceea anamneza chirurgicală atentă (inclusiv pentru proceduri aparent inofensive, de chirurgie plastică, de exemplu) este esențială pentru elucidarea modalității de contractare a infecției.
Mamele cu statut serologic anti-HBc pozitiv pot transmite hepatita B ocultă, după cum o arată un studiu efectuat pe 2365 de mame, dintre care 147 (6,2%) au fost anti-HBc pozitive. Din acest lot, șapte nou-născuți (6,6%) au avut markeri de infecție VHB, deși anterior la mame AgHBs a fost negativ. Acest studiu arată că VHB poate fi transmis perinatal chiar și în absența AgHBs. Prin urmare, se pune întrebarea: oare este necesar screening la gravide prin Ac anti-HBc?
Măsuri practice pentru diminuarea
transmiterii verticale a VHBManagementul gravidelor cu infecție VHB
Se impun o serie de măsuri medicale pentru diminuarea transmiterii, în funcție de risc și de statusul serologic al mamei.
- Gravide cu risc crescut de infecție VHB, neinfectate
- Interval minim de 4 săptămâni între prima și a doua doză
- Interval minim de 16 săptămâni între prima și a treia doză
0 – 1 – 4 luni
- Recomandări pentru femeile infectate cu VHB care vor să rămână gravide
- Sarcină înainte de tratament.
Boală hepatică moderată, absența cirozei
- Tratament înainte de sarcină; dacă există răspuns, tratamentul se oprește înainte de sarcină.
Boală hepatică avansată
- Tratament înainte și în timpul sarcinii; continuă tratamentul după naștere.
Boala hepatică ușoară, viremie foarte înaltă
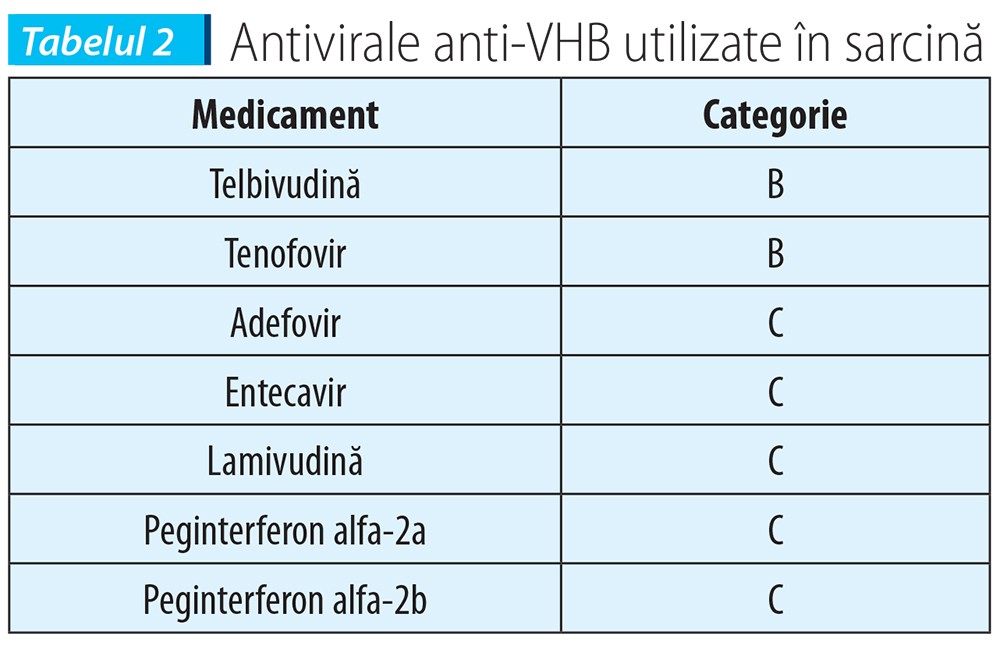
- Tratament în ultimul trimestru cu agent de clasa „B” (telbivudină, tenofovir).
Prevenția transmiterii perinatale a VHB
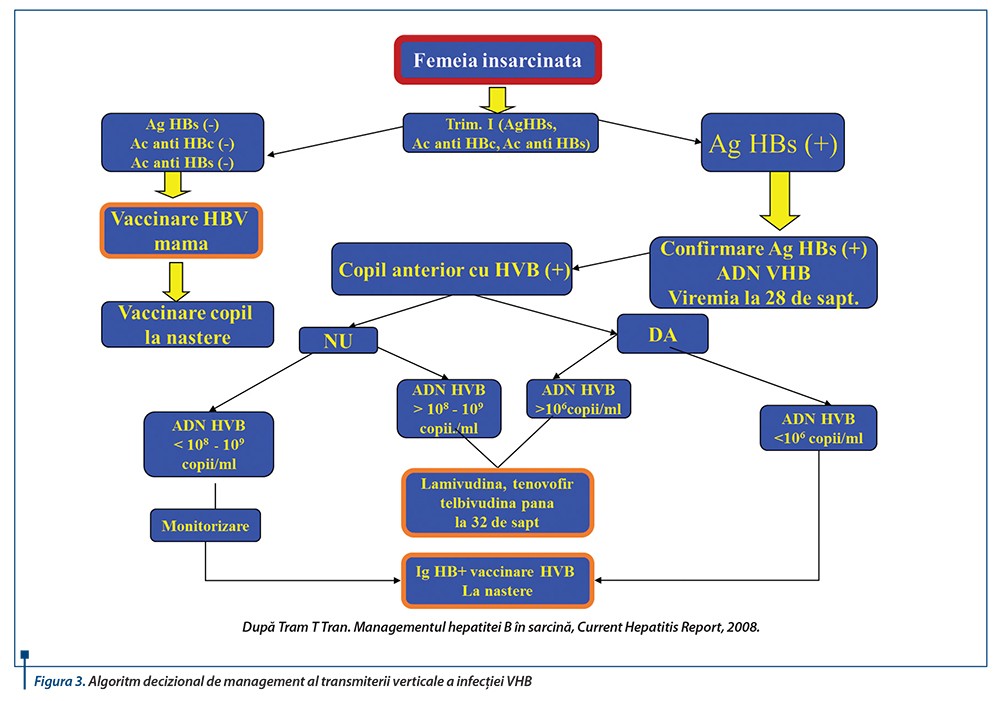
Transmiterea VHB apare în momentul nașterii. Toate gravidele necesită screening pentru AgHBs și AgHBe, iar nou-născuții din mame AgHBs pozitive necesită tratament imediat cu imunoglobuline specifice anti-VHB (HBIG) și administrare simultană a vaccinului antihepatitic B. HBIG trebuie administrată în primele 12 ore de la naștere, dar se presupune a fi eficientă dacă se administrează până la 48 de ore. Analogii nucleozidici din săptămâna a 34-a la mamele AgHBe pozitive cu viremie înaltă, adăugate administrării HBIG și vaccinării nou-născutului imediat după naștere, reduc semnificativ riscul transmiterii VHB (12% vs. 28%)
Prima doză a vaccinului anti-VHB se face în coapsă, în primele 12 ore de la naștere. Daca mama este AgHBs pozitivă sau statusul ei este necunoscut, se administrează și HBIG 0,5 ml, în coapsa opusă, intramuscular, în primele 12 ore de la naștere, dar nu mai târziu de vârsta de 7 zile.
Managementul nou-născutului expus la AgHBs+ continuă cu vaccinarea completă anti-VHB după schema recomandată:
- doza 2 din vaccinul anti-VHB la vârsta de 1-2 luni
- doza 3 din vaccinul anti-VHB la vârsta de 6 luni.
Rezultatele vaccinarii anti-VHB la sugari:
- Dacă AgHBs negativ și Ac anti-HBs pozitivi >10 mIU/mL ⇒ copilul este protejat.
- Dacă AgHBs negativ și Ac anti-HBs <10 mIU/mL sau negativi ⇒ revaccinare cu 3 doze de vaccin anti-VHB și retestare la 1-2 luni după doza finală (a 6-a).
- Dacă AgHBs este pozitiv:
⇒ raportarea infecției perinatale în cadrul Programului de Hepatită la Copil.
Profilaxia VHB la prematuri și copii cu greutate <2000 g proveniți din mame AgHBs +
- Inițierea profilaxiei în primele 12 ore de la naștere dacă nou-născutul este stabil din punct de vedere medical:
Doza 1 de vaccin anti-VHB în coapsa opusă în primele 12 ore de la naștere.
- Nu se ia în considerație doza de la naștere ca parte a vaccinării anti-VHB. Acești sugari trebuie să primească în total patru doze de vaccin anti-VHB:
Doza 3 din vaccinul anti-VHB la vârsta de 2-4 luni
Doza 4 din vaccinul anti-VHB la vârsta de 6 luni
Testarea postvaccinală trebuie realizată în aceeași manieră temporală ca la nou-născutul la termen cu greutate normală, ideal în luna a 9-a sau a 12-a, dar niciodată sub vârsta de 9 luni.
Imunoprofilaxia pasivă și activă scade riscul cu 85-96% (CDC). Imunoprofilaxia presupune vaccinare antihepatitică: 0, 1, 6, 12 luni, concomitent cu Hepatect® i.m. (Ig i.v. anti-HBs), 2 ml = 100 UI, 20-50 UI/kgc/doză, ritm 0,1 ml/kgc/oră în 10 minute. Prima doză de imunoglobulină se face în primele 12 ore după naștere, a doua (dacă este cazul) - la vârsta de o lună.
Interzicerea alăptării la sugarii proveniți din mame AgHBs pozitive a fost mulți ani o strategie importantă de stopare a transmisiei infecției. Academia Americană de Pediatrie recomandă alăptarea după profilaxia pasiv-activă. Nu vor alăpta mamele care primesc terapie antivirală complexă.
Transmiterea verticală a infecției cu VHC la copil
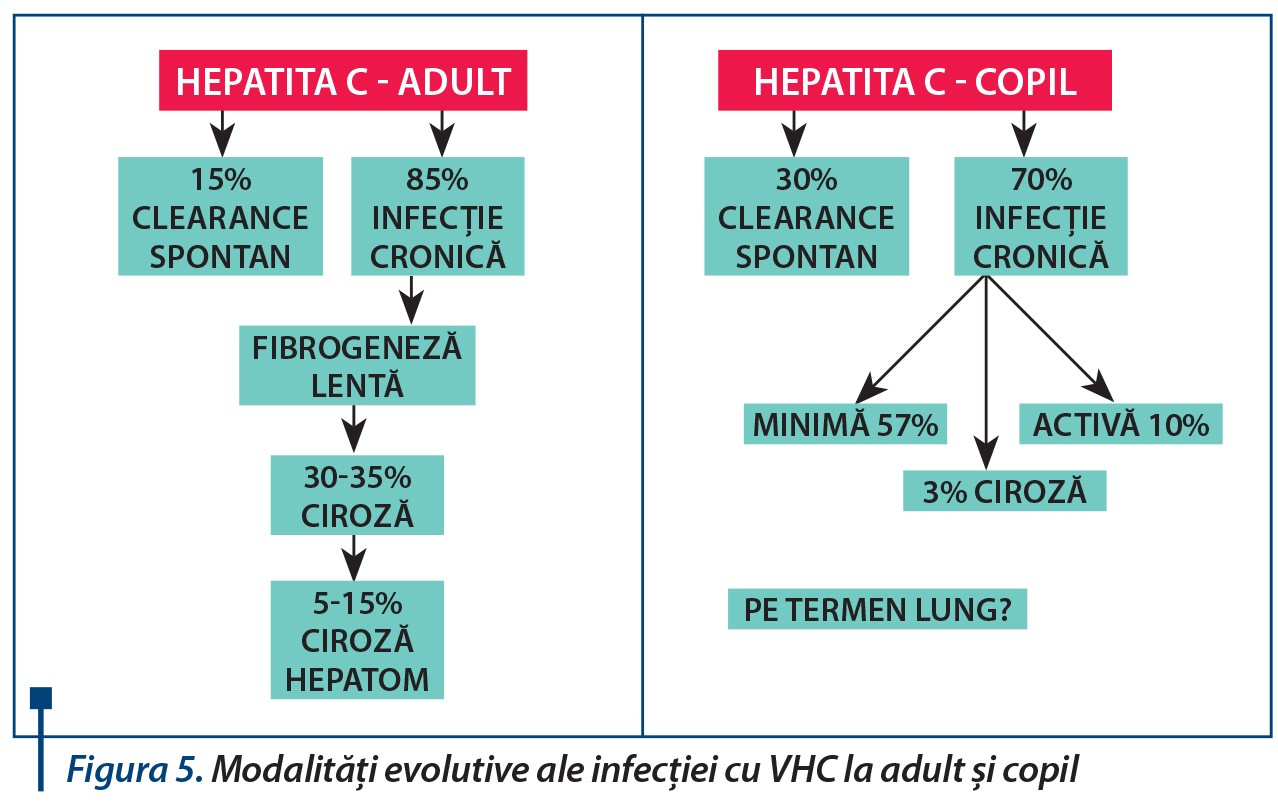
Istoria naturală a bolii este mai complet descrisă în studiile la adulți. După expunere, infecția acută poate fi urmată de cronicizare în 6 din 10 cazuri. Progresia spre fibroză apare ca regulă evolutivă, ritmul acesteia fiind modulat de intervenția sistemului imun hepatic. Stadiile avansate ale fibrozei sunt inevitabil însoțite de boală hepatică decompensată și de cortegiul complicațiilor cirozei. Probabilitatea de apariție a carcinomului hepatocelular este de 2-5%.Patternul clinic și evolutiv este semnificativ diferit de cel de la adult, la copil elementele de risc fiind oarecum specifice. Deși aparent riscul de cronicizare este mai mic la copil, evoluția pe termen lung rămâne încă incomplet elucidată.
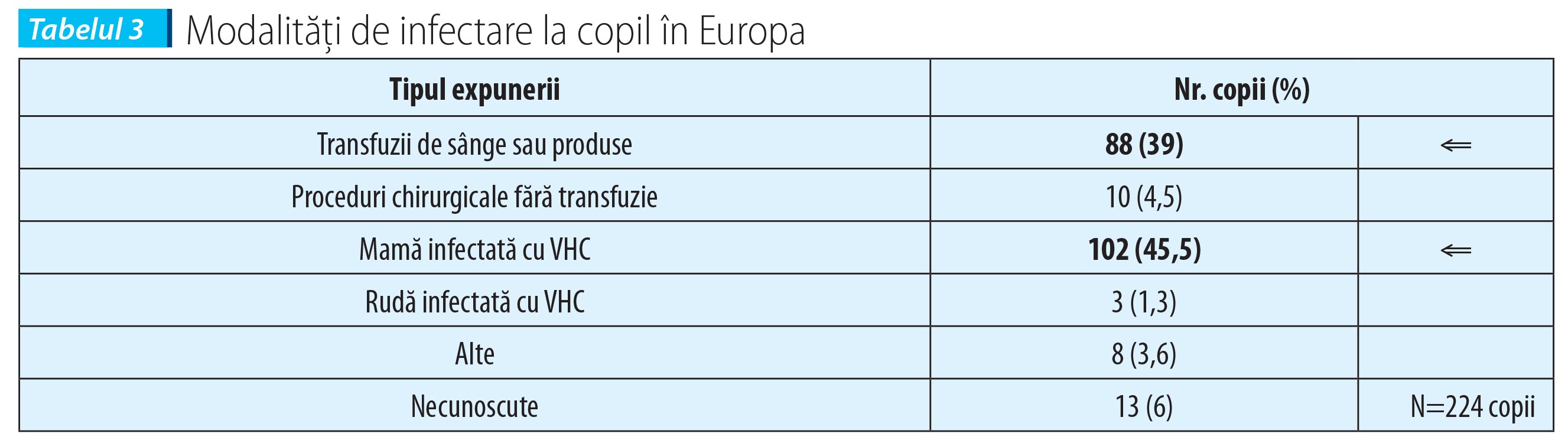
Dacă modalitatea de contaminare prin transfuzii și administrare de produse biologice părea uniformă la cele două grupe populaționale comparate înainte de 1991-1992, imediat după aceea s-a asistat la un real shift spre modalitatea de transmitere de la mamă la copil.
Studii multicentrice efectuate în Europa relevă necesitatea supravegherii cuplurilor în care există acest risc și susțin ideea de cercetare a factorilor care cresc riscul de transmitere intrafamilială și în special de la mamă la copil. În tabelul 3 se constată ponderea comparativă a celor două modalități de transmitere.
Riscurile de infectare la copil țin de patru factori principali:
- comorbidități care necesită transfuzii și administrări de produse biologice;
- mamă infectată cu VHC, în special persoanele cu diverse deficite imune;
- proceduri chirurgicale, dializă, transplant de organe;
- conduită de viață la risc.
Există condiții și riscuri noi care țin de invazivitatea unor proceduri ortopedice aplicate precoce, ca îngrijiri speciale în unitățile de terapie intensivă neonatală, ca și procedurile tot mai spectaculare de fertilizare in vitro.
În afara riscului de transmitere de la mamă, se poate menționa transmiterea „casnică” (folosirea în comun de obiecte potențial infectante - aparate de ras, periuțe de dinți, instrumente de igienă și cosmetică).
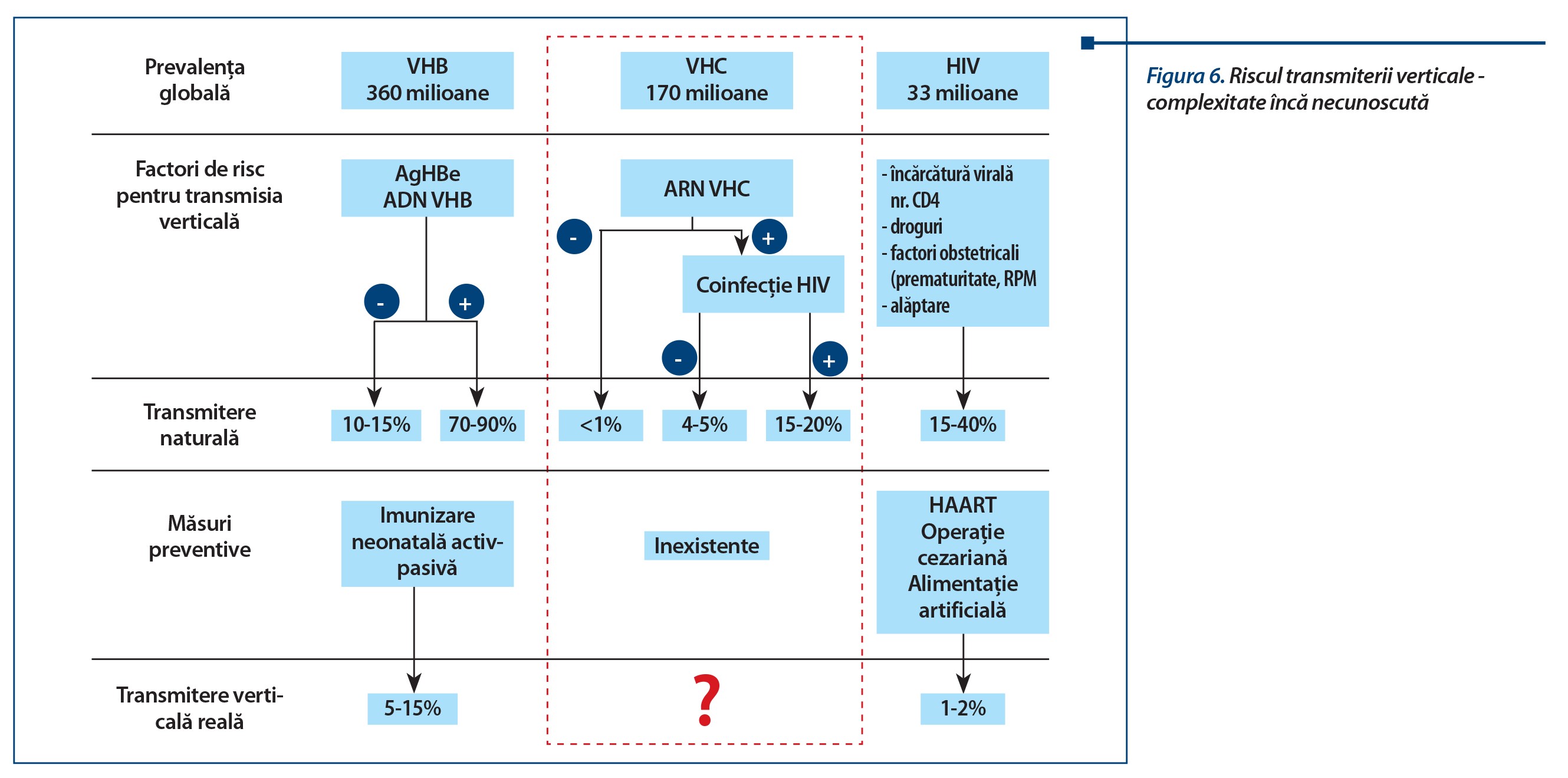
În epoca actuală există un mare interes pentru o abordare mai eficientă, având ca obiectiv scăderea riscului de transmitere de la mamă la copil în hepatita C, fapt pe care Lopez și Coll îl dezbat comparând posibilitățile existente în celelalte două mari probleme din domeniul bolilor infecțioase, hepatita B și infecția cu HIV.
Dacă riscul teoretic de transmitere de la gravida infectată este mai mic în infecția cu VHC, el devine totuși semnificativ în condițiile în care în hepatita B este posibilă astăzi o strategie eficientă care diminuează riscul la cei care beneficiază de o profilaxie pasiv-activă, prin vaccin și imunoglobulină specifică, iar transmiterea infecției cu HIV poate fi stopată în condițiile aplicării HAART până la 1-2%. Astfel, când viremia gravidei cu hepatită C este absentă, riscul este sub 1% și crește la cele viremice în jur de 5%, dacă nu există coinfecție HIV, putând ajunge la 20% când gravida este coinfectată.
Shift-ul progresiv de la riscul transfuzional la cel mamă - copil devine preocupant în măsura în care, de la contaminarea posttransfuzională la peste 50% dintre cazuri înainte de 1990, s-a ajuns la existența mamelor cu serologie pozitivă pentru VHC la peste 90% dintre cazurile copiilor depistați după 1990.
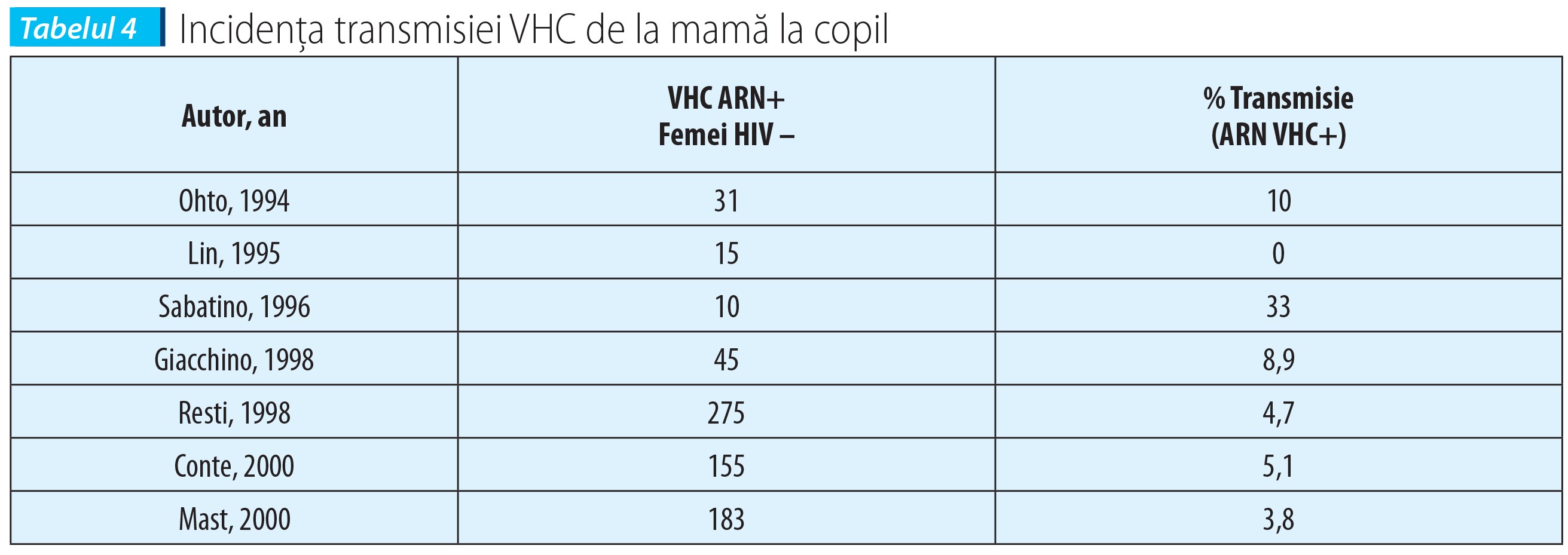


Riscul după statusul maternal imun
Riscul diferă în concordanță cu nivelul viremiei VHC și în cazul coinfecției cu HIV, astfel:
- Ac anti-VHC pozitivi, ARN-VHC pozitiv - risc de 5-12%;
- Ac anti-VHC pozitivi, ARN-VHC negativ - riscul este 0;
- risc crescut - viremie peste 1000000 de copii virale/ml;
- coinfecție HIV - riscul poate ajunge la 40%.
Nou-născutul posedă jumătate din alelele MHC materne, iar cealaltă jumătate, setul „nou”, este moștenit de la tată. Mai există încă necunoscute în ceea ce privește modul cum va reacționa sistemul imun, în devenire, al copilului, în diverse etape de dezvoltare în infecția durabilă.
Studiul lui Gibb din 2000, după observația efectuată asupra a 441 de perechi mamă-copil în Marea Britanie și Irlanda, arată că rata globală a transmiterii perinatale a fost de 6,7% și de 3,8 ori mai mare la femeile coinfectate cu HIV (fără cotransmiterea infecției HIV).
Există și factori mult mai nuanțați în evaluarea riscului de transmisie, iar aceștia sunt încă dezbătuți prin cercetări actuale. Astfel, transmisia verticală este de două ori mai probabilă la fetițe decât la băieți.
La 1787 de gravide infectate cu VHC în 33 de centre din Europa, transmiterea mamă-copil a fost de 6,2%. Nașterea cezariană nu a influențat transmiterea. Femeile coinfectate HIV+VHC au avut rata mai mare de transmisie verticală a VHC (8,7% vs. 5,5%). A existat un risc mai mare de infecție verticală la fetițe comparativ cu băiețeii (OR=2,07, p=0,006).
Infecția cu VHC nu reprezintă indicație strictă pentru cezariană și nici pentru oprirea alimentării la sân. Preponderența fetițelor e aparent surprinzătoare, probabil reflectă diferențele genetice în răspunsul la infecție.
După unii autori, există o dublare a riscului transmisiei în cazul coinfecției cu HIV (risc de 2,8 ori mai mare).
Alăptarea și nașterea naturală nu cresc riscul infecției nou-născutului. Spectaculoase sunt constatările din studiul recent al lui Bevilacqua(2).
Se cunoaște existența factorilor genetici determinanți în evoluția infecției cu VHC (HLA-DRB1, MBL2, TNF-α, IFN-γ și IL-10) și progresia bolii hepatice (HFE and TGF-β1). Studiul a fost efectuat pe un lot de 384 de subiecți italieni, la care s-a cercetat corelația parametrilor genetici materni și riscul de transmisie a infecției. S-a constatat că HLA-DRB1*04 matern s-a corelat cu protecție pentru transmiterea verticală (p=0,023). În schimb, HLA-DRB1*10 la copil a reprezentat un factor de risc pentru transmisie (p=0,036). Interesant este că neconcordanța locusului HLA-DRB1 între mamă și copil a reprezentat un factor protectiv, indicând că răspunsurile imune alloreactive sunt implicate în prevenția transmisiei verticale a VHC.
Nou-născuții infectați au, în general, viremie prin PCR negativă. Sensibilitatea și specificitatea metodei cresc odată cu vârsta, după două luni. Evaluările precoce vor depista anticorpii materni, fără semnificație în a afirma infectarea reală.
În condiții bine cunoscute, riscul se amplifică prin incidente la naștere: folosirea dispozitivelor intrauterine de monitorizare fetală, viremia crescută la mamă, ruptura prelungită a membranelor (peste șase ore).
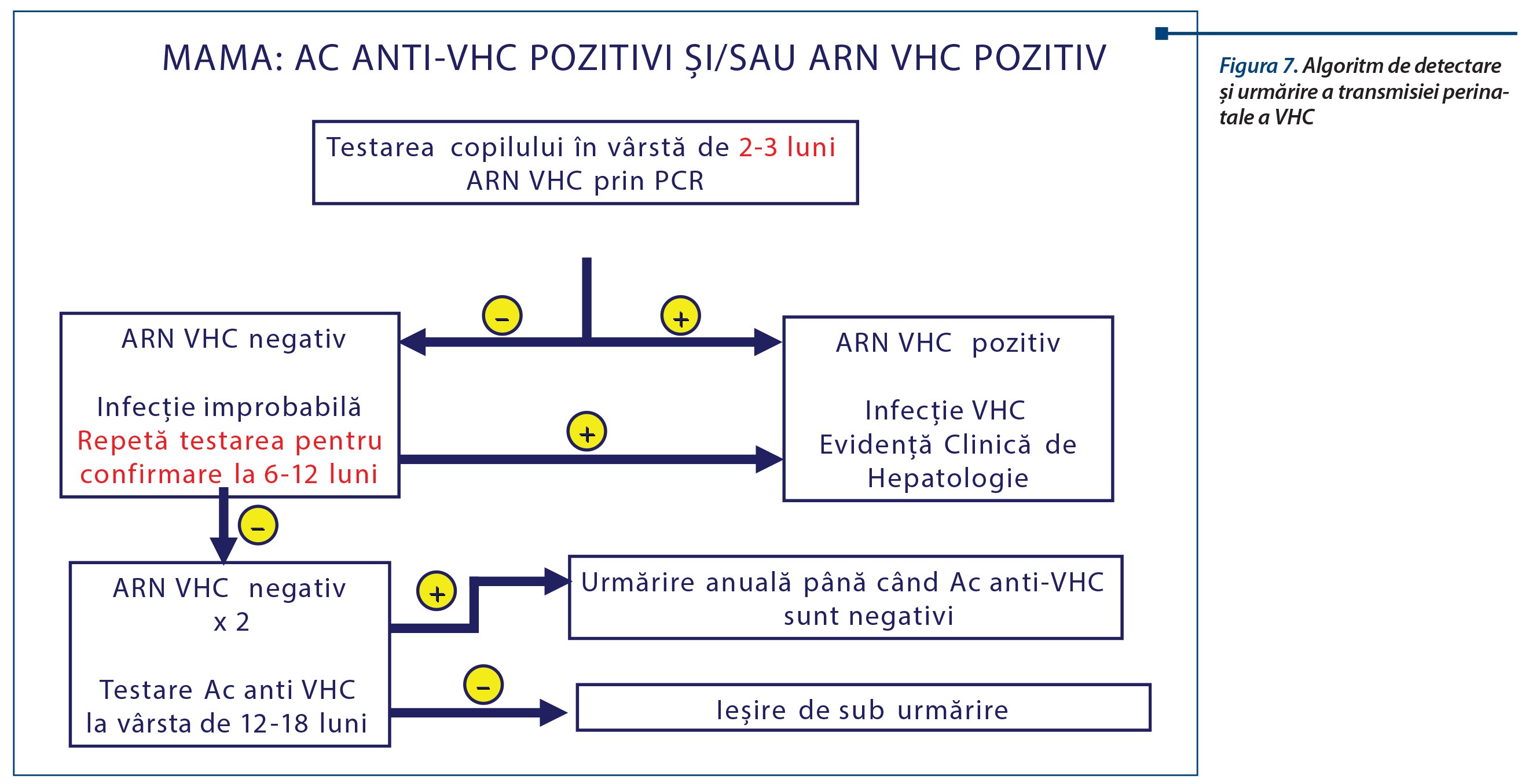
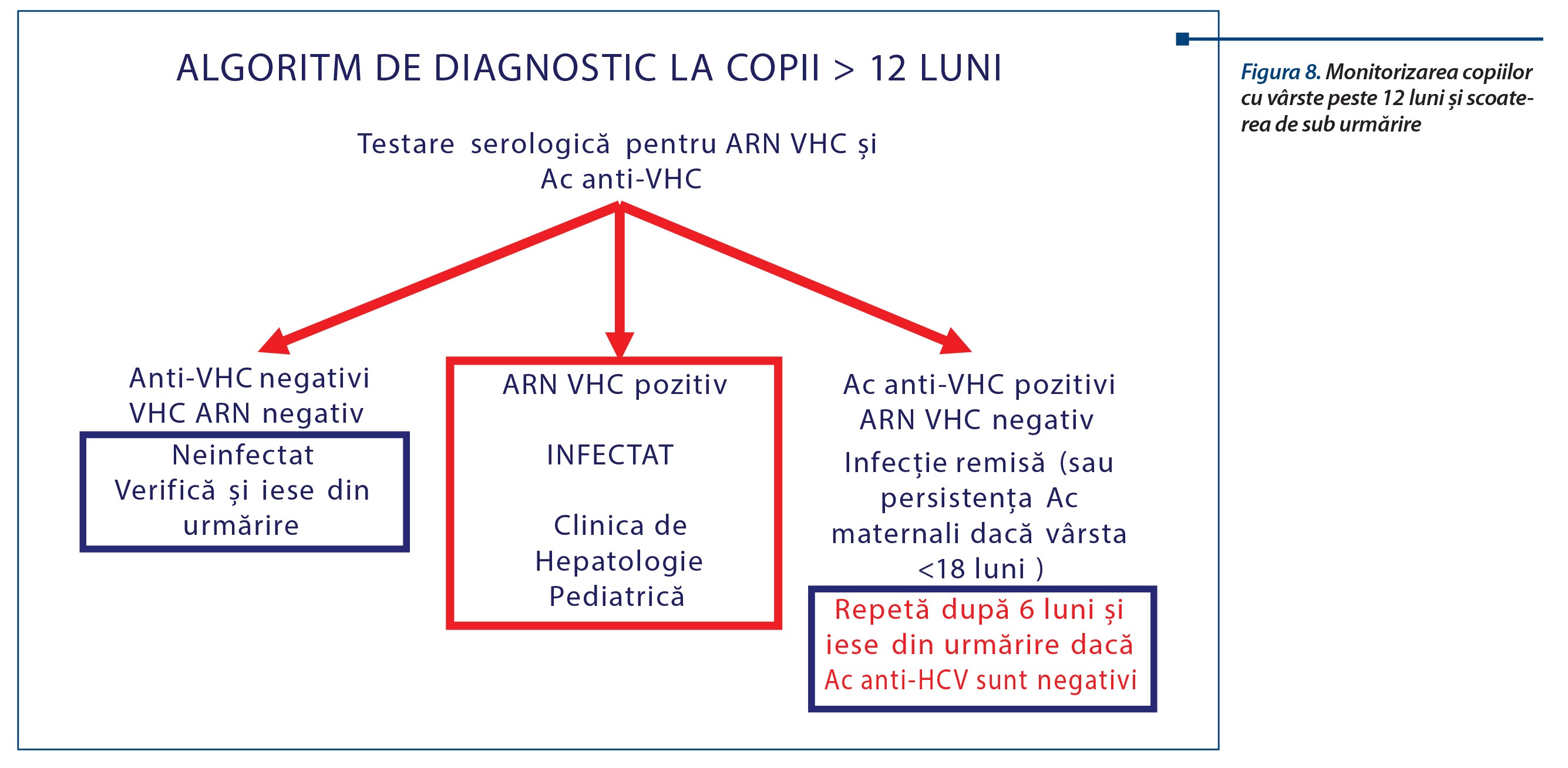
Algoritmul de diagnostic și urmărire a copiilor la risc este complex, implicând monitorizare periodică riguroasă și criterii puternice negative, care să permită ieșirea de sub urmărire: Ac anti-VHC negativi, viremia ARN VHC negativă, acestea repetate la 6 luni, în cazul persistenței anticorpilor VHC materni.
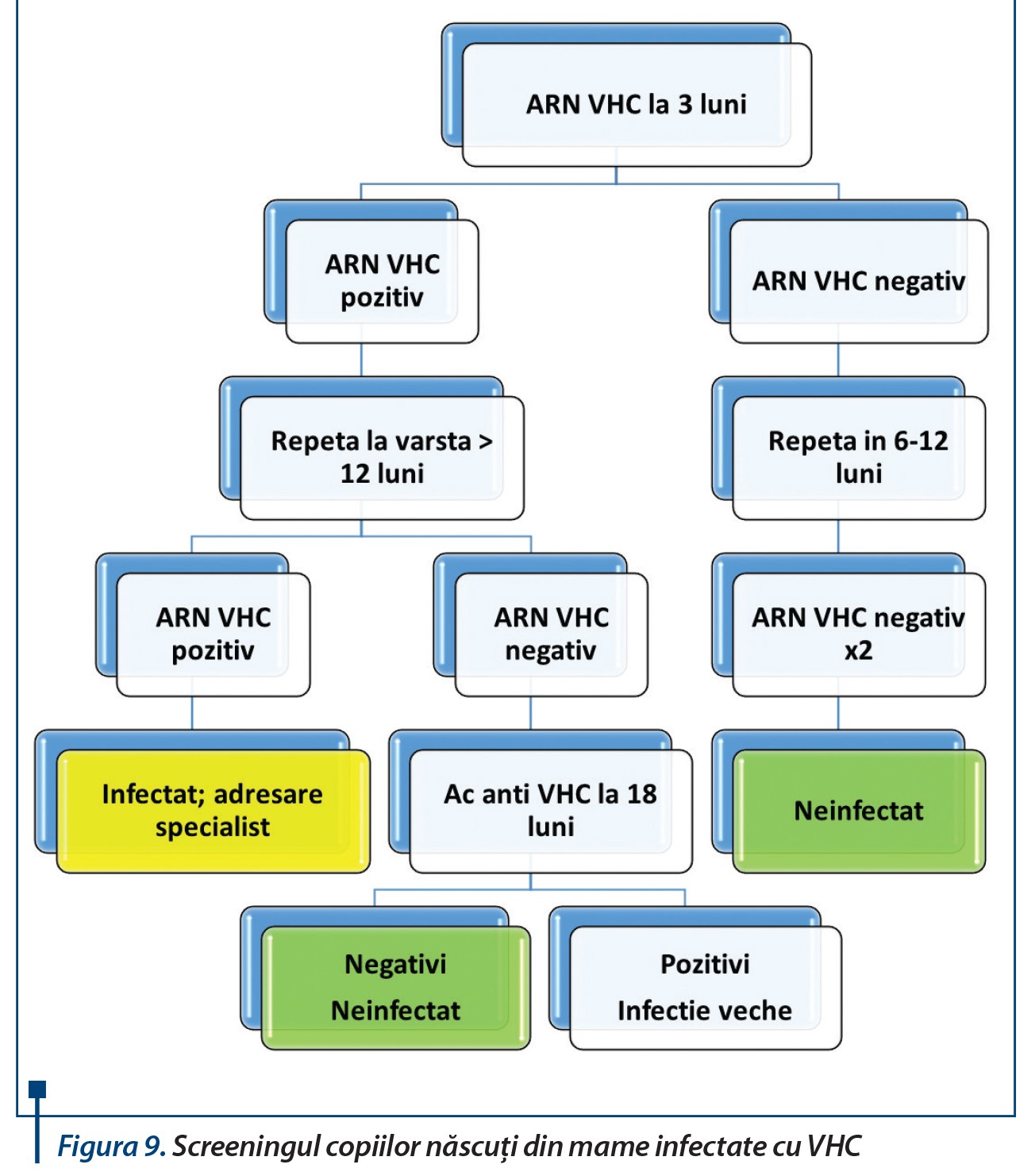
Istoria naturală a infecției perinatale cu VHC
Raportări de-a lungul vremii au arătat rezultate variabile în ceea ce privește persistența infecției la copil:- Palomba (1996): din 7 copii infectați VHC, proveniți din mame coinfectate HCV/HIV - toți au rămas infectați după 26-90 de luni;
- Sasaki (1997): 3 din 15 copii cu risc - doar unul a rămas infectat la 16 luni (ARN VHC pozitiv în prima lună);
- Bortolotti (1997): din 10 copii infectați cu VHC și urmăriți 12-48 de luni - 8 au rămas infectați;
- Zuccotti (2000): din 11 copii infectați cu VHC urmăriți 42-144 de luni - 10 au rămas infectați; 2 copii infectați perinatal au dezvoltat ciroză la 11, respectiv 13 ani, iar 2 copii infectați perinatal au dezvoltat ciroză decompensată la 4, 6, 11 ani (doi din mame coinfectate VHC/HIV).
Obezitatea și rezistența la insulină au efect nefavorabil asupra ratei de progresie a bolii hepatice în infecția cronică cu VHC. Copiii infectați cu VHC și rezistență la insulină pot dezvolta o formă mai severă a bolii hepatice. Noi teorii implică, pe lângă simptomele și semnele clasice ale afectărilor hepatice, afectări sistemice aparent surprinzătoare, unele dintre aceste efecte fiind explicate de mecanismul patogen direct al virusului asupra diverselor aparate și sisteme.
Patogeneza hepatitei C în timpul sarcinii este afectată de schimbările imunologice asociate cu gestația și toleranța materno-fetală, fapt care duce la încărcătura virală VHC crescută în al treilea trimestru de sarcină, ceea ce implică un risc mare de transmitere a VHC la făt. De asemenea, există posibilitatea crescută de leziuni hepatocelulare observate imediat după naștere. Răspunsurile imune intensificate, care încearcă să țină replicarea virală sub control, reprezintă un posibil moment strategic pentru a iniția tratamentul antiviral la mamă.
În ciuda expunerii aparent copleșitoare a fătului la virioni HCV, la mamă are loc o creștere a producției de imunoglobuline, o scădere a răspunsurilor celulare T mediate, datorită unui shift în balanța Th1/Th2 spre răspuns Th2, ceea ce duce la expansiunea celulelor T reglatorii și NK, ce limitează replicarea virală. Fenomenele de restricție a replicării VHC izolează fizic fătul de contactul cu VHC. Astfel, modularea imună din timpul sarcinii influențează răspunsurile anti-VHC, atât infecția maternă, cât și transmiterea verticală.
Măsurile profilactice sunt descurajante în infecția cronică cu VHC, iar când o gravidă cu hepatită C întreabă: „cum pot preveni chiar riscul mic de transmitere?”, răspunsul corect este, din păcate, „nu știu”. De perspectivă sunt tratamentele interferon-free și ribavirin-free (sofosbuvir), cu rezultate spectaculoase în infecția cronică cu VHC, dar studiile la gravide sunt încă în desfășurare.
Concluzii
În contextul evoluției imprevizibile a infecțiilor hepatitice B și C la copil, sunt necesare măsuri de depistare a acestor infecții la femeia gravidă, pentru un management ulterior specific. Evoluția cronică fluctuantă a acestor infecții, împreună cu problemele de tratament și complicațiile pe termen lung impun creșterea atenției și responsabilizarea medicală, pentru diminuarea transmiterii verticale.Bibliografie
2. Bevilacqua E, Fabris A, Floreano P, Pembrey L, Newell ML, Tovo PA, Amoroso AD et al. – Genetic factors in mother-to-child transmission of HCV infection, Virology 390;(2009):64–70.
3. Donald K. Strickland, Caroline A. Riely, Christian C. Patrick, Dana Jones-Wallace, James M. Boyett, Bradford Waters, Jaquelyn Fitch Fleckenstein, Patrick J. Dean, Rene Davila, Tony E. Caver, and Melissa M. Hudson. Hepatitis C infection among survivors of childhood cancer, Blood. 2000;95:3065-3070.
4. EASL Clinical Practice Guidelines: Management of chronic hepatitis B virus infection, Journal of Hepatology 2012;57:167–185.
5. EASL HBV Guidelines. J Hepatol. 2009; 50:227-242.
6. Esposti S, Shah D. Hepatitis B in Pregnancy: Challenges and Treatment. Gastroenterol Clin N Am 40 (2011) 355–372.
7. Gibb DM, Goodall RL, Dunn DT, Healy M, Neave P, Cafferkey M, Butler K. Mother-to-child transmission of hepatitis C virus: evidence for preventable peripartum transmission, Lancet. 2000 Sep 9; 356(9233):904-7.
8. Ian M. Paul, Jeffrey Sanders, et al. – Chronic Hepatitis C Virus Infections in Leukemia Survivors: Prevalence, Viral Load, and Severity of Liver Disease, Blood, Vol. 93 No. 11 (June 1), 1999: pp. 3672-3677.
9. Lopez M, Coll O et al. Chronic Viral Infections and Invasive Procedures: Risk of Vertical Transmission and Current Recommendations, Fetal Diagn Ther, June 2010.
10. Maureen M. Jonas, Breastfeeding by Hepatitis B Virus-infected Women, Liver International 2009; 29(s1):133-139.
11. Polis CB et al. Impact of maternal HIV coinfection on the vertical transmission of hepatitis C virus: a meta-analysis. Clin Inf Dis 44: 1123-1131, 2007.
12. Sharon Castellino, Shelly Lensing et al. – The Epidemiology Of Chronic Hepatitis C Infection In Survivors Of Childhood Cancer, Blood First Edition Paper, prepublished online December 18; 2005.
13. Simone Cesaro, Flavia Bortolotti et al. – An Updated Follow-Up of Chronic Hepatitis C After Three Decades of Observation in Pediatric Patients Cured of Malignancy, Pediatric Blood Cancer 2010;55:108–112.
14. Sweet, Delage G., Lok A. Canadian Association for the Study of the Liver, 2003.
15. Tovo PA, Pembrey L et al., A Significant Sex - but Not Elective Cesarean Section - Effect on Mother-to-Child Transmission of Hepatitis C Virus Infection, The Journal of Infectious Diseases 2005; 192:1872-9.
16. Vassiliki Syriopoulou, George L. Daikos, Stavroula L. Kostaridou, Nina Manolaki, Lydia Nakopoulou, Antonis Kattamis, Christos Kattamis – Sustained response to interferon α-2a in thalassemic patients with chronic hepatitis C. A prospective 8-year follow-up study, Haematologica 2005; 90:129-131.
17. Walz A, Wirth S, Hucke J, Gerner P. Vertical transmission of hepatitis B virus (HBV) from mothers negative for HBV surface antigen and positive for antibody to HBV core antigen. J Infect Dis. 2009 Oct 15; 200(8):1227-31.
18. Wedemeyer H et al. Dtsch Med Wochenschr, 2007; 132:1775-1782.
Articole din ediţiile anterioare
Evoluţia pacienţilor cu durere abdominală acută
Durerea abdominală acută reprezintă o urgență medico-chirurgicală, ce presupune elucidare etiologică și uneori management de urgență. Cauzele dur...
Ibuprofen: eficacitate şi siguranţă pentru pacientul pediatric
Ibuprofenul este principalul antiinflamator nesteroidian (AINS) cu efect analgezic şi antipiretic recomandat copiilor, în cazul unei game de afecţi...
Acute liver failure associated with recent SARS-CoV-2 infection in a pediatric patient – case report
Insuficienţa hepatică acută (IHA) la copil este o patologie rară, dar severă, caracterizată prin coagulopatie şi modificări de laborator sugestive ...
Evaluarea cazurilor de intoxicaţii cu insecticide inhibitorii de colinesterază la copil: studiu retrospectiv pe 7 ani
În acest studiu retrospectiv au fost evaluaţi 87 de copii internaţi în Centrul regional de toxicologie al Spitalului Clinic de Urgenţă pentru Cop...