Coordonate în evaluarea ecografică a splinei la câine și pisică
Coordinates in ultrasound evaluation of the spleen in cats and dogs
Abstract
Ultrasonography is one of the most accessible imaging methods, with high diagnostic value, because the ultrasound can provide data regarding the splenic parenchyma appearance, the nature of lesions and their extent. Confirmation of the diagnosis is done by integrating the splenic ultrasound examination into a complete clinical and paraclinical examination (anamnesis, blood tests, Rx, CT, etc.), and the gold standard procedure for the diagnosis of different splenic formations is represented by the echo-guided splenic puncture and by the cytological and histopathology examination.Keywords
spleenultrasoundecho-guided punctureRezumat
Ecografia este una dintre cele mai accesibile metode imagistice, având valoare diagnostică ridicată întrucât prin ecografie se pot obține date în ceea ce privește aspectul parenchimului splenic, caracterul leziunilor și întinderea lor. Confirmarea diagnosticului se face prin integrarea examenului ecografic al splinei într-un examen clinic și paraclinic complet (anamneză, investigații sangvine, Rx, CT etc.), iar procedeul gold standard pentru diagnosticul formațiunilor splenice este reprezentat de puncția ecoghidată a splinei și realizarea examenului citologic și histopatologic.Cuvinte Cheie
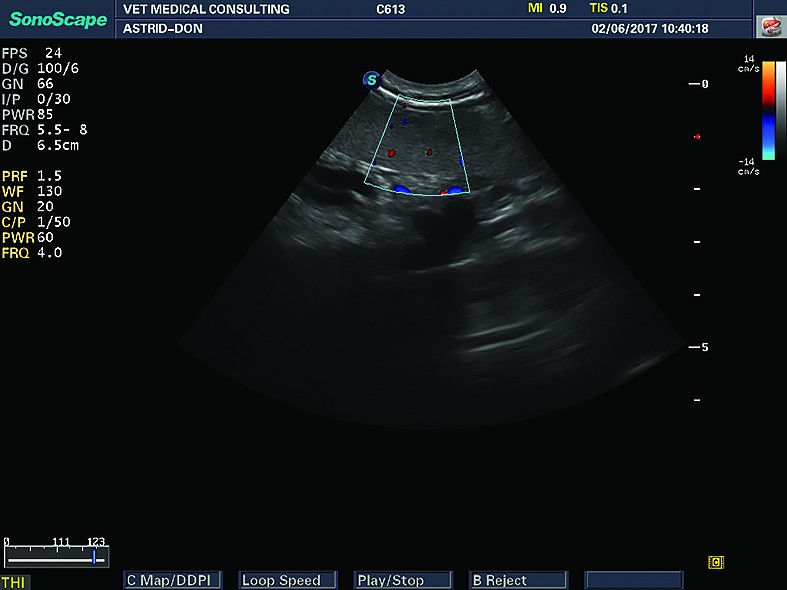
splinăecografiepuncție ecoghidatăEvaluarea ecografică a splinei este indicată atunci când prin alte metode de examinare (examinare clinică directă, Rx) se identifică/suspectează modificări de mărime a splinei, o mărire a abdomenului, în cazul acumulărilor lichidiene abdominale, în cazul limfadenopatiei, a unor boli infecțioase, a febrei de origine necunoscută, a anemiei etc. Evaluarea ecografică are valoare diagnostică ridicată față de alte metode imagistice, întrucât prin ecografie se pot obține date în ceea ce privește aspectul parenchimului splenic, caracterul leziunilor și întinderea lor - focale/multifocale sau difuze. Tot cu ajutorul examenului ecografic se pot face puncții și aspirații (puncții ecoghidate) cu mare acuratețe, din diferite formațiuni splenice. Ecografia Doppler este utilă în evaluarea vascularizației și fluxurilor de sânge, cu precădere în afecțiuni de tip trombotic, dar și în evaluarea diferitelor șunturi ale venelor splenice.
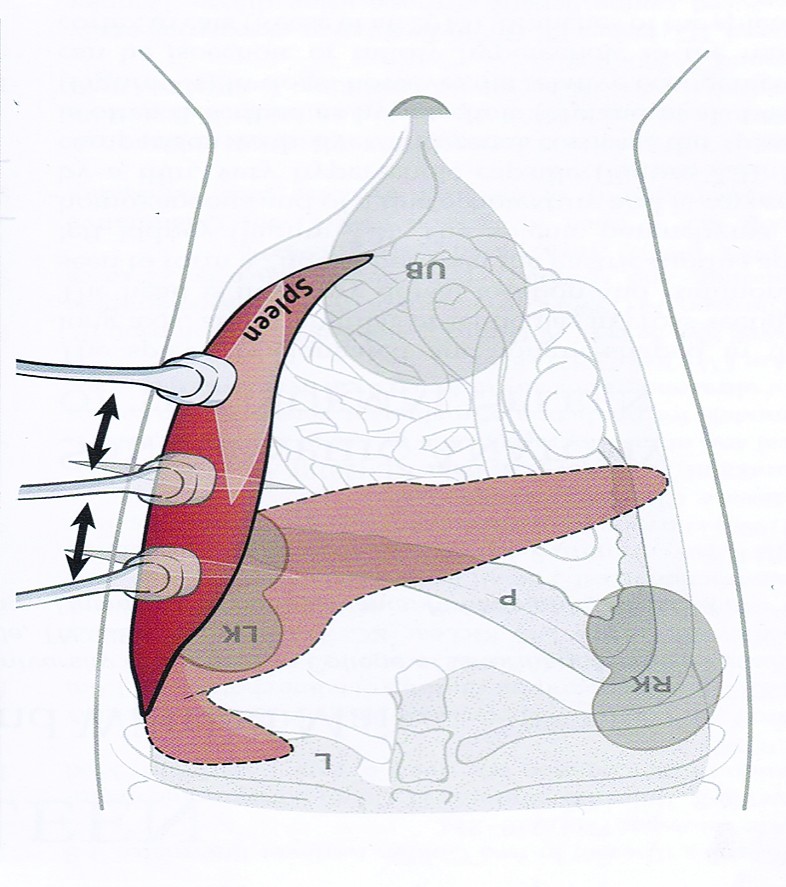
Pregătirea animalului
Ca la orice examinare ecografică, sunt necesare tunderea zonei de interes, degresarea suprafeței tunse cu soluție alcoolică și aplicarea gelului ecografic.Examinarea ecografică a splinei se realizează, de obicei, prin poziționarea animalului în decubit dorsal. La rasele de câini cu toracele adânc, pentru evaluarea extremității craniale a splinei se poate poziționa animalul în decubit lateral drept, folosindu-se chiar o fereastră acustică la nivelul ultimelor spații intercostale. Alegerea sondei se face în funcție de talia animalului examinat: la câinii de talie mică și la pisici este indicat să se folosească sonde cu frecvență ridicată (7,5-10-12 MHz), iar pentru câinii de talie medie și mare este indicat să se folosească sonde cu frecvență mai redusă (4-8 MHz). Splina fiind un organ situat în apropierea peretelui abdominal, se pot folosi atât sonde microconvexe, macroconvexe, cât și sondele liniare.
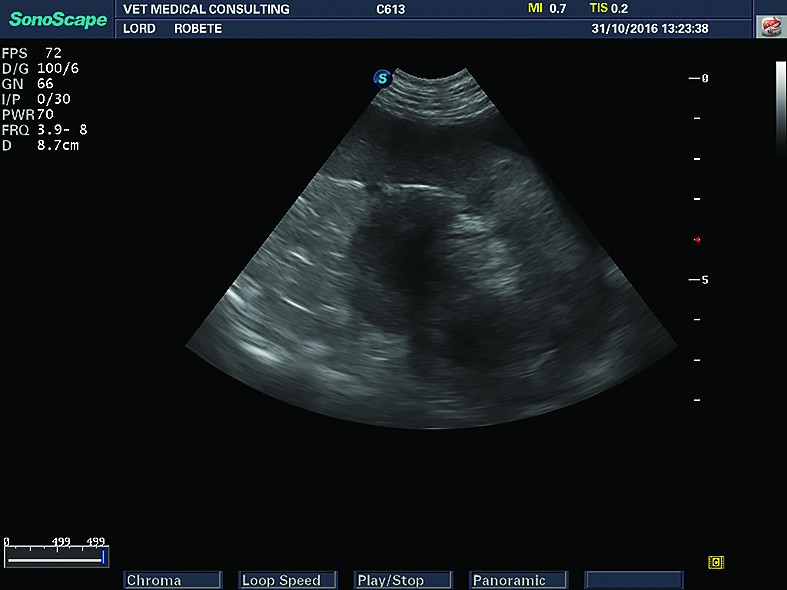
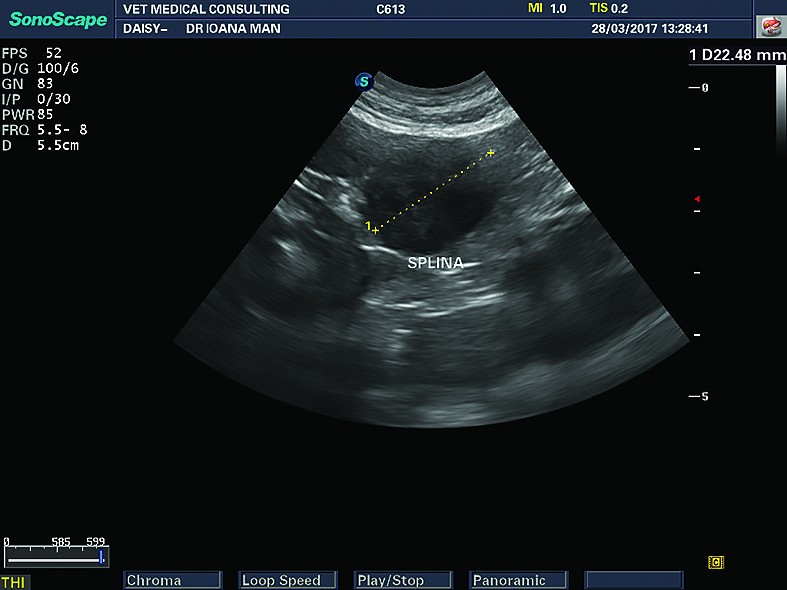
În examinarea ecografică a splinei, ca la orice organ parenchimatos, se urmăresc: dimensiunea, aspectul marginilor, aprecierea ecostructurii și ecogenității, vascularizația, relația cu structurile învecinate, dar și ganglionii sateliți.
Topografie
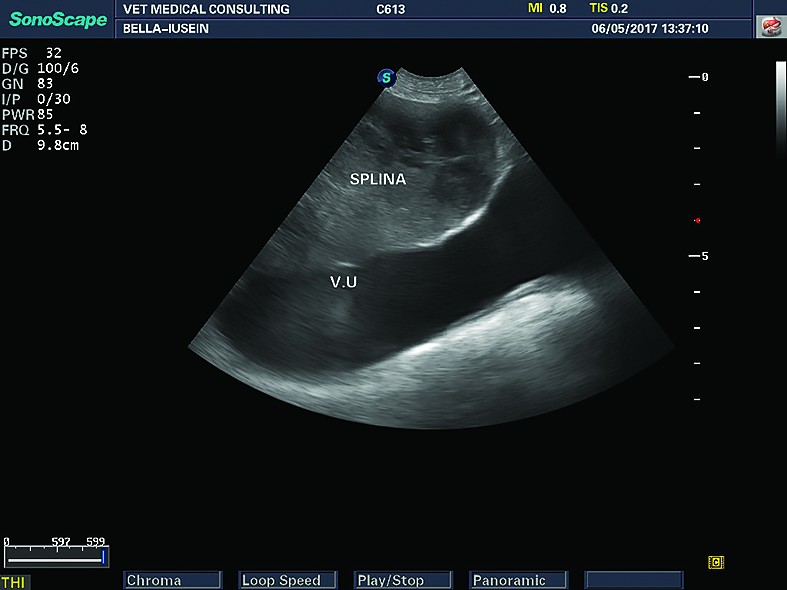
Extremitatea cranială a splinei este situată în partea cranio-dorsală stângă a abdomenului, înapoia stomacului, de care este „legată” prin ligamentul gastro-splenic și în apropierea peretelui abdominal. Hilul și extremitatea caudală a splinei au poziție variabilă, în funcție de cantitatea de conținut gastric, dar și de mărimea splinei și poziția de examinare. Posterior, se întinde până în apropierea rinichiului stâng, putându-se deplasa caudal și spre partea dreaptă, când este mărită în volum.Ecoanatomia splinei
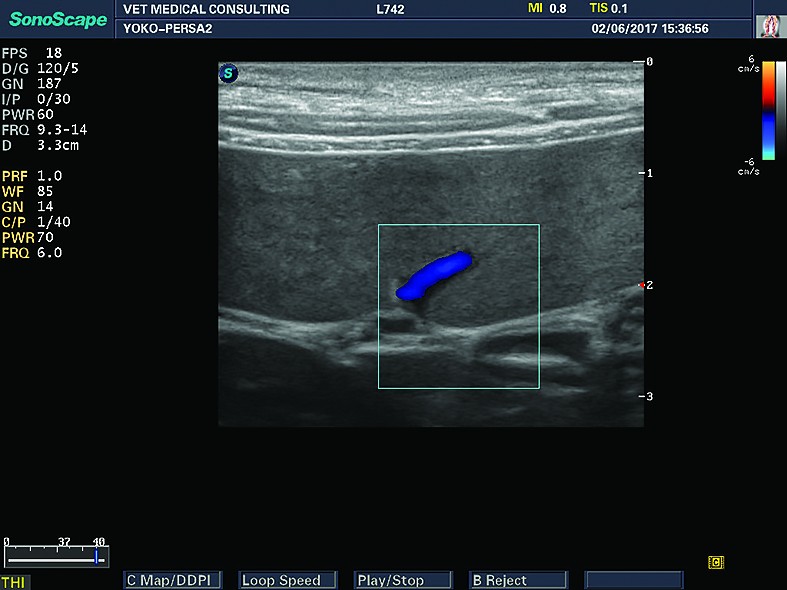
Din punct de vedere ecografic, splina are aspect elongat în secțiune longitudinală și aspect triunghiular sau lenticular în secțiune transversală. Extremitatea anterioară (capul splinei) are formă de virgulă și este poziționată între regiunea fundică gastrică și rinichiul stâng.Parenchimul splenic este omogen, fin granulat, iar capsula splenică este fin hiperecogenă (aspectul hiperecogen al capsulei splenice este mai vizibil în zonele unde ultrasunetele „cad” perpendicular pe splină) (Nyland și col., 1995). Vascularizația splenică este reprezentată de vena splenică, care se divide în partea stângă și cea dreaptă (ramura stângă mai mare decât cea dreaptă), care sunt formațiuni tubulare în interiorul parenchimului, cât și în afara lui, la nivelul hilului splenic. La pisici, venele splenice sunt mai puțin vizibile. Obișnuit, venele splenice sunt înconjurate de o cantitate mică de grăsime - zone hiperecogene care mărginesc venele splenice. Vena splenică se urmărește de la hilul splinei până la „vărsarea” în vena portă, dar uneori acest lucru este dificil din cauza interferențelor generate de gazul din intestine. Tot la nivelul hilului splenic se urmărește cu atenție și se evaluează ganglionul splenic, care, în mod normal, este destul de greu de vizualizat ecografic. De obicei, arterele splenice nu sunt vizibile (ele sunt vizibile dacă se folosește sistemul Doppler).
Aprecierea ecogenității splinei se face în raport de ecogenitatea organelor adiacente, astfel: față de parenchimul hepatic, splina are o ecogenitate mai înaltă și nu este traversată de canale biliare. La câine, parenchimul hepatic are o ecotextură mai „aspră, rugoasă”, comparativ cu ecotextura splinei, spre deosebire de pisici, unde ecotextura este asemănătoare. Ecogenitatea splinei, în raport cu cortexul renal, este mai ridicată și mai ușor de recunoscut (la câine). La pisică, aceste diferențe sunt mai discrete. În unele cazuri, ecotextura splinei poate fi asemănătoare cu cea a cortexului renal (Reese și col., 2013). Se consideră că ecogenitatea ficatului este intermediară, între cea a splinei și cea a cortexului renal (Nyland și col., 2002). Modificările subtile de ecogenitate ale acestor organe sunt uneori dificil de recunoscut și necesită experiență din partea examinatorului.
La unele animale (extrem de rar) literatura de specialitate citează splina accesorie (splenunculi), care poate fi găsită în vecinătatea splinei. Este reprezentată de țesut splenic ectopic, normal congenital sau secundar unor traumatisme splenice (autoimplant de țesut splenic). De obicei, este localizat între splină, stomac, pancreas și lobul stâng hepatic. Poate fi confundat cu leziuni perisplenice, chisturi pancreatice sau cu limfonodurile splenice.
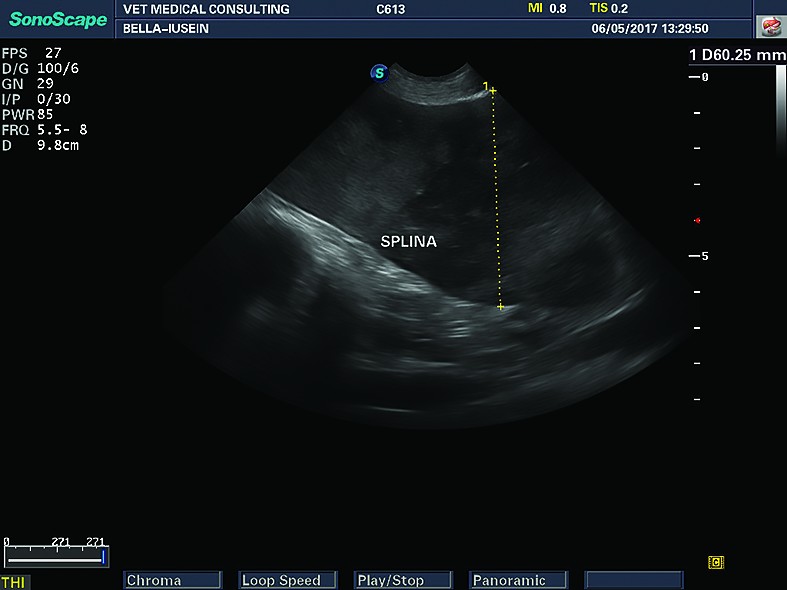
La câini, aprecierile de mărime a splinei sunt subiective, atât din cauza unei mari variabilități a raselor, cât și din cauza unor creșteri în volum a splinei, care nu sunt atribuite neapărat unor procese patologice (câinii sportivi, de vânătoare). Din aceste motive, la câini nu sunt stabiliți parametri standard de mărime pentru splină, evaluarea dimensiunilor splinei făcându-se după metode subiective. Se apreciază ca fiind splenomegalie deplasarea caudală și medială a splinei, cu sau fără dilatarea vaselor splenice. La pisici se apreciază ca fiind normală splina cu o grosime medie de până la 8,2 mm în secțiune transversală (la nivelul hilului splenic) și o lungime de 26,7 mm în secțiune longitudinală (Reese și col., 2013).
Identificarea unor mase/leziuni splenice este, în general, ușor de realizat prin investigație ecografică, dar prin această metodă nu se pot face aprecieri asupra caracterului leziunilor - malign sau benign, inflamator sau infecțios. În plus, boala splenică poate fi prezentă chiar dacă, din punct de vedere ecografic, nu sunt modificări nici de volum, nici de structură și nici vasculare.
Modificările difuze ale splinei
Congestia splenică/splenomegaliaAprecierile de volum ale splinei sunt subiective. În mărirea în volum a splinei, marginile sunt rotunjite, vasele din hilul splenic sunt mărite, iar splina se deplasează de obicei caudal și spre partea dreaptă a abdomenului. La pisică, diametrul transversal mai mare de 8-9 mm este considerat splenomegalie (Reese și col., 2013). Tot splenomegalie se apreciază atunci când splina apare „pliată” sub forma literei „U” (Hanson și col., 2001).
Examenul ecografic al modificărilor de volum ale splinei nu ne ajută în stabilirea diagnosticului diferențial și în identificarea cauzelor care au generat splenomegalia.
Congestia splenică se întâlnește în insuficiența cardiacă dreaptă, când întâlnim și hepatomegalie marcantă, iar splenomegalia este mai redusă din cauza vărsării venelor splenice în vena portă.
Splenomegalia se poate instala în timpul sedării cu acepromazină, thiopental, diazepam și ketamină, când ecogenitatea este normală sau ușor redusă (Wilson și col., 2004), dar și în boli infecțioase (hemobartonella, babesia erlichia etc.), leucemie, torsiune splenică, infiltrații maligne (limfoame) sau tromboze ale vaselor splenice (Hanson și col., 2001, Sato și Solano, 2004).
În medicina omului s-a încercat a se face corelații între modificările de ecogenitate ale parenchimului splenic și modificările patologice din diferite stadii incipiente ale bolii splenice. Astfel, se consideră că o ecogenitate a parenchimului splenic mai redusă decât normal ar putea fi regăsită în afecțiuni maligne (limfom, neoplazie plasmocitară), dar și în congestia acută a splinei. Ecogenitatea mai mare decât normal s-ar putea regăsi în congestia cronică, în procese inflamatorii cronice și în afecțiuni mieloproliferative cronice (Lamb Cr și col., 1990). Este de menționat faptul că toate aceste repere sunt orientative, iar diagnosticul de certitudine se stabilește în urma puncției ecoghidate a splinei și a examenului citologic/histologic, dar și în integrarea examenului ecografic al splinei într-un protocol de examinare clinic și paraclinic complet.
Modificările difuze de ecogenitate ale parenchimului splenic sunt întâlnite și în torsiunea splenică - ecotextură de tip hipoecogen (cu cât torsiunea are un grad mai mare, cu atât hipoecogenitatea este mai intensă) în care apar zone difuze fin hipoecogene (sinusoide dilatate și mici hemoragii intraparenchimatoase), dar și aspectul unor linii oarecum paralele hipoecogene (reprezentate de vase dilatate), iar vasele din apropierea hilului sunt mărite (Nyland și Matoon, 2015). Aceste aspecte/detalii ecografice ajută într-un oarecare grad la diferențierea torsiunii splenice de modificările necrotice din splenită și de infarctizările splenice, în care întâlnim tot splenomegalie cu hipoecogenitate, dar în care vasele intraparenchimatoase sunt mici și greu decelabile.
Bolile inflamatoare sau infecțioase sistemice pot să determine splenomegalie (splenită), care de obicei are hipoecogenitate discretă sau cu păstrarea normală a ecogenității în formele acute. În formele cronice, ecogenitatea este de obicei crescută.
Afecțiunile infiltrative difuze ale splinei determină de obicei splenomegalie, cu păstrarea sau scăderea ecogenității parenchimului splenic. Aceste modificări se regăsesc frecvent în limfomul splenic, care poate evolua difuz hipoecogen sau cu ecogenitate normală și chiar cu ecogenitate de tip granular ori poate evolua cu apariția de noduli hipoecogeni diseminați în parenchimul splenic (când devine multifocal). De cele mai multe ori, în astfel de cazuri se identifică ecografic și reacția ganglionilor din hilul splenic, dar și a celorlalți ganglioni din cavitatea abdominală.
Limfosarcomul splenic și amiloidoza pot provoca, de asemenea, splenomegalie, dar de obicei cu creșterea ecogenității parenchimului splenic.
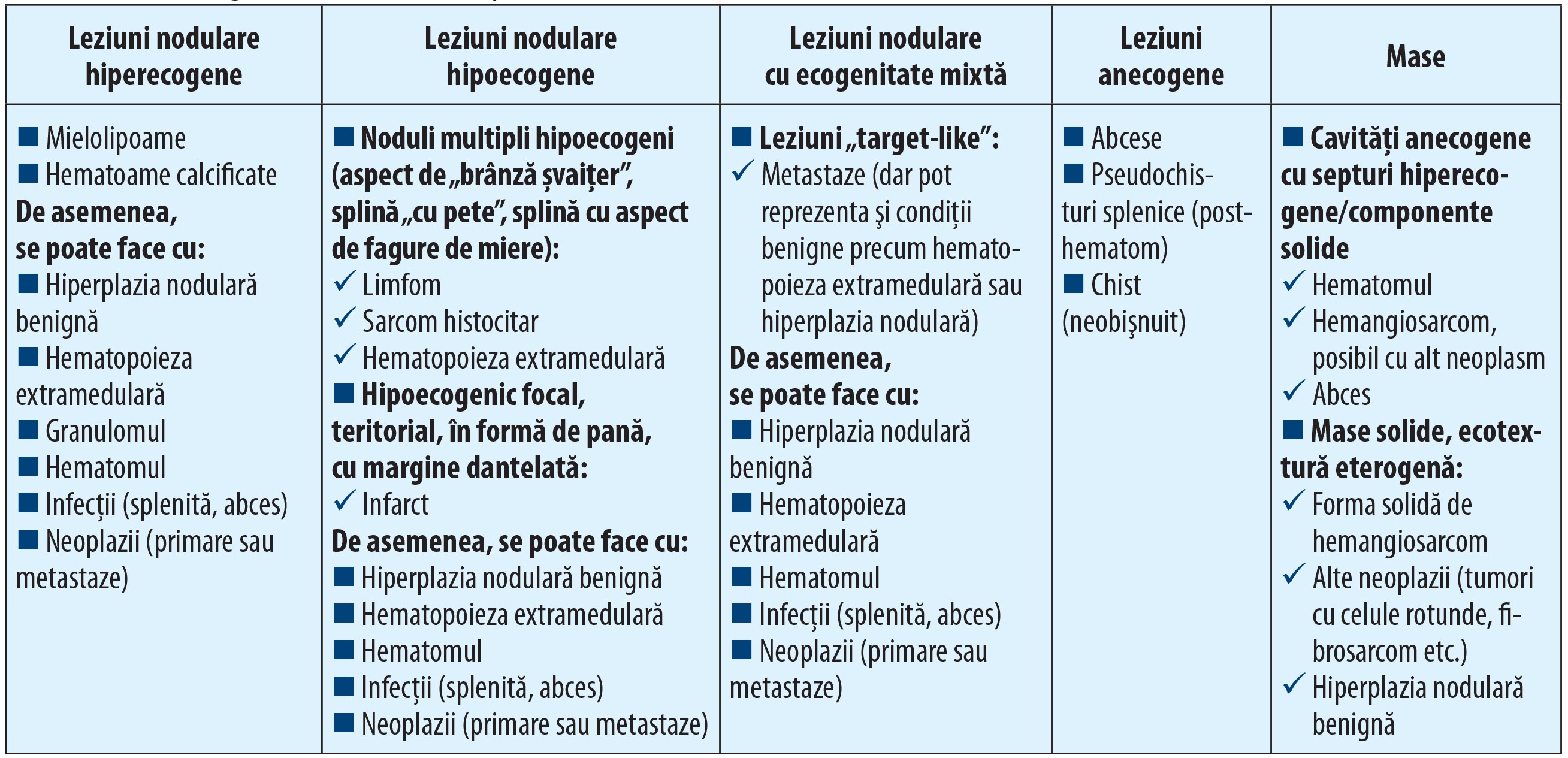
Modificările focale și multifocale ale parenchimului splenic
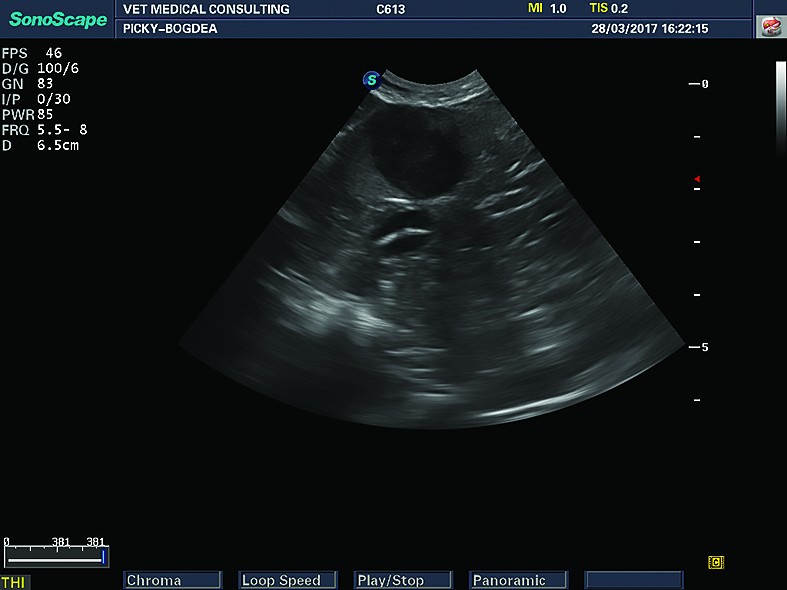
Leziunile focale ale splinei sunt relativ ușor de diagnosticat ecografic și pot fi leziuni unice sau multiple, de dimensiuni de la câțiva milimetri până la câteva zeci de centimetri, cu ecogenitate care variază de la anecogen până la hiperecogen.
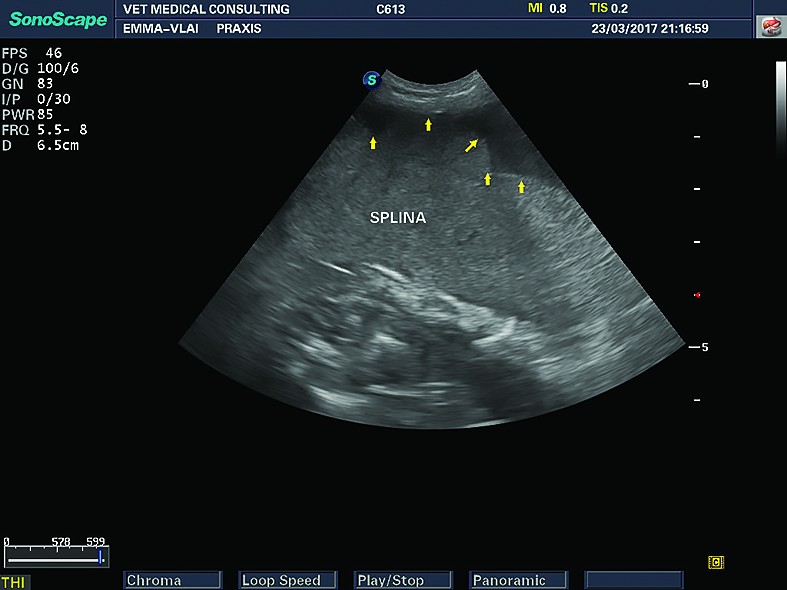
Nodulii splenici (hiperplazia nodulară) sunt cel mai des întâlnite leziuni la nivel splenic. Nodulii hiperplazici „tipici” au ecogenitate care variază de la hipoecogen până la izoecogen, în raport cu parenchimul splenic. În multe cazuri, hiperplazia nodulară, la câinii bătrâni, a fost raportată în urma examenului necropsic sau citologic, deși ecografic nu a putut fi observată. Acest lucru este posibil ca urmare a ecogenității asemănătoare a nodulilor cu parenchimul normal. De aceea, hiperplazia nodulară poate fi suspectată când la examenul ecografic se disting margini ușor neregulate ale splinei, în absența altor leziuni parenchimatoase. Nodulii hiperplazici pot avea și ecogenitate crescută, dar sunt mult mai rar descriși în literatura de specialitate. Forma și mărimea sunt diferite și nu au specificitate, în sensul că, în diferite afecțiuni, în funcție de faza în care sunt descoperiți, pot avea caracteristici ecografice asemănătoare cu alte leziuni focale. Pot avea origine splenică sau metastatică.
În limfoamele splenice, splina apare mărită în volum, cu ecostructură neomogenă de tip inflitrativ în tot parenchimul splenic sau cu noduli (zone) hipoecogeni diseminați în masa splenică. Aspectul de „brânză șvaițer”, cu prezența unor noduli multipli, mici, hipoecogeni, este sugestiv pentru limfomul splenic, deși acest aspect poate fi întâlnit și în alte afecțiuni splenice, maligne sau benigne.
Mielolipoamele splenice sunt formațiuni benigne și au aspectul unor noduli lipidici hiperecogeni de mărimi și forme diferite, situați de obicei în lungul marginii mezenterice a splinei sau în lungul vaselor splenice, și pot genera sau nu aspectul de umbrire posterioară. Aceste leziuni se întâlnesc frecvent la câinii și pisicile bătrâne, iar cauza este necunoscută (Schwartz și col., 2001).
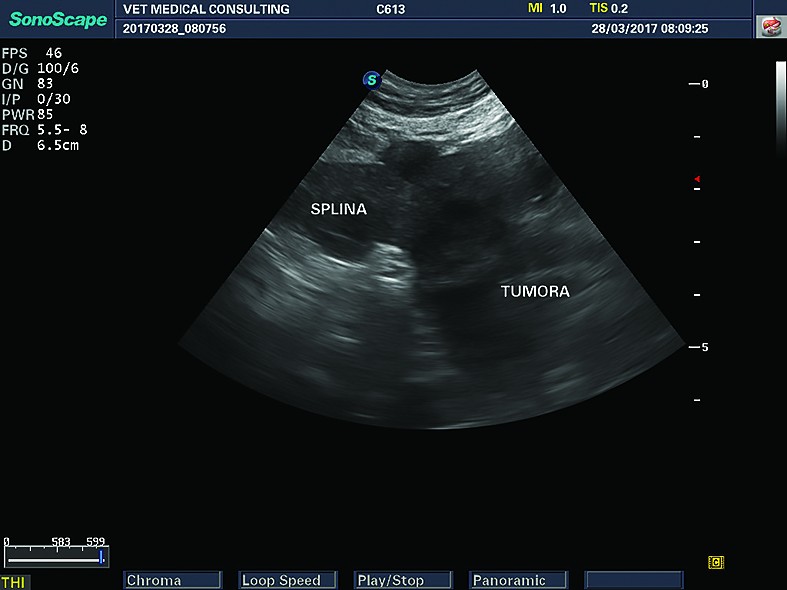
Masele splenice de mari dimensiuni pot avea mărimi și forme diferite, pot deforma marginile splinei, pot fi benigne sau maligne și nu pot fi diferențiate pe baza examenului ecografic.
Dintre leziunile benigne amintim hiperplazia nodulară (pot ajunge la dimensiuni uriașe) și hematoamele, iar dintre cele maligne, cel mai frecvent întâlnite sunt hemangiosarcoamele, alte sarcoame și neoplasmele.
Hematoamele splenice apar în urma unor traumatisme abdominale, în diferite afecțiuni de coagulare, dar de cele mai multe ori sunt asociate ruperii formațiunilor tumorale splenice. Hematoamele pot fi intraparenchimatoase (cu păstrarea integrității capsulei) - conturul splinei este deformat - sau extracapsulare, când sunt însoțite și de hemoperitoneu. Aspectul ecografic este diferit, în funcție de momentul diagnosticării. Hematoamele mici intraparenchimatoase sunt de obicei hiperecogene. Acumulările mari de sânge inițial sunt hipoecogene, cu întărire posterioară, apoi, pe măsura începerii organizării coagulului, ecogenitatea începe să crească și se pot distinge chiar și unele septări în interiorul coagulului. Din cauza acestor variabilități ale aspectului ecografic, hematoamele pot fi confundate cu leziuni de altă natură. Pentru un diagnostic de certitudine se apelează la examinarea completă a cavității abdominale, la anamneză completă, examene complementare, evaluarea în dinamică a leziunilor splenice și la puncția aspirativă ecoghidată.
Infarctele splenice apar secundar bolii tromboembolice sau pot fi asociate cu boli inflamatoare, ca peritonita, pancreatita, endocardita, septicemia, în afecțiuni hepatice care scad timpul de coagulare. Aspectul ecografic este diferit, în funcție de momentul apariției. În general, infarctele sunt zone hipoecogene, slab delimitate, cu formă de „pană” cu baza orientată către marginea splinei (Nyland și Mattoon, 2015).
O categorie aparte de leziuni splenice este reprezentată de chisturile și abcesele splenice, care au forma unor cavități delimitate de o membrană mai mult sau mai puțin hiperecogenă, cu aspect care variază de la anecogen (chisturile) până la hipoecogen (abcesele) și chiar cu ecogenitate asemănătoare parenchimului splenic normal (abcesele vechi). În cazul celor cu ecogenitate scăzută, se întâlnește și artefactul de întărire posterioară. Dacă sunt implicate bacterii gazogene, se poate întâlni și artefactul de „umbrire murdară” (nu are margini clar delimitate). Aceste formațiuni sunt greu de diferențiat de hematoamele splenice „proaspete” doar pe baza examenului ecografic (Dominnique Penninck și Mark-Andre d’Anjou, 2017).
Neoplasmele
Sunt leziuni focale sau multifocale, cu aspecte ecografice dintre cele mai variabile, greu de diferențiat dacă sunt maligne sau benigne, primare sau metastatice. Se consideră că masele splenice cu margini hipoecogene și zona centrală hiperecogenă sunt, de obicei, asociate cu procese maligne sau de tip metastatic (Cuccovillio și Lamb, 2002). Unele formațiuni maligne - și mai puțin cele benigne (nodulii hiperplazici) - pot rupe capsula splenică și să invadeze țesutul mezenteric adiacent (Day și col., 1995).
Hemangiosarcomul splenic are aspect care poate să varieze de la anecogen la hiperecogen în interiorul aceleiași leziuni, este slab delimitat și are o întărire posterioară redusă. Frecvent este însoțit de hemoperitoneu.
Limfosarcoamele sunt mase hipoecogene, fără întărire posterioară și cu margini slab delimitate. Pot fi însoțite de lichide cavitare și pot deforma splina.
Sarcoamele histiocitare sunt mase hipoecogene, bine delimitate, care de obicei deformează splina și sunt însoțite de reacție ganglionară.
Concluzie
Examinarea ecografică a splinei este un procedeu facil, ușor de realizat chiar și cu aparatură mai puțin performantă. Modificările de volum și de ecogenitate ale splinei sunt ușor de diagnosticat din punct de vedere ecografic, dar specificitatea lor este scăzută din punctul de vedere al diagnosticului de certitudine (etiologic). Confirmarea diagnosticului se face prin integrarea examenului ecografic al splinei într-un examen clinic și paraclinic complet (anamneză, investigații sangvine, Rx, CT etc.), iar procedeul gold standard pentru diagnosticul formațiunilor splenice este reprezentat de puncția ecoghidată a splinei și realizarea examenului citologic și histopatologic.
În tabelele 1 și 2 sunt enumerate atât principalele diferențe ecografice între leziunile focale și multifocale ale splinei, cât și diferențele între leziunile difuze de ecogenitate. n
Bibliografie
1. Wood AK, McCarthy PH, Angles JM. Ultrasonographic anatomic correlation and imaging protocol for the spleen in anesthetized dogs. Am J Vet Res 1990;51: 1433–8.
2. Biller DS, Myer W. Ultrasound scanning of superficial structures using an ultrasound standoff pad. Vet Radiol 1988;29:138–42.
3. Yabuki A, Endo Y, Sakamoto H, et al. Quantitative assessment of renal cortical echogenicity in clinically normal cats. Anat Histol Embryol 2008;37(5):383–6.
4. Spangler WL, Culbertson MR. Prevalence, type, and importance of splenic diseases in dogs: 1,480 cases (1985-1989). J Am Vet Med Assoc 1992;200:829–34.
5. Day MJ, Lucke VM, Pearson H. A review of pathological diagnoses made from 87 canine splenic biopsies. J Small Anim Pract 1995;36:426–33.
6. Spangler WL, Culbertson MR. Prevalence and type of splenic diseases in cats: 455 cases (1985-1991). J Am Vet Med Assoc 1992;201:773–6.
7. Wrigley RH, Konde LJ, Park RD, et al. Clinical features and diagnosis of splenic hematomas in dogs: 10 cases (1980-1987). J Am Anim Hosp Assoc 1989;25:371–5.
8. Hanson JA, Penninck DG. Ultrasonographic evaluation of a traumatic splenic hematoma and literature review. Vet Radiol Ultrasound 1994;35:463–6.
9. Wrigley RH, Konde LJ, Park RD, et al. Ultrasonographic features of splenic lymphosarcoma in dogs: 12 cases (1980-1986). J Am Vet Med Assoc 1988;193:1565–8.
10. Schelling CG, Wortman JA, Saunders HM. Ultrasonic detection of splenic necrosis in the dog: three case reports of splenic necrosis secondary to infarction. Vet Radiol 1988;29:227–33.
11. Lamb CR. Abdominal ultrasonography in small animals: examination of the liver, spleen and pancreas. J Small Anim Pract 1990;31:6–15.
12. vanSonnenberg E, Simeone JF, Mueller PR, et al. Sonographic appearance of hematoma in liver, spleen, and kidney: a clinical, pathologic, and animal study. Radiology 1983;147:507–10.
13. Lupien C, Sauerbrei EE. Healing in the traumatized spleen: sonographic investigation. Radiology 1984;151: 181–5.
14. Coelho JC, Sigel B, Ryva JC, et al. B-mode sonography of blood clots. JCU J Clin Ultrasound 1982;10:323–7.
15. Peter DJ, Flanagan LD, Cranley JJ. Analysis of blood clot echogenicity. JCU J Clin Ultrasound 1986;14:111–16.
16. Sofer M, Michowitz M, Mandelbaum Y, et al. Percutaneous drainage of subcapsular splenic hematoma: an experimental model in dogs. Am Surg 1998;64:1212–14.
17. Wrigley RH, Park RD, Konde LJ, et al. Ultrasonographic features of splenic hemangiosarcoma in dogs: 18 cases (1980-1986). J Am Vet Med Assoc 1988; 192:1113–17.
18. Liu JB, Merton DA, Goldberg BB, et al. Contrast-enhanced two- and three-dimensional sonography for evaluation of intra-abdominal hemorrhage. J Ultrasound Med 2002;21: 161–9.
19. Goerg C, Schwerk WB. Splenic infarction: sonographic patterns, diagnosis, follow-up, and complications. Radiology 1990;174:803–7.
20. Ellison GW, King RR, Calderwood-Mays M. Medical and surgical management of multiple organ infarctions secondary to bacterial endocarditis in a dog. J Am Vet Med Assoc 1988;193:1289–91.
21. Hardie EM, Vaden SL, Spaulding K, et al. Splenic infarction in 16 dogs: a retrospective study. J Vet Intern Med 1995;9:141–8.
22. Nyland TG, Hager DA. Sonography of the liver, gallbladder, and spleen. Vet Clin North Am Small Anim Pract 1985;15:1123–48.
23. Nyland TG, Hager DA, Herring DS. Sonography of the liver, gallbladder, and spleen. Semin Vet Med Surg (Small Anim) 1989;4:13–31.
24. Shirkhoda A, Wallace S, Sokhandan M. Computed tomography and ultrasonography in splenic infarction. J Can Assoc Radiol 1985;36:29–33.
25. Brown JM, Quedens-Case C, Alderman JL, et al. Contrast enhanced sonography of visceral perfusion defects in dogs. J Ultrasound Med 1997;16:493–9.
26. Dubbins PA. Ultrasound in the diagnosis of splenic abscess. Br J Radiol 1980; 53:488–9.
27. Konde LJ, Lebel JL, Park RD, et al. Sonographic application in the diagnosis of intraabdominal abscess in the dog. Vet Radiol 1986;27:151–4.
28. Ginel PJ, Lucena R, Arola J, et al. Diffuse splenomegaly caused by splenic abscessation in a dog. Vet Rec 2001.