A high-frequency occurence of different pathologies induced by the infection caused by the human papillomavirus (HPV) infection is reported in GP practices. These show up in different shapes, sizes and on different regions of the body. Most common requests come from patients who exhibit vulgar or plantar warts, papiloma, acuminate condyloma and, last but not least, different degrees of dysplasia of the cervix. As there is no definitive curative treatment to date and because of the multitude of long-term risks, the safest and most noninvasive approach is prevention, carried out by an active vaccination of the general public aged 9-45, ideally before sexual activity starts, at 11-12 years of age, respectively.
Beneficiile vaccinării împotriva HPV
Benefits of HPV vaccination
First published: 18 aprilie 2022
Editorial Group: MEDICHUB MEDIA
DOI: 10.26416/Med.146.2.2022.6324
Abstract
Rezumat
În cadrul cabinetelor de medicină de familie, întâlnim cu o frecvenţă sporită diverse patologii provocate de infecţia cauzată de virusul papilomatozei umane (HPV). Acestea se prezintă sub diverse forme, localizări sau dimensiuni. Cele mai frecvente solicitări provin de la pacienţii care au veruci vulgare, veruci plantare, papiloame, condiloame acuminate şi, nu în ultimul rând, diferite grade de displazie a colului uterin. Pentru că nu există încă un tratament curativ definitiv şi din cauza multiplelor riscuri pe termen lung, cea mai neinvazivă şi sigură metodă de abordare este prevenţia, reprezentată de vaccinarea activă a populaţiei cu vârsta cuprinsă între 9 şi 45 de ani, ideal înaintea începerii activităţii sexuale, respectiv la 11-12 ani.
Introducere
În cadrul cabinetelor, medicii de familie întâlnesc deseori în practica lor diverse patologii cauzate de infecţia cu virusul papilomatozei umane (HPV). Probabil, fiecare medic de familie are cel puţin o pacientă pe an cu dispalzie de col uterin.
Infecţia cu HPV, care este comună, produce leziuni epiteliale şi mucoase (nongenitale şi genitale). De obicei, aceste infecţii sunt autolimitante, însă persistenţa lor duce spre o varietate de cancere epiteliale(1).
În anii ’70 s-a demonstrat potenţialul oncogenic al HPV de către Orth şi colegii săi la o afecţiune nongenitală – epidermodyspalsia verriciformis, o afecţiune rară ce poate duce la carcinom cu celule scuamoase(2). În anii ’80 s-a identificat ADN-ul HPV în majoritatea cancerelor cervicale de către Harald zur Hausen(3).
Definiţie şi patogenie
Prin definiţie, virusul papilomatozei umane aparţine familiei Papillomaviridae, care sunt virusuri şi au în structura lor ADN dublu-caternar şi circular, capsidă icosaedrică şi anvelopă, cea din urmă oferindu-i stabilitate şi rezistenţă la variatele tratamente încercate până în prezent.
Aceste microorganisme au specificitate de gazdă, singurul rezervor pe care îl pot infecta fiind reprezentat de fiinţa umană. Infecţia cu HPV nu poate singură să transforme malign ţesuturile infectate. Printre cofactori în carcinogeneză se numără tagabismul, expunerea la radiaţii UV, sarcina, deficitul de folaţi şi imunosupresia(4).
Până astăzi, s-au identificat peste 100 de serotipuri de HPV, din care mai mult de 80 de serotipuri au beneficiat de secvenţierea genomului. Acest fapt a contribuit la clasificarea HPV în corelaţie cu forma clinică şi ţesuturile predominant infectate(4,5,6,7,8) – tabelul 1.
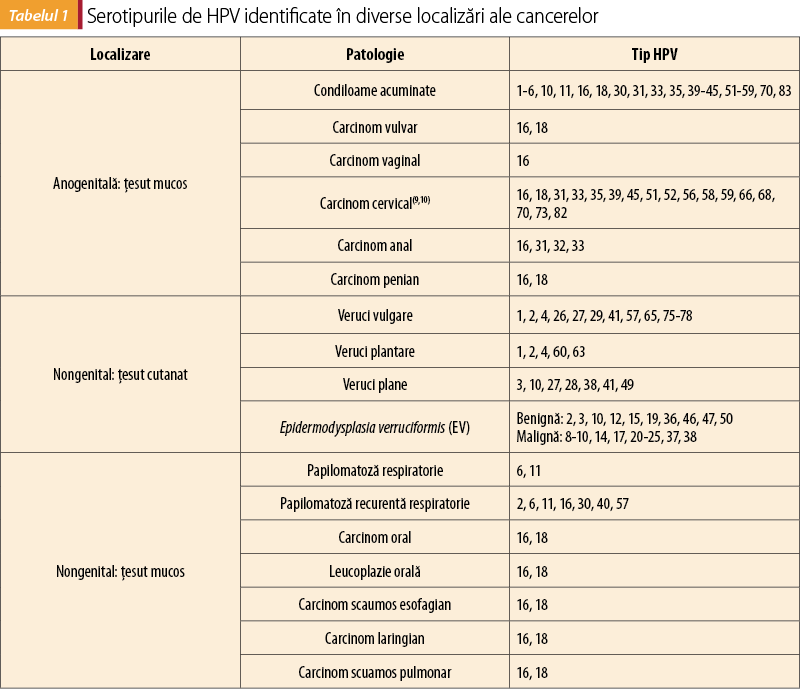
Epidemiologie
HPV este responsabil în peste 90% din cazurile de cancere cervicale şi anale, 70% din cele vaginale şi vulvare şi în peste 60% din cancerele peniene. Fumatul şi alcoolul erau incriminate până de curând pentru majoritatea cancerelor orofaringiene, dar studii recente arată că aproximativ 70% din aceste cancere sunt iniţiate de infecţia cu HPV, menţinându-se ca factori de risc şi celelalte două(11).
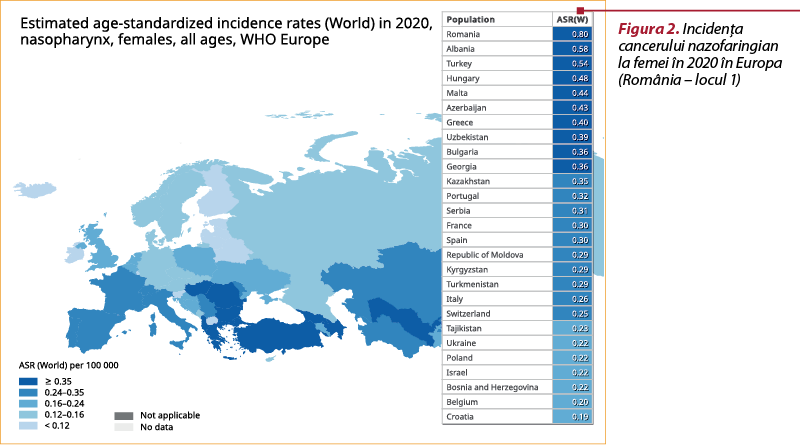
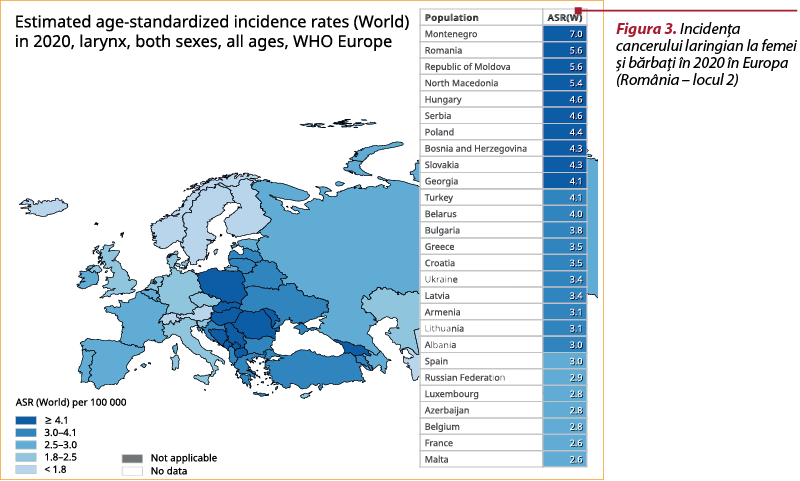
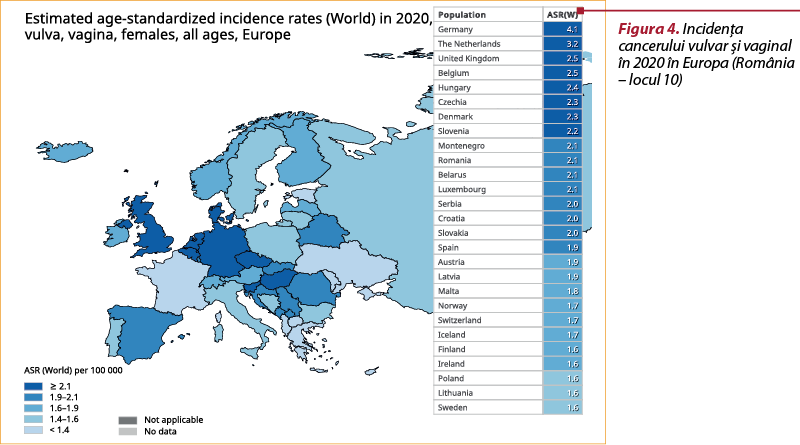
Incidenţa acestor cancere în ţara noastră este foarte mare. Datele oferite de Global Cancer Observatory(12) sunt îngrijorătoare pentru societatea medicală din România, ceea ce ne face să ne întrebăm ce putem schimba în practica noastră medicală şi cum putem să influenţăm aceste cifre în favoarea pacienţilor noştri.
Pe lângă cancere, infecţia cu HPV cauzează şi leziuni benigne, care pot afecta calitatea vieţii. Amintim de papilomatoza respiratorie recurentă (PRR) şi de condiloame anogenitale, deşi infecţia cu HPV este incriminată în foarte multe patologii.
Dacă avem un pacient care prezintă disfonie rezistentă la tratamentele standard, trebuie să îl îndrumăm spre un cabinet ORL pentru investigaţii suplimentare, existând posibilitatea de a evolua o papilomatoză laringiană subiacentă. Incriminate sunt tulpinile 6 şi 11 de HPV. Există o tendinţă spre recurenţă şi risc de malignizare(13). PRR poate prezenta o morbiditate înaltă din cauza necesităţii multiplelor intervenţii chirurgicale cauzate de recidive(14). O altă ţintă a HPV este papilomatoza respiratorie recidivantă la populaţia pediatrică, inclusiv la sugari. Aceştia dobândesc infecţia cu HPV în timpul naşterii pe cale vaginală, dar în unele cazuri şi prin cezariană. În urma unei analize amănunţite, s-au evidenţiat aceleaşi serotipuri de HPV în diferite ţesuturi (placentă, lichid de lavaj cervico-vaginal, inclusiv la nou-născut). Aceste serotipuri de HPV se asociază cu PRR şi cu negii anogenitali, majoritatea mamelor acestor copii având un istoric de boală genitală HPV(15).
Prevalenţa condiloamelor anogenitale în populaţia generală este de 0,2-5%. În SUA, prevalenţa infecţiei genitale cu HPV între 18 şi 59 de ani a fost între 25,1% şi 45,2% la bărbaţi şi între 20,4% şi 39,9% la femei(15).
Dintre toţi agenţii infecţioşi, în anul 2018 infecţia cu HPV a cauzat 56,1% din totalitatea cancerelor la nivel mondial la femei(12) – figura 5.
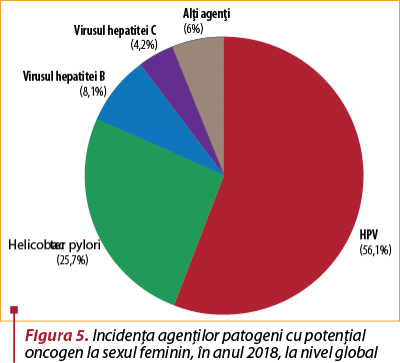
Infecţiile cu HPV cauzează un spectru mult mai extins de boli faţă de ceea ce am amintit, însă pe cele menţionate anterior le întâlnim cel mai des în practica noastră curentă, respectiv în cadrul cabinetului de medicină de familie.
Prevenţia primară prin vaccinare activă

Toate organizaţiile internaţionale, precum Organizaţia Mondială a Sănătăţii (OMS), Strategic Advisory Group of Experts (SAGE) şi Centers for Disease Control and Prevention (CDC), recomandă ferm vaccinarea împotriva HPV.
În ultimii ani am observat o uşoară creştere pentru acceptarea vaccinării cu vaccinul 9-valent în rândul femeilor de peste 30 de ani, care au fost diagnosticate cu diferite boli cauzate de infecţia cu HPV. Foarte important este sfatul oferit de medicul lor curant să se vaccineze, în urma administrării tratamentului adecvat.
În România, după o lungă perioadă în care vaccinul împotriva infecţiei cu HPV a lipsit din stocurile mediciilor de familie, putem relua vaccinarea cu vaccinul 9-valent prin Programul Naţional de Vaccinare (PNV). Din septembrie 2021, vârsta fetelor la care putem administra acest vaccin în mod gratuit a crescut la 18 ani (de la 14 ani). O metaanaliză despre vaccinul HPV ca terapie în papilomatoza respiratorie recurentă a fost publicată în The Journal of Infections Diseases şi arată o scădere semnificativă a intervenţiilor chirurgicale în recidiva acestei boli(16).
În 2020, FDA a aprobat în regim de urgenţă extinderea indicaţiei vaccinării cu vaccinul 9-valent pentru a preveni cancerul orofaringian cauzat de HPV(17).
Din decembrie 2014, ne bazăm pe trei vaccinuri aprobate împotriva infecţiei virale HPV: Cervarix® (2vHPV), Gardasil® (4vHPV) şi Gardasil 9® (9vHPV).
Vaccinul nonavalent oferă protecţie împotriva serotipurilor 6, 11, 16 şi 18, prevenind astfel condiloamele vaginale, leziunile precanceroase, displazia şi cancerul cervical la bărbaţi şi femei cu vârsta între 9 şi 26 de ani(28,29). Gardasil® a fost înlocuit de Gardasil 9®, care acoperă aceleaşi tulpini, însă la care s-au mai adăugat încă cinci tulpini suplimentar: 31, 33, 45, 52 şi 58. Acesta conţine dublă încărcătură antigenică HPV 16 şi 18, tipuri care au un rol oncogen deosebit în cancerul cervical. S-a observat un răspuns imun inferior la vaccinul Gardasil®, fiind îmbunătăţit şi înlocuit cu Gardasil 9®(30). Acesta oferă protecţie împotriva condiloamelor genitale, leziunilor displazice şi precanceroase, respectiv cancerului cervical, vulvar, vaginal şi anal, la femei putându-se administra la vârste între 9 şi 45 de ani(31). Cervarix® are eficacitate echivalentă cu a Gardasil 9®, oferind protecţie împotriva infecţiei cu HPV şi a cancerelor asociate acestuia pentru serotipurile 16 şi 18(28). Vaccinarea anti-HPV aduce cele mai mari beneficii dacă schema completă este realizată înaintea începerii vieţii sexuale. Dacă finalizăm vaccinarea până la 12 ani, răspunsul imun va fi maximal, iar anticorpii pot apăra gazda la primul contact cu infecţia virală cu HPV(33). Un trial clinic a demonstrat că fetele şi băieţii care au fost vaccinaţi până la vârsta de 12 ani au avut un titru de anticorpi maximal, respectiv dublu faţă de lotul care s-a vaccinat la vârsta de peste 15 ani(34).
Recomandările CDC’s Advisory Committee on Immunization Practices (ACIP) sunt:
-
Vârsta ideală pentru vaccinarea împotriva HPV este de 11-12 ani.
-
Vaccinul poate fi efectuat începând cu vârsta de 9 ani.
-
Vaccinul ar trebui administrat până la vârsta de 26 de ani.
-
Se poate administra vaccinul şi de la vârsta de 27 de ani până la vârsta de 45 de ani, dar beneficiile nu mai sunt maximale, din cauza faptului că persoana respectivă a intrat deja în contact cu unele tulpini de HPV.
-
Vaccinul are eficacitate maximă dacă persoana nu a intrat în contact cu tulpinile de HPV.
Aceste recomandări se aplică atât pentru persoanele de sex feminin, cât şi pentru cele de sex masculin(25).Ministerul Sănătăţii din România asigură vaccinul împotriva HPV cu 9 valenţe în mod gratuit tuturor fetelor între 11 şi 18 ani (inclusiv 18 ani), pe baza unei cereri efectuate de către aparţinători către medicul de familie. Reprezentantul legal al minorului trebuie să facă o cerere către medicul de familie prin care solicită achiziţia vaccinului prin PNV, iar în urma acestei solicitări, medicul de familie obţine de la direcţiile de sănătate publică (DSP) vaccinul în vederea administrării.
Schema de vaccinare:
-
Între 9 şi 14 ani (15 ani fără o zi): 2 doze la 6-12 luni distanţă.
-
Peste 15 ani: 3 doze – 0, 2, 6-12 luni.
Australia este prima ţară din lume care a avut o scădere semnificativă a cancerului de col uterin, introducând în mod gratuit vaccinul împotriva HPV începând cu anul 2007(26).
Beneficiile vaccinării anti-HPV sunt incontestabile şi trebuie să facem un efort în vederea informării atât a părinţilor, cât şi a adolescentelor asupra administrării vaccinului în mod gratuit. Dar să nu omitem nici băieţii şi nici femeile active sexual. Dacă oferim informaţiile necesare în mod corect, prin consiliere despre prevenţia infecţiei cu HPV, putem să rămânem surprinşi că mulţi dintre pacienţi îşi vor achiziţiona singuri din farmacii vaccinul.
Prevenţia terţiară prin tratamentul leziunilor provocate de HPV
Tratamentul infecţiei cauzate de HPV este orientat în funcţie de tipul leziunii macroscopice (veruci vulgare, plane, condiloame acuminate) sau histopatologic (displazie de diferite grade)(31,32). Infecţia genitală cu HPV se poate remite spontan, astfel nu se recomandă tratament specific antiviral în absenţa leziunilor sau în infecţia cu HPV subclinică. De asemenea, nu se recomandă tratament antiviral în neoplazia intraepitelială cervicală 1 (CIN 1). Conform Asociaţiei Americane de Colposcopie şi Patologie Cervicală (ASSCP) şi Congresului Obstetricienilor şi Ginecologilor(33), pentru CIN 2 sau displazii mai severe se folosesc ghidurile de evaluare şi management în vederea tratamentului antiviral(31,32,34).

Condiloamele genitale sunt, de obicei, asimptomatice, însă, în funcţie de dimensiunea şi localizarea lor, pot deveni dureroase şi pot produce prurit. Durata tratamentului trebuie să fie de minimum trei luni pentru un răspuns terapeutic favorabil. Putem administra aplicaţii locale cu podofilox gel 0,5%, imiquimod cremă 5%, răşină podofilă (tinctură), acid tricloroacetic (80-90%), crioterapie sau îndepărtare chirurgicală prin excizie, chiuretaj sau electrocauterizare. Condiloamele vaginale şi anale au parte de un tratament realizat prin crioterapie (azot lichid), aplicaţii de acid tricloracetic (80-90%) sau excizie chirurgicală(35).
Tratamentul folosit în majoritatea infecţiilor cu HPV se bazează pe excizie chirurgicală, ablaţie chimică sau crioterapie(36).
Mai jos, vom prezenta câteva exemple extrase din studii din literatura medicală de specialitate, care au avut ca abordare vaccinarea ca tratament adjuvant postinfecţie cu HPV. Rezultatele lor au fost favorabile, obţinând în unele cazuri ameliorarea sau chiar remisiunea bolii. Specificăm că aceste studii sunt puţine şi s-au desfăşurat pe loturi mici de pacienţi, nefiind semnificative statistic.
Într-un studiu, Nofal şi colaboratorii au împărţit 44 de pacienţi în două loturi, patologia de bază fiind reprezentată de multiple veruci plantare. În lotul 1 s-a administrat schema completă de vaccin Cervarix® (lunile 0, 1, 6), iar lotul 2 a primit o injecţie intralezională la două săptămâni (în total şase şedinţe)(35). În urma acestui studiu, s-a observat un clearance complet la 18 pacienţi (81,8%) care făceau parte din lotul numărul 2, respectiv la 14 pacienţi (63,3%) din lotul numărul 1. La ambele loturi nu au mai apărut alte recidive timp de peste 6 luni. Un studiu retrospectiv pe 30 de pacienţi cu veruci vulgare şi plantare a demonstrat că 14 pacienţi (46,67%) au prezentat o rezoluţie completă după vaccinarea cu Gardasil® (trei doze), iar cinci dintre aceştia au avut un răspuns parţial, comparativ cu 11 pacienţi (36,67%) care nu au prezentat niciun răspuns(36).
Abeck şi Holst au studiat efectul vaccinării cu schema completă folosind vaccinul Gardasil®. Studiul a fost efectuat la şase copii cu istoric de peste doi ani cu veruci vulgare diseminate(37). După doza a doua au prezentat un răspuns favorabil cinci din şase copii. Aceştia au prezentat o rezoluţie completă a leziunilor. Al şaselea copil a reacţionat prin remisiune completă, doar în urma finalizării schemei complete cu trei doze de Gardasil®(36).
Lee et al. au observat cazul unui pacient de sex masculin (44 de ani), care avea ca istoric importante condiloame acuminate în zona perianală, fiind rezistent la tratamentul uzual cu imiquimod(40). Acesta a primit trei doze de vaccin Gardasil®, având un răspuns favorabil. Astfel, în urma primei doze s-a observat o ameliorare importantă în primele opt săptămâni postvaccinare. Rezoluţia completă a avut loc după trei luni şi a fost confirmată prin biopsii şi examen histopatologic.
În anul 2019, într-un alt studiu s-a încercat pe un lot de zece pacienţi care prezentau multiple condiloame acuminate administrarea schemei complete a vaccinului Gardasil®. Din zece pacienţi, şase (60%) au avut un răspuns complet, unul singur (10%) a avut un răspuns parţial, iar trei (30%) nu au prezentat niciun răspuns(41).
Mai jos reproducem o scurtă prezentare de caz care redă succint o situaţie favorabilă întâlnită la o pacientă din cadrul cabinetului nostru.
Prezentare de caz
Anamneză. Date generale: I.R., în vârstă de 29 de ani, din mediul urban, cu studii superioare. S-a prezentat la un consult ginecologic de specialitate pentru a efectua un examen citologic Babeş-Papanicolau (BPN), pe care îl solicită anual de la începerea vieţii sexuale.
Motivele prezentării. 2015: screening de rutină, examen citologic BPN, în urma căruia a avut un rezultat anormal, reprezentat de celule epiteliale superficiale şi intermediare atipice, fiind încadrată în clasa ASCUS.
APF: menarha la 14 ani, ciclu menstrual regulat, la 28 de zile, durata medie de aproximativ 5-7 zile, cu flux menstrual moderat. Activitate sexuală începută la 16 ani, partener unic.
APP: infecţii de tract urinar repetitive cu E. coli (din copilărie).
AHC: mama cu fibrom uterin, doi polipi vaginali de natură benignă.
Condiţii de muncă şi viaţă: corespunzătoare.
Istoricul bolii actuale
-
2015: boala actuală a debutat în urmă cu opt ani, în urma efectuării unui examen citologic BPN de rutină, care a avut ca rezultat ASCUS. În urma acestuia s-a efectuat tiparea HPV, prin care au fost depistate două tulpini diferite de HPV: 52, cu risc oncogen crescut, şi 62, cu risc oncogen scăzut de a dezvolta cancer de col uterin.
-
2016: s-a repetat examenul citologic BPN, în urma căruia au rezultat aceleaşi leziuni care o menţine în statusul ASCUS. La indicaţia medicului ginecolog, s-a urmat un tratament antiviral cu izoprinozine timp de aproape doi ani (trei luni cu o lună pauză).
-
2018: după efectuarea unui alt test BPN, situaţia s-a agravat, fiind încadrată într-o treaptă superioară – LSIL-PAP III, astfel a primit indicaţia de a urma o colposcopie.
-
2019: la colposcopie – col nativ fără leziuni; după aplicarea de acid acetic, s-a constatat o zonă aceto-albă, care se întinde de la buza posterioară, de la ora 4 până la ora 6. La nivelul exocolului s-au prelevat multiple biopsii (orele 3-4-5-6-7). Examenul histopatologic a identificat o agravare a leziunilor (neoplazie scuamoasă intraepitelială de grad înalt = HSIL-CIN 2). După şase săptămâni s-a intervenit chirurgical prin conizaţie, în vederea unui tratament curativ. Se repetă testul BPN, rezultatul fiind nesatisfăcător, stagnând în categoria HSIL-CIN II (displazie severă de col uterin).
-
2020: s-a vaccinat anti-HPV cu schema completă (trei doze – vaccin HPV cu 9 valenţe).
-
2021: repetă testul BPN, fiind negativă pentru leziuni intraepiteliale şi malignitate (NLIM-PAP 2). Pentru siguranţă s-a efectuat tiparea HPV (ADN-HPV), fiind negativ.
Investigaţii
-
Examen ginecologic (valve şi tuşeu vaginal): organe genitale externe normal conformate; vagin suplu, elastic; uter retrovers, de dimensiuni normale, consistenţă elastică, mobil, insensibil la palpare; anexe şi spaţiul Douglas libere.
-
Ecografie pelviană şi intravaginală: uter în RVF, de dimensiuni normale, ecostructură parenchimatoasă, omogenă, contur regulat, endometru de 10 mm; ovare normale; fără lichid în spaţiul Douglas.
Discuţie
Din totalitatea studiilor extrase şi analizate din literatura medicală nu am găsit niciunul care să demonstreze vindecarea prin vaccinare a unei femei diagnosticate cu displazie cervicală, de oricare grad.
Prin vaccinarea cazurilor deja infectate cu HPV se urmăreşte scăderea riscului de reinfecţie. În cazul de faţă, există în continuare discuţii în ceea ce priveşte obţinerea vreunui beneficiu prin vaccinarea făcută la această pacientă cu displazie cervicală severă (HSIL). Nu putem preciza care au fost cauzele ce au provocat această ameliorare în cadrul multiplelor teste efectuate. Însă ceea ce ştim cu siguranţă din studii este că vaccinarea a scăzut riscul de reinfectare cu HPV.
Conflict of interests: The author declares no conflict of interests.
Bibliografie
-
-
de Villiers EM. Cross-roads in the classification of Papillomaviruses. Virology. 2013;445(1-2):2-10.
-
Orth G. Host defenses against HPV: lessons from Epidermodyspasia Verrucifomis. Curr Top Microbiol Immunol. 2008;321:59-83 2008.
-
zur Hausen H. Molecular pathogenesis of cancer of the cervix and its causation by specific HPV types. Curr Top Microbiol Immunol. 1994;186:131-156.
-
Human Papillomavirus (HPV): Practice Essentials, Background, Pathophysiology. medscape.com.
-
Sanchez-Aleman MA, Uribe-Salas FJ, Lazcano-Ponce EC, Conde-Glez CJ. Human Papillomavirus incidence and risk factors among Mexican female college students. Sex Transm Dis. 2011 Apr;38(4):275-8.
-
Castle PE, Rodriguez AC, Burk RD, et al. Long-term persistence of prevalently detected Human Papillomavirus infections in the absence of detectable cervical precancer and cancer. J Infect Dis. 2011 Mar 15;203(6):814-22.
-
Giuliano AR, Lee JH, Fulp W, et al. Incidence and clearance of genital Human Papillomavirus infection in men (HIM): a cohort study. Lancet. 2011 Mar 12;377(9769):932-40.
-
Chaturvedi AK, Katki HA, Hildesheim A, et al. Human Papillomavirus infection with multiple types: pattern of coinfection and risk of cervical disease. J Infect Dis. 2011 Apr 1;203(7):910-20.
-
de Sanjose S, Quint WG, Alemany L, et al. Human Papillomavirus genotype attribution in invasive cervical cancer: a retrospective cross-sectional worldwide study. Lancet Oncol. 2010 Nov;11(11):1048-56.
-
Chaturvedi AK, Katki HA, Hildesheim A, et al. Human Papillomavirus infection with multiple types: pattern of coinfection and risk of cervical disease. J Infect Dis. 2011 Apr 1;203(7):910-20.
-
www .cdc.gov/cancer/hpv/statistics/index .htm
-
gco.iarc.fr/today/online-analysis-map
-
Gaylis B, Hayden RE. Recurrent respiratory papillomatosis: progression to invasion and malignancy. Am J Otolaryngol. 1991;12(2):104–12.
-
Weekly epidemiological record No 19. 2017. 92, 241–268. Available at: https://www.who.int/publications/journals/weekly-epidemiological-record
-
Bennett JE, Dolin R, Martin J. Papillomavirusurile (HPV). In: William Bonnez Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases Ninth Edition, 2019, Elsevier.
-
Rosenberg T, Philipsen BB, Mehlum CS, et al. Therapeutic Use of the Human Papillomavirus Vaccine on Recurrent Respiratory Papillomatosis: A Systematic Review and Meta-Analysis. J Infect Dis. 2019;219(7):1016-1025.
-
fda.gov/media
-
Harpe D, DeMars LR. HPV vaccines – a review of the first decade. Gynecol Oncol. 2017;146(1):196–204.
-
Gardasil package insert. Whitehouse Station, NJ: Merck & Co; October 2016. Human Papillomavirus (HPV) Vaccine Update (medscape.com).
-
Wang R, Pan W, Jin L, et al. Human Papillomavirus vaccine against cervical cancer: opportunity and challenge. Cancer Letters. 2020;471:88–102.
-
Gardasil 9 package insert. Whitehouse Station, NJ: Merck & Co; June 2020. (Human Papillomavirus (HPV) Vaccine Update (medscape.com).
-
Human Papillomavirus (HPV) Vaccine Update (medscape.com).
-
Bednarczyk RA. Addressing HPV vaccine myths: practical information for healthcare providers. Hum Vaccin Immunother. 2019;15(7–8):1628–1638.
-
Markowitz LE, Dunne EF, Saraiya M, et al. Human Papillomavirus vaccination: recommendations of the Advisory Committee on Immunization Practices (ACIP) [published correction appears in MMWR Recomm Rep. 2014;63(49):1182]. MMWR Recomm Rep. 2014;63(RR-05):1–30.
-
https://www.cdc.gov/vaccines/vpd/hpv/hcp/recommendations.html
-
Brotherton JM, Fridman M, May CL, et al. Early effect of the HPV vaccination programme on cervical abnormalities in Victoria, Australia: an ecological study. Lancet. 2011;377(9783):2085-2092.
-
http://www.who.int/mediacentre/factsheets/fs380/en/
-
https://www.cdc.gov/hpv/parents/screening.html
-
Cervical Screening: Overview, Human Papillomavirus, Papanicolaou Test (medscape.com).
-
Pecorelli S, Zigliani L, Odicino F. Revised FIGO staging for carcinoma of the cervix. Int J Gynaecol Obstet. 2009 May;105(2):107-8.
-
Centers for Disease Control and Prevention. Sexually Transmitted Diseases Treatment Guidelines, 2010. MMWR. 2010. 59(No. RR-12):69-73.
-
Gearhart P, Randall TC, Buckley RM Jr. Human Papillomavirus. Medscape Reference. May 4, 2011. (Human Papillomavirus (HPV) Organism-Specific Therapy: Specific Therapeutic Regimens (medscape.com).
-
Wright TC, Massad LS, Dunton CJ. 2006 consensus guidelines for the management of women with cervical intraepithelial neoplasia or adenocarcinoma in situ. Am J Obstet Gynecol. 2007;197(4):340-345.
-
ACOG Committee on Practice Bulletins-Gynecology. ACOG Practice Bulletin no. 109: Cervical cytology screening. Obstet Gynecol. 2009 Dec;114(6):1409-20.
-
Human Papillomavirus (HPV) Organism-Specific Therapy: Specific Therapeutic Regimens (medscape.com).
-
Human Papillomavirus (HPV) Treatment & Management: Approach Considerations, Considerations in Specific Patient Subgroups, Pharmacologic Therapy (medscape.com).
-
Nofal A, Marei A, Ibrahim AM, et al. Intralesional versus intramuscular bivalent Human Papillomavirus vaccine in the treatment of recalcitrant common warts. J Am Acad Dermatol. 2020 Jan;82(1):94–100.
-
Yang MY, Son JH, Kim GW, et al. Quadrivalent human papilloma virus vaccine for the treatment of multiple warts: a retrospective analysis of 30 patients. J Dermatolog Treat. 2019 Jun;30(4):405–9.
-
Abeck D, Folster-Holst R. Quadrivalent human papillomavirus vaccination: a promising treatment for recalcitrant cutaneous warts in children. Acta Derm Venereol. 2015 Nov;95(8):1017-9.
-
Lee HJ, Kim JK, Kim DH, et al. Condyloma accuminatum treated with recombinant quadrivalent human papillomavirus vaccine (types 6, 11, 16, 18). J Am Acad Dermatol. 2011 Jun;64(6):e130–2.
-
Choi H. Can quadrivalent human papillomavirus prophylactic vaccine be an effective alternative for the therapeutic management of genital warts? an exploratory study. Int Braz J Urol. 2019 Mar-Apr;45(2):361–8.
-
Articole din ediţiile anterioare
Importanţa aplicaţiilor POCUS în asistenţa medicală primară la nivel european şi un studiu prospectiv POCUS la pacienţi cu dureri acute abdomino-pelviene în medicina de familie
Ultrasonografia Point of Care (POCUS) – efectuată de clinician la locul de îngrijire al pacientului, atât în cabinetul medical sau în zone izolate,...
Manifestările cutanate ale infecţiei cu virusul papiloma uman
Virusul papiloma uman (HPV) este un virus ADN care face parte din familia Papaviridae şi pentru care s-au descris mai mult de 200 de tipuri, clasif...
Prevenţia diabetului zaharat de tip 2
Diabetul zaharat de tip 2 (DZ2) este o boală cronică a cărei prevalență este în creștere, reprezentând una dintre cele patru boli cronice netran...
Abordarea disfuncţiei tiroidiene în sarcină
Disfuncţia tiroidiană este o tulburare frecvent întâlnită în sarcină, de cele mai multe ori diagnosticată premergător concepţiei. Preocuparea p...