Hypericum perforatum L. (sunătoare) este utilizat în tratamentul depresiei uşoare până la moderate. Riscurile sale potenţiale de siguranţă sunt interacţiunile farmacocinetice ale medicamentelor prin intermediul enzimelor din citocromul P450 (CYP) şi al glicoproteinei P, probabil cauzate de hiperforină. În cadrul unui studiu de fază I, în regim deschis, nerandomizat, cu o singură secvenţă, extractul Ze 117 de Hypericum cu nivel scăzut de hiperforină a fost investigat folosind un cocktail de medicamente pe 20 de voluntari sănătoşi. Nu au fost observate interacţiuni farmacocinetice ale Ze 117 pentru CYP1A2, CYP2B6, CYP2C9, CYP2C19, CYP3A4 şi glicoproteina P. Aria de sub curbă (ASC) şi peak-ul concentraţiei plasmatice maxime (Cmax) a medicamentelor comparatoare utilizate au evidenţiat intervale de încredere (IÎ) de 90% pentru raporturile mediilor geometrice ale medicamentelor luate împreună cu Ze 117 faţă de administrarea medicamentului comparator administrat singular, chiar în intervalul predefinit de bioechivalenţă, de 80‑125%. Deşi Ze 117 nu a indus metabolizarea dextrometorfanului de către CYP2D6, a crescut uşor raportul ASC pentru dextrometorfan (medie 147,99, IÎ 95% 126,32-173,39), dar nu şi rata de metabolizare corespunzatoare. Ze 117 nu prezintă interacţiuni farmacocinetice clinic relevante cu CYP-uri importante şi cu glicoproteina P.
ELEMENTE DE INTERES ALE STUDIULUI
CARE SUNT CUNOŞTINŢELE CURENTE PE ACEASTĂ TEMĂ?
Preparatele din sunătoare pot induce citocromi şi pot transporta proteine precum glicoproteina P (P-gp), care ar putea duce la interacţiuni între medicamente. S-a demonstrat că hiperforina constituentă este responsabilă pentru multe dintre aceste interacţiuni medicamentoase.
LA CE ÎNTREBĂRI A ÎNCERCAT SĂ RĂSPUNDĂ ACEST STUDIU?
Dovezile sugerează că extractele cu doze mici de hiperforină au un risc redus de interacţiuni medicamentoase. Prin urmare, extractul Ze 117 cu nivel scăzut de hiperforină ar putea avea un potenţial mai scăzut de interacţiuni decât alte preparate pe bază de sunătoare cu nivel ridicat de hiperforină.
CE APORT DE CUNOŞTINŢE ADUCE ACEST STUDIU?
Nu s-a observat nicio dovadă pentru interacţiunea farmacocinetică (nici inducţie, nici inhibare) a extractului Ze 117 (Remotiv®) cu nivel scăzut de hiperforină pentru CYP1A2, CYP2B6, CYP2C9, CYP2C19, CYP3A4 şi P-gp. De asemenea, Ze 117 (Remotiv®) nu a prezentat inducţie CYP2D6, ci mai degrabă o inhibare slabă, nerelevantă clinic, a acestei enzime.
CUM POATE AFECTA ACEST LUCRU FARMACOLOGIA CLINICĂ SAU MEDICINA TRANSLAŢIONALĂ?
Extractele de sunătoare cu nivel scăzut de hiperforină, cum ar fi Ze 117 (Remotiv®), ar putea avea un avantaj major în siguranţa administrării medicamentelor în comparaţie cu preparatele pe bază de sunătoare cu nivel ridicat de hiperforină, evitând riscurile inutile de siguranţă în terapia comedicamentoasă.
Extractul uscat de sunătoare Ze 117 este aprobat în mai multe ţări pentru tratamentul de scurtă durată al tulburărilor depresive uşoare până la moderate (ICD-10 F32.0 şi F32.1). Numeroase studii clinice au arătat că preparatele de sunătoare sunt la fel de eficiente ca antidepresivele sintetice, dar sunt de obicei mai bine tolerate decât omologii lor chimici(1) şi au primit autorizaţie de punere pe piaţă din partea Agenţiei Europene pentru Medicamente (EMA)(2,3).
Componentele majore din extractele de sunătoare sunt hipericina, hiperforina, diferite flavonoide şi procianidine(4). Conform monografiei Comitetului pentru Medicamente pe Bază de Plante (HMPC) al EMA(2,3), extractele de Hypericum pot conţine cantităţi variabile de constituenţi, până la un maxim de 6%, 0,1‑0,3% hipericină şi un minimum de 6% flavonoide.
Extractul comercial Ze 117 (Remotiv®) conţine până la 0,3% hipericină şi cantităţi mici de hiperforină (≤0,2%).
Mecanismul de acţiune al sunătoarei nu este încă elucidat în detaliu, dar ipoteza acceptată este că sunătoarea îşi manifestă efectele antidepresive prin inhibarea recaptării norepinefrinei, serotoninei şi dopaminei în fanta presinaptică şi printr-un efect de modulare asupra neurotransmiţătorilor la nivelul membranei postsinaptice(5,6).
Contribuţia constituenţilor individuali din Hypericum la eficacitatea generală este încă în dezbatere. Datele in vitro şi in vivo sunt fie în favoarea, fie împotriva ideii că hiperforina ar fi substanţa activă majoră, dar nu se poate ajunge la o concluzie certă pe baza datelor publicate(6). Studiile au demonstrat că extractul de Hypericum (Ze 117) este la fel de eficace ca imipramina şi fluoxetina şi superior preparatelor placebo(7–9) în tratamentul tulburărilor depresive.
Mai multe studii au arătat că, proporţional cu doza, hiperforina este responsabilă pentru multe dintre interacţiunile medicamentoase observate(10,11). Există dovezi rezonabile care sugerează că extractele de hiperforină în doze mici nu exercită efecte semnificative asupra enzimelor din citocromul P450 (CYP), cum ar fi CYP3A4, sau asupra proteinelor de transport, cum ar fi glicoproteina P (P-gp)(12‑14). Prin urmare, datorită conţinutului scăzut de hiperforină, Ze 117 ar putea prezenta un potenţial mai mic de interacţiuni medicamentoase decât alte preparate din sunătoare. A fost efectuat un studiu cu participanţi umani sănătoşi. Scopul studiului a fost de a analiza efectul extractului Ze 117 de Hypericum (cu nivel scăzut de hiperforină) asupra potenţialului de interacţiune cu enzimele CYP relevante şi cu transportorul P-gp.
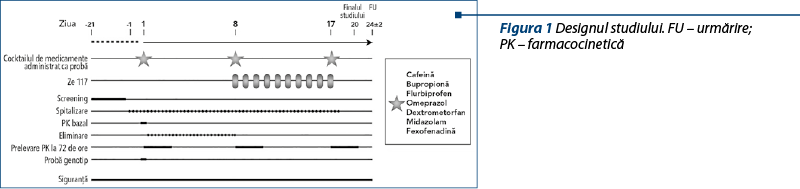
Protocolul studiului a fost unul standard pentru studiile asupra interacţiunii între medicamente şi s-a bazat pe ghidurile de reglementare ale Administraţiei SUA pentru Alimente şi Medicamente (FDA)(15,16) şi EMA19 (Figura 1 – proiectul studiului).
Pentru fenotipare, au fost utilizate abordări pe bază de cocktailuri de medicamente, implicând administrarea mai multor medicamente comparatoare specifice CYP sau P-gp, pentru evaluarea simultană a activităţilor acestor enzime şi ale transportorului P-gp. În ultimii ani, au fost dezvoltate şi utilizate multe cocktailuri de fenotipare(18–22). Pentru acest studiu, compilarea medicamentelor a fost realizată conform unui cocktail validat de fenotipare (cocktail Geneva(23,24)), care a inclus şi un medicament comparator pentru P-gp (fexofenadină). Din câte ştim, este primul studiu de interacţiune cu un cocktail de şapte medicamente comparatoare pentru analiza extractului de sunătoare.
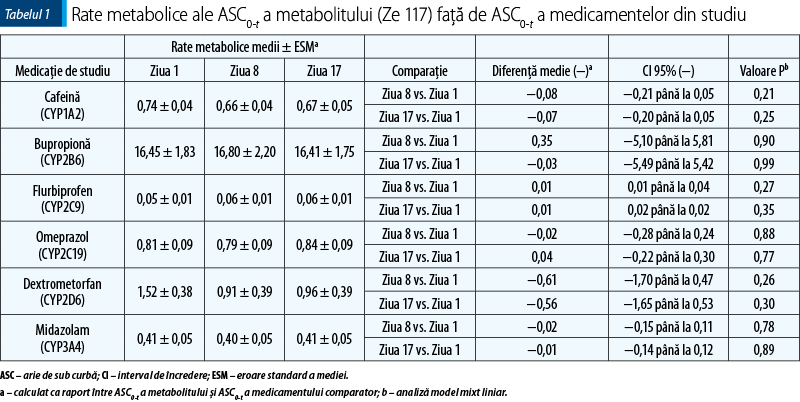
Obiectivul primar al acestui studiu a fost de a evalua o posibilă interacţiune (inducţie sau inhibare) a extractului uscat de sunătoare Ze 117 asupra mai multor enzime ale citocromului P450 (CYP 450) şi P-gp. Prin urmare, am comparat punctele finale farmacocinetice (aria de sub curbă de la momentul 0 până la ultima probă recoltată – ASC0-t) şi ratele metabolice) ale substraturilor selective pentru CYP-uri specifice şi P-gp administrate drept un cocktail obţinut în ziua 8 (de reflectare a inhibării) şi ziua 17 (de reflectare a inducţiei) cu ziua 1.
Mai mult, a fost evaluată şi siguranţa Ze 117 administrat singur şi în combinaţie cu medicamentele comparatoare.
REZULTATE
Date demografice
Studiul a inclus 20 de participanţi sănătoşi de origine europeană (10 bărbaţi, 10 femei). Participanţii au fost consideraţi eligibili dacă aveau vârsta cuprinsă între 18 şi 55 de ani, aveau o greutate corporală medie de 72,3 kg (interval 53,6-88,9 kg) şi un indice de masă corporală între 19,5 şi 28,3 kg/m2.
Farmacocinetică
Ratele metabolice (tabelul 1) nu s-au modificat între diferitele tratamente. Deşi a fost observată o scădere mai mare a ratei metabolice pentru dextrometorfan, reflectând astfel o inhibare CYP2D6 slabă, aceasta nu a fost semnificativă statistic nici pentru comparaţia dintre ziua 8 şi ziua 1, nici pentru cea dintre ziua 17 şi ziua 1.
Genotipare
Genotiparea a fost realizată pentru CYP2B6, CYP2C9, CYP2C19, CYP2D6 şi ABCB1 (P-gp). Toţi cei 20 de participanţi au fost metabolizatori rapizi pentru CYP2B6. Au fost identificaţi doi metabolizatori intermediari şi un metabolizator lent pentru CYP2C. Au fost detectaţi doi metabolizatori ultrarapizi, şase metabolizatori rapizi, doi intermediari şi un metabolizator lent pentru CYP2C19, iar pentru CYP2D6 au fost determinaţi un metabolizator ultrarapid, unul intermediar şi unul lent.
Au fost investigate trei polimorfisme pentru P-gp (rs2032583, rs2235015 şi rs2235015).
Tolerabilitate
Şaisprezece participanţi au raportat 31 de reacţii adverse, de intensitate uşoară până la moderată (cele mai prevalente fiind cefaleea şi oboseala). Ze 117, administrat singur şi împreună cu cocktailul de medicamente, a fost bine tolerat. Patru participanţi (21,1%) au raportat şase reacţii adverse asociate cu Ze 117 după administrarea Ze 117 în zilele 10-16, când Ze 117 a fost administrat singur, iar patru participanţi (20%) au raportat patru reacţii adverse asociate medicamentelor în ziua 1.
Nu au apărut reacţii adverse după ultima doză de Ze 117 administrată împreună cu cocktailul Geneva.
Cel mai frecvent raportată reacţie adversă a fost cefaleea (20%), urmată de oboseală (15%).
Toate reacţiile adverse au fost de intensitate uşoară sau moderată şi s-au remediat până la sfârşitul studiului.
Semnele vitale nu au prezentat modificări relevante clinic după administrare, cu excepţia creşterii temperaturii corpului la trei participanţi (15%) în perioada dintre prima administrare a cocktailului şi înainte de începerea administrării Ze 117. S-a considerat că este puţin probabil să fie asociate administrării medicaţiei din studiu.
Electrocardiogramele nu au prezentat modificări semnificative clinic.
DISCUŢIE
Din anul 1999, când a fost prezentat primul studiu clinic orientat pe interacţiunile farmacocinetice şi care a implicat un extract comercial de Hypericum şi digoxină, interacţiunile medicamentoase cu sunătoarea au început să beneficieze de o atenţie sporită(25).
În general, majoritatea interacţiunilor între medicamente (şi a interacţiunilor între medicamente şi plante medicinale) sunt interacţiuni legate de metabolizare; într-adevăr, cele mai multe xenobiotice sunt capabile să interacţioneze cu enzimele CYP în diferite moduri, ducând fie la inducţia, fie la inhibiţia enzimei.
La inducţia enzimelor prin creşterea sintezei enzimatice se obţin niveluri serice reduse ale medicamentului şi, prin urmare, un răspuns scăzut la medicament; inhibiţia enzimelor (reversibilă sau ireversibilă) determină concentraţii serice mai ridicate ale medicamentului. În funcţie de magnitudinea efectului, sunt posibile reacţii adverse clinic relevante la medicamente. În plus faţă de inducţia/inhibiţia enzimelor CYP din ficat şi intestine, transportorul de eflux P-gp interferează cu absorbţia medicamentului şi controlează penetrarea ţesutului (de exemplu, în creier).
Datele obţinute in vitro şi in vivo indică faptul că, dependent de concentraţia de hiperforină din extract, preparatele din sunătoare pot induce enzimele CYP şi proteina de transport P-gp(10,11,26). S-a demonstrat că hiperforina activează receptorul nuclear PXR, care reglează expresia diferitelor enzime CYP şi a P-gp.
Deoarece Ze 117 este un extract de sunătoare cu nivel scăzut de hiperforină, scopul studiului a fost de a-i determina potenţialul de interacţiune cu enzimele CYP relevante şi cu transportorul P-gp la participanţii umani sănătoşi, folosind un cocktail de medicamente.
Interacţiunea farmacocinetică a fost exclusă când valorile intervalului de referinţă de 90% pentru rate ale mediei geometrice s-au încadrat în limitele de bioechivalenţă de 80‑125% sau în limitele extinse de bioechivalenţă de 70‑143%, de asemenea acceptate pentru măsurătorile de fenotipare(17,27).
În general, aceste rezultate au fost confirmate de punctele finale secundare, cum ar fi peak-ul concentraţiei plasmatice maxime (Cmax) şi ratele metabolice. Astfel, ar putea fi exclusă o interacţiune farmacocinetică între Ze 117 şi medicamentele-substrat ale acestor enzime.
Prin urmare, faţă de datele anterioare cu preparate de Hypericum perforatum cu nivel ridicat de hiperforină(28), în studiul nostru nu a fost observată inducţia CYP1A2, CYP2B6, CYP2C9, CYP2C19, CYP2D6, CYP3A4 sau P-gp de către Ze 117. Comparaţia dintre ASC0-t dextrometorfan în ziua 8 şi ziua 17 cu valoarea iniţială a sugerat o inhibare CYP2D6 slabă (tabelul 1).
În studiul nostru, amploarea inhibării CYP2D6 ar putea fi clasificată ca slabă, conform ghidurilor FDA(16).
Pe scurt, având în vedere utilizarea bine stabilită a Ze 117 în tratamentul episoadelor de depresie moderată până la severă(2,3), aceste rezultate ale studiului oferă dovezi ale unui avantaj major al Ze 117 în ceea ce priveşte siguranţa în comparaţie cu extractele de sunătoare cu nivel ridicat de hiperforină. Aceasta subliniază opiniile actuale ale experţilor, care recomandă extracte cu nivel scăzut de hiperforină la o doză zilnică de sub 1 mg de hiperforină pentru a reduce sau atenua potenţialele riscuri inutile de siguranţă în comedicaţie(2,3).
METODĂ
Acest studiu a fost realizat la Centrul pentru Farmacologie Umană din Neu-Ulm, Germania, începând cu 6 februarie 2018 şi până la 23 martie 2018. Toate procedurile studiului au fost aprobate de Comitetul de Etică al Consiliului Medical de Stat Bavarez, din München, Germania, şi de Institutul Federal pentru Medicamente şi Dispozitive Medicale. Toţi pacienţii au semnat consimţăminte informate scrise înainte de intrarea în studiu. Pentru genotipare s-a semnat un consimţământ informat suplimentar.
Participanţi
Voluntarii sănătoşi de sex masculin sau feminin au fost eligibili pentru înscrierea în studiu dacă erau sănătoşi fizic şi mental, de origine europeană, aveau vârste cuprinse între 18 şi 55 de ani inclusiv, un indice de masă corporală între 19 şi 29 kg/m2 inclusiv, o greutate corporală mai mică sau egală cu 90 kg, erau nefumători, iar femeile nu erau gravide.
Femeile de vârstă fertilă au trebuit să adopte o metodă acceptabilă de contracepţie. Examenele fizice (inclusiv electrocardiograma) şi analizele de laborator (inclusiv testul toxicologic) trebuiau să nu aibă rezultate patologice.
Mărimea eşantionului
Un eşantion de 16 participanţi a permis respingerea fiecărei ipoteze nule „interacţiune prezentă inducţie/inhibare” cu a=0,05 (unilateral) şi o putere de cel puţin 90% pentru o zonă de toleranţă de 0,70‑1,43, presupunând că valorile CV intraindividuale depăşesc 30% şi că raportul real µtest/µreferinţă=1,0(27). Ca marjă de siguranţă, au fost incluşi încă patru participanţi pentru a lua în considerare renunţările, rezultând un eşantion total de N = 20.
A fost administrat un cocktail format din şapte medicamente, de 3 ori, pe cale orală, în doză unică fiecare (ziua 1, ziua 8, ziua 17), conform unui cocktail validat (cocktail Geneva(24)) ce a conţinut următoarele medicamente: cafeină (CYP1A2), bupropionă (CYP2B6), flurbiprofen (CYP2C9), omeprazol (CYP2C19), dextrometorfan (CYP2D6), midazolam (CYP3A4) şi fexofenadină (P-gp). Cocktailul de şapte medicamente a fost administrat în ziua 1, ziua 8 şi ziua 17, dimineaţa.
Probele plasmatice pentru determinarea medicamentelor şi a metaboliţilor lor au fost recoltate înainte şi după administrare până la 72 de ore după fiecare administrare a cocktailului. Obiectivul primar a constat în evaluarea unei posibile interacţiuni (inducţie sau inhibare) a extractului uscat de sunătoare Ze 117 asupra mai multor enzime CYP P450 şi cu transportorul P-gp, comparând ASC0-t din Zilele 1 şi 17 ale substraturilor din cocktail. Obiectivele secundare au constat în evaluarea unei posibile interacţiuni a extractului uscat de sunătoare de Ze 117 asupra mai multor enzime CYP P450 şi cu transportorul P-gp, comparând Cmax a substraturilor din cocktail şi ratele metabolice ale substraturilor din cocktail şi ale metaboliţilor relevanţi. În plus, am căutat să evaluăm siguranţa Ze 117 administrat singur şi în combinaţie cu medicamentele din studiu.
Medicament investigat şi dozaj
A fost administrat un singur comprimat filmat extract uscat de sunătoare Ze 117 (cu un conţinut de 0,96 mg de hiperforină/cpr. film.) timp de 10 zile (din ziua 8).
Designul studiului
Studiul a fost unul clinic de fază I, în regim deschis nerandomizat, cu o singură secvenţă (Figura 1).
Participanţii au fost spitalizaţi începând cu ziua 1 până la externare în dimineaţa zilei 18. Li s-au administrat, pe cale orală, 500 mg de Ze 117 în dimineaţa zilei 8 până în ziua 17.
Doza de 500 mg de extract uscat de sunătoare Ze 117, selectată pentru acest studiu, este doza zilnică recomandată recunoscută în monografia Comitetului pentru medicamente pe bază de plante al EMA(2,3). Comprimatele filmate au fost fabricate de Max Zeller Soehne AG, Romanshorn, Elveţia.
Cocktailul de şapte medicamente disponibile pe piaţă a fost administrat dimineaţa, în ziua 1, ziua 8 şi ziua 17, conform cocktailului Geneva validat: tabletă cu cafeină 50 mg (CYP1A2), bupropion HCl 75 mg (CYP2B6), soluţie orală de flurbiprofen 10 mg (CYP2C9), capsulă de omeprazol 10 mg (CYP2C19), soluţie orală de dextrometorfan 10 mg (CYP2D6), soluţie orală de midazolam 1 mg (CYP3A4) şi suspensie orală de fexofenadină 25 mg (P-gp).
Medicamentele au fost administrate fără medicamentul analizat Ze 117 (ziua 1) sau împreună cu medicamentul analizat Ze 117 (zilele 8 şi 17) cu 240 ml de apă. Ze 117 a fost administrat timp de 10 zile (din ziua 8 până în ziua 17), iar cocktailul a fost administrat de trei ori (ziua 1, ziua 8, ziua 17). Participanţii au primit mese standard, iar comedicaţia a fost controlată. Cocktailul de medicamente, împreună cu Ze 117, a fost administrat à jeun. În celelalte zile ale studiului, Ze 117 a fost administrat în condiţii de repaus alimentar.
Pentru cuantificare, s-au utilizat standarde interne izotopice marcate.
Au fost obţinute următoarele limite inferioare de cuantificare: 0,05 ng/ml pentru dextrometorfan, dextrorfan, midazolam şi 1-hidroximidazolam; 0,5 ng/ml pentru fexofenadină; 1 ng/ml pentru 4-hidroxiflurbiprofen, bupropionă, 4-hidroxibupropionă, omeprazol şi 5-hidroxiomeprazol; 5 ng/ml pentru flurbiprofen; şi 10 ng/ml pentru cafeină şi paraxantină.
Rezultate finale PK şi statistice
Cu Phoenix WinNonlin 7.0 au fost calculate următoarele rezultate finale farmacocinetice non-compartimentale din datele individuale de concentraţie sanguină în timp a medicamentelor studiate şi metaboliţilor aferenţi în zilele 1, 8 şi 17: ASC0-t (ASC de la momentul 0 până la ultima probă recoltată) ASC0-inf (ASC extrapolată la constanta de viteză infinită) t1/2.
Program de recoltare a probelor şi măsurare
Probele de sânge pentru determinarea concentraţiei medicamentelor şi a metaboliţilor aferenţi au fost recoltate prin puncţie venoasă sau cu un cateter venos permanent cât mai aproape de următoarele rezultate temporale: predoză şi 10, 20, 30, 45 de minute şi 1, 1,5, 2, 2,5, 3, 4, 5, 6, 8, 12, 16, 24, 48 şi 72 de ore după fiecare administrare a cocktailului. Probele de sânge au fost analizate folosind o metodă validată de cromatografie lichidă şi spectrometrie de masă în tandem. Analizaţii au fost: cafeină şi paraxantină, bupropionă şi 4-hidroxibupropionă, flurbiprofen şi 4-hidroxiflurbiprofen, omeprazol şi 5-hidroxiomeprazol, dextrometorfan şi dextrorfan, midazolam şi 1-hidroximidazolam şi fexofenadină.
Măsurători bioanalitice
Pentru determinarea cantitativă a flurbiprofenului, 4-hidroxiflurbiprofenului, bupropionei, 4-hidroxibupropionei, dextrometorfanului, dextrorfanului, fexofenadinei, omeprazolului, 5-hidroxiomeprazolului, cafeinei, paraxantinei, midazolamului şi 1-hidroximidazolamului în plasmă umană K3 - EDTA, a fost dezvoltată şi validată o analiză la Nuvisan GmbH, conform Ghidului EMA privind validarea metodelor bioanalitice(29).
Genotipare
Genotiparea CYP2B6, CYP2C9, CYP2C19 şi ABCB1 a fost efectuată prin reacţia de polimerizare în lanţ (PCR) cantitativă, iar genotiparea CYP2D6 a fost realizată prin secvenţierea cu terminatori de catenă marcaţi fluorescent şi electroforeză în gel de agaroză pe 20 de probe de sânge uman, folosind martori pozitivi şi negativi adecvaţi.
ADN-ul a fost extras din tuburi de ADN sangvin PAXgene folosind kitul midi de ADN sanguin QIAamp (Qiagen) conform instrucţiunilor producătorului. Concentraţia (ng/µL) şi puritatea (raporturi de absorbţie 260 nm/280 nm şi 260 nm/230 nm) au fost determinate utilizând un spectrofotometru NanoDrop ND-1000 UV-VIS.
Genotiparea CYP2D6 (alelele *2, *3, *4, *6, *7, *8, *9, *10, *14, *17, *19, *29, *35, *38, *41) a fost efectuată prin secvenţierea cu terminatori de catenă marcaţi a produşilor PCR selectaţi folosind amorse PCR specifice, urmată de electroforeză capilară. Datele de secvenţiere au fost analizate folosind software-ul SeqPilot (JSI Medical Systems). Alelele *5 (deleţie) şi *xN (multiplicare) au fost analizate prin electroforeză în gel de agaroză utilizând martori adecvaţi. Haplotipurile, diplotipurile şi fenotipurile au fost prezise în baza datelor de secvenţiere şi a celor de electroforeză în gel de agaroză. n
DATE JUSTIFICATIVE
Informaţiile suplimentare sunt ataşate la această lucrare pe site-ul Clinical Pharmacology & Therapeutics (www.cpt-journal.com).
FINANŢARE
Costurile studiului au fost acoperite de Max Zeller Söhne AG.
Autorii (C.Z., E.K., J.U., M.L., M.H., S.N., J.D. S.K.) nu au primit nicio finanţare.
© 2019 Max Zeller & Söhne AG. Clinical Pharmacology & Therapeutics publicată de Wiley Periodicals, Inc. în numele Societăţii Americane pentru Farmacologie Clinică şi Terapeutică.
Acesta este un articol cu acces deschis sub licenţă Creative Commons de atribuire necomercială, care permite utilizarea, distribuirea şi reproducerea pe orice suport, cu condiţia ca lucrarea originală să fie citată în mod corespunzător şi să nu fie utilizată în scopuri comerciale.